Похожие презентации:
Основные понятия и законы термохимии. Интерактивный плакат
1.
ИНТЕРАКТИВНЫЙ ПЛАКАТОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ТЕРМОХИМИИ
КРАТКАЯ ТЕОРИЯ
ПРОВЕРКА ЗНАНИЙ
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
КРАТКАЯ ТЕОРИЯ
ПРОВЕРКА ЗНАНИЙ
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
КРАТКАЯ ТЕОРИЯ
ПРОВЕРКА ЗНАНИЙ
РАЗРАБОТКА ИНТЕРАКТИВНОГО ПЛАКАТА СТРЕЛЬНИКОВОЙ ВИКТОРИИ ВИКТОРОВНЫ,
МЕТОДИСТА ОТДЕЛА НАУЧНО-МЕТОДИЧЕСКОГО ОБЕСПЕЧЕНИЯ ОБРАЗОВАТЕЛЬНОЙ ДЕЯТЕЛЬНОСТИ ГБОУ ИРО КК (АРМАВИРСКИЙ ФИЛИАЛ)
2.
ИНТЕРАКТИВНЫЙ ПЛАКАТОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ТЕРМОХИМИИ
ПОНЯТИЕ
ОПРЕДЕЛЕНИЕ
ТЕПЛОВОЙ ЭФФЕКТ
ХИМИЧЕСКОЙ РЕАКЦИИ
КОЛИЧЕСТВО ТЕПЛОТЫ, ВЫДЕЛЕВШЕЕСЯ ИЛИ
ПОГЛОЩЕННОЕ ХИМИЧЕСКОЙ СИСТЕМОЙ ПРИ
ПРОТЕКАНИИ ВНЕЙ ХИМИЧЕСКОЙ РЕАКЦИИ.
ТЕПЛОВОЙ ЭФФЕКТ ОБОЗНАЧАЕТСЯ СИМВОЛАМИ
Q ИЛИ ΔΗ (Q =― ΔΗ)
ТЕРМОХИМИЯ
РАЗДЕЛ ХИМИИ, ИЗУЧАЮЩИЙ
ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
ТЕРМОХИМИЧЕСКОЕ
УРАВНЕНИЕ
УРАВНЕНИЕ РЕАКЦИИ,
В КОТОРОМ УКАЗАН ТЕПЛОВОЙ ЭФФЕКТ
ТЕПЛОТА ОБРАЗОВАНИЯ
(ΔΗ0ОБР )
ТЕПЛОВОЙ ЭФФЕКТ ОБРАЗОВАНИЯ ОДНОГО МОЛЯ
ВЕЩЕСТВА ИЗ ПРОСТЫХ ВЕЩЕСТВ В СТАНДАРТНЫХ
СОСТОЯНИЯХ. ТЕПЛОТА ОБРАЗОВАНИЯ ПРОСТОГО
ВЕЩЕСТВА В СТАНДАРТНОМ СОСТОЯНИИ РАВНА НУЛЮ
3.
ИНТЕРАКТИВНЫЙ ПЛАКАТОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ТЕРМОХИМИИ
ПОНЯТИЕ
ОПРЕДЕЛЕНИЕ
СТАНДАРТНОЕ СОСТОЯНИЕ
СОСТОЯНИЕ ВЕЩЕСТВА ПРИ 1 АТМ. , 00 С (или 298,15 К и
101 кПа. ДЛЯ ПРОСТЫХ ВЕЩЕСВТ В КАЧЕСТВЕ
СТАНДАРТНОГО ВЫБИРАЮТ НАИБОЛЕЕ УСТОЙЧИВУЮ В
ЭТИХ УСЛОВИЯХ АЛЛОТРОПНУЮ ФОРМУ (УГЛЕРОДА –
ГРАФИТ, ФОСФОРА – БЕЛЫЙ ФОСФОР)
ЗАКОН
ЗАКОН ГЕССА
СЛЕДСТВИЕ ИЗ ЗАКОНА ГЕССА
ФОРМУЛИРОВКА
ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ НЕ
ЗАВИСИТ ОТ ПУТИ РЕАКЦИИ, А ОПРЕДЕЛЯЕТСЯ ТОЛЬКО
СОСТОЯНИЕМ ИСХОДНЫХ ВЕЩЕСТВ И ПРОДУКТОВ
РЕАКЦИИ
ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ РАВЕН
РАЗНОСТИ СУММ ТЕПЛОТ ОБРАЗОВАНИЯ ПРОДУКТОВ И
СУММ ТЕПЛОТ ОБРАЗОВАНИЯ ИСХОДНЫХ ВЕЩЕСВТ С
УЧЕТОМ СТЕХИОМЕТРИЧЕСКИХ КОЭФФИЦИЕНТОВ
4.
ИНТЕРАКТИВНЫЙ ПЛАКАТОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
ПОНЯТИЕ
ОПРЕДЕЛЕНИЕ
ХИМИЧЕСКАЯ КИНЕТИКА
ЭТО УЧЕНИЕ О СКОРОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ
СКОРОСТЬ ХИМИЧЕСКОЙ
РЕАКЦИИ
ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ОДНОГО ИЗ
РЕАГИРУЮЩИХ ВЕЩЕСТВ ЗА ЕДИНИЦУ ВРЕМЕНИ
ЭЛЕМЕНТАРНАЯ СТАДИЯ
РЕАКЦИИ
РЕАКЦИЯ, КОТОРАЯ ПРОТЕКАЕТ НЕПОСРЕДСТВЕННО
ПРИ СТОЛКНОВЕНИИ МОЛЕКУЛ ИЛИ ПРИ ИХ РАСПАДЕ
МЕХАНИЗМ ХИМИЧЕСКОЙ
РЕАКЦИИ
СОВОКУПНОСТЬ ЭЛЕМЕНТАРНЫХ СТАДИЙ
(УСТАНАВЛИВАЕТСЯ ЭКСПЕРИМЕНТАЛЬНО)
ЭНЕРГИЯ АКТИВАЦИИ
ЭНЕРГИЯ, КОТОРУЮ НАДО СООБЩИТЬ МОЛЕКУЛАМ,
ЧТОБЫ ОНИ СМОГЛИ ВСТУПИТЬ В ХИМИЧЕСКУЮ
РЕАКЦИЮ
КАТАЛИЗАТОР
ВЕЩЕСТВО, ИЗМЕНЯЮЩЕЕ СКОРОСТЬ ХИМИЧЕСКОЙ
РЕАКЦИИ, НО САМО В РЕАКЦИИ НЕ УЧАСТВУЮЩЕЕ
5.
ИНТЕРАКТИВНЫЙ ПЛАКАТОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
ПОНЯТИЕ
ОПРЕДЕЛЕНИЕ
КАТАЛИТИЧЕСКАЯ
РЕАКЦИЯ
РЕАКЦИЯ, ПРОТЕКАЮЩАЯ В ПРИСУТСТВИИ
КАТАЛИЗАТОРА
КОНСТАНТА СКОРОСТИ
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ПРИ ЕДИНИЧНОЙ
КОНЦЕНТРАЦИИ ВСЕХ РЕАГИРУЮЩИХ ВЕЩЕСТВ
ГОМОГЕННЫЙ КАТАЛИЗ
РЕАГЕНТЫ И КАТАЛИЗАТОР
НАХОДЯТСЯ В ОДНОЙ ФАЗЕ
ГЕТЕРОГЕННЫЙ КАТАЛИЗ
РЕАГЕНТЫ И КАТАЛИЗАТОР
НАХОДЯТСЯ В РАЗНЫХ ФАЗАХ
6.
ИНТЕРАКТИВНЫЙ ПЛАКАТОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
ПОНЯТИЕ
ОПРЕДЕЛЕНИЕ
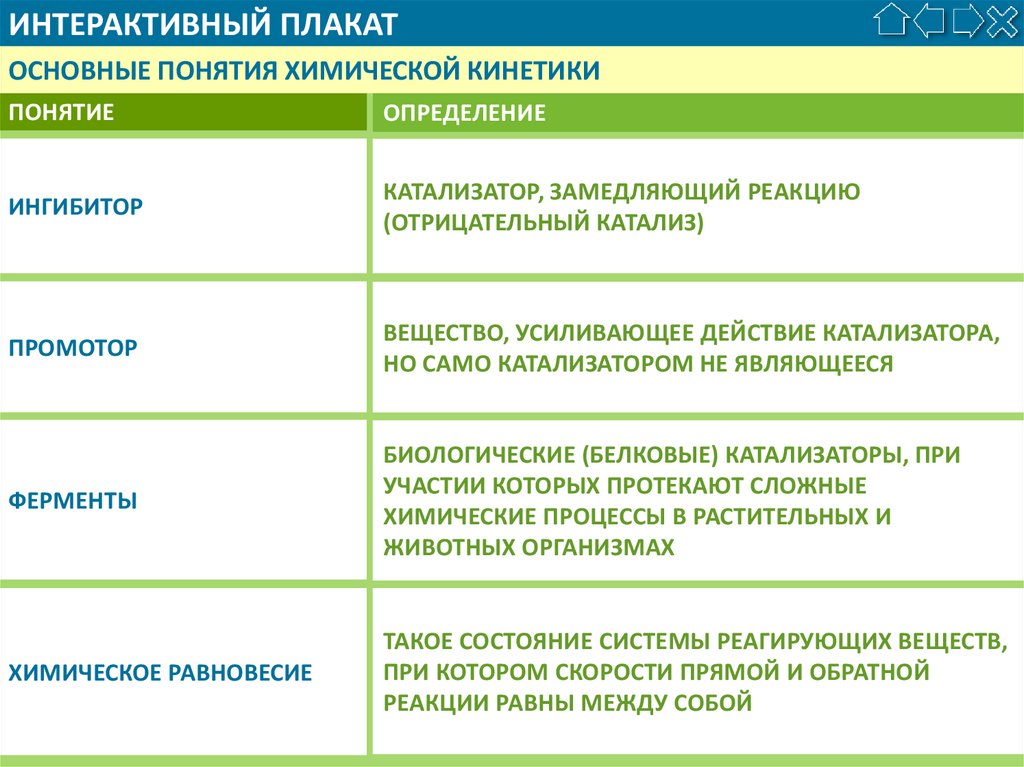
ИНГИБИТОР
КАТАЛИЗАТОР, ЗАМЕДЛЯЮЩИЙ РЕАКЦИЮ
(ОТРИЦАТЕЛЬНЫЙ КАТАЛИЗ)
ПРОМОТОР
ВЕЩЕСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ КАТАЛИЗАТОРА,
НО САМО КАТАЛИЗАТОРОМ НЕ ЯВЛЯЮЩЕЕСЯ
ФЕРМЕНТЫ
БИОЛОГИЧЕСКИЕ (БЕЛКОВЫЕ) КАТАЛИЗАТОРЫ, ПРИ
УЧАСТИИ КОТОРЫХ ПРОТЕКАЮТ СЛОЖНЫЕ
ХИМИЧЕСКИЕ ПРОЦЕССЫ В РАСТИТЕЛЬНЫХ И
ЖИВОТНЫХ ОРГАНИЗМАХ
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
ТАКОЕ СОСТОЯНИЕ СИСТЕМЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ,
ПРИ КОТОРОМ СКОРОСТИ ПРЯМОЙ И ОБРАТНОЙ
РЕАКЦИИ РАВНЫ МЕЖДУ СОБОЙ
7.
ИНТЕРАКТИВНЫЙ ПЛАКАТОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
ЗАКОНОМЕРНОСТЬ
ФОРМУЛИРОВКА
МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ
ДЛЯ РЕАКЦИИ
ЗАКОН ДЕЙСТВУЮЩИХ
МАСС (ОСНОВНОЙ ЗАКОН
ХИМИЧЕСКОЙ КИНЕТИКИ)
СКОРОСТЬ ХИМИЧЕСКОЙ
РЕАКЦИИ ПРОПОРЦИОНАЛЬНА
ПРОИЗВЕДЕНИЮ КОНЦЕНТРАЦИЙ
РЕАГИРУЮЩИХ ВЕЩЕСТВ
A+B⟶C+D,
ИМЕЕМ
Ʋ = k ⋅ CA ⋅ CB , ГДЕ
Ʋ - СКОРОСТЬ,
k - КОНСТАНТА,
CA , CB - КОНЦЕНТРАЦИЯ А И В
ИЛИ
УРАВНЕНИЕ АРРЕНИУСА
МЕЖДУ КОНСТАНТОЙ СКОРОСТИ
ХИМИЧЕСКОЙ РЕАКЦИИ И
ТЕМПЕРАТУРОЙ СУЩЕСТВУЕТ
ЭКСПОНЕНЦИАЛЬНАЯ
ЗАВИСИМОСТЬ
ГДЕ
k – КОНСТАНТА СКОРОСТИ,
А – КОНСТАНТА АРРЕНИУСА (ПОСТОЯННАЯ,
ХАРАКТЕРИЗУЮЩАЯ КАЖДУЮ
КОНКРЕТНУЮ РЕАКЦИЮ),
ЕA – ЭНЕРГИЯ АКТИВАЦИИ
R – УНИВЕРСАЛЬНАЯ ГАЗОВАЯ ПОСТОЯННАЯ,
T – ТЕМПЕРАТУРА
8.
ИНТЕРАКТИВНЫЙ ПЛАКАТОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
ЗАКОНОМЕРНОСТЬ
ФОРМУЛИРОВКА
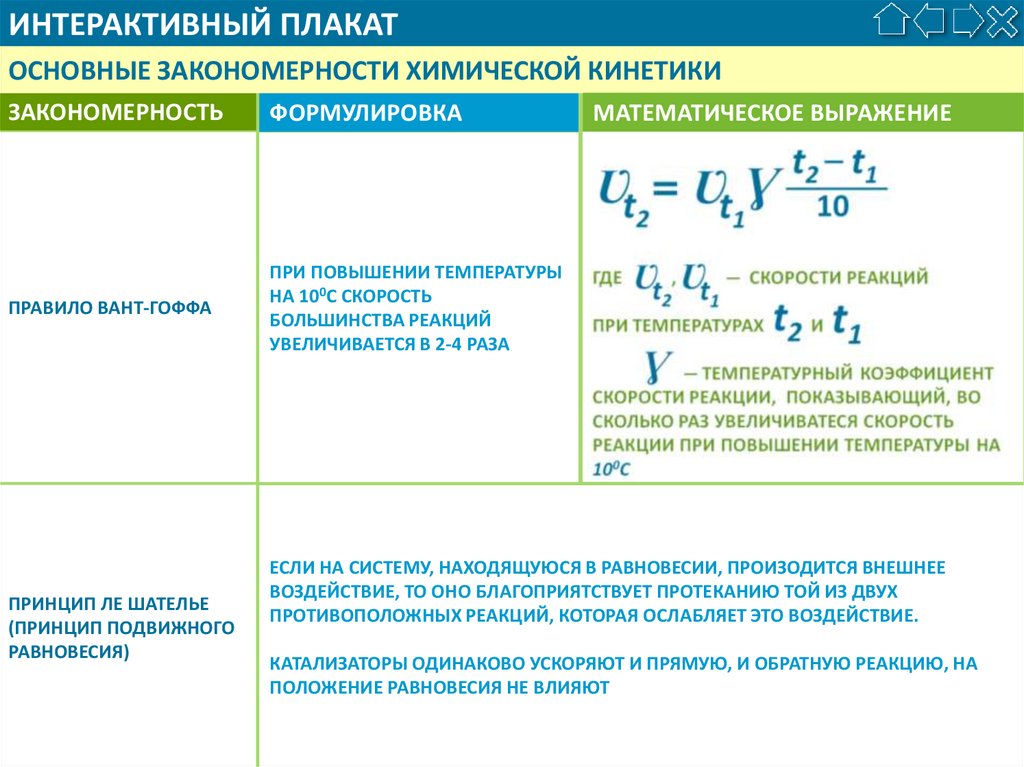
ПРАВИЛО ВАНТ-ГОФФА
ПРИ ПОВЫШЕНИИ ТЕМПЕРАТУРЫ
НА 100С СКОРОСТЬ
БОЛЬШИНСТВА РЕАКЦИЙ
УВЕЛИЧИВАЕТСЯ В 2-4 РАЗА
ПРИНЦИП ЛЕ ШАТЕЛЬЕ
(ПРИНЦИП ПОДВИЖНОГО
РАВНОВЕСИЯ)
МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ
ЕСЛИ НА СИСТЕМУ, НАХОДЯЩУЮСЯ В РАВНОВЕСИИ, ПРОИЗОДИТСЯ ВНЕШНЕЕ
ВОЗДЕЙСТВИЕ, ТО ОНО БЛАГОПРИЯТСТВУЕТ ПРОТЕКАНИЮ ТОЙ ИЗ ДВУХ
ПРОТИВОПОЛОЖНЫХ РЕАКЦИЙ, КОТОРАЯ ОСЛАБЛЯЕТ ЭТО ВОЗДЕЙСТВИЕ.
КАТАЛИЗАТОРЫ ОДИНАКОВО УСКОРЯЮТ И ПРЯМУЮ, И ОБРАТНУЮ РЕАКЦИЮ, НА
ПОЛОЖЕНИЕ РАВНОВЕСИЯ НЕ ВЛИЯЮТ
9.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ОПРЕДЕЛЕНИЯМ:ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ РАВЕН
РАЗНОСТИ СУММ ТЕПЛОТ ОБРАЗОВАНИЯ ПРОДУКТОВ
И СУММ ТЕПЛОТ ОБРАЗОВАНИЯ ИСХОДНЫХ ВЕЩЕСВТ
С УЧЕТОМ СТЕХИОМЕТРИЧЕСКИХ КОЭФФИЦИЕНТОВ
СОСТОЯНИЕ ВЕЩЕСТВА ПРИ 1 АТМ. , 00 С (или 298,15 К и
101 кПа. ДЛЯ ПРОСТЫХ ВЕЩЕСВТ В КАЧЕСТВЕ
СТАНДАРТНОГО ВЫБИРАЮТ НАИБОЛЕЕ УСТОЙЧИВУЮ В
ЭТИХ УСЛОВИЯХ АЛЛОТРОПНУЮ ФОРМУ (УГЛЕРОДА –
ГРАФИТ, ФОСФОРА – БЕЛЫЙ ФОСФОР)
УРАВНЕНИЕ РЕАКЦИИ,
В КОТОРОМ УКАЗАН ТЕПЛОВОЙ ЭФФЕКТ
ТЕПЛОВОЙ ЭФФЕКТ ОБРАЗОВАНИЯ ОДНОГО МОЛЯ
ВЕЩЕСТВА ИЗ ПРОСТЫХ ВЕЩЕСТВ В СТАНДАРТНЫХ
СОСТОЯНИЯХ. ТЕПЛОТА ОБРАЗОВАНИЯ ПРОСТОГО
ВЕЩЕСТВА В СТАНДАРТНОМ СОСТОЯНИИ РАВНА НУЛЮ
КОЛИЧЕСТВО ТЕПЛОТЫ, ВЫДЕЛЕВШЕЕСЯ ИЛИ
ПОГЛОЩЕННОЕ ХИМИЧЕСКОЙ СИСТЕМОЙ ПРИ
ПРОТЕКАНИИ ВНЕЙ ХИМИЧЕСКОЙ РЕАКЦИИ.
ТЕПЛОВОЙ ЭФФЕКТ ОБОЗНАЧАЕТСЯ СИМВОЛАМИ
Q ИЛИ ΔΗ (Q =― ΔΗ)
ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ НЕ
ЗАВИСИТ ОТ ПУТИ РЕАКЦИИ, А ОПРЕДЕЛЯЕТСЯ ТОЛЬКО
СОСТОЯНИЕМ ИСХОДНЫХ ВЕЩЕСТВ И ПРОДУКТОВ
РЕАКЦИИ
проверка
очистка
10.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ОПРЕДЕЛЕНИЯМ:ЭТО УЧЕНИЕ О СКОРОСТИ ХИМИЧЕСКИХ
РЕАКЦИЙ
ЭНЕРГИЯ, КОТОРУЮ НАДО СООБЩИТЬ
МОЛЕКУЛАМ, ЧТОБЫ ОНИ СМОГЛИ
ВСТУПИТЬ В ХИМИЧЕСКУЮ РЕАКЦИЮ
ВЕЩЕСТВО, ИЗМЕНЯЮЩЕЕ СКОРОСТЬ
ХИМИЧЕСКОЙ РЕАКЦИИ, НО САМО В
РЕАКЦИИ НЕ УЧАСТВУЮЩЕЕ
СОВОКУПНОСТЬ ЭЛЕМЕНТАРНЫХ СТАДИЙ
(УСТАНАВЛИВАЕТСЯ
ЭКСПЕРИТМЕНТАЛЬНО)
РЕАКЦИЯ, КОТОРАЯ ПРОТЕКАЕТ
НЕПОСРЕДСТВЕННО ПРИ СТОЛКНОВЕНИИ
МОЛЕКУЛ ИЛИ ПРИ ИХ РАСПАДЕ
ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ОДНОГО ИЗ
РЕАГИРУЮЩИХ ВЕЩЕСТВ ЗА ЕДИНИЦУ
ВРЕМЕНИ
проверка
очистка
11.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ОПРЕДЕЛЕНИЯМ:ТАКОЕ СОСТОЯНИЕ СИСТЕМЫ
РЕАГИРУЮЩИХ ВЕЩЕСТВ, ПРИ КОТОРОМ
СКОРОСТИ ПРЯМОЙ И ОБРАТНОЙ
РЕАКЦИИ РАВНЫ МЕЖДУ СОБОЙ
КАТАЛИЗАТОР, ЗАМЕДЛЯЮЩИЙ РЕАКЦИЮ
(ОТРИЦАТЕЛЬНЫЙ КАТАЛИЗ)
ВЕЩЕСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ
КАТАЛИЗАТОРА, НО САМО
КАТАЛИЗАТОРОМ НЕ ЯВЛЯЮЩЕЕСЯ
БИОЛОГИЧЕСКИЕ (БЕЛКОВЫЕ)
КАТАЛИЗАТОРЫ, ПРИ УЧАСТИИ КОТОРЫХ
ПРОТЕКАЮТ СЛОЖНЫЕ ХИМИЧЕСКИЕ
ПРОЦЕССЫ В РАСТИТЕЛЬНЫХ И
ЖИВОТНЫХ ОРГАНИЗМАХ
РЕАГЕНТЫ И КАТАЛИЗАТОР НАХОДЯТСЯ В
РАЗНЫХ ФАЗАХ
РЕАГЕНТЫ И КАТАЛИЗАТОР НАХОДЯТСЯ В
ОДНОЙ ФАЗЕ
проверка
очистка
12.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ОПРЕДЕЛЕНИЯМ:РЕАКЦИЯ, ПРОТЕКАЮЩАЯ В
ПРИСУТСТВИИ КАТАЛИЗАТОРА
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ПРИ
ЕДИНИЧНОЙ КОНЦЕНТРАЦИИ ВСЕХ
РЕАГИРУЮЩИХ ВЕЩЕСТВ
СОВОКУПНОСТЬ ЭЛЕМЕНТАРНЫХ СТАДИЙ
(УСТАНАВЛИВАЕТСЯ
ЭКСПЕРИТМЕНТАЛЬНО)
ВЕЩЕСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ
КАТАЛИЗАТОРА, НО САМО
КАТАЛИЗАТОРОМ НЕ ЯВЛЯЮЩЕЕСЯ
ВЕЩЕСТВО, ИЗМЕНЯЮЩЕЕ СКОРОСТЬ
ХИМИЧЕСКОЙ РЕАКЦИИ, НО САМО В
РЕАКЦИИ НЕ УЧАСТВУЮЩЕЕ
ТАКОЕ СОСТОЯНИЕ СИСТЕМЫ
РЕАГИРУЮЩИХ ВЕЩЕСТВ, ПРИ КОТОРОМ
СКОРОСТИ ПРЯМОЙ И ОБРАТНОЙ
РЕАКЦИИ РАВНЫ МЕЖДУ СОБОЙ
проверка
очистка
13.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ОПРЕДЕЛЕНИЯМ:ВЕЩЕСТВО, ИЗМЕНЯЮЩЕЕ СКОРОСТЬ
ХИМИЧЕСКОЙ РЕАКЦИИ, НО САМО В РЕАКЦИИ
НЕ УЧАСТВУЮЩЕЕ
РЕАКЦИЯ, ПРОТЕКАЮЩАЯ В ПРИСУТСТВИИ
КАТАЛИЗАТОРА
РЕАГЕНТЫ И КАТАЛИЗАТОР
НАХОДЯТСЯ В РАЗНЫХ ФАЗАХ
ТАКОЕ СОСТОЯНИЕ СИСТЕМЫ РЕАГИРУЮЩИХ
ВЕЩЕСТВ, ПРИ КОТОРОМ СКОРОСТИ ПРЯМОЙ И
ОБРАТНОЙ РЕАКЦИИ РАВНЫ МЕЖДУ СОБОЙ
ВЕЩЕСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ
КАТАЛИЗАТОРА, НО САМО КАТАЛИЗАТОРОМ НЕ
ЯВЛЯЮЩЕЕСЯ
ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ОДНОГО ИЗ
РЕАГИРУЮЩИХ ВЕЩЕСТВ ЗА ЕДИНИЦУ ВРЕМЕНИ
СОВОКУПНОСТЬ ЭЛЕМЕНТАРНЫХ СТАДИЙ
(УСТАНАВЛИВАЕТСЯ ЭКСПЕРИМЕНТАЛЬНО)
ЭТО УЧЕНИЕ О СКОРОСТИ ХИМИЧЕСКИХ
РЕАКЦИЙ
проверка
очистка
14.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ОПРЕДЕЛЕНИЯМ:РЕАКЦИЯ, КОТОРАЯ ПРОТЕКАЕТ
НЕПОСРЕДСТВЕННО ПРИ СТОЛКНОВЕНИИ
МОЛЕКУЛ ИЛИ ПРИ ИХ РАСПАДЕ
ЭНЕРГИЯ, КОТОРУЮ НАДО СООБЩИТЬ
МОЛЕКУЛАМ, ЧТОБЫ ОНИ СМОГЛИ ВСТУПИТЬ В
ХИМИЧЕСКУЮ РЕАКЦИЮ
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ПРИ
ЕДИНИЧНОЙ КОНЦЕНТРАЦИИ ВСЕХ
РЕАГИРУЮЩИХ ВЕЩЕСТВ
КАТАЛИЗАТОР, ЗАМЕДЛЯЮЩИЙ РЕАКЦИЮ
(ОТРИЦАТЕЛЬНЫЙ КАТАЛИЗ)
БИОЛОГИЧЕСКИЕ (БЕЛКОВЫЕ) КАТАЛИЗАТОРЫ,
ПРИ УЧАСТИИ КОТОРЫХ ПРОТЕКАЮТ СЛОЖНЫЕ
ХИМИЧЕСКИЕ ПРОЦЕССЫ В РАСТИТЕЛЬНЫХ И
ЖИВОТНЫХ ОРГАНИЗМАХ
РЕАГЕНТЫ И КАТАЛИЗАТОР
НАХОДЯТСЯ В ОДНОЙ ФАЗЕ
ЭТО УЧЕНИЕ О СКОРОСТИ ХИМИЧЕСКИХ
РЕАКЦИЙ
РЕАГЕНТЫ И КАТАЛИЗАТОР
НАХОДЯТСЯ В РАЗНЫХ ФАЗАХ
проверка
очистка
15.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ФОРМУЛИРОВКАМ:КАТАЛИЗАТОР, ЗАМЕДЛЯЮЩИЙ РЕАКЦИЮ
(ОТРИЦАТЕЛЬНЫЙ КАТАЛИЗ)
ТАКОЕ СОСТОЯНИЕ СИСТЕМЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ,
ПРИ КОТОРОМ СКОРОСТИ ПРЯМОЙ И ОБРАТНОЙ
РЕАКЦИИ РАВНЫ МЕЖДУ СОБОЙ
ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ОДНОГО ИЗ
РЕАГИРУЮЩИХ ВЕЩЕСТВ ЗА ЕДИНИЦУ ВРЕМЕНИ
ЭНЕРГИЯ, КОТОРУЮ НАДО СООБЩИТЬ МОЛЕКУЛАМ,
ЧТОБЫ ОНИ СМОГЛИ ВСТУПИТЬ В ХИМИЧЕСКУЮ
РЕАКЦИЮ
ВЕЩЕСТВО, ИЗМЕНЯЮЩЕЕ СКОРОСТЬ ХИМИЧЕСКОЙ
РЕАКЦИИ, НО САМО В РЕАКЦИИ НЕ УЧАСТВУЮЩЕЕ
СОВОКУПНОСТЬ ЭЛЕМЕНТАРНЫХ СТАДИЙ
(УСТАНАВЛИВАЕТСЯ ЭКСПЕРИМЕНТАЛЬНО)
РЕАГЕНТЫ И КАТАЛИЗАТОР
НАХОДЯТСЯ В ОДНОЙ ФАЗЕ
ЭТО УЧЕНИЕ О СКОРОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ПРИ ЕДИНИЧНОЙ
КОНЦЕНТРАЦИИ ВСЕХ РЕАГИРУЮЩИХ ВЕЩЕСТВ
ВЕЩЕСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ КАТАЛИЗАТОРА,
НО САМО КАТАЛИЗАТОРОМ НЕ ЯВЛЯЮЩЕЕСЯ
проверка
очистка
16.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ФОРМУЛИРОВКАМ:БИОЛОГИЧЕСКИЕ (БЕЛКОВЫЕ) КАТАЛИЗАТОРЫ, ПРИ
УЧАСТИИ КОТОРЫХ ПРОТЕКАЮТ СЛОЖНЫЕ
ХИМИЧЕСКИЕ ПРОЦЕССЫ В РАСТИТЕЛЬНЫХ И
ЖИВОТНЫХ ОРГАНИЗМАХ
РЕАКЦИЯ, ПРОТЕКАЮЩАЯ В ПРИСУТСТВИИ
КАТАЛИЗАТОРА
РЕАКЦИЯ, КОТОРАЯ ПРОТЕКАЕТ НЕПОСРЕДСТВЕННО
ПРИ СТОЛКНОВЕНИИ МОЛЕКУЛ ИЛИ ПРИ ИХ РАСПАДЕ
ЭНЕРГИЯ, КОТОРУЮ НАДО СООБЩИТЬ МОЛЕКУЛАМ,
ЧТОБЫ ОНИ СМОГЛИ ВСТУПИТЬ В ХИМИЧЕСКУЮ
РЕАКЦИЮ
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ПРИ ЕДИНИЧНОЙ
КОНЦЕНТРАЦИИ ВСЕХ РЕАГИРУЮЩИХ ВЕЩЕСТВ
РЕАГЕНТЫ И КАТАЛИЗАТОР
НАХОДЯТСЯ В РАЗНЫХ ФАЗАХ
ТАКОЕ СОСТОЯНИЕ СИСТЕМЫ РЕАГИРУЮЩИХ
ВЕЩЕСТВ, ПРИ КОТОРОМ СКОРОСТИ ПРЯМОЙ И
ОБРАТНОЙ РЕАКЦИИ РАВНЫ МЕЖДУ СОБОЙ
СОВОКУПНОСТЬ ЭЛЕМЕНТАРНЫХ СТАДИЙ
(УСТАНАВЛИВАЕТСЯ ЭКСПЕРИМЕНТАЛЬНО)
ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ОДНОГО ИЗ
РЕАГИРУЮЩИХ ВЕЩЕСТВ ЗА ЕДИНИЦУ ВРЕМЕНИ
ВЕЩЕСТВО, ИЗМЕНЯЮЩЕЕ СКОРОСТЬ ХИМИЧЕСКОЙ
РЕАКЦИИ, НО САМО В РЕАКЦИИ НЕ УЧАСТВУЮЩЕЕ
проверка
очистка
17.
ВЫБЕРИТЕ НАЗВАНИЯ ПО ФОРМУЛИРОВКАМ:ПРИ ПОВЫШЕНИИ ТЕМПЕРАТУРЫ НА 100С
СКОРОСТЬ БОЛЬШИНСТВА РЕАКЦИЙ
УВЕЛИЧИВАЕТСЯ В 2-4 РАЗА
МЕЖДУ КОНСТАНТОЙ СКОРОСТИ ХИМИЧЕСКОЙ
РЕАКЦИИ И ТЕМПЕРАТУРОЙ СУЩЕСТВУЕТ
ЭКСПОНЕНЦИАЛЬНАЯ ЗАВИСИМОСТЬ
ЕСЛИ НА СИСТЕМУ, НАХОДЯЩУЮСЯ В
РАВНОВЕСИИ, ПРОИЗОДИТСЯ ВНЕШНЕЕ
ВОЗДЕЙСТВИЕ, ТО ОНО БЛАГОПРИЯТСТВУЕТ
ПРОТЕКАНИЮ ТОЙ ИЗ ДВУХ
ПРОТИВОПОЛОЖНЫХ РЕАКЦИЙ, КОТОРАЯ
ОСЛАБЛЯЕТ ЭТО ВОЗДЕЙСТВИЕ.
КАТАЛИЗАТОРЫ ОДИНАКОВО УСКОРЯЮТ И
ПРЯМУЮ, И ОБРАТНУЮ РЕАКЦИЮ, НА
ПОЛОЖЕНИЕ РАВНОВЕСИЯ НЕ ВЛИЯЮТ
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
ПРОПОРЦИОНАЛЬНА ПРОИЗВЕДЕНИЮ
КОНЦЕНТРАЦИЙ РЕАГИРУЮЩИХ ВЕЩЕСТВ
проверка
очистка
18.
ИНТЕРАКТИВНЫЙ ПЛАКАТПРИ РАЗРАБОТКЕ ИНТЕРАКТИВНОГО ПЛАКАТА ИСПОЛЬЗОВАЛАСЬ ЛИТЕРАТУРА:
ХИМИЯ В ТАБЛИЦАХ. 8-11 КЛ.: СПРАВОЧНОЕ ПОСОБИЕ/АВТ.-СОСТ. А. Е.
НАСОНОВА. – 16-Е ИЗД., СТЕРЕОТИП. – М.: ДРОФА, 2013. – 92, [4] С.: ИЛ.
РАЗРАБОТКА ИНТЕРАКТИВНОГО ПЛАКАТА СТРЕЛЬНИКОВОЙ ВИКТОРИИ ВИКТОРОВНЫ,
МЕТОДИСТА ОТДЕЛА НАУЧНО-МЕТОДИЧЕСКОГО ОБЕСПЕЧЕНИЯ ОБРАЗОВАТЕЛЬНОЙ ДЕЯТЕЛЬНОСТИ ГБОУ ИРО КК (АРМАВИРСКИЙ ФИЛИАЛ), 2017 Г.
















 Химия
Химия








