Похожие презентации:
Ацетоуксусный эфир
1.
Ацетоуксусный эфир2.
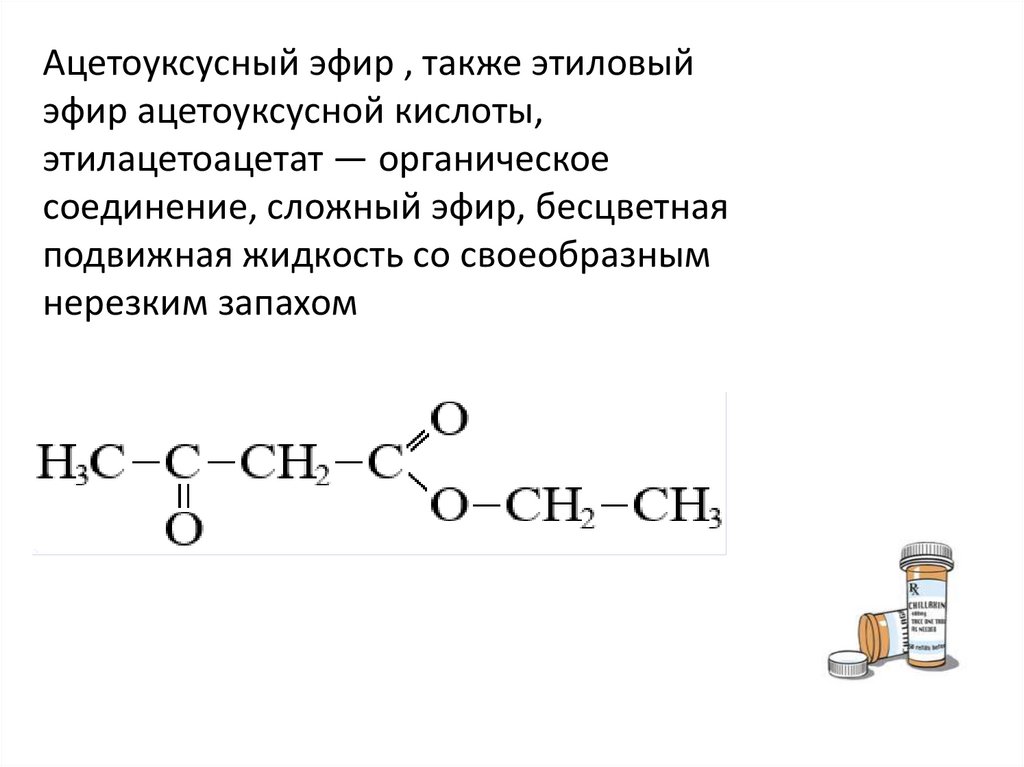
Ацетоуксусный эфир , также этиловыйэфир ацетоуксусной кислоты,
этилацетоацетат — органическое
соединение, сложный эфир, бесцветная
подвижная жидкость со своеобразным
нерезким запахом
3.
Сложно эфирная конденсацияКляйзена
Ацетоуксусный эфир образуется при конденсации двух молекул
этилацетата под действием этилата натрия:
4.
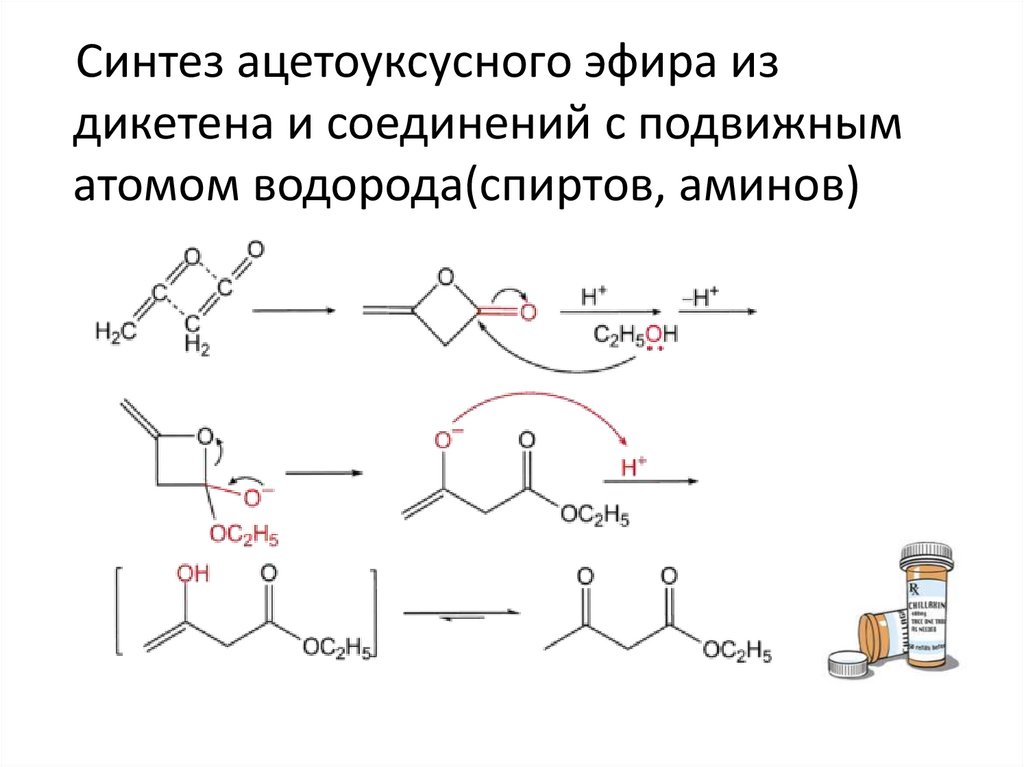
Синтез ацетоуксусного эфира издикетена и соединений с подвижным
атомом водорода(спиртов, аминов)
5.
Синтез из сложного эфира и натрияКлассическим методом синтеза ацетоуксусного эфира
является сложноэфирная конденсация этилацетата в
присутствии этанола под действием металлического натрия
6.
Кето- енольная таутомерияСогласно правилу Эльтекова енольные формы карбонильных
соединений неустойчивы. Однако в ряде случаев енольные формы
могут быть достаточно стабильными. Например, енольный
таутомер стабилизирован за счет образования сопряжённой
системы ( (H):О—C(CH3)=C(H) —C(:OC2H5)=O: ; см. 2-ю формулу
енольной формы на рис., R — CH3, R’ — C2H5) и
внутримолекулярной водородной связи между протоном и
соседним карбонильным кислородом.
7.
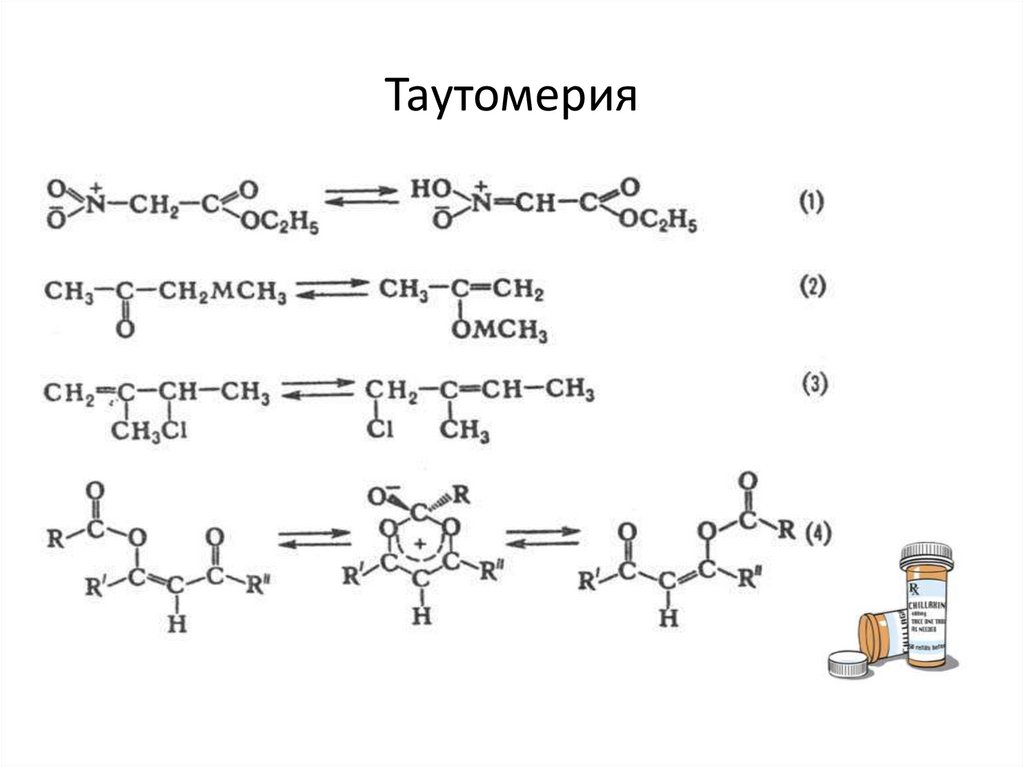
ТаутомерияИзомерия, при к-рой происходит быстрое обратимое самопроизвольное
взаимопревращение структурных изомеров-таутомеров. При
установившемся равновесии в-во содержит
одновременно молекулы таутомеров в определенном соотношении.
Процесс такою взаимопревращения таутомеров называется
таутомеризацией. Она протекает с обязательным разрывом одних хим.
связей и образованием др. связей
между атомами одной молекулы (внутримолекулярная таутомерия) или
агрегата молекул (межмолекулярная таутомерия). В большинстве
таутомерных систем процессы разрыва-образования связей можно
представить как миграцию определенной атомной группы между двумя или
неск. центрами в молекуле. Таутомеризация может происходить в результате
миграции катионов (катионотропная таутомерия). Очень важной
мигрирующей группой является протон, и потому главный вид таутомериипрототропная таутомерия(1). Мигрирующими группами м.
б. металлы (метал-лотропия)(2), анионы (анионотропия)(3), ацильные
группы (ацилотропия)(4) и др.
8.
Таутомерия9.
Кислотный и щелочной катализтаутомерного превращения
Кислотный и щелочной катализ таутомерного превращения ацетоуксусной
кислоты - это процессы, связанные с изменением распределения двойных
связей и протонов в молекуле ацетоуксусной кислоты, что приводит к
образованию двух изомерных форм этого соединения - энольной (таутомер)
и кетоной формы.
10.
Кислотный катализ таутомерногопревращения
В кислотном катализе таутомерного превращения ацетоуксусной кислоты,
кислота служит катализатором реакции, то есть ускоряет процесс
таутомеризации. Это происходит путем передачи протона (H+) с активного
центра кислоты на атом кислорода ацетоуксусной кислоты, образуя
карбониевый катион. Карбониевый катион затем стабилизируется
перераспределением электронов, включая сдвиг двойной связи и протона
на другие атомы. Таким образом, образуется энольная форма
ацетоуксусной кислоты.
11.
Щелочной катализ таутомерногопревращения
В щелочном катализе таутомерного превращения ацетоуксусной кислоты,
роль катализатора выполняет щелочь. Щелочная молекула принимает протон
от ацетоуксусной кислоты, образуя оксиониевый катион. Затем протон
передается от карбониевого катиона кислого оксигруппового атома кислоты к
оксиониевому катиону, образуя одновременно кетонную форму
ацетоуксусной кислоты и щелочь. Полученный кетон может обратно
превратиться в кислоту путем передачи протона обратно с помощью щелочи.
12.
Отличие таутомерии от мезомерииМезомерия относится к явлению, при котором молекула может быть
представлена в виде гибридной структуры (обычно состоящей из
нескольких резонирующих структур), которая объясняет наблюдаемые
свойства. Мезомерные структуры различаются распределением двойных
связей и заряда по молекуле, при этом они не обладают разной
расстановкой атомов и связей, как в случае с таутомерией.
Таким образом, отличие таутомерии от мезомерии заключается в том, что
таутомерия связана с изменением распределения протона или
протонированных групп, в то время как мезомерия связана с изменением
распределения электронов и образованием резонирующих структур.
13.
Получение кетоной и енольной формыОбе формы эфира могут быть получены в свободном состоянии: кетонная
– вымораживанием (она плавится при более высокой температуре),
енольная – перегонкой в кварцевой посуде (кипит при более низкой
температуре, чем кетонная форма)
14.
Подтверждения существования таутомеров, ихравновесия
Спектроскопия, включая применение ультрафиолетовой, видимой и
инфракрасной спектроскопии. Измерение волновых длин поглощения и
отражения света на молекуле позволяет определить, какие структуры
присутствуют и в каком количестве. Сравнение экспериментальных спектров с
расчетными спектрами для различных изомеров позволяет установить, какие
таутомеры существуют в системе и их относительное количество.
Хроматографические методы, такие как жидкостная и газовая хроматография,
позволяют разделить смесь компонентов на основе их различий в
взаимодействии с стационарной и мобильной фазами. Если смесь содержит
таутомеры, они могут проявить различную скорость или энергию
взаимодействия с фазами, что приводит к разделению их на хроматограмме.
Также, теоретические расчеты играют важную роль в подтверждении
существования таутомеров. Методы компьютерного моделирования позволяют
предсказывать энергетические уровни и структуры различных изомеров, а также
определить энергию активации для перехода между ними. Сравнение
расчетных данных с экспериментальными результатами позволяет подтвердить
наличие таутомеров и их равновесие в системе.
15.
Предельные структуры, делокализацияотрицательного заряда
В случае ацетоуксусного эфира, одна из возможных предельных структур
предполагает две двойные связи - между кислородом и атомом углерода
с метиловой группой, и между кислородом и атомом углерода с
этиловым остатком. Это позволяет делокализовать отрицательный заряд,
возникающий на атоме кислорода, на все четыре атома углерода. В этой
предельной структуре каждый из атомов углерода имеет формальный
положительный заряд, а кислород - отрицательный. Это распределение
зарядов обусловлено общей электронной плотностью,
делокализованной по всей молекуле.
Однако следует отметить, что реальная структура ацетоуксусного эфира
является гибридной комбинацией нескольких предельных структур и
состоит из равновесного сочетания этих структур. Это означает, что в
молекуле ацетоуксусного эфира происходит некая молекулярная
колебательная вибрация, при которой электронная плотность
перераспределяется между различными атомами. Этот процесс
булевской колебательной структуры называется делокализацией
отрицательной зарядной плотности.
16.
Реакционные центры: этоксикарбонильная,карбонильная и метиленовая
Этоксикарбонильная группа представляет собой углеродную
карбонильную группу (С=O), которая присоединена к остатку этанола
(CH3-CH2-O-). Это типичное свойство эфиров, и оно определяет их
реакционную способность. Этоксикарбонильная группа может быть
подвержена различным химическим реакциям, включая гидролиз,
окисление и замещение на другие функциональные группы.
Карбонильная группа (С=О) также является реакционным центром
ацетоуксусного эфира. Карбонильная группа является функциональной
группой, содержащей атом кислорода, связанный с углеродом двойной
связи. Она является ключевым компонентом при многих реакциях
органического синтеза, включая аддицию нуклеофилов и окисление.
Метиленовая группа (СН2) представляет собой углеродный фрагмент,
который связан с двумя атомами водорода. Она имеет два свободных
электронных параметра и может участвовать в различных реакциях,
включая аддицию, элиминации и замещение.
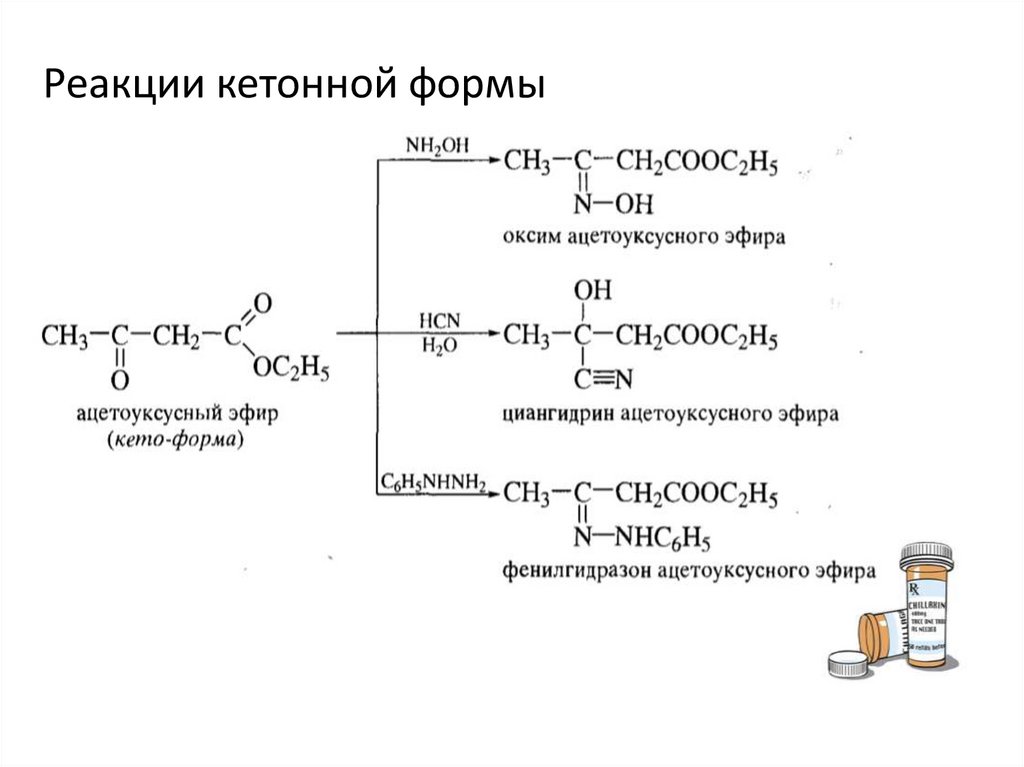
17.
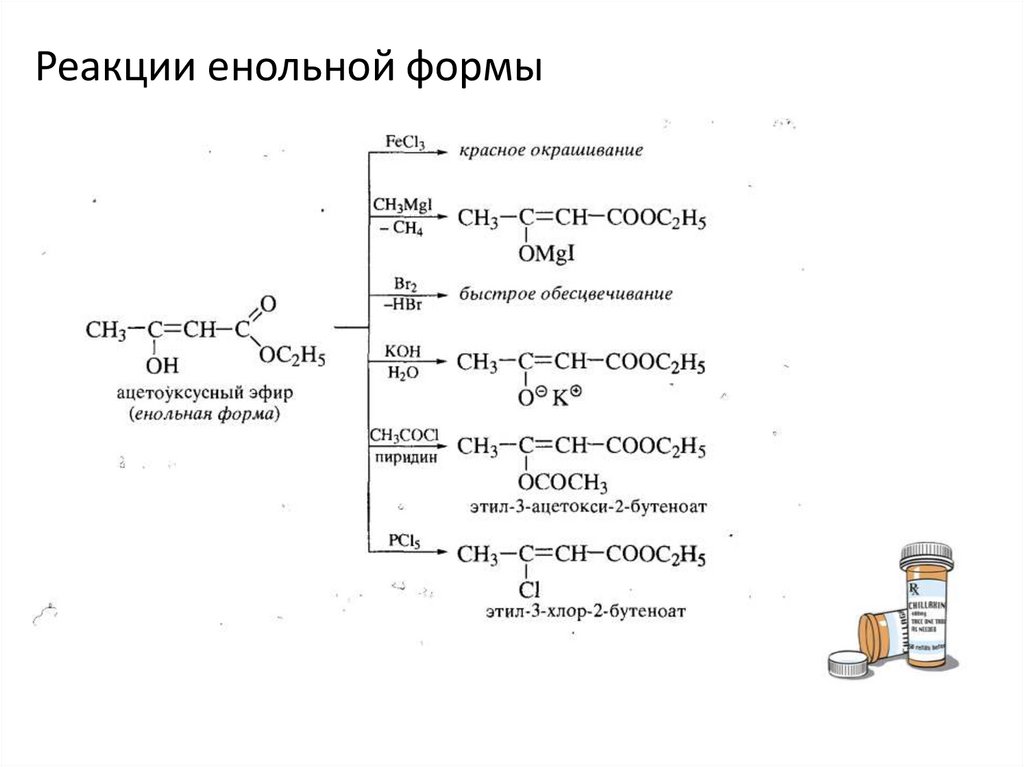
Реакции кетонной формы18.
Реакции енольной формы19.
С- и O- алкилированиеПри проведении реакции в спирте более электроотрицательный атом
кислорода енолят-иона сильно сольватирован, вследствие чего большую
нуклеофильность проявляет атом углерода. Эти условия способствуют Салкилированию. В диметилформаниде оба нуклеофильных центра не
сольватированы, вследствие чего преимущественно наблюдается реакция
О-алкилирования
20.
С- и O- алкилированиеАцетоуксусный эфир может реагировать с алкилирующими агентами не
только по метиленовой, но и по метильной группе. Эти два реакционных
центра ацетоуксусного эфира существенно различаются по кислотности:
ионизация по метиленовой группе оценивается значением pKa 10,7, а
ионизация по метильной группе – значением pKa ~20.
21.
С- и O- алкилированиеПоэтому при применении 1 моль основания в качестве реакционного
центра, конкурирующего с О-атомом в реакции с галогеналканом,
выступает только карбанион, образовавшийся при ионизации
метиленовой группы. При применении 2 моль сильного основания(
например, литийдиизопропиламида) оба СН-кислотных центра
ацетоуксусного эфира подвергаются ионизации. При этом карбанион,
образующийся при ионизации метильной группы, является более
сильным основанием(как сопряженное основание более слабой
кислоты), а следовательно, и более сильным нуклеофилом. Именно этот
реакционный центр будет реагировать при прочих равных условиях с
галогеналканом
22.
Енолятный анион ацетоуксусного эфира амбидентный нуклеофил с мягкими ижесткими центрами
Енолятный анион ацетоуксусного эфира может быть описан как
амбидентный нуклеофил с мягкими и жёсткими центрами. Это означает,
что этот анион может действовать как нуклеофил, образуя химическую
связь с электрофильным центром в химической реакции.
Мягкие и жёсткие центры относятся к электрофильным центрам, с
которыми может связываться анион. Мягкие центры имеют более
низкую электроотталкивающую способность и предпочтительно
связываются с нуклеофилами, которые обладают более высокими
электронными плотностями. Жёсткие центры, с другой стороны, имеют
высокую электроотталкивающую способность и обычно предпочитают
связываться с нуклеофилами, обладающими более низкими
электронными плотностями.
23.
Енолятный анион ацетоуксусного эфира амбидентный нуклеофил с мягкими ижесткими центрами
Енолятный анион ацетоуксусного эфира по сути является двухцентровым
нуклеофилом, то есть он обладает двумя электронными центрами,
которые могут реагировать с электрофильными центрами. Он
образуется при депротонировании ацетоуксусного эфира сильными
основаниями, такими как гидроксид натрия или амид натрия.
Когда эти анионы реагируют с электрофильными центрами, такими как
карбонильные соединения или электрофильные алкилы, происходит
образование новых химических связей. Мягкий центр этих анионов
может взаимодействовать с электрофильными центрами, которые
обладают более высокими электронными плотностями, тогда как
жёсткий центр будет предпочитать реагировать с электрофильными
центрами, обладающими более низкими электронными плотностями.
24.
Влияние на ход алкилирования природыалкилирующего реагента
Природа алкилирующего реагента играет важную роль в ходе
алкилирования. Различные алкилирующие реагенты могут иметь
разную реакционную активность и способность образовывать
стабильные промежуточные соединения. Например, сильные
электрофилы, такие как алкилгалогены (например, хлориды или
бромиды), могут легко алкилировать нуклеофилы, такие как амин или
гидроксид, и образовывать стабильные продукты алкилирования. С
другой стороны, менее реакционноспособные алкилирующие реагенты,
такие как алкилсульфонаты или алкилфосфаты, могут требовать более
жестких условий реакции или использования катализаторов для
успешного алкилирования.
25.
Влияние на ход алкилирования енолят-ионаЕнолят-ион – это анион, образующийся при депротонировании енола
или энолатного аниона. Енолят-ионы обладают высокой
нуклеофильностью и могут реагировать с электрофильными
алкилирующими реагентами. Они могут образовывать стабильные
промежуточные соединения, такие как енолаты, которые могут дальше
реагировать с электрофильными реагентами. Енолаты могут быть
использованы для алкилирования различных функциональных групп,
таких как карбонильные соединения или аминогруппы. Влияние енолятиона на ход алкилирования заключается в его способности
образовывать стабильные промежуточные соединения и реагировать с
электрофильными реагентами.
26.
Влияние на ход алкилирования средыСреда, в которой происходит алкилирование, может оказывать
значительное влияние на ход реакции. Например, реакции
алкилирования, проводимые в протических средах, таких как вода или
спирты, могут протекать с участием протонов, что может способствовать
образованию стабильных промежуточных соединений и повысить
скорость реакции. С другой стороны, реакции алкилирования,
проводимые в апротических средах, таких как ацитонитрил или
диметилсульфоксид, могут протекать без участия протонов и требовать
использования сильных оснований или катализаторов для активации
алкилирующего реагента. Также, среда может влиять на растворимость
реагентов и продуктов, что может оказывать влияние на их
взаимодействие и ход реакции.
27.
Принцип ПирсонаПринцип Пирсона для ацетоуксусного эфира основан на том, что
реакция между ацетоуксусным эфиром и нуклеофилом происходит с
образованием карбокатиона. Этот карбокатион может быть
стабилизирован различными эффектами, такими как индуктивный
эффект, гиперконъюгация и сопряжение.
Карбокатион в реакции ацетоуксусного эфира может быть
стабилизирован индуктивным эффектом, гиперконъюгацией и
сопряжением. Индуктивный эффект обусловлен
электроотрицательностью атомов, которые окружают карбокатион.
Гиперконъюгация возникает, когда электронная плотность
перераспределяется между пи-связями и зарядом карбокатиона.
Сопряжение происходит, когда пи-электроны могут перемещаться по
сопряженной системе двойных связей. Стабильность карбокатиона в
реакции ацетоуксусного эфира зависит от электроотрицательности
атомов, которые окружают карбокатион, а также от наличия
сопряженных пи-связей и гиперконъюгации. Чем больше
электроотрицательность атомов, тем больше стабильность
карбокатиона. Также наличие сопряженных пи-связей и
гиперконъюгации увеличивает стабильность карбокатиона.
28.
Принцип ПирсонаПринцип Пирсона применяется к реакции ацетоуксусного эфира путем
анализа структуры и электроотрицательности атомов, которые окружают
карбокатион. Чем больше электроотрицательность атомов, тем больше
стабильность карбокатиона. Это позволяет предсказать, какие
нуклеофилы будут наиболее эффективными в реакции с ацетоуксусным
эфиром.
29.
Действие хлорида железа 3 и бромаЕнол ацетоуксусного эфира проявляет ОН кислотность и подобно фенолу
дает красное окрашивание с хлоридом железа 3, обесцвечивается
раствором брома
30.
Синтезы на основе ацетоуксусного эфираНа основе ацетоуксусного эфира можно провести различные синтезы,
включая:
- Синтезы гетероциклических соединений, таких как пиразолы,
пиридины и индолы.
- Синтезы карбоновых кислот, например, ацетоуксусной кислоты и ее
производных.
- Синтезы эфиров, амидов и эстеров.
- Синтезы альдегидов и кетонов.
31.
Синтезы на основе ацетоуксусного эфираДля получения гетероциклических соединений на основе
ацетоуксусного эфира можно провести следующие реакции:
-Конденсацию с гидразином для получения пиразолов.
-Реакцию с аммиаком и аминами для получения пиридинов.
- Реакцию с анилином для получения индолов.
Для получения карбоновых кислот на основе ацетоуксусного эфира
можно провести следующие реакции:
- Гидролиз эфира в щелочной среде для получения ацетоуксусной
кислоты.
- Окисление эфира с помощью калия перманганата или хромовой
кислоты для получения карбоновых кислот.
Для получения эфиров, амидов и эстеров на основе ацетоуксусного
эфира можно провести следующие реакции:
-Реакцию с алкоголями для получения эфиров.
- Реакцию с аминами для получения амидов.
- Реакцию с карбоновыми кислотами для получения эстеров.
32.
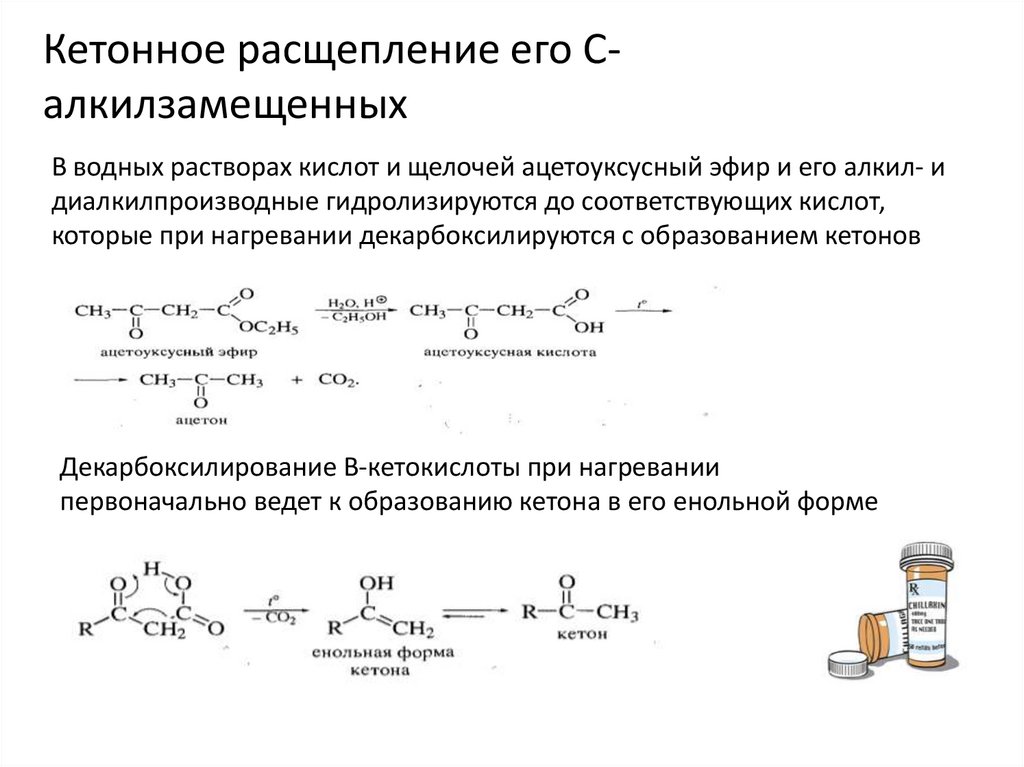
Кетонное расщепление его СалкилзамещенныхВ водных растворах кислот и щелочей ацетоуксусный эфир и его алкил- и
диалкилпроизводные гидролизируются до соответствующих кислот,
которые при нагревании декарбоксилируются с образованием кетонов
Декарбоксилирование B-кетокислоты при нагревании
первоначально ведет к образованию кетона в его енольной форме
33.
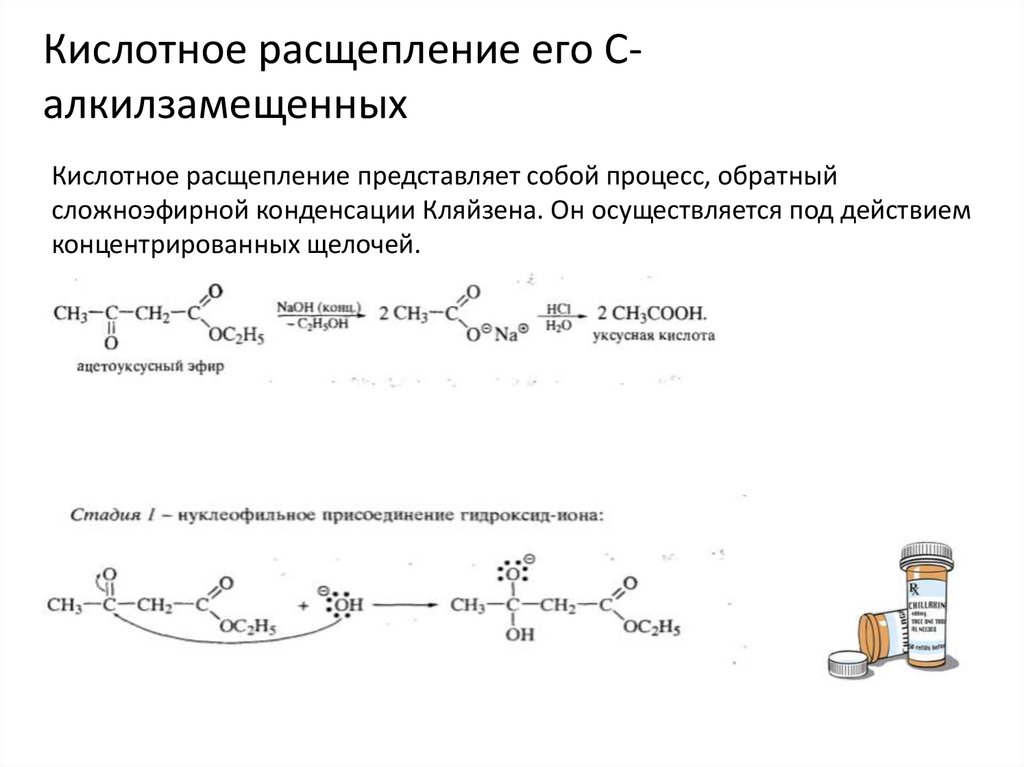
Кислотное расщепление его СалкилзамещенныхКислотное расщепление представляет собой процесс, обратный
сложноэфирной конденсации Кляйзена. Он осуществляется под действием
концентрированных щелочей.
34.
Кислотное расщепление его СалкилзамещенныхЕсли кислотному расщеплению подвергается алкил- или
диалкилацетоуксусный эфир, то наряду с уксусной кислотой образуется
моно- или диалкилуксусная кислота
35.
Получение метилкетонов36.
Получение гомологов уксусной кислотыБлижайших гомологов: муравьиную, масляную, пропионовую, капроновую
и валериановую.
Валериановую кислоту можно рассматривать как продукт замещения в
уксусной кислоте дного атома водорода на н-пропильную группу.
Следовательно, для получения этого соединения пред кислотным
расщеплением в ацетоуксусный эфир необходимо ввести н-пропильную
группу.
37.
Получение лекарственных средствАцетоуксусный эфир может быть использован в синтезе аминоалканов,
которые являются важными компонентами многих лекарственных веществ.
Также ацетоуксусный эфир может быть использован в синтезе
гетероциклических соединений, которые также могут быть
лекарственными веществами.
38.
Получение лекарственных средств, красителей,производных пиридина
Ацетоуксусный эфир может быть использован в синтезе аминоалканов,
которые являются важными компонентами многих лекарственных веществ.
Также ацетоуксусный эфир может быть использован в синтезе
гетероциклических соединений, которые также могут быть
лекарственными веществами.
Ацетоуксусный эфир может быть использован в синтезе азокрасителей,
которые являются одним из наиболее распространенных классов
красителей. Также ацетоуксусный эфир может быть использован в синтезе
индиго, который является одним из самых известных органических
красителей.
Ацетоуксусный эфир может быть использован в синтезе никотиновой
кислоты, которая является производным пиридина и имеет важное
значение в биохимии. Также ацетоуксусный эфир может быть использован
в синтезе других производных пиридина, таких как пиридиновые красители
или фармацевтические препараты.































 Химия
Химия