Похожие презентации:
Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины
1.
Функциональные производные скратной связью C=“Э”
Часть 1
Карбонильные соединения и имины
Физтех, 1 курс. Весна 2016
1
2.
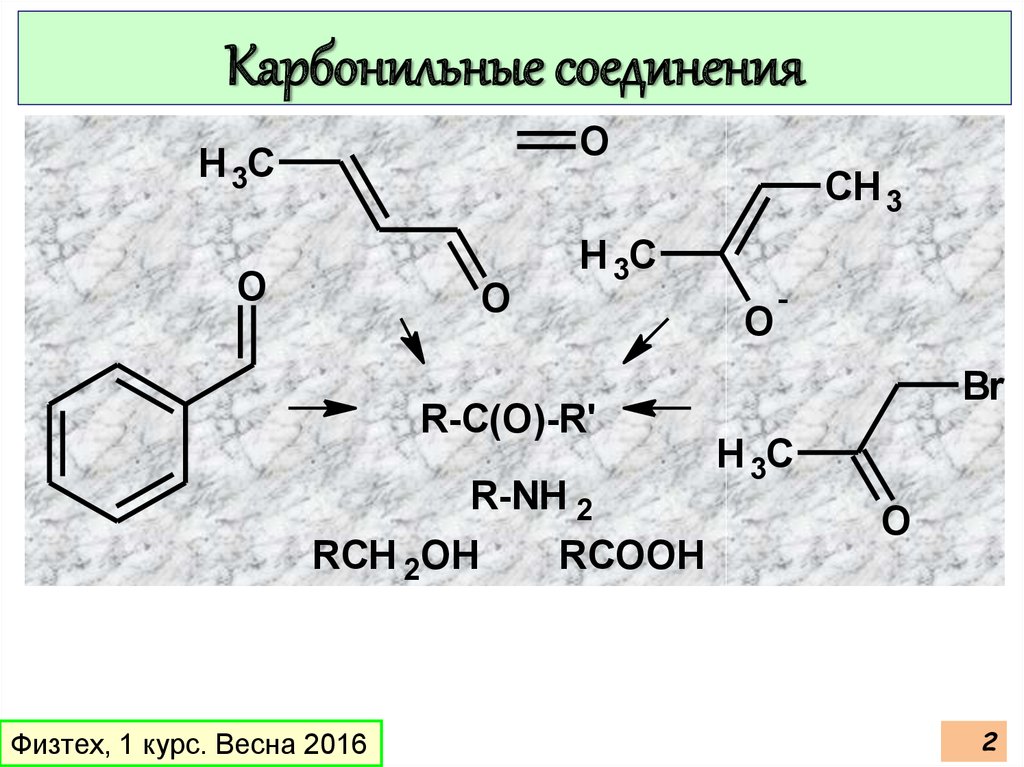
Карбонильные соединенияO
H 3C
CH 3
O
O
H 3C
O
R-C(O)-R'
R-NH 2
RCH 2OH
Физтех, 1 курс. Весна 2016
RCOOH
-
Br
H 3C
O
2
3.
Карбонильные соединенияЭлектрофильность
Стабильность
Физтех, 1 курс. Весна 2016
3
4.
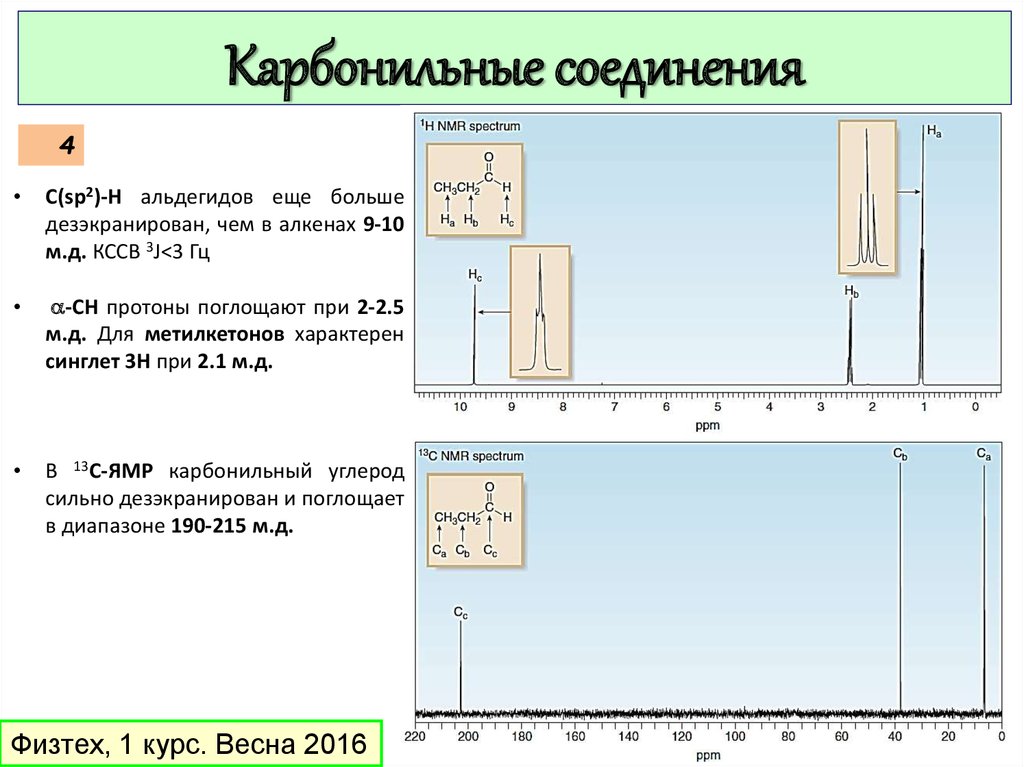
Карбонильные соединения4
C(sp2)-H альдегидов еще больше
дезэкранирован, чем в алкенах 9-10
м.д. КССВ 3J<3 Гц
a-CH протоны поглощают при 2-2.5
м.д. Для метилкетонов характерен
синглет 3H при 2.1 м.д.
В 13С-ЯМР карбонильный углерод
сильно дезэкранирован и поглощает
в диапазоне 190-215 м.д.
Физтех, 1 курс. Весна 2016
5.
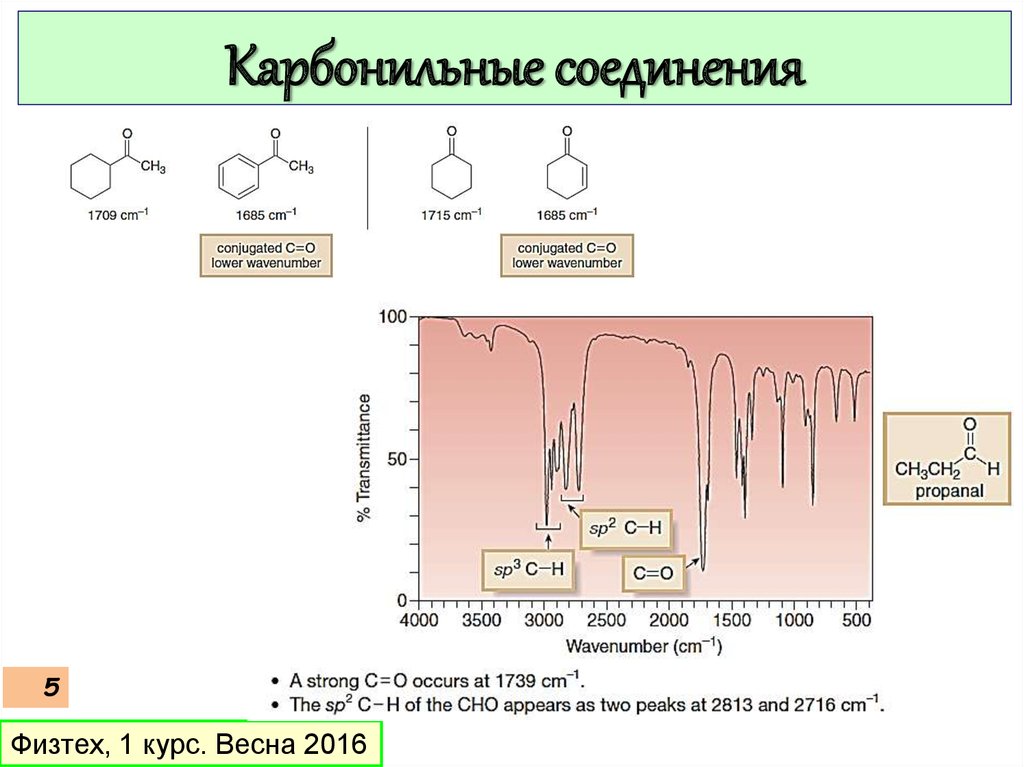
Карбонильные соединения5
Физтех, 1 курс. Весна 2016
6.
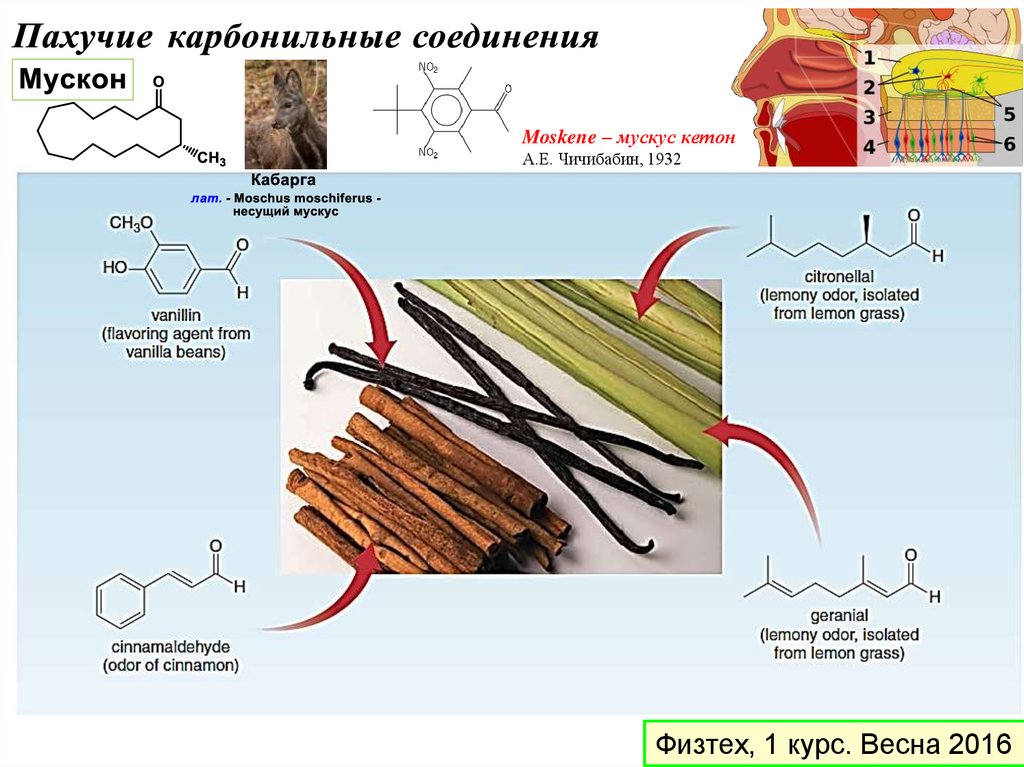
Moskene – мускус кетонА.Е. Чичибабин, 1932
Физтех, 1 курс. Весна 2016
7.
Linda B. Buck & Richard Axel NPPM, 2004Генезис обоняния:
Физтех, 1 курс. Весна 2016
8.
Карбонильные соединения, ФСОсновность
Кислотность α-С-Н связей
Енол является на несколько порядков более сильной О-Н кислотой, чем кетон С-H
кислотой. Соотношение кетонной и енольной форм прямо пропорционально отношению
величин рКа двух этих форм, т.е. обратно пропорционально кислотности двух форм. Чем
более слабой С-H кислотой является кето-форма, тем выше ее содержание в смеси двух
таутомеров.
Физтех, 1 курс. Весна 2016
8
9.
Карбонильные соединения, ФСАльдегиды – более реакционноспособные соединения чем
кетоны в реакциях нуклеофильного присоединения
Более высокая реакционная способность альдегидов связана с:
а) отсутствием стерических препятствий для атаки нуклеофильного агента
б) более высокой термодинамической стабильностью кетонов по сравнению с
альдегидами
1) гиперконъюгация σ-связи С-Н-α-углеродного атома и частично
пустой p-орбитали карбонильного углерода
приводит к делокализации
заряда
2) (+I)-эффект алкильной группы при карбонильном атоме
углерода также приводит к делокализации
положительного
заряда по цепи углеродных связей
Физтех, 1 курс. Весна 2016
9
10.
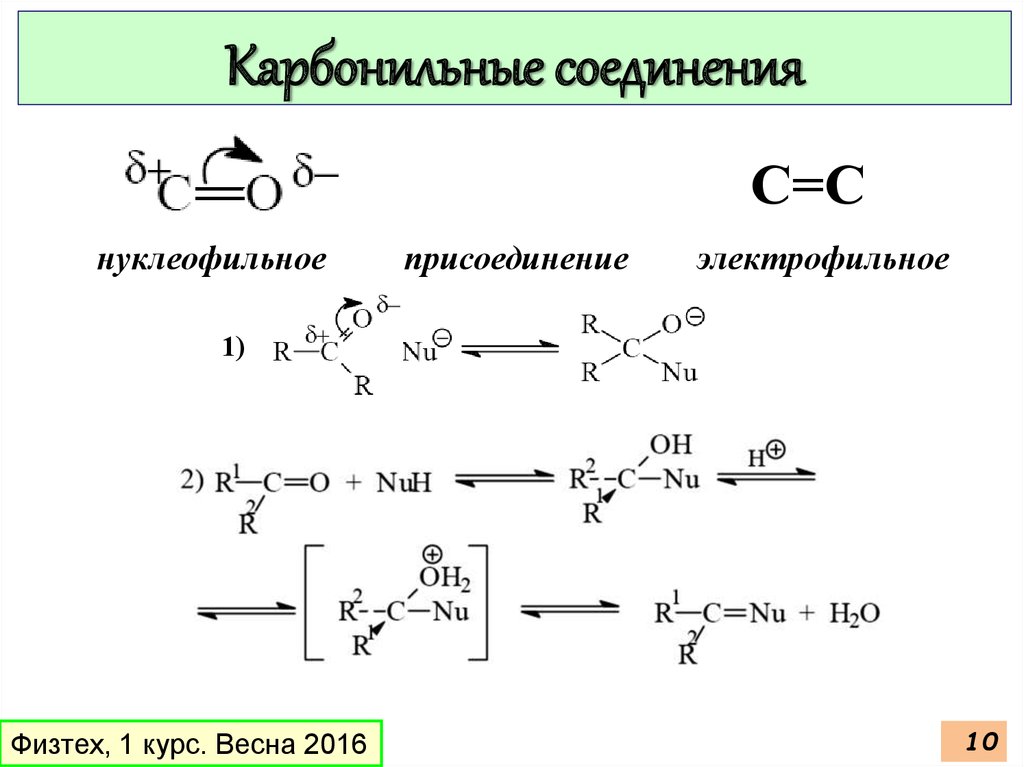
Карбонильные соединенияС=С
нуклеофильное
присоединение
электрофильное
1)
Физтех, 1 курс. Весна 2016
10
11.
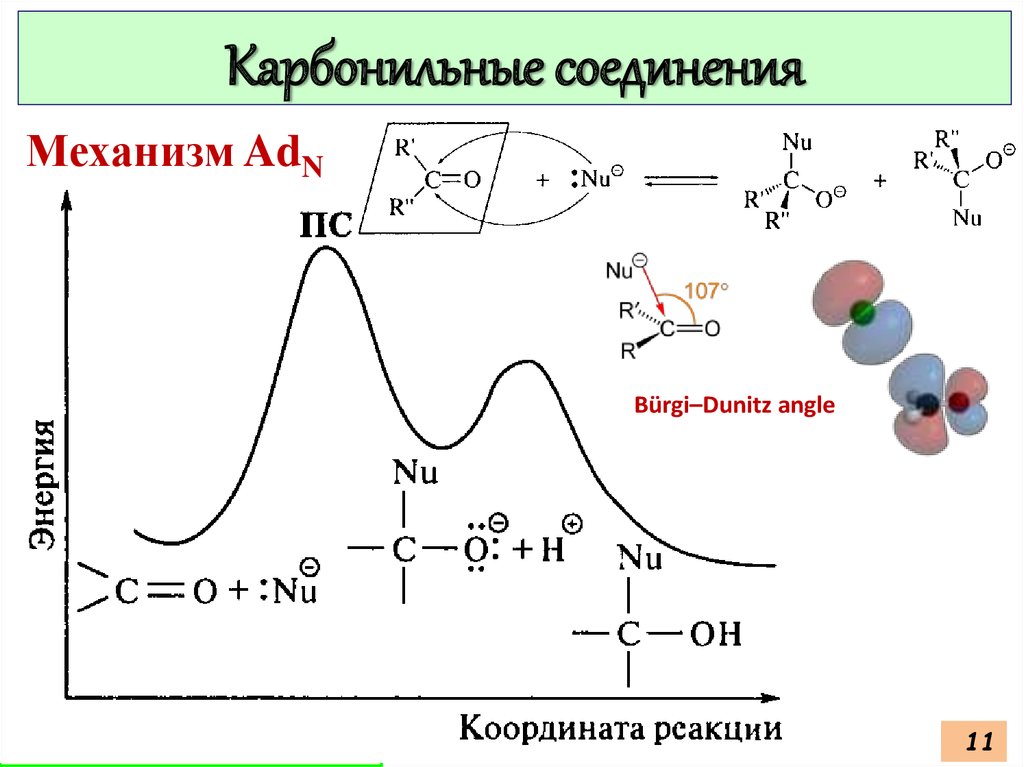
Карбонильные соединенияМеханизм AdN
Bürgi–Dunitz angle
Физтех, 1 курс. Весна 2016
11
12.
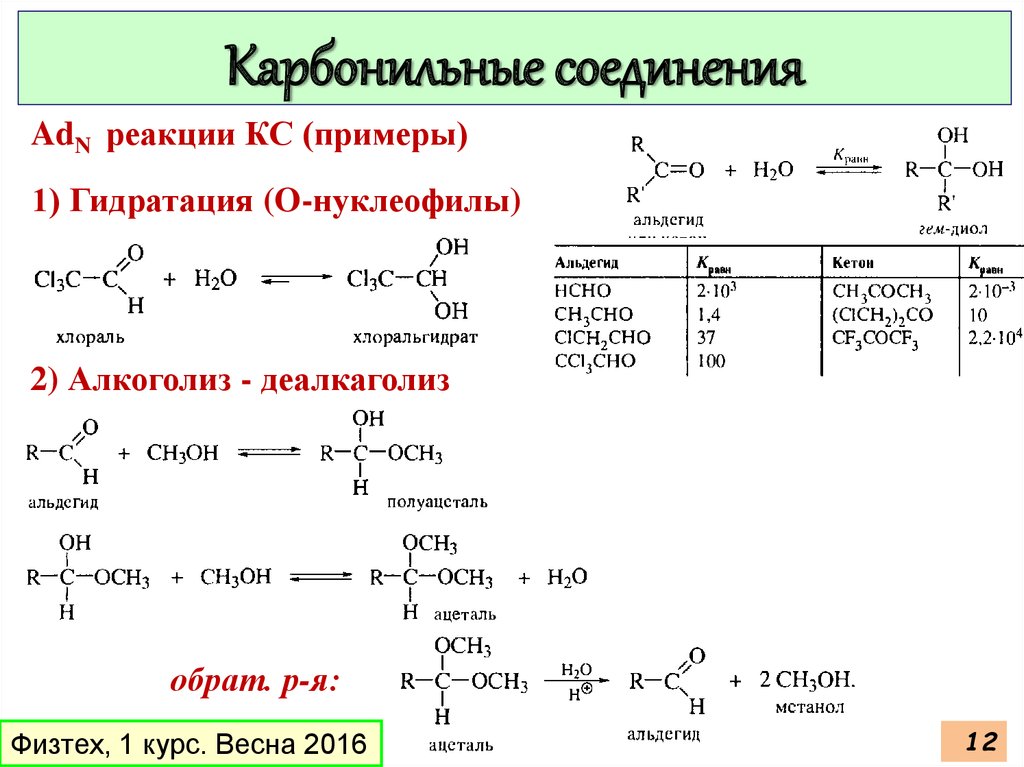
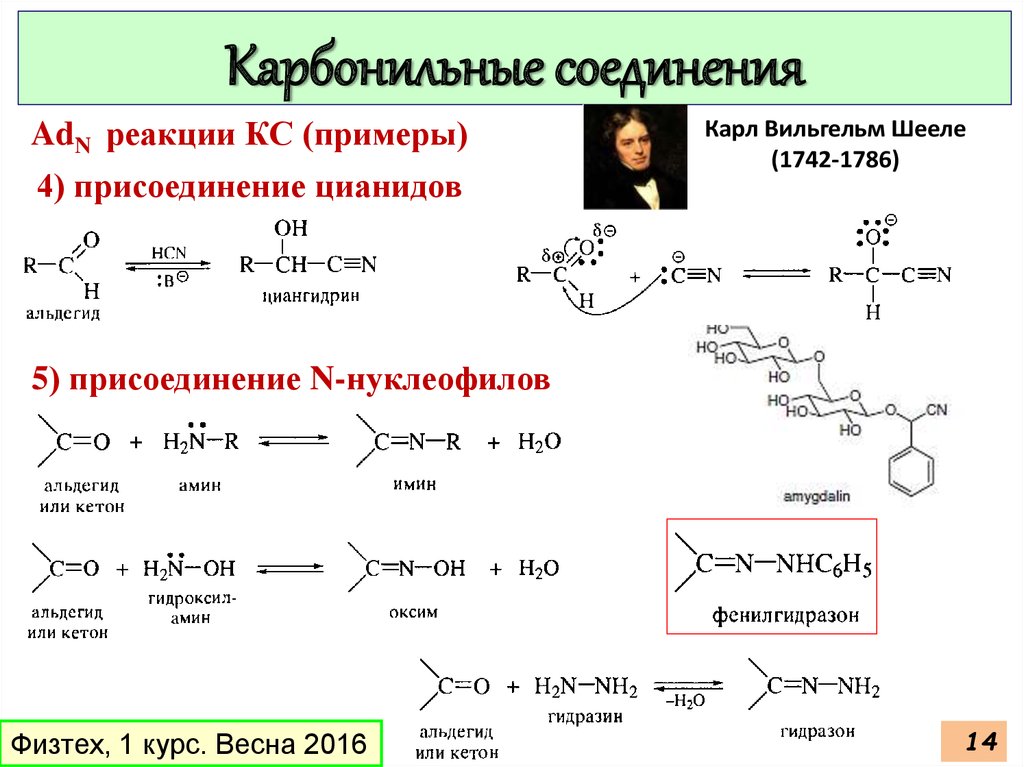
Карбонильные соединенияAdN реакции КС (примеры)
1) Гидратация (O-нуклеофилы)
2) Алкоголиз - деалкаголиз
обрат. р-я:
Физтех, 1 курс. Весна 2016
12
13.
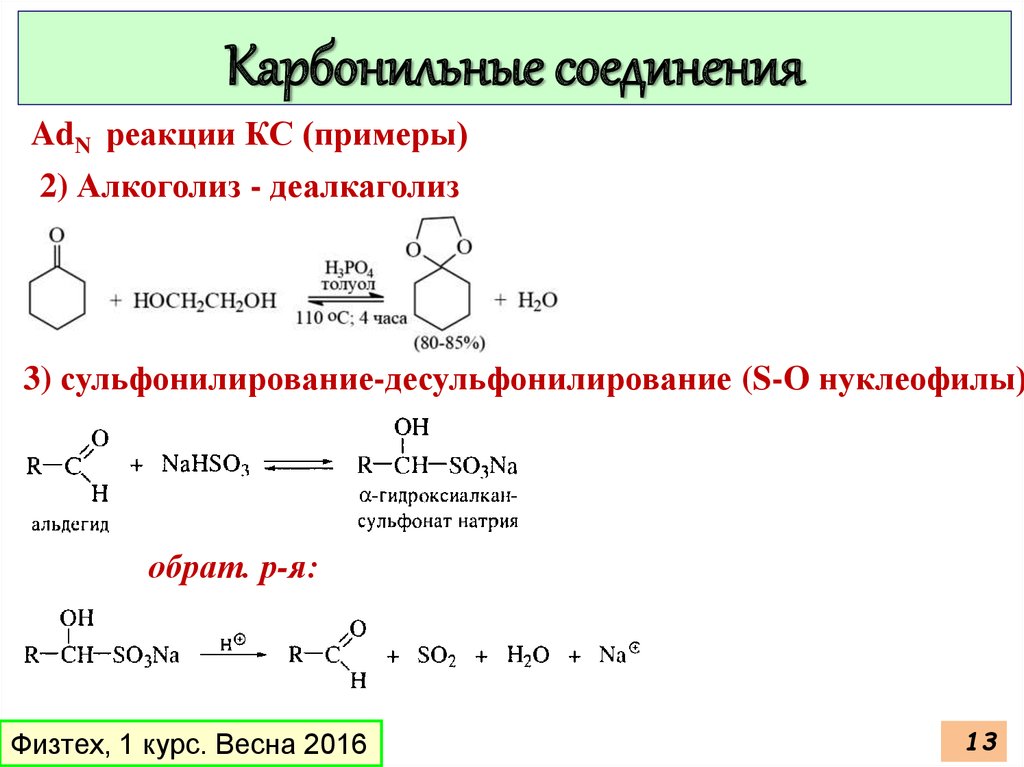
Карбонильные соединенияAdN реакции КС (примеры)
2) Алкоголиз - деалкаголиз
3) сульфонилирование-десульфонилирование (S-O нуклеофилы)
обрат. р-я:
Физтех, 1 курс. Весна 2016
13
14.
Карбонильные соединенияAdN реакции КС (примеры)
4) присоединение цианидов
Карл Вильгельм Шееле
(1742-1786)
5) присоединение N-нуклеофилов
Физтех, 1 курс. Весна 2016
14
15.
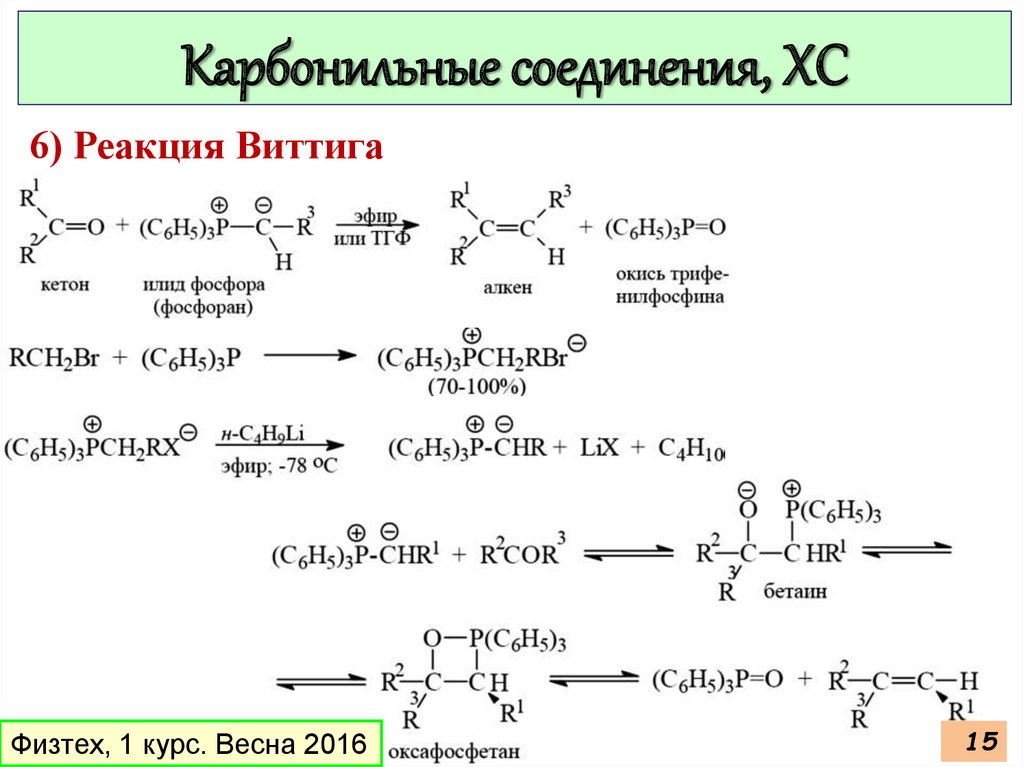
Карбонильные соединения, ХС6) Реакция Виттига
Физтех, 1 курс. Весна 2016
15
16.
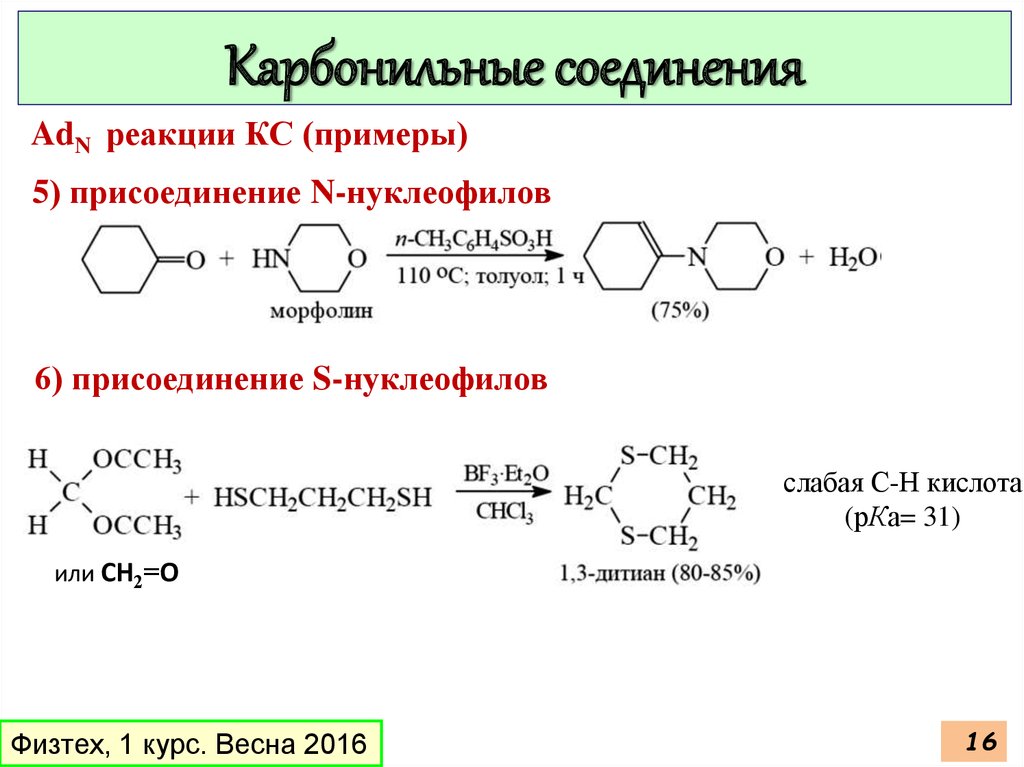
Карбонильные соединенияAdN реакции КС (примеры)
5) присоединение N-нуклеофилов
6) присоединение S-нуклеофилов
слабая С-Н кислота
(рКа= 31)
или CH2=O
Физтех, 1 курс. Весна 2016
16
17.
Elias James Corey (1928)Daniel Swern
(1916 –1982)
Lewis Hastings Sarett
(1917-1999)
Sir Ewart Ray Herbert Jones
(1911-2002)
18.
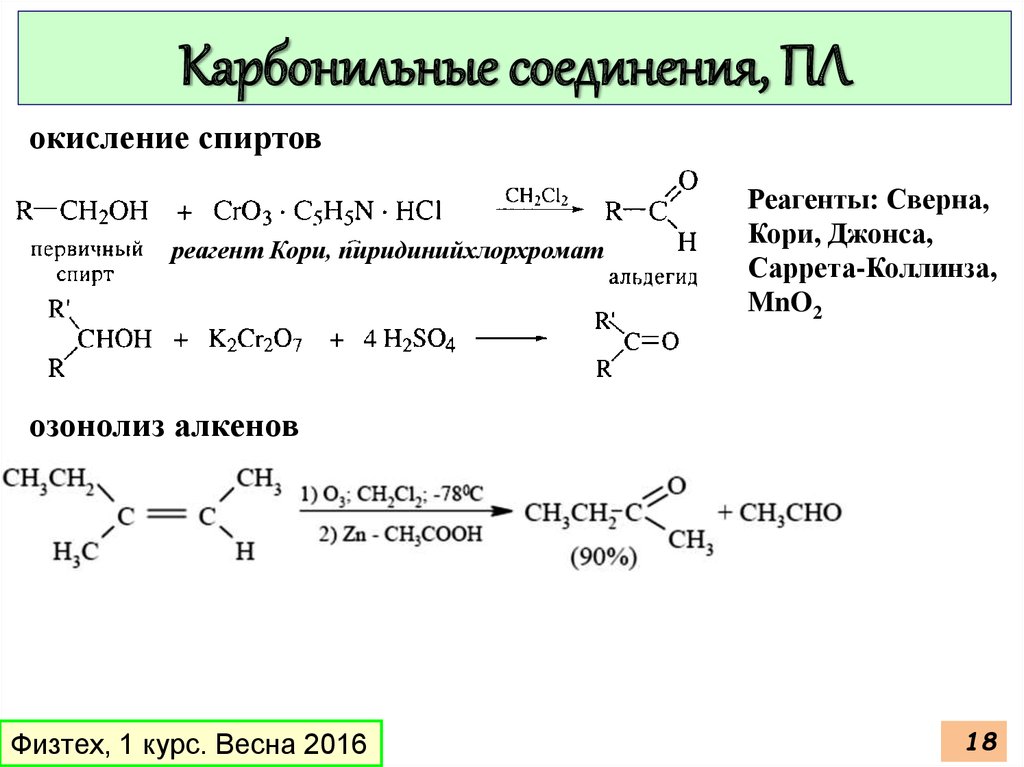
Карбонильные соединения, ПЛокисление спиртов
реагент Кори, пиридинийхлорхромат
Реагенты: Сверна,
Кори, Джонса,
Саррета-Коллинза,
MnO2
озонолиз алкенов
Физтех, 1 курс. Весна 2016
18
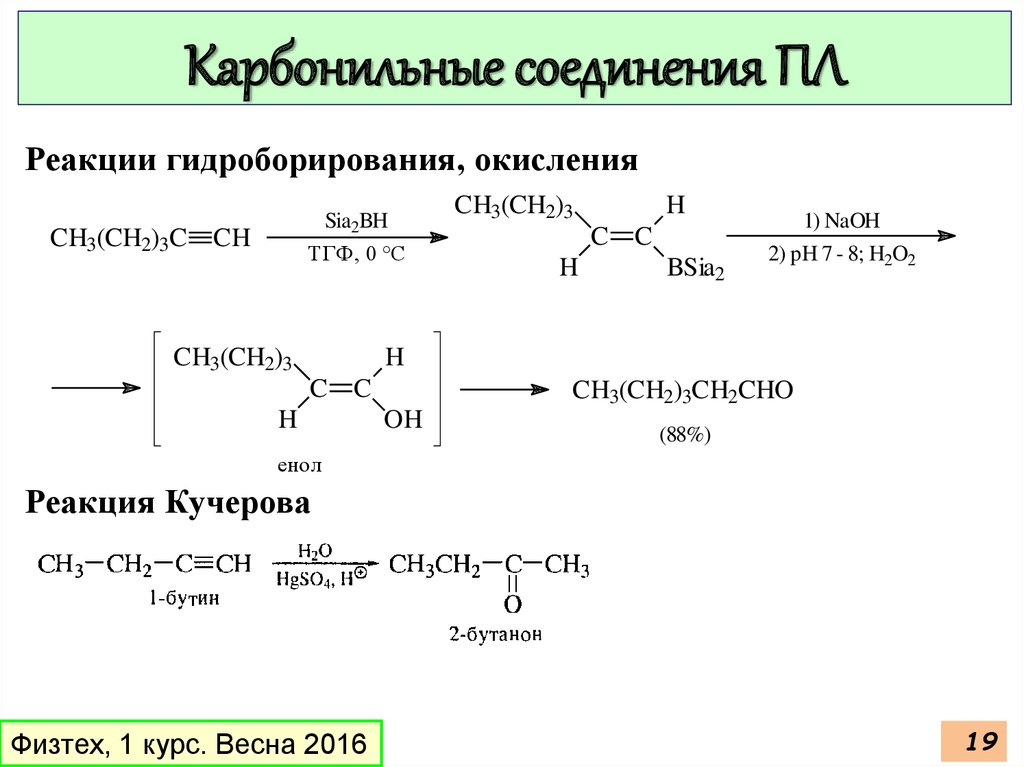
19.
Карбонильные соединения ПЛРеакции гидроборирования, окисления
Sia2BH
CH3(CH2)3C CH
ТГФ, 0 °С
CH3(CH2)3
CH3(CH2)3
H
C C
H
BSia2
1) NaOH
2) pH 7 - 8; H2O2
H
C C
H
CH3(CH2)3CH2CHO
OH
(88%)
енол
Реакция Кучерова
Физтех, 1 курс. Весна 2016
19
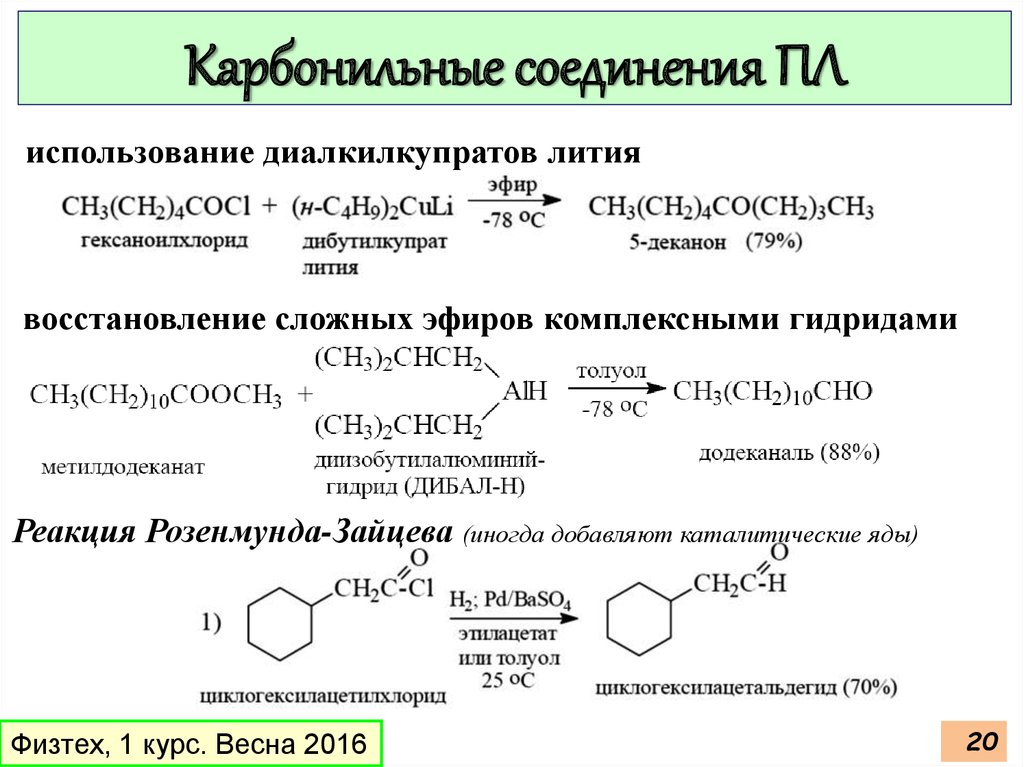
20.
Карбонильные соединения ПЛиспользование диалкилкупратов лития
восстановление сложных эфиров комплексными гидридами
Реакция Розенмунда-Зайцева (иногда добавляют каталитические яды)
Физтех, 1 курс. Весна 2016
20
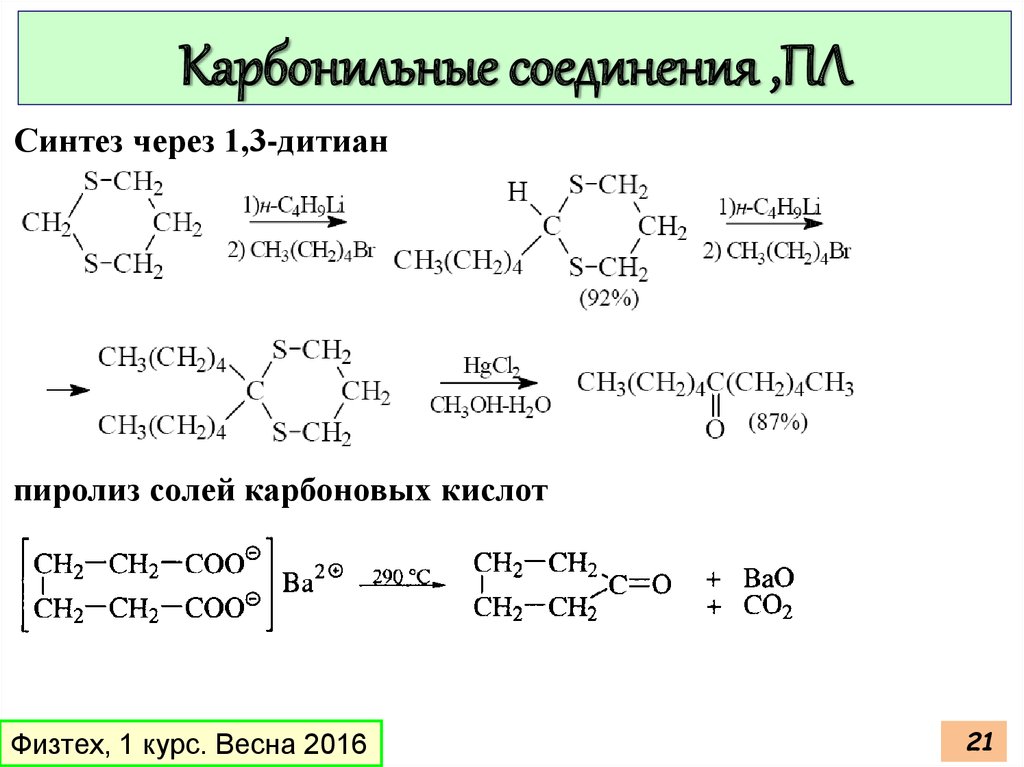
21.
Карбонильные соединения ,ПЛСинтез через 1,3-дитиан
пиролиз солей карбоновых кислот
Физтех, 1 курс. Весна 2016
21
22.
Карбонильные соединения, ХСВосстановление по Кижнеру-Вольфу
Восстановление по Клемменсену
В основном используется для восстановления кетонов
Физтех, 1 курс. Весна 2016
22
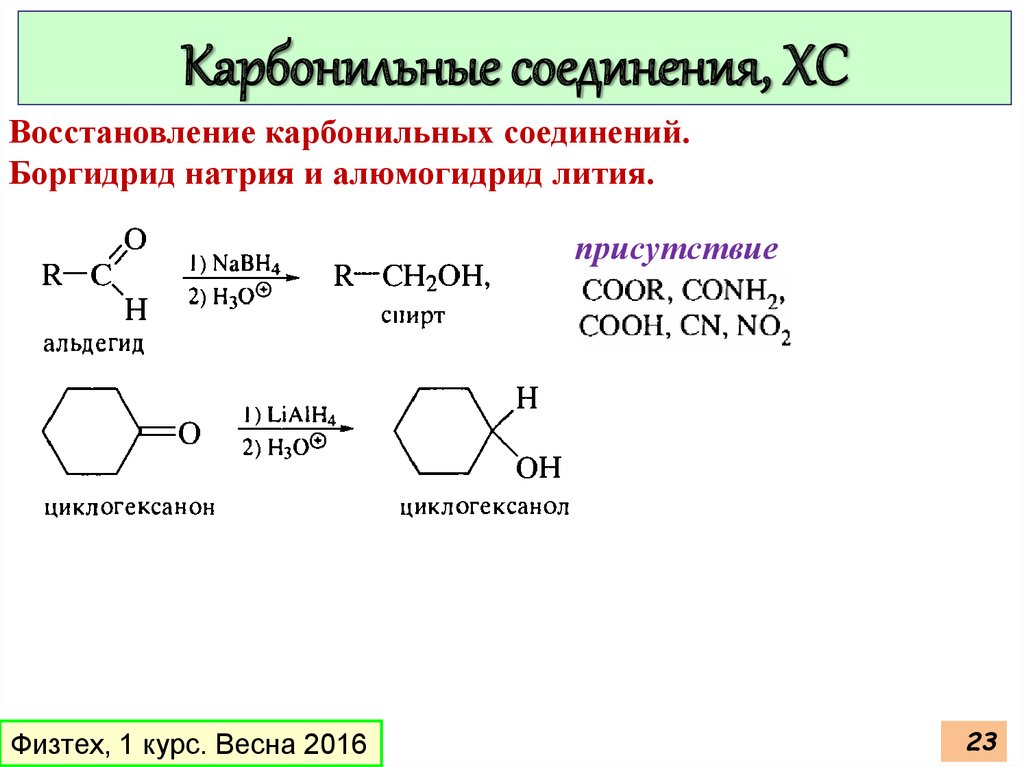
23.
Карбонильные соединения, ХСВосстановление карбонильных соединений.
Боргидрид натрия и алюмогидрид лития.
присутствие
Физтех, 1 курс. Весна 2016
23
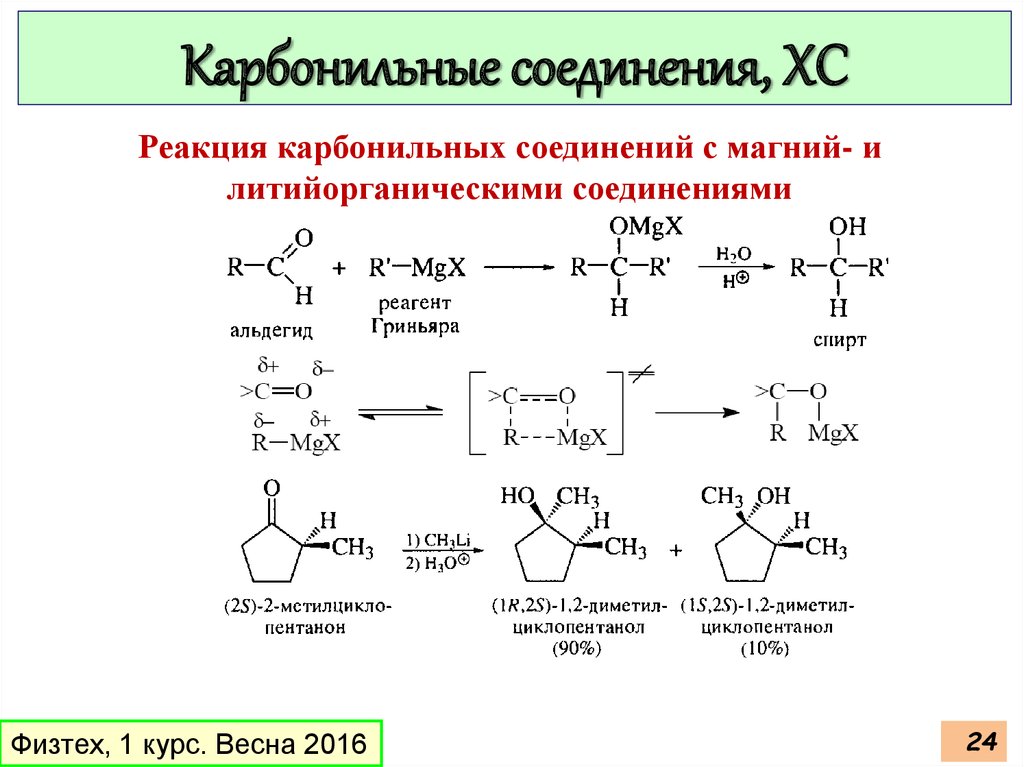
24.
Карбонильные соединения, ХСРеакция карбонильных соединений с магний- и
литийорганическими соединениями
Физтех, 1 курс. Весна 2016
24
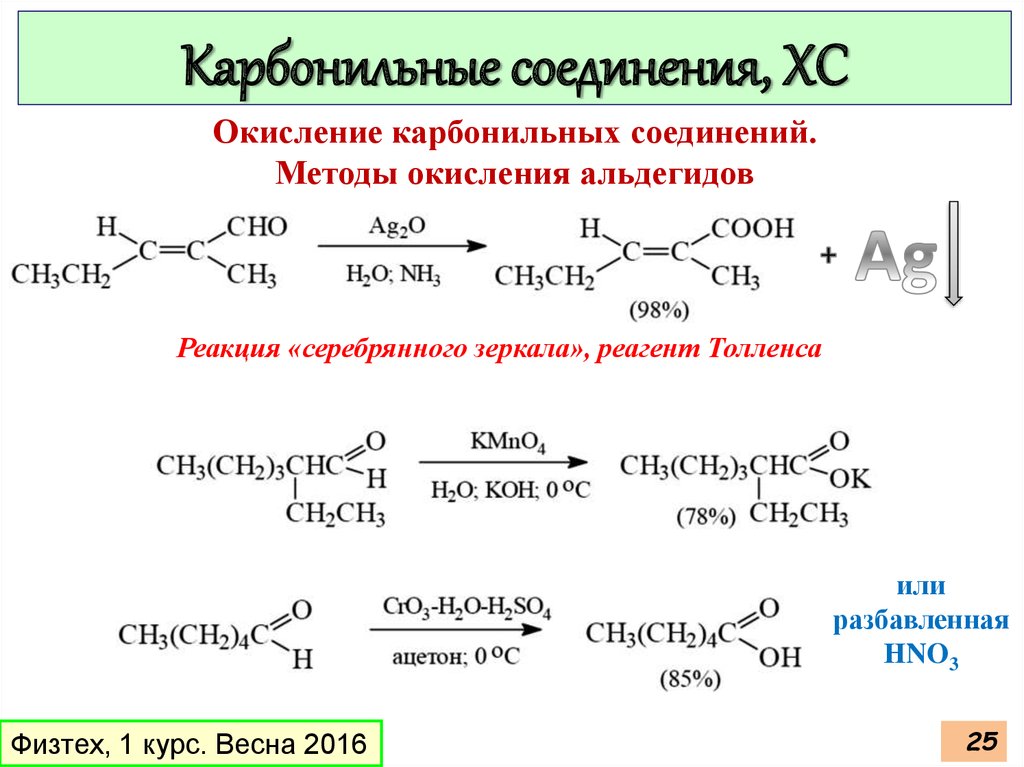
25.
Карбонильные соединения, ХСОкисление карбонильных соединений.
Методы окисления альдегидов
Реакция «серебрянного зеркала», реагент Толленса
или
разбавленная
НNO3
Физтех, 1 курс. Весна 2016
25
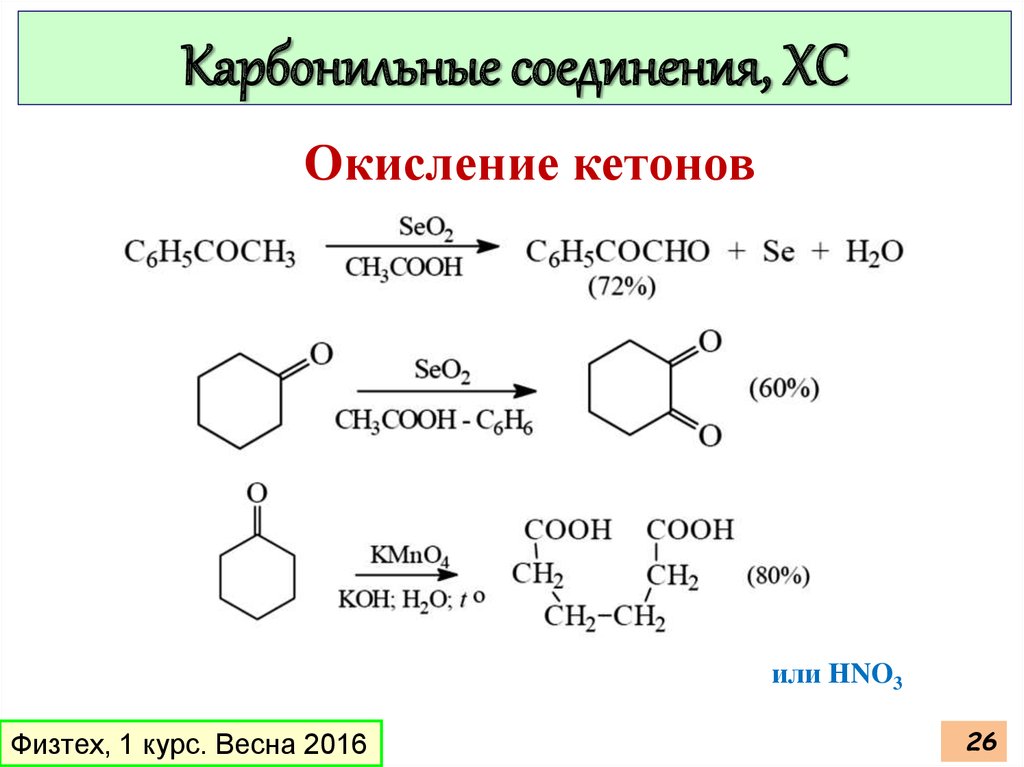
26.
Карбонильные соединения, ХСОкисление кетонов
или НNO3
Физтех, 1 курс. Весна 2016
26
27.
Карбонильные соединения, ХСРеакция Канниццаро
Формальдегид легче присоединяет гидрид-ион, так как δ+ на углероде
карбонильной группы в ароматичеких альдегидах понижена
Физтех, 1 курс. Весна 2016
27
28.
Функциональные производные скратной связью C=“Э”
Часть 2
Химические свойства енолов
и енолят-ионов
Физтех, 1 курс. Весна 2016
28
29.
Карбонильные соединенияРеакция Байера-Виллигера
По способности к миграции группы располагаются в следующем ряду
Н > С6Н5 > (СН3)3С > (СН3)2СН > RCH2 >> СН3.
Физтех, 1 курс. Весна 2016
29
30.
Карбонильные соединения, ХСПерегруппировка Бекмана
Секстетная
перегруппировка
или минеральная кислота
Физтех, 1 курс. Весна 2016
30
31.
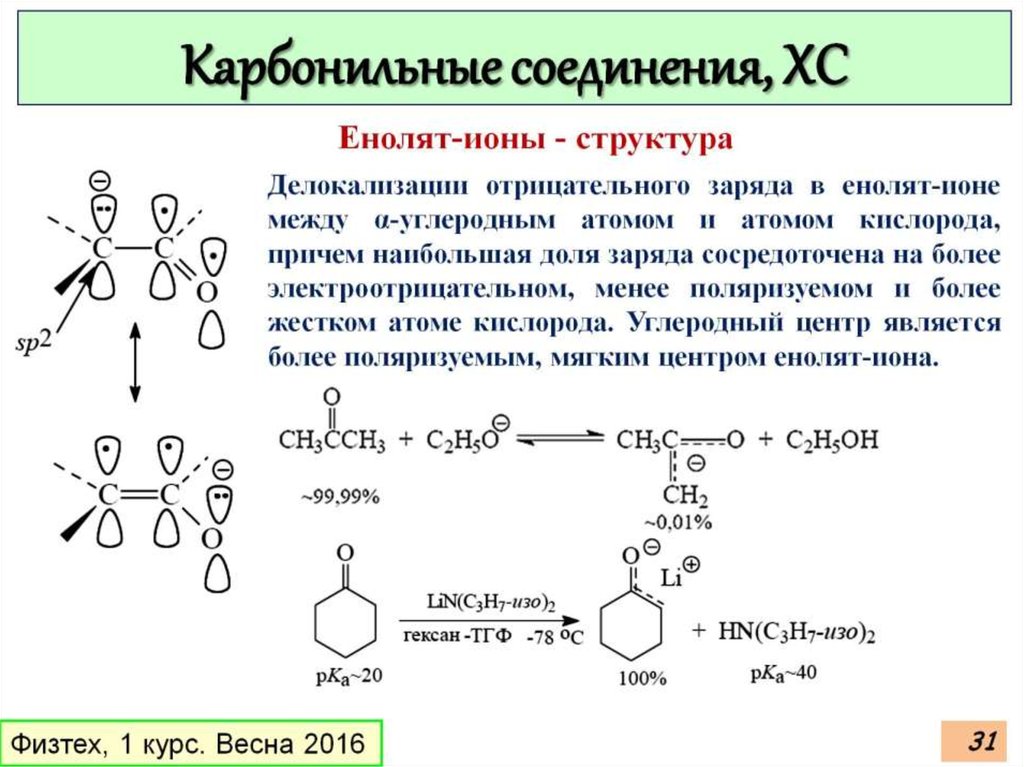
Карбонильные соединения, ХСКислотность α-С-Н связей в карбонильных соединениях
Катализ основанием
Катализ кислотой
Физтех, 1 курс. Весна 2016
31
32.
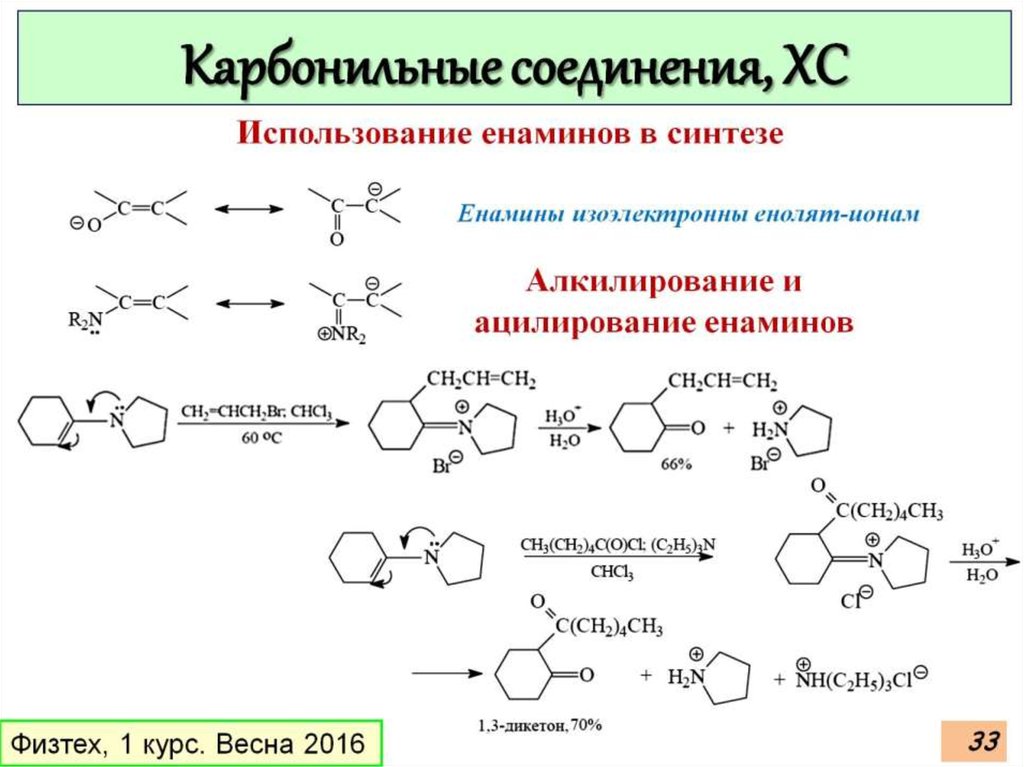
33.
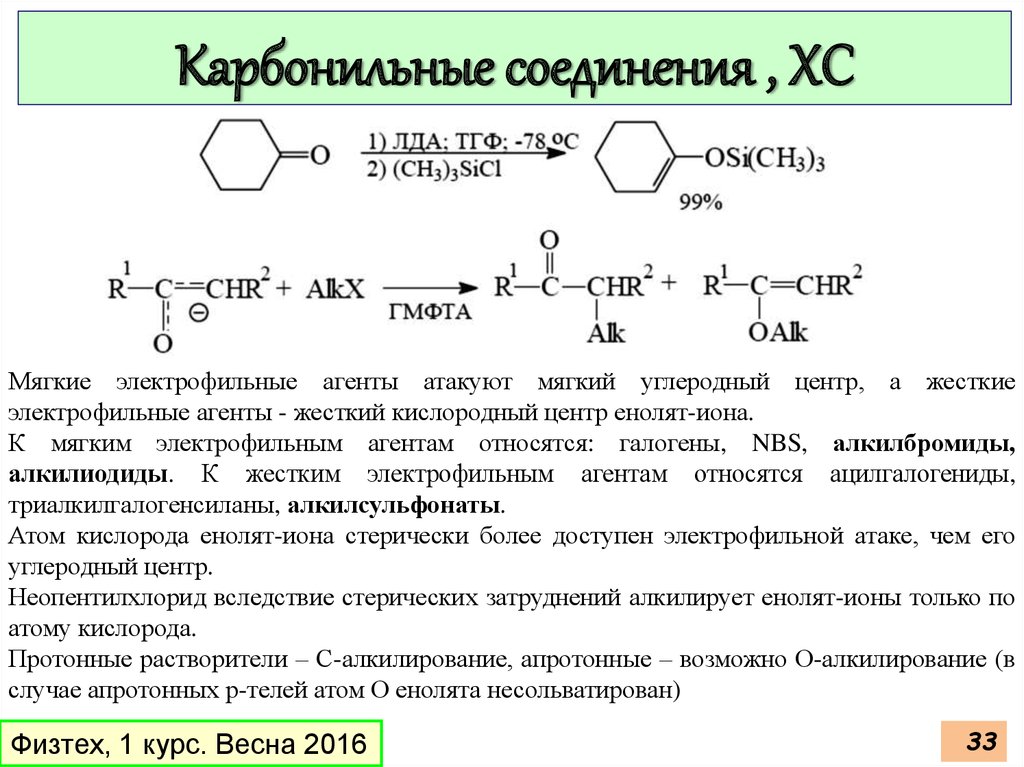
Карбонильные соединения , ХСМягкие электрофильные агенты атакуют мягкий углеродный центр, а жесткие
электрофильные агенты - жесткий кислородный центр енолят-иона.
К мягким электрофильным агентам относятся: галогены, NBS, алкилбромиды,
алкилиодиды. К жестким электрофильным агентам относятся ацилгалогениды,
триалкилгалoгeнсиланы, алкилсульфонаты.
Атом кислорода енолят-иона стерически более доступен электрофильной атаке, чем его
углеродный центр.
Неопентилхлорид вследствие стерических затруднений алкилирует енолят-ионы только по
атому кислорода.
Протонные растворители – С-алкилирование, апротонные – возможно О-алкилирование (в
случае апротонных р-телей атом О енолята несольватирован)
Физтех, 1 курс. Весна 2016
33
34.
35.
Карбонильные соединения, ХСРацемизация. Дейтерообмен
Физтех, 1 курс. Весна 2016
35
36.
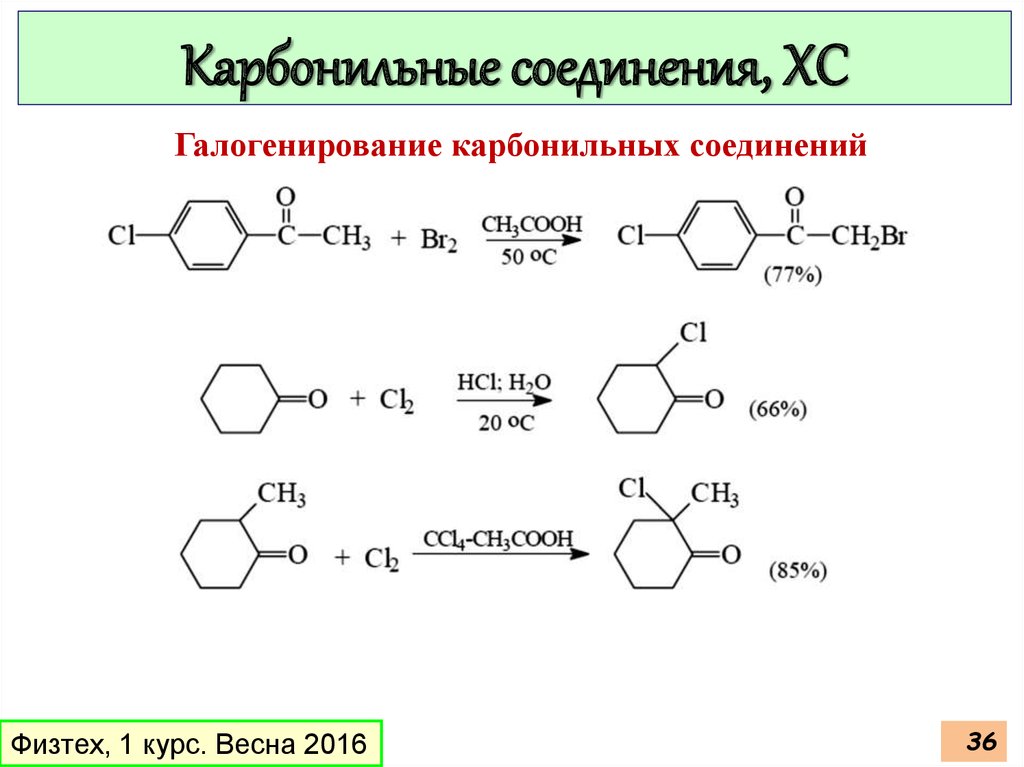
Карбонильные соединения, ХСГалогенирование карбонильных соединений
Физтех, 1 курс. Весна 2016
36
37.
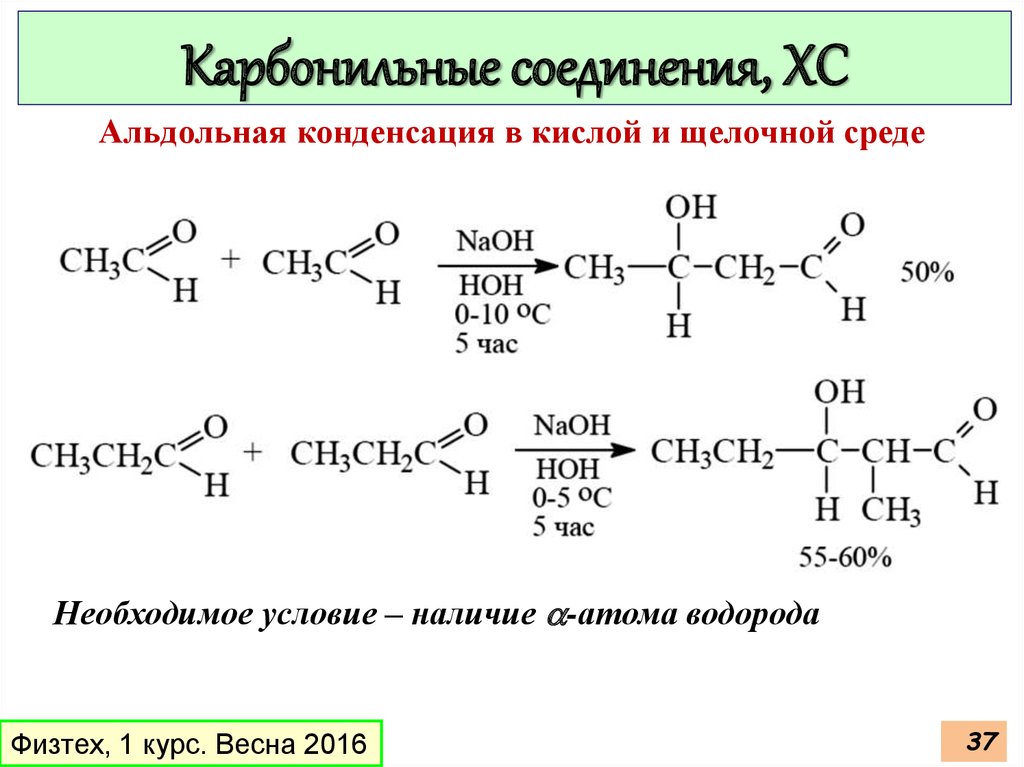
Карбонильные соединения, ХСАльдольная конденсация в кислой и щелочной среде
Необходимое условие – наличие a-атома водорода
Физтех, 1 курс. Весна 2016
37
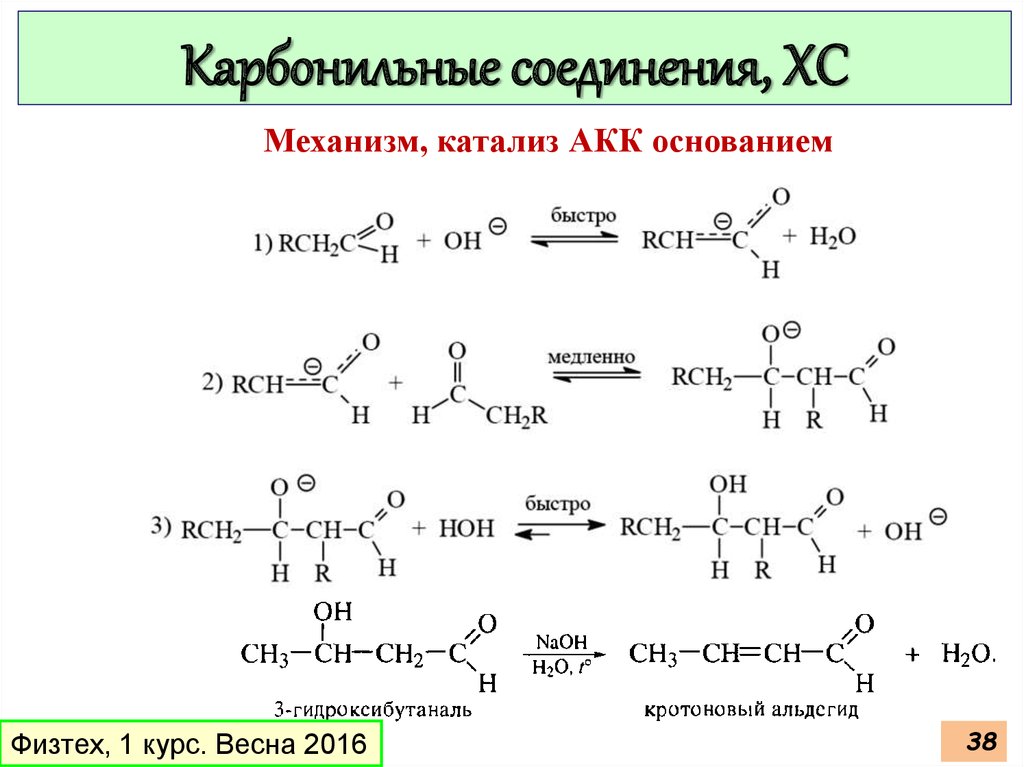
38.
Карбонильные соединения, ХСМеханизм, катализ АКК основанием
Физтех, 1 курс. Весна 2016
38
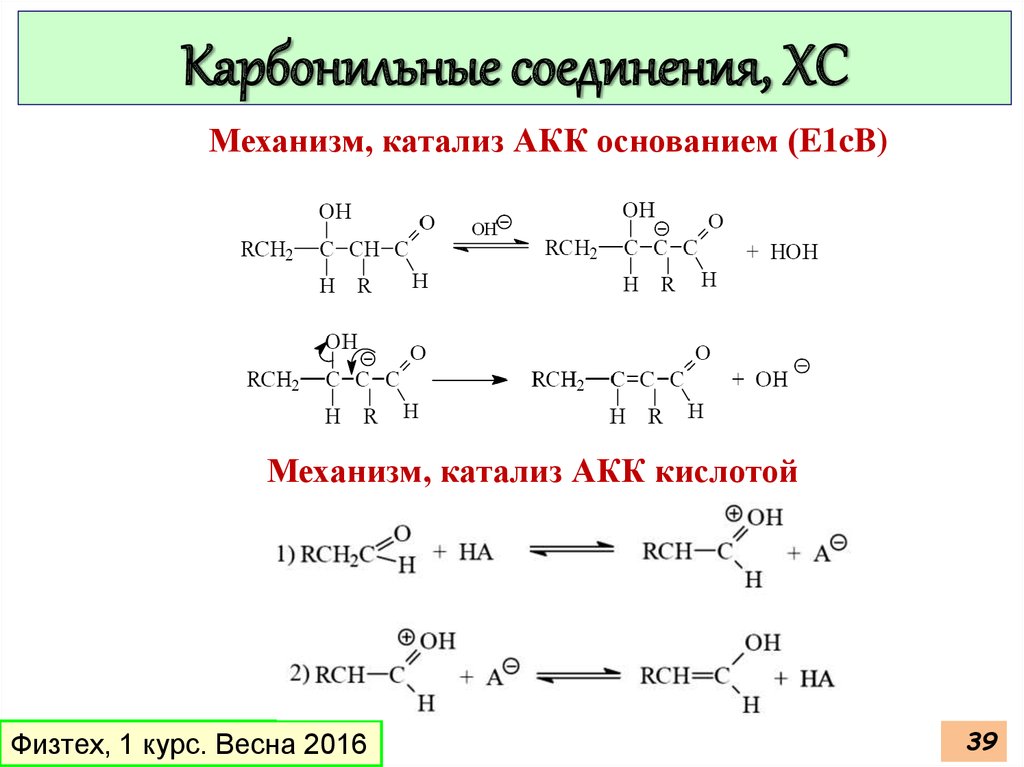
39.
Карбонильные соединения, ХСМеханизм, катализ АКК основанием (E1cB)
Механизм, катализ АКК кислотой
Физтех, 1 курс. Весна 2016
39
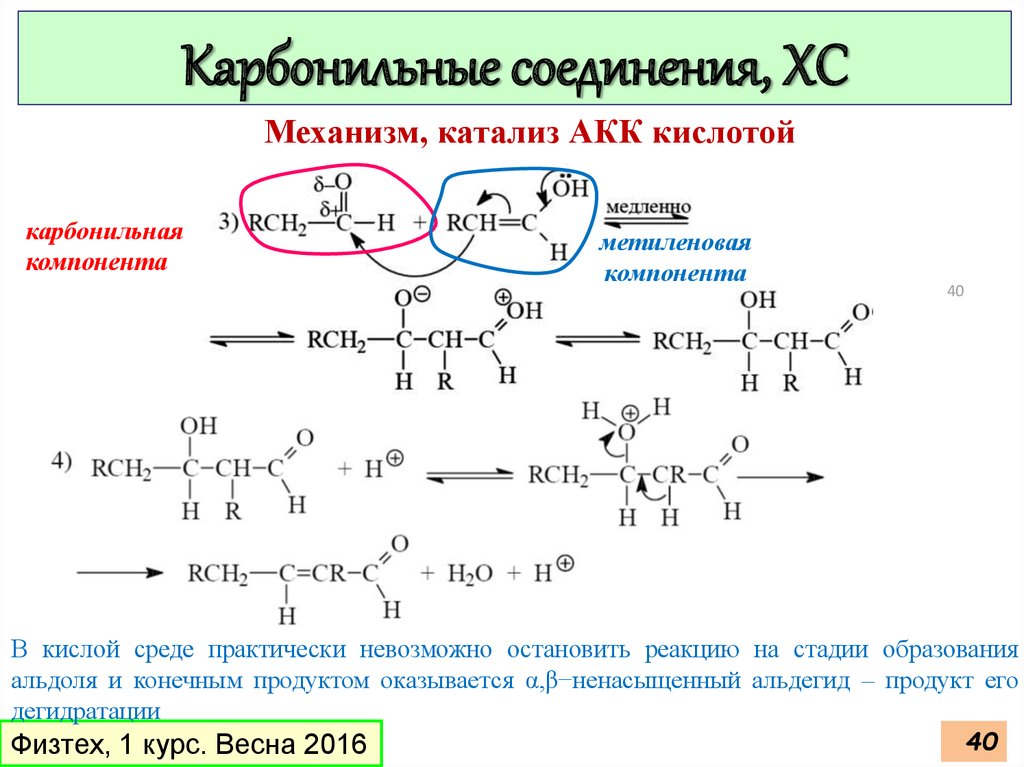
40.
Карбонильные соединения, ХСМеханизм, катализ АКК кислотой
карбонильная
компонента
метиленовая
компонента
40
В кислой среде практически невозможно остановить реакцию на стадии образования
альдоля и конечным продуктом оказывается α,β−ненасыщенный альдегид – продукт его
дегидратации
40
Физтех, 1 курс. Весна 2016
41.
Карбонильные соединенияНаправленные конденсации
Физтех, 1 курс. Весна 2016
41
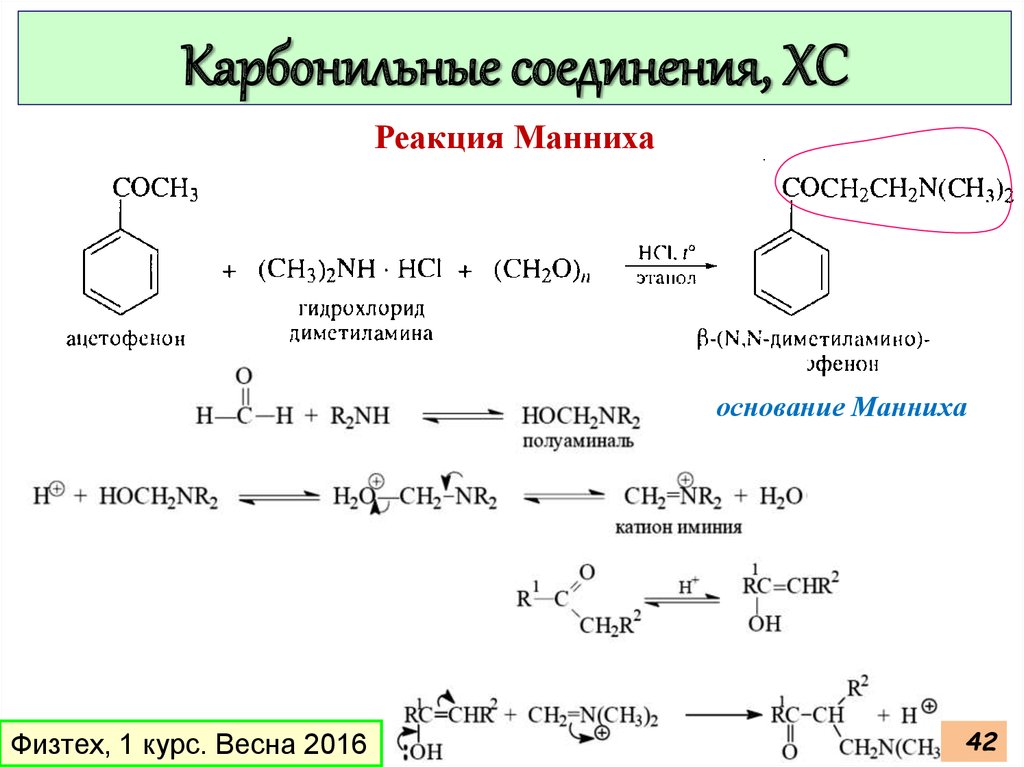
42.
Карбонильные соединения, ХСРеакция Манниха
основание Манниха
Физтех, 1 курс. Весна 2016
42
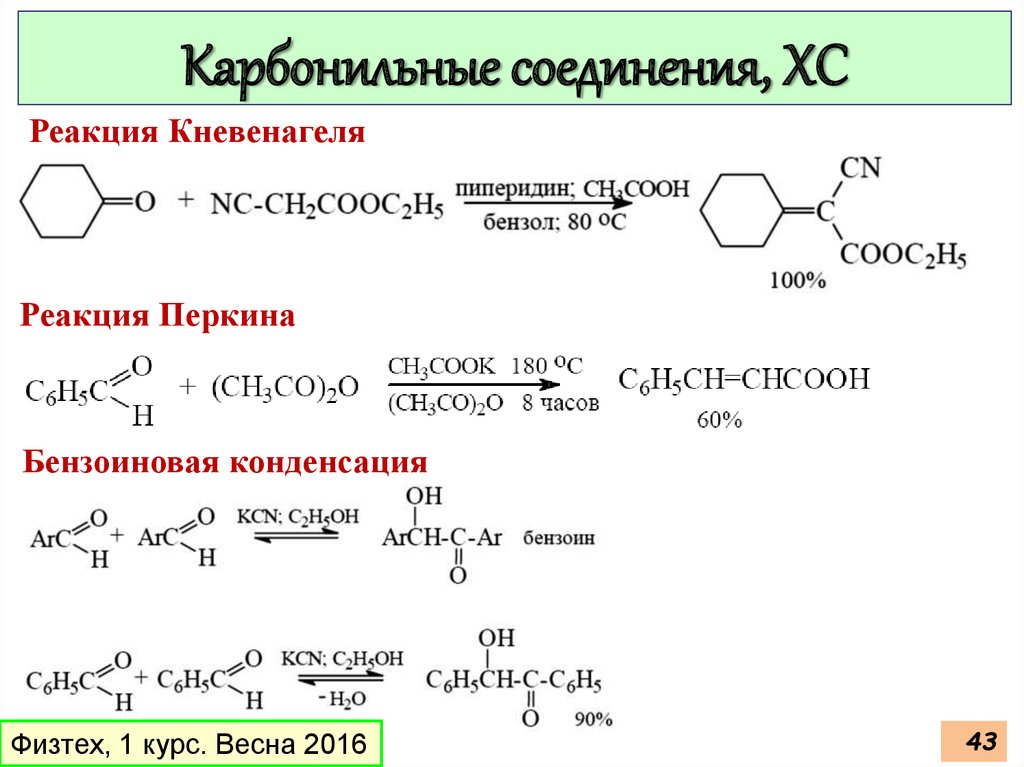
43.
Карбонильные соединения, ХСРеакция Кневенагеля
Реакция Перкина
Бензоиновая конденсация
Физтех, 1 курс. Весна 2016
43
44.
Функциональные производные скратной связью C=“Э”
Часть 3
Сопряженные непредельные
карбонильные соединения
Физтех, 1 курс. Весна 2016
44
45.
Нн Карбонильные соединения, ПЛСтроение α,β-непредельных альдегидов и кетонов
Физтех, 1 курс. Весна 2016
45
46.
Нн Карбонильные соединения, ПЛПрочие методы:
1. Пиролиз оснований Манниха;
2. Винилкуприрование RC(O)Cl;
3. Р-я.Кондакова;
Физтех, 1 курс. Весна 2016
46
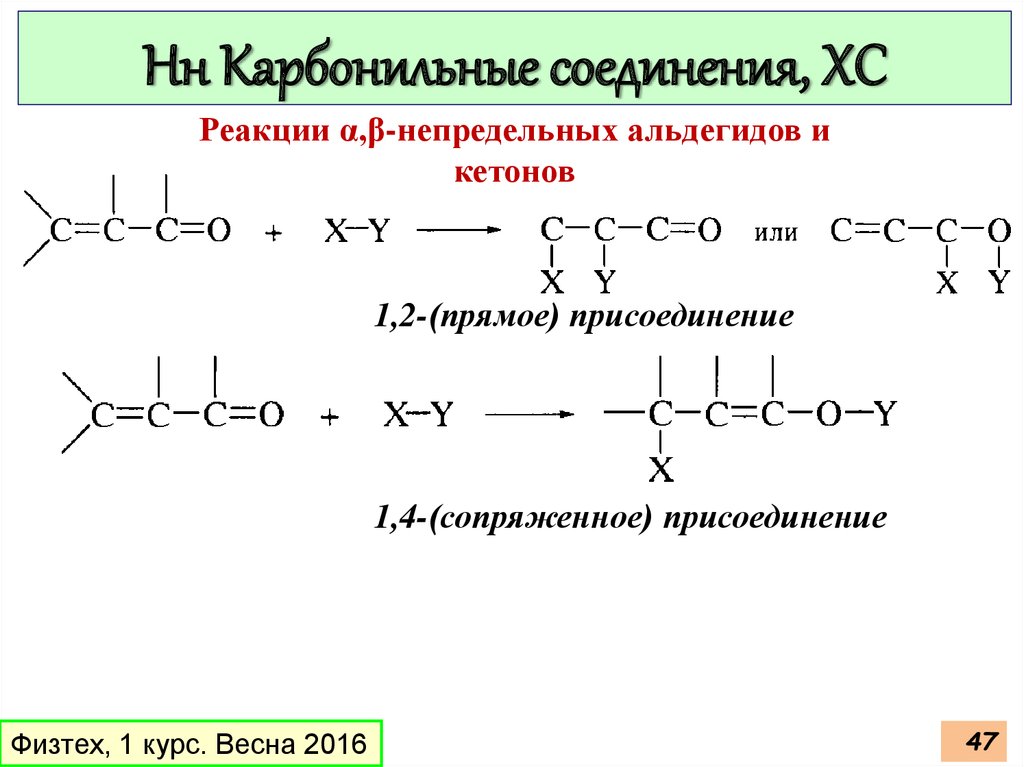
47.
Нн Карбонильные соединения, ХСРеакции α,β-непредельных альдегидов и
кетонов
1,2-(прямое) присоединение
1,4-(сопряженное) присоединение
Физтех, 1 курс. Весна 2016
47
48.
Нн Карбонильные соединения, ПЛБензохиноны
Физтех, 1 курс. Весна 2016
48
49.
Карбонильные соединения, ХСБензохиноны
Физтех, 1 курс. Весна 2016
49
50.
Нн Карбонильные соединения, ХСБензохиноны
Физтех, 1 курс. Весна 2016
50
51.
Нн Карбонильные соединения, ХСФизтех, 1 курс. Весна 2016
51
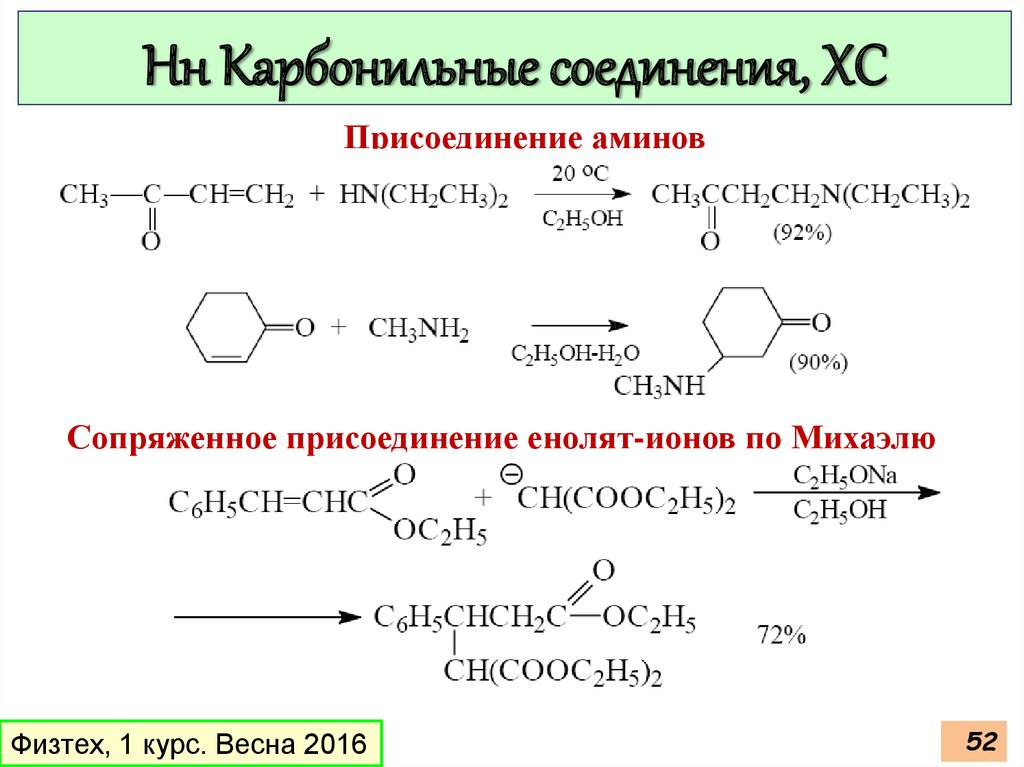
52.
Нн Карбонильные соединения, ХСПрисоединение аминов
Сопряженное присоединение енолят-ионов по Михаэлю
Физтех, 1 курс. Весна 2016
52
53.
54.
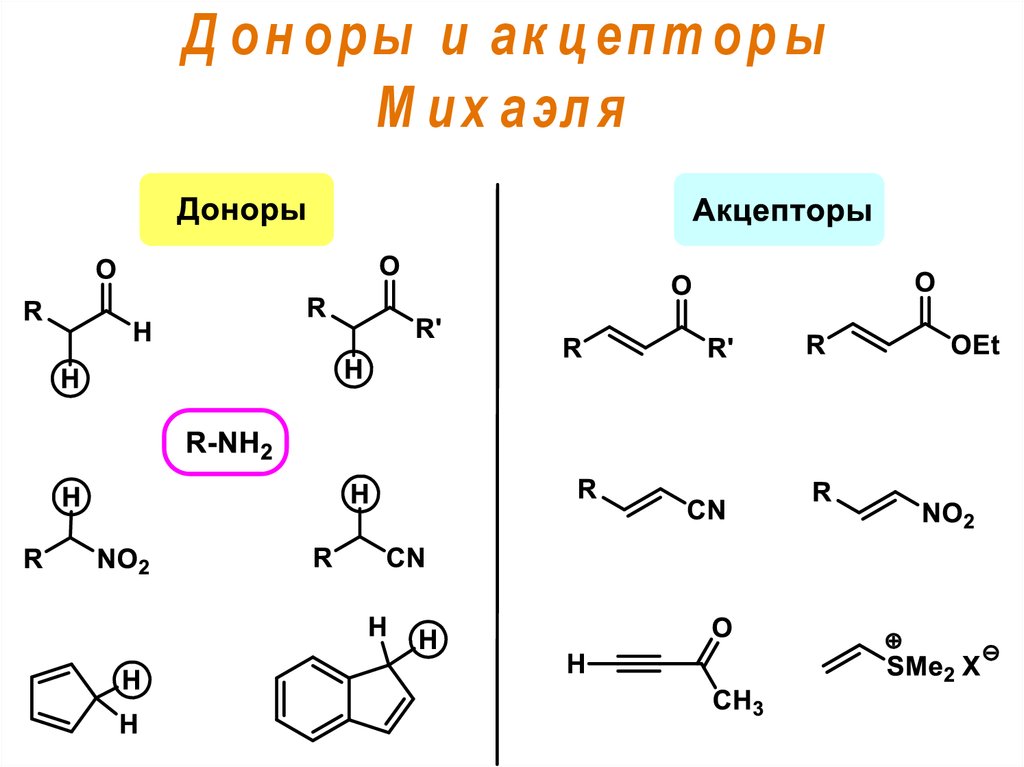
Д он оры и ак ц епт ор ыМ и х а эл я
55.
А к т ивац ия ад енил ат ци кл азывоздействие на клеточную мембрану
56.
57.
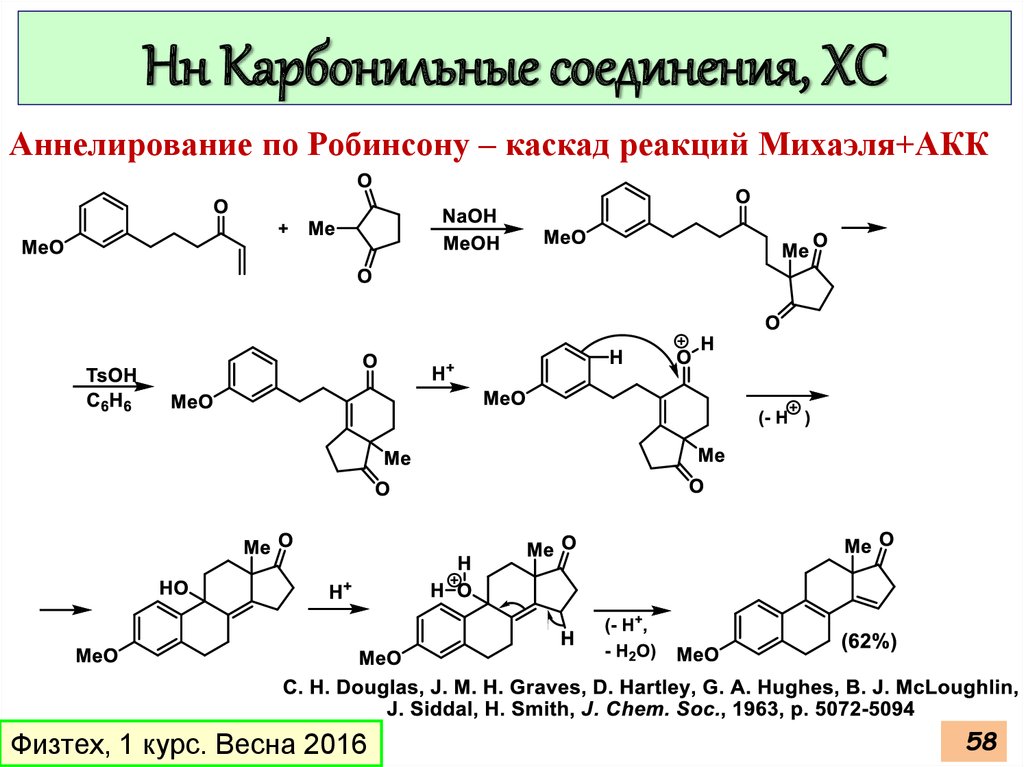
Нн Карбонильные соединения, ХСАннелирование по Робинсону – каскад реакций Михаэля+АКК
Физтех, 1 курс. Весна 2016
57
58.
Нн Карбонильные соединения, ХСАннелирование по Робинсону – каскад реакций Михаэля+АКК
Физтех, 1 курс. Весна 2016
58
59.
Нн Карбонильные соединения, ХСПрисоединение металлоорганики
LiR – 1,2-присоединение
купраты – 1,4-присоединение
Физтех, 1 курс. Весна 2016
59
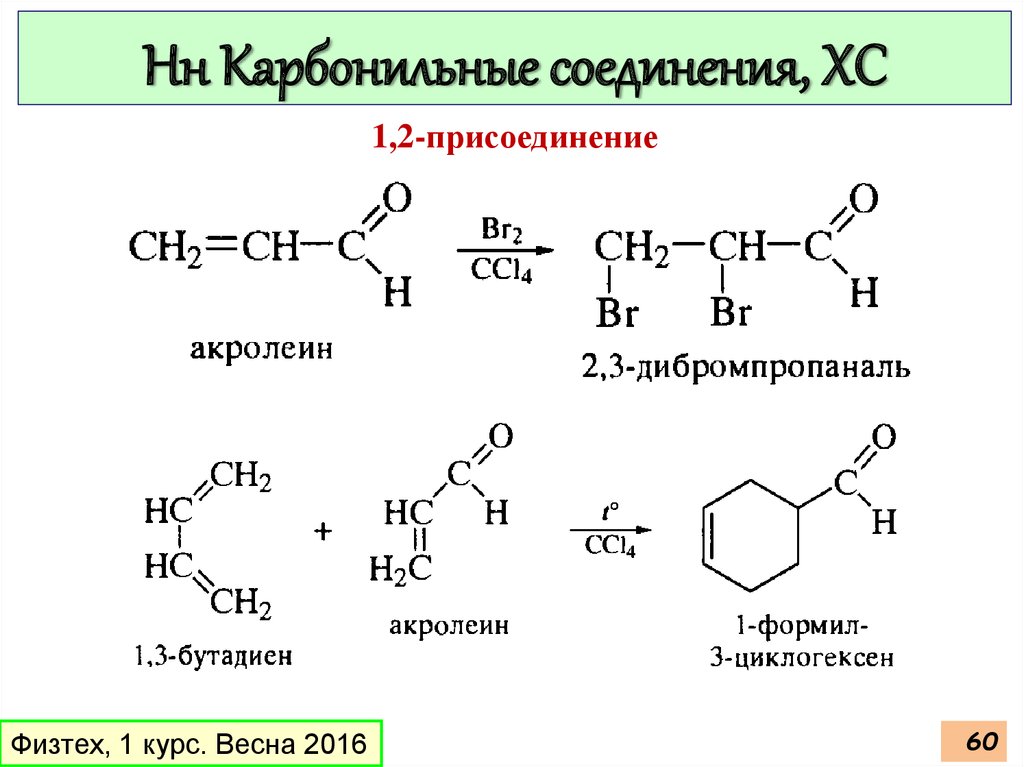
60.
Нн Карбонильные соединения, ХС1,2-присоединение
Физтех, 1 курс. Весна 2016
60
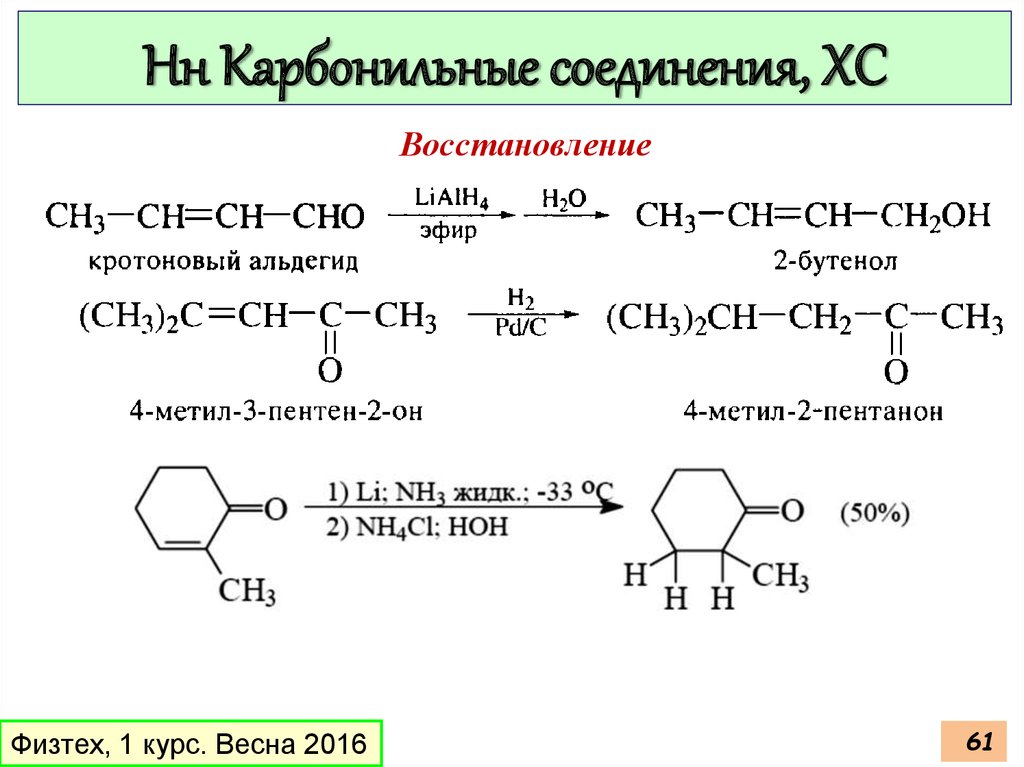
61.
Нн Карбонильные соединения, ХСВосстановление
Физтех, 1 курс. Весна 2016
61
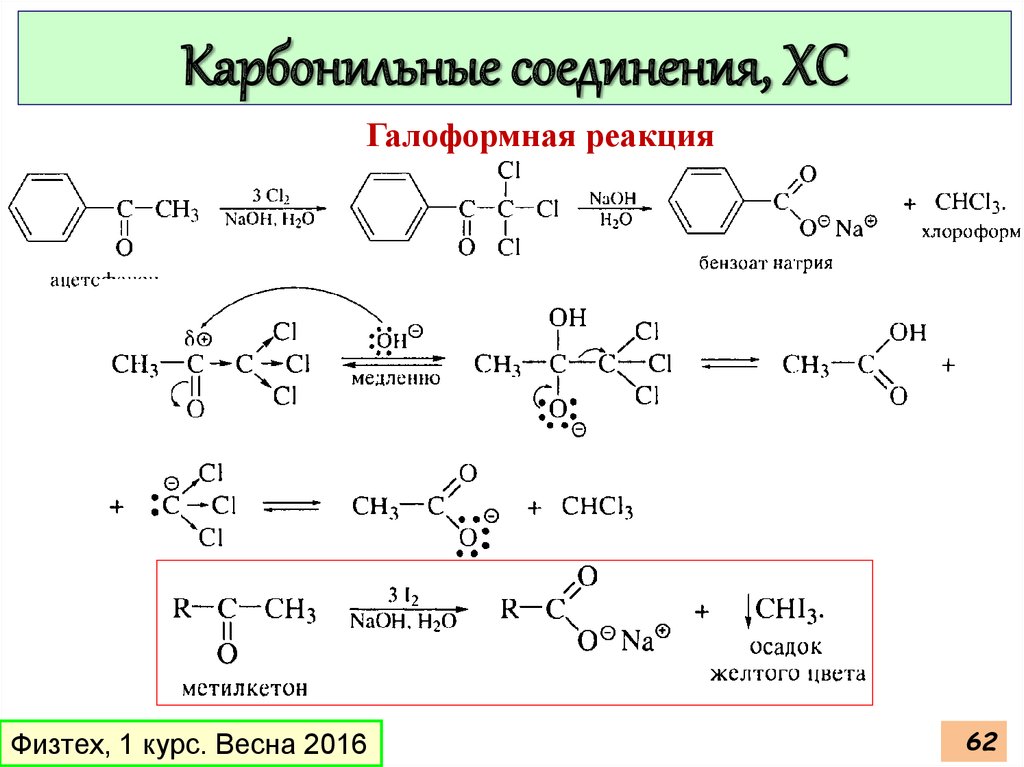
62.
Карбонильные соединения, ХСГалоформная реакция
Физтех, 1 курс. Весна 2016
62
63. Коротко о главном
1. Кетоны и альдегиды кислородсодержащий промежуточный класс(между спиртами и кислотами) реакционноспособных органических
соединений.
2. Для карбонильной функции характерны реакции протекающие по
механизмам AdN, SE
3. Широкий спектр превращений для КС (в том числе «автореакций»)
составляют реакции конденсации и диспропорционирования.
4. Для оксимов и кетонов используют (две) реакции перехода к
карбокси-производным (амидам и сл.эфирам) через
перегруппировки Бекмана и Байера-Виллигера.
5.
a,b-Непредельные КС - основные продукты АК-конденсаций
исходные для создания алициклических полифункциональных КС
через каскад реакций аннелирования
Физтех, 1 курс. Весна 2016
63
64. Основные понятия
Для реакции карбонильной группы основной путьлежит через «тетраэдрический интермедиат».
Относительная устойчивость гем-дизамещенных
аминов, спиртов, эфиров, сульфидов.
AdN – атака внешнего нуклеофила зависит от
природы субстрата и конкурирует с
термодинамически-выгодным процессом депротонирование – автоконденсация (АКК).
Амбидентная природа енолята и a,b- енонов
согласуется с общими принципами теории ЖМКО
Физтех, 1 курс. Весна 2016
64
65.
Функциональные производные скратной связью C=“Э”
Часть 4
Производные карбоновых кислот и
енолят-ионов
Физтех, 1 курс. Весна 2016
65
66.
Карбонильные соединенияO
H 3C
C
O
X
CH 3
X
O
O
X
O
R-C(O)-R'
R-NH 2
RCH 2OH
Физтех, 1 курс. Весна 2016
RCOH
-
Br
X
O
66
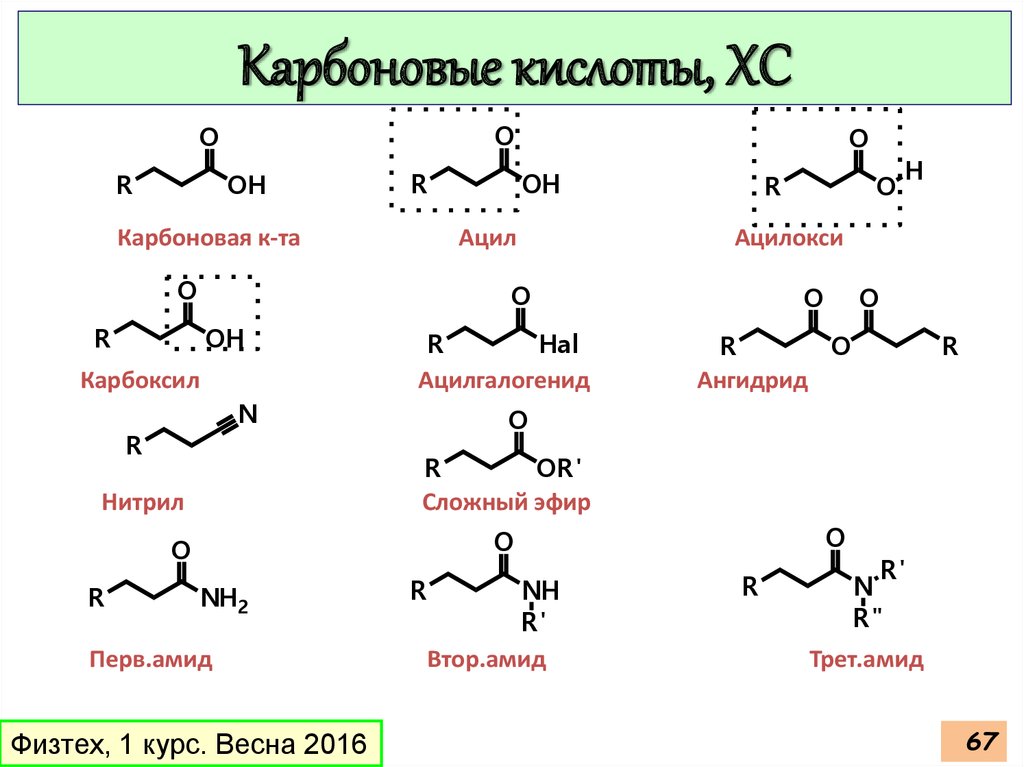
67.
Карбоновые кислоты, ХСO
O
R
OH
R
Карбоновая к-та
R
OH
R
Hal
Ацилгалогенид
N
R
O
H
Ацилокси
O
Карбоксил
O
O
R
O
Ангидрид
R
O
R
OR'
Сложный эфир
Нитрил
O
O
O
R
OH
Ацил
O
R
O
NH2
Перв.амид
Физтех, 1 курс. Весна 2016
R
NH
R'
Втор.амид
R
R'
N
R''
Трет.амид
67
68.
Карбоновые кислоты, ХСO
R
N
OH
Карбоновая к-та
N
R
R
R
OH
H
Гидразид
N
R
Иминоэфир
R
R'
N
R''
Тиоамид
NR'
Физтех, 1 курс. Весна 2016
Азид
NH
R
Амидин
O
R
R
NH2
R'
N
R'
Амидразон
S R'
Дитиоэфир
NH2
R
S
S R'
N
H
N
OH
Амидоксим
O
Тиоэфир
S
O
Гидроксамовая к-та
OR'
R
OH
N
N
NH2
N
68
69.
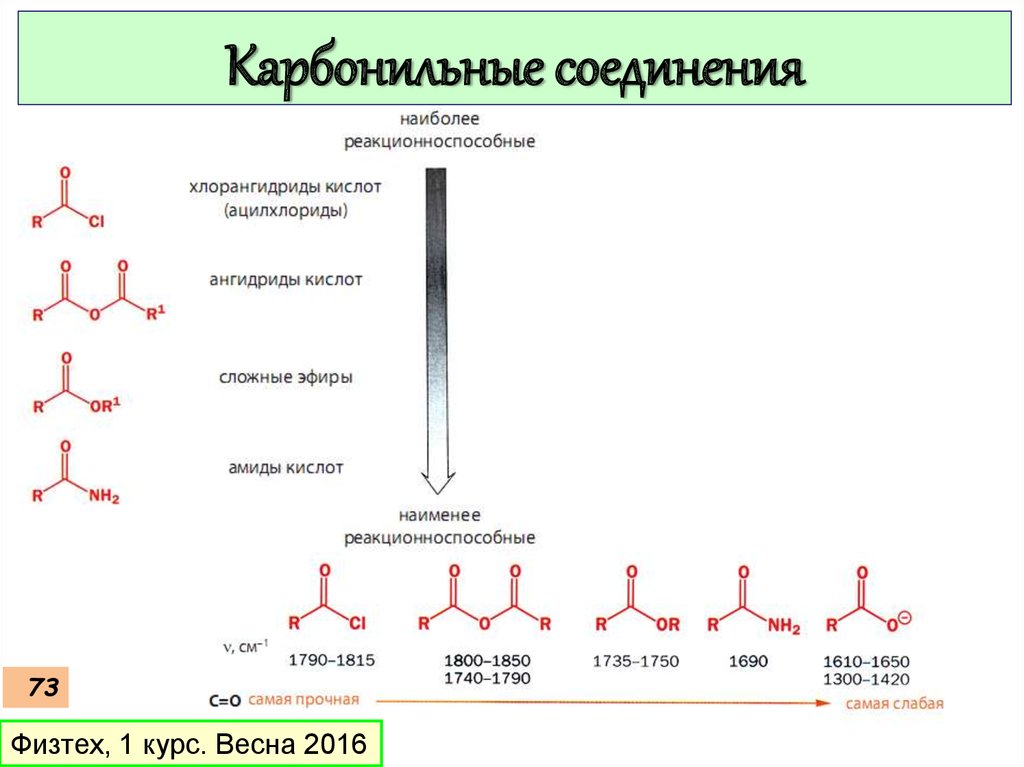
Карбонильные соединенияСвязь С-О короче, спиртовой из-за вклада
резонансной структуры с С=ОН связью
Электрофильность
H 3C
H 3C
Cl
O
O
O
R-CN H 3C
OC(O)R
H 3C
OH
O
O
H 3C
OR
NH 2
Стабильность
Физтех, 1 курс. Весна 2016
69
70.
71.
Карбонильные соединения72
C(sp2)-OH
кислот
сильно
дезэкранирован 11-15 м.д. N-H
амидов 7-9 м.д.
a-CH протоны поглощают при 2-2.5
м.д.
В 13С-ЯМР карбоксильный углерод
менее дезэкранирован и поглощает
в диапазоне 160-185 м.д. CN в
нитрилах 115-120 м.д.
Физтех, 1 курс. Весна 2016
72.
Карбонильные соединения73
Физтех, 1 курс. Весна 2016
73.
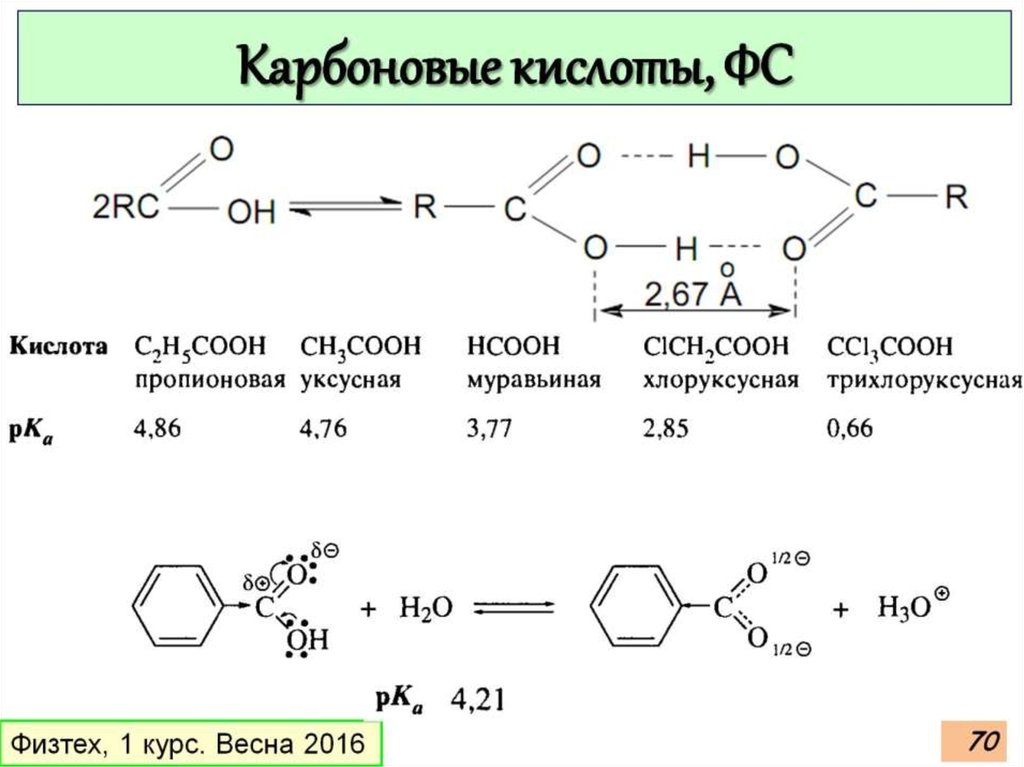
Карбоновые кислоты, ФСОбщие подходы к синтезу карбоновых кислот
O
O
R
Z
OE t
Z=O, S, NR
X=Cl, OAc,
X
OR, SR, NR2
CCl3
R
R=CH3, COOEt
R
R
Hal
R
N
Гидролиз
O
R
R
H
Окисление
O
R
OH
Карбоксилирование
M
R
O
C
O
OH
р-я Арндта-Эйстерта
Галоформная реакция
O
R
Физтех, 1 курс. Весна 2016
R
Окисл. расщепление
R
OH
O
R
74
74.
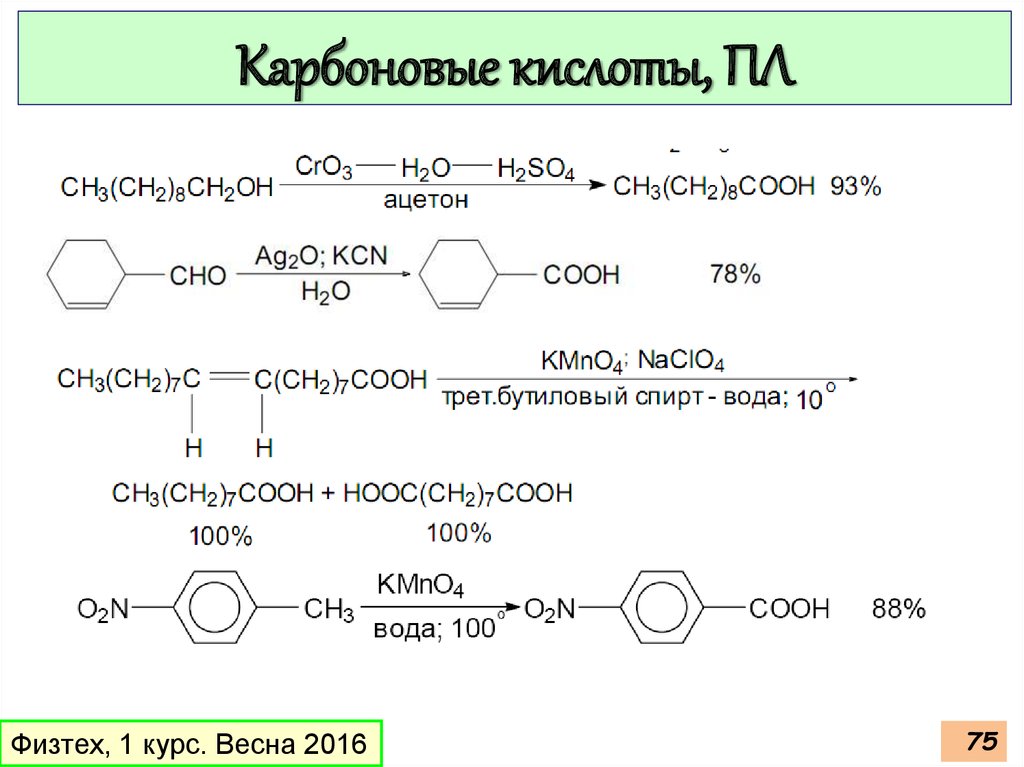
Карбоновые кислоты, ПЛФизтех, 1 курс. Весна 2016
75
75.
Карбоновые кислоты, ПЛВсе производные
карбоновых кислот
при гидролизе в
кислой или
щелочной
среде образуют
карбоновые
кислоты.
Физтех, 1 курс. Весна 2016
76
76.
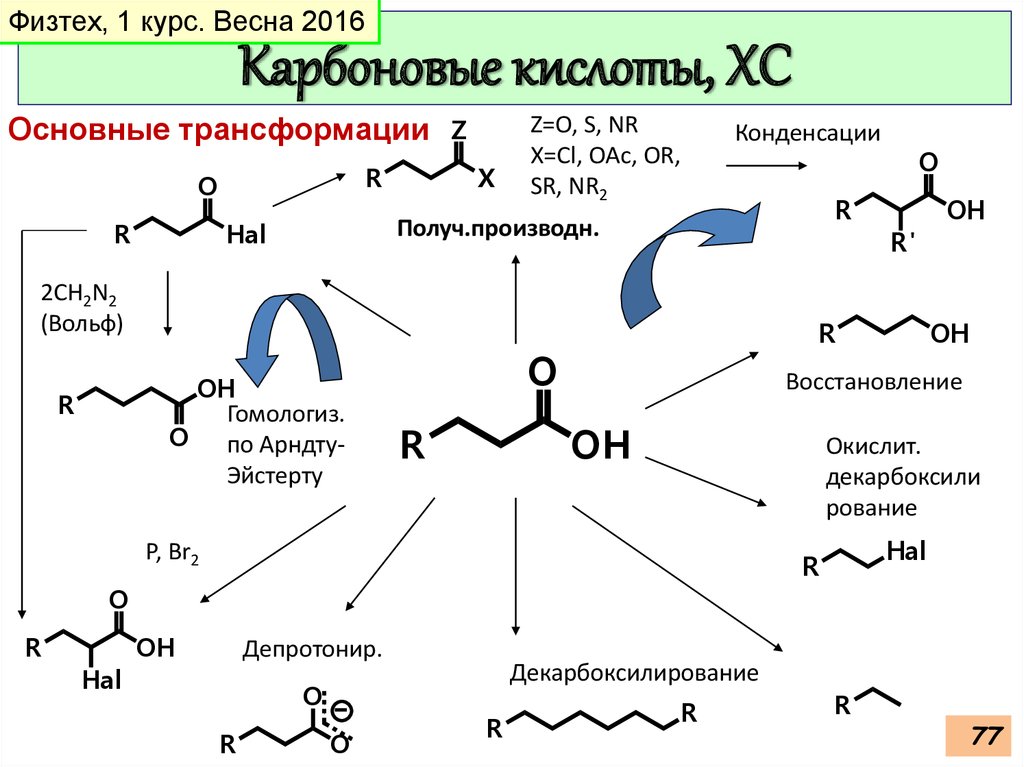
Физтех, 1 курс. Весна 2016Карбоновые кислоты, ХС
Основные трансформации Z
R
O
R
Hal
X
Z=O, S, NR
X=Cl, OAc, OR,
SR, NR2
Конденсации
R
Получ.производн.
2CH2N2
(Вольф)
OH
Гомологиз.
O по АрндтуЭйстерту
R
OH
O
Hal
Депротонир.
O
R
O
Декарбоксилирование
R
OH
Окислит.
декарбоксили
рование
Hal
R
OH
OH
Восстановление
P, Br2
R
R'
R
O
R
O
R
R
77
77.
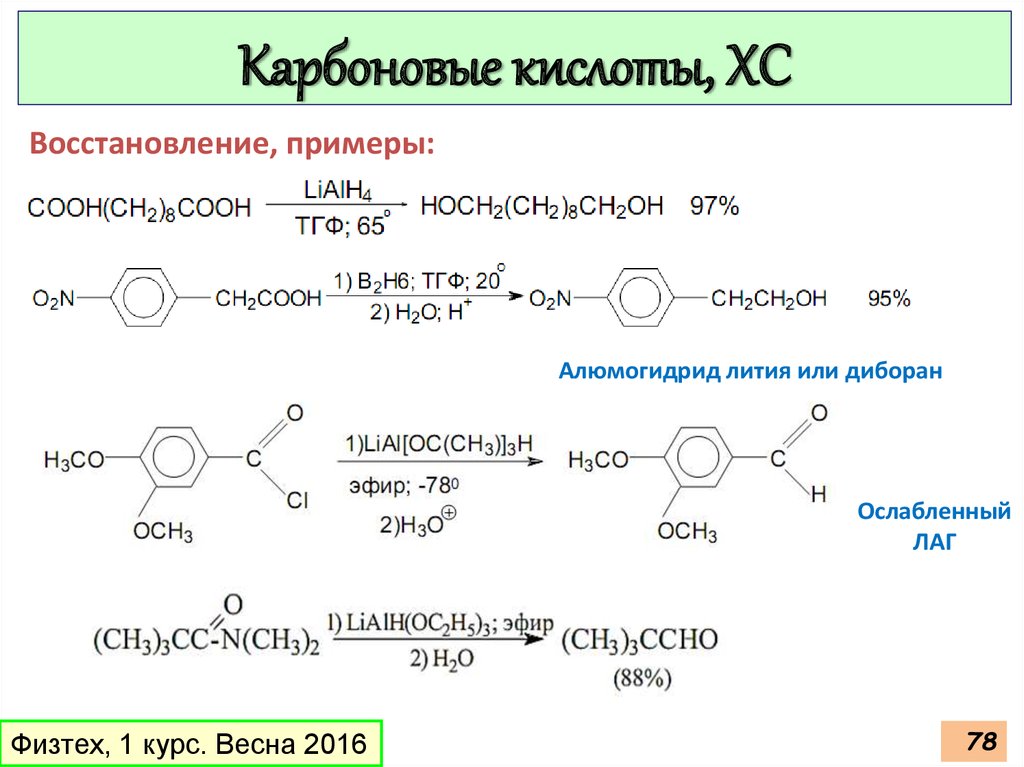
Карбоновые кислоты, ХСВосстановление, примеры:
Алюмогидрид лития или диборан
Ослабленный
ЛАГ
Физтех, 1 курс. Весна 2016
78
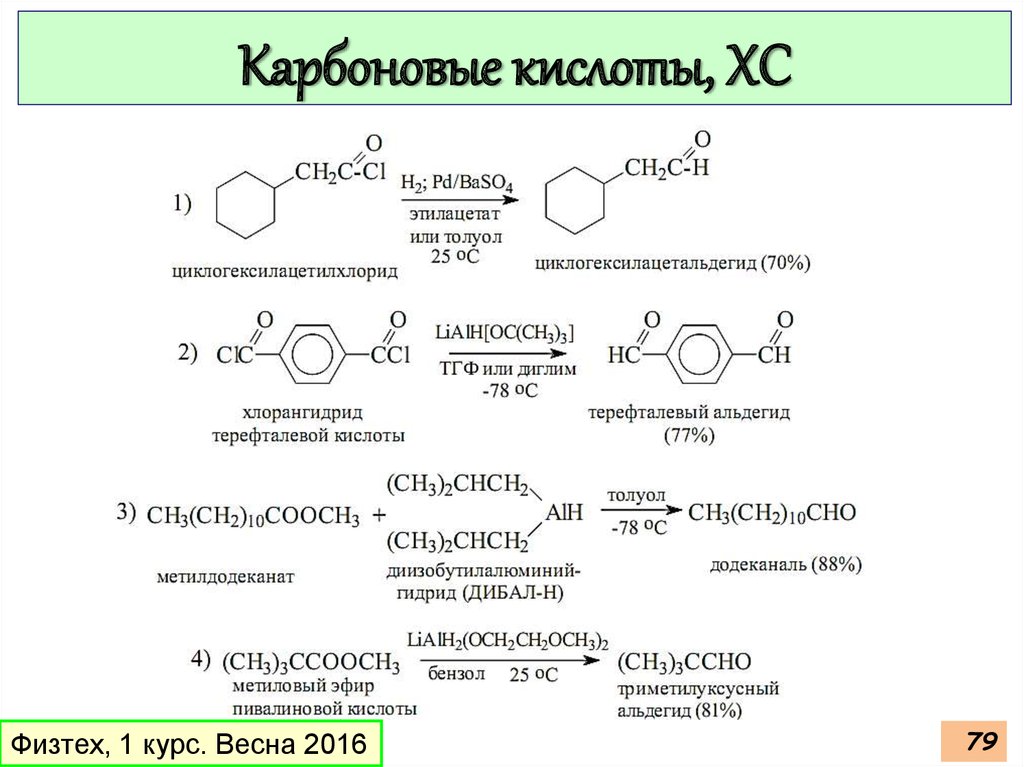
78.
Карбоновые кислоты, ХСФизтех, 1 курс. Весна 2016
79
79.
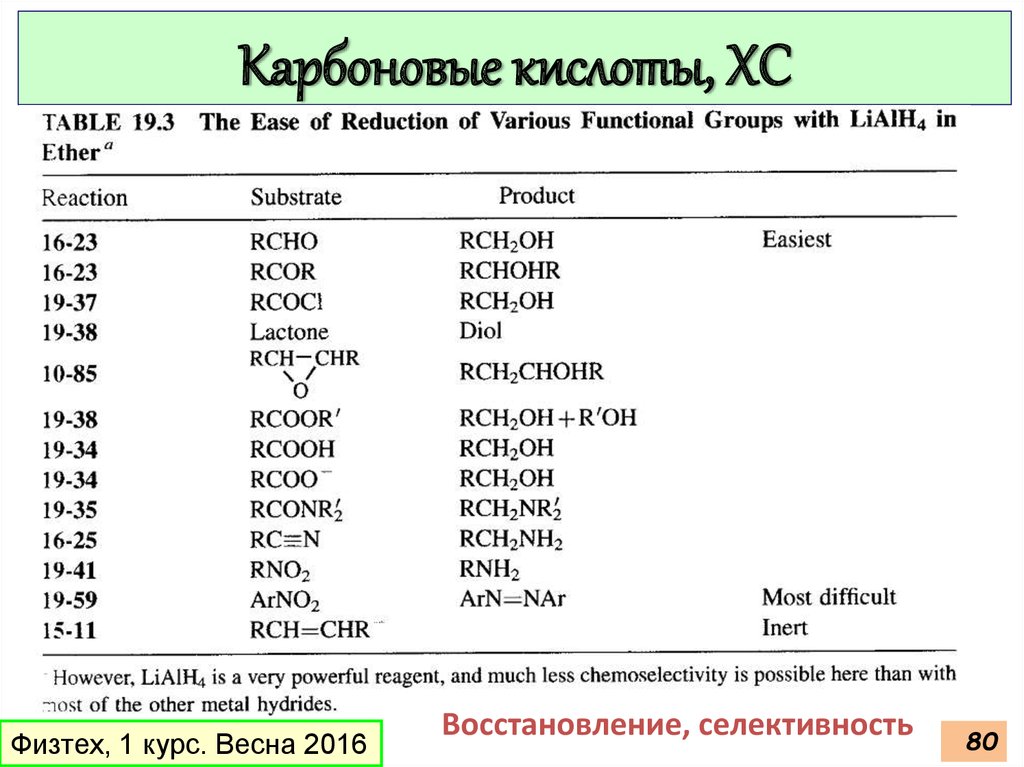
Карбоновые кислоты, ХСФизтех, 1 курс. Весна 2016
Восстановление, селективность
80
80.
Карбоновые кислоты, ХСВосстановление, селективность
Физтех, 1 курс. Весна 2016
81
81.
82.
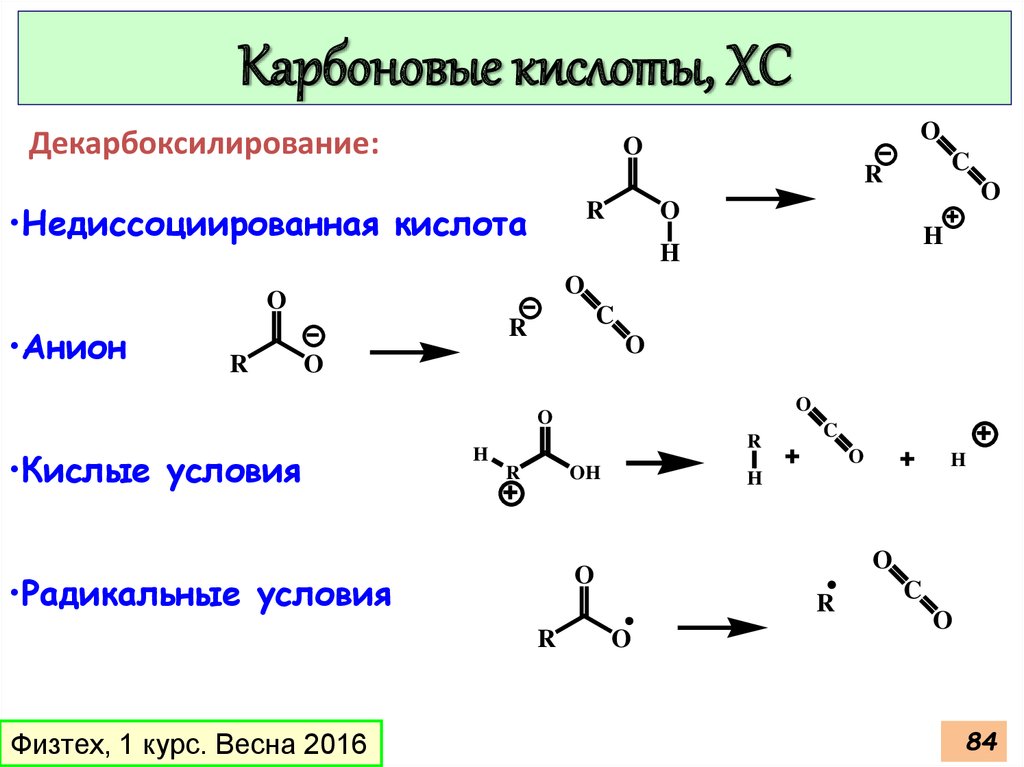
Карбоновые кислоты, ХСДекарбоксилирование:
O
O
C
R
•Недиссоциированная кислота
R
O
C
R
R
H
H
O
•Анион
O
O
O
O
O
O
•Кислые условия
R
H
R
OH
O
O
R
R
H
H
O
•Радикальные условия
Физтех, 1 курс. Весна 2016
C
O
C
O
84
83.
Карбоновые кислоты, ХСФизтех, 1 курс. Весна 2016
85
84.
Карбоновые кислоты, ХСДекарбоксилирование радикальное: Бородин - Хунсдиккер
Физтех, 1 курс. Весна 2016
86
85.
Карбоновые кислоты, ХСДекарбоксилирование радикальное: Кочи (1965)
Физтех, 1 курс. Весна 2016
87
86.
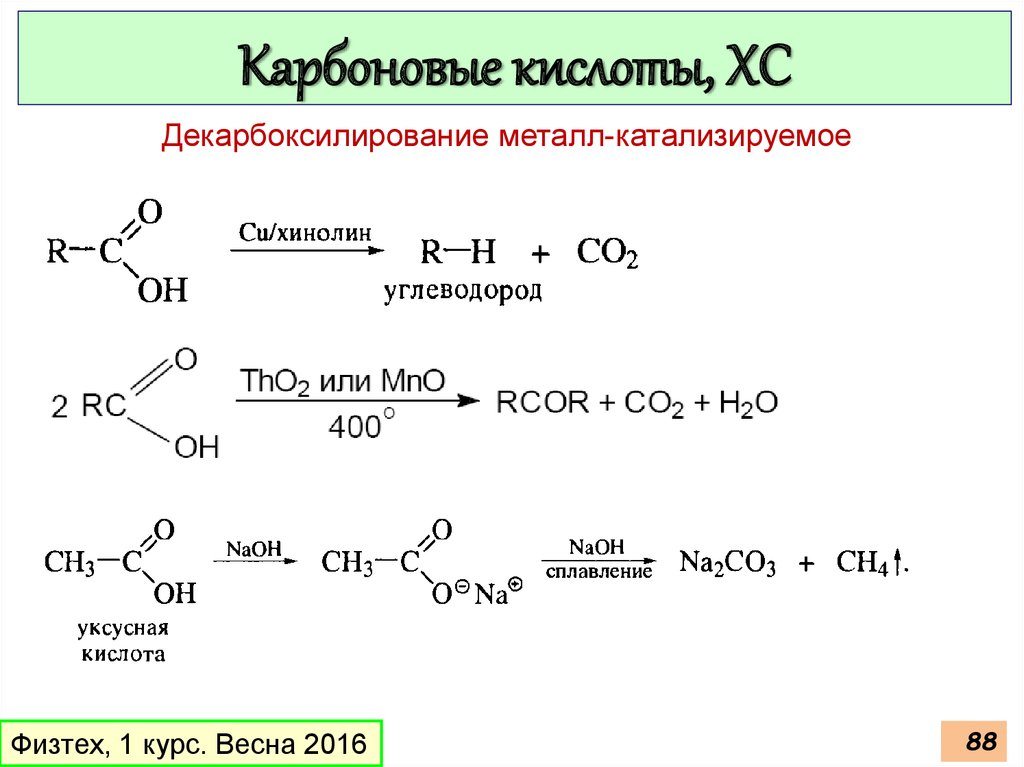
Карбоновые кислоты, ХСДекарбоксилирование металл-катализируемое
Физтех, 1 курс. Весна 2016
88
87.
Карбоновые кислоты, ХСДекарбоксилирование радикальное: Бородин - Хунсдиккер
Физтех, 1 курс. Весна 2016
89
88.
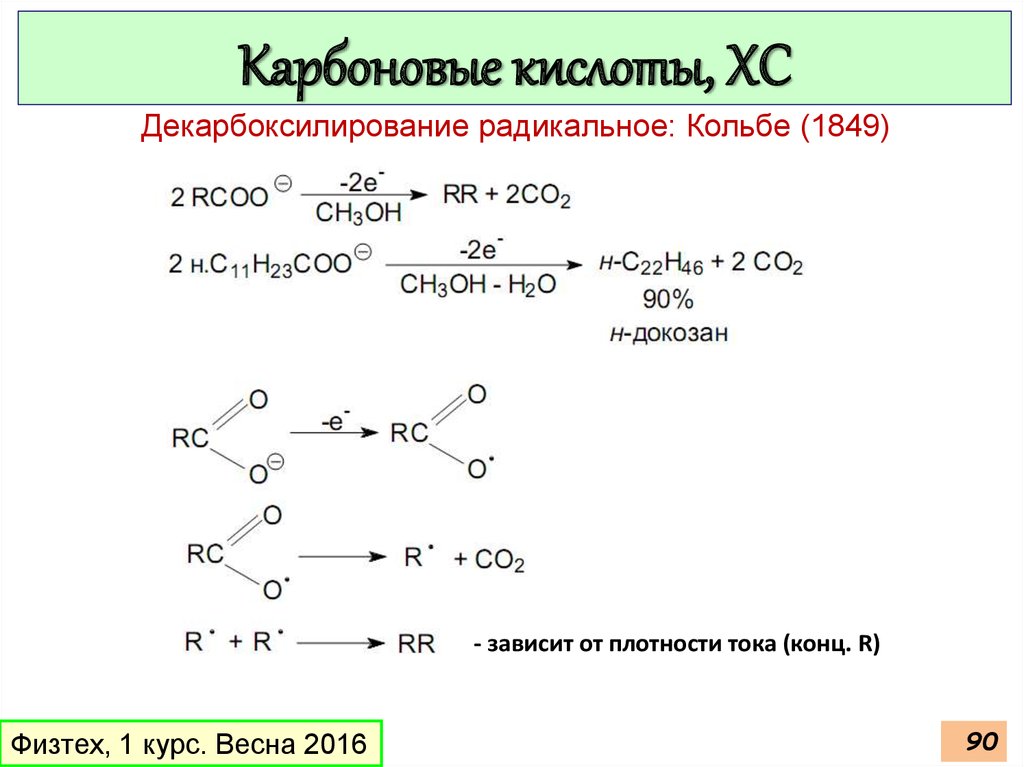
Карбоновые кислоты, ХСДекарбоксилирование радикальное: Кольбе (1849)
- зависит от плотности тока (конц. R)
Физтех, 1 курс. Весна 2016
90
89.
Карбоновые кислоты, ХСГалогенирование в альфа-положение
Реакция Гелль (1881) -Фольгарда-Зелинского
Что будет при радикальном галогенировании?
Физтех, 1 курс. Весна 2016
91
90.
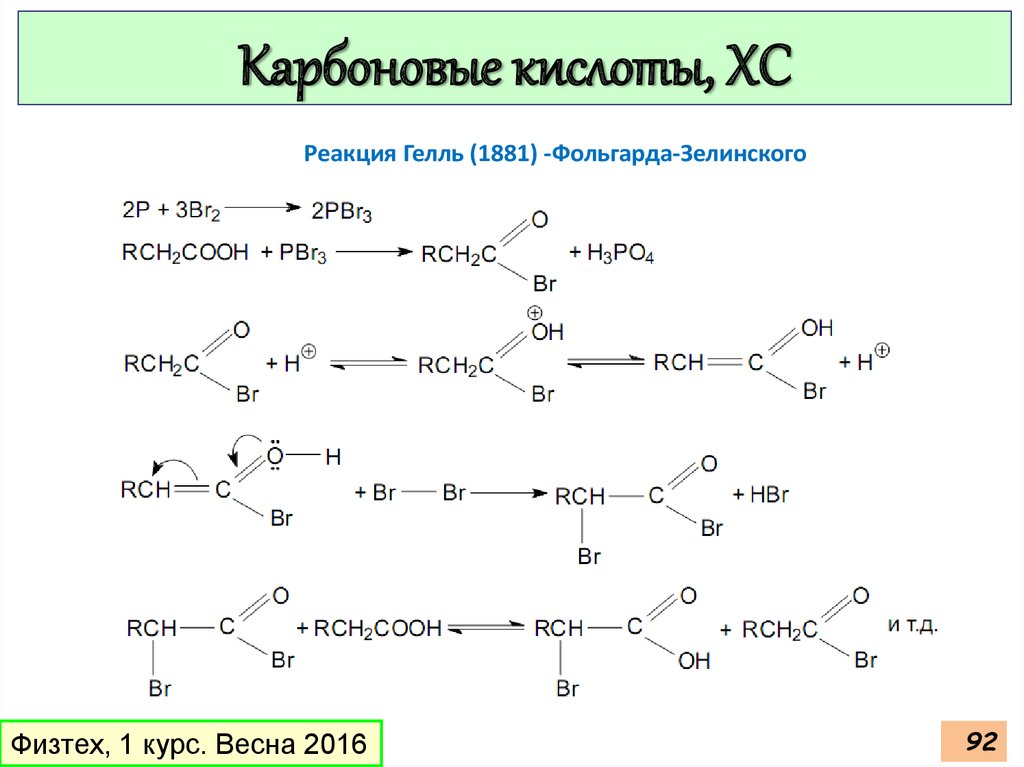
Карбоновые кислоты, ХСРеакция Гелль (1881) -Фольгарда-Зелинского
Физтех, 1 курс. Весна 2016
92
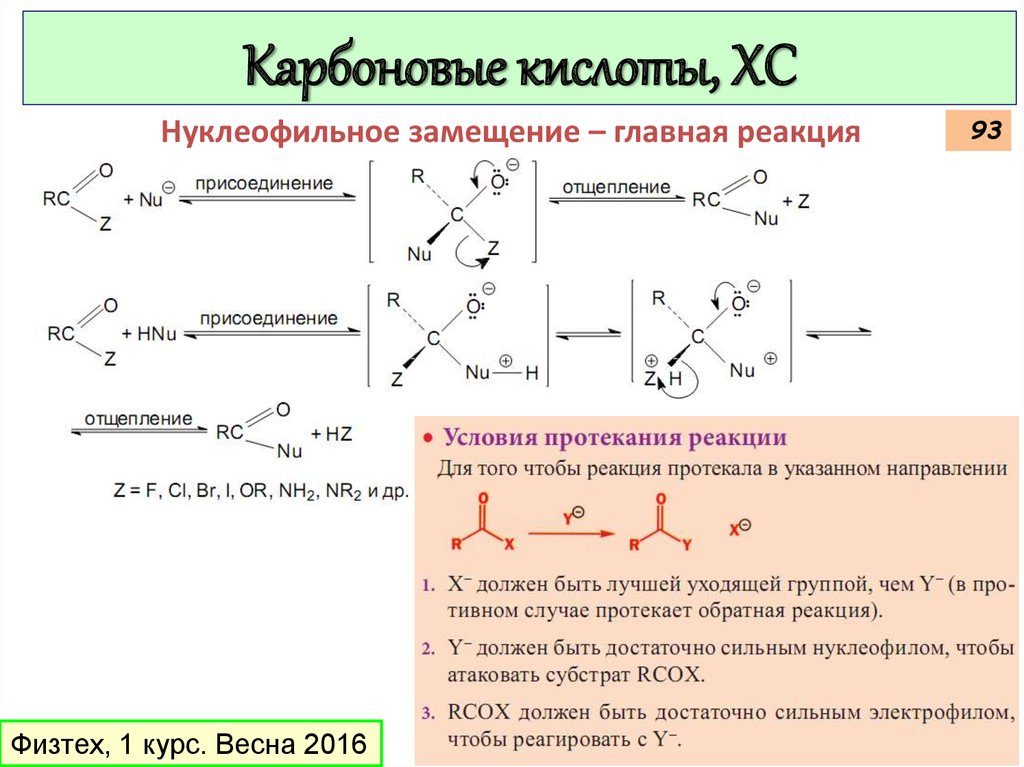
91.
Карбоновые кислоты, ХСНуклеофильное замещение – главная реакция
Физтех, 1 курс. Весна 2016
93
92.
Карбоновые кислоты, ХСв
з
а
и
м
о
п
р
е
в
р
а
щ
е
н
и
е
Физтех, 1 курс. Весна 2016
94
93.
Карбоновые кислоты, ХСВзаимопревращение, примеры:
Физтех, 1 курс. Весна 2016
95
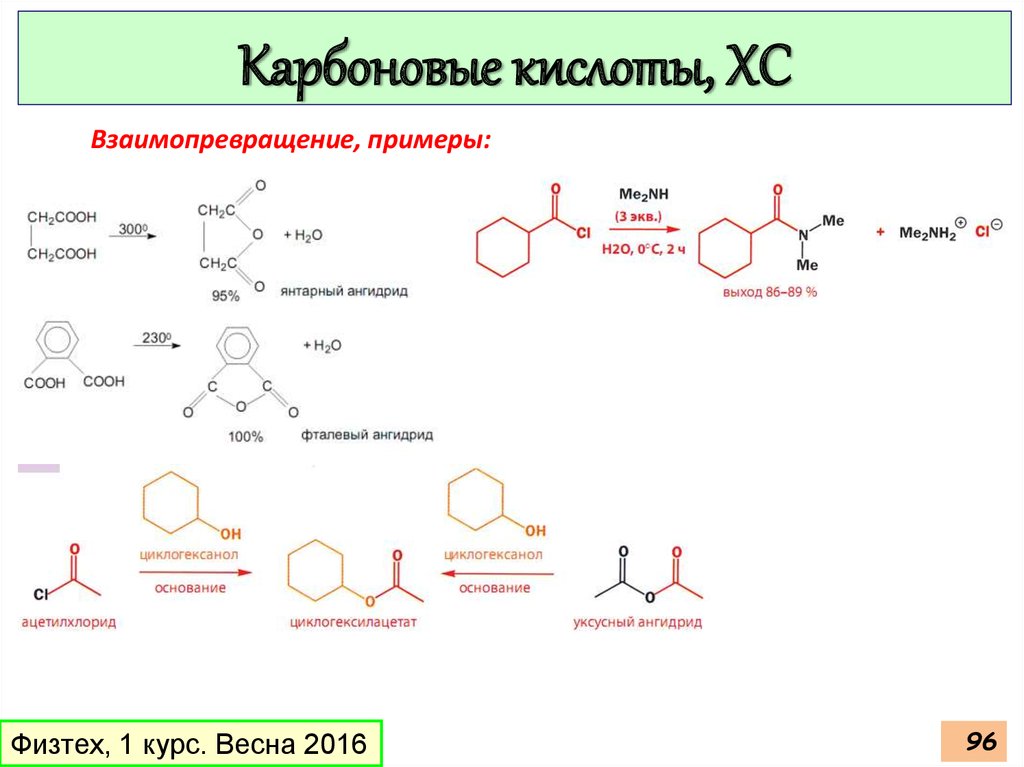
94.
Карбоновые кислоты, ХСВзаимопревращение, примеры:
Физтех, 1 курс. Весна 2016
96
95.
Карбоновые кислоты, ХСЭтерификация кислот
Физтех, 1 курс. Весна 2016
97
96.
Карбоновые кислоты, ХСЭтерификация кислот, гидролиз сложных эфиров
Физтех, 1 курс. Весна 2016
98
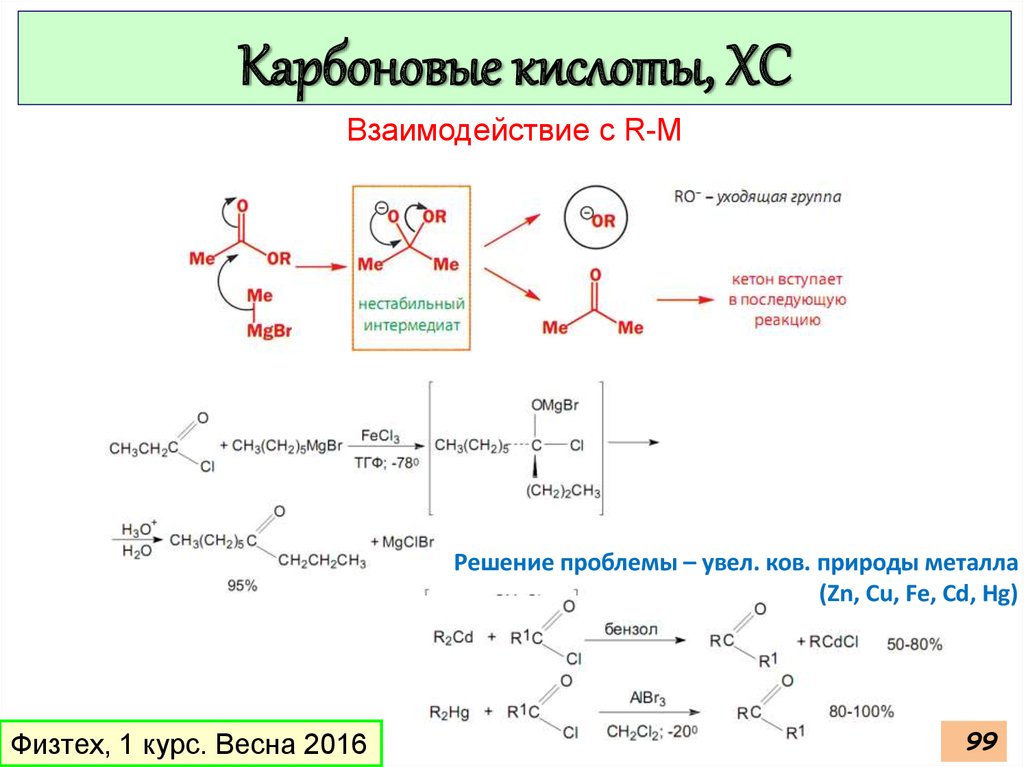
97.
Карбоновые кислоты, ХСВзаимодействие с R-M
Решение проблемы – увел. ков. природы металла
(Zn, Cu, Fe, Cd, Hg)
Физтех, 1 курс. Весна 2016
99
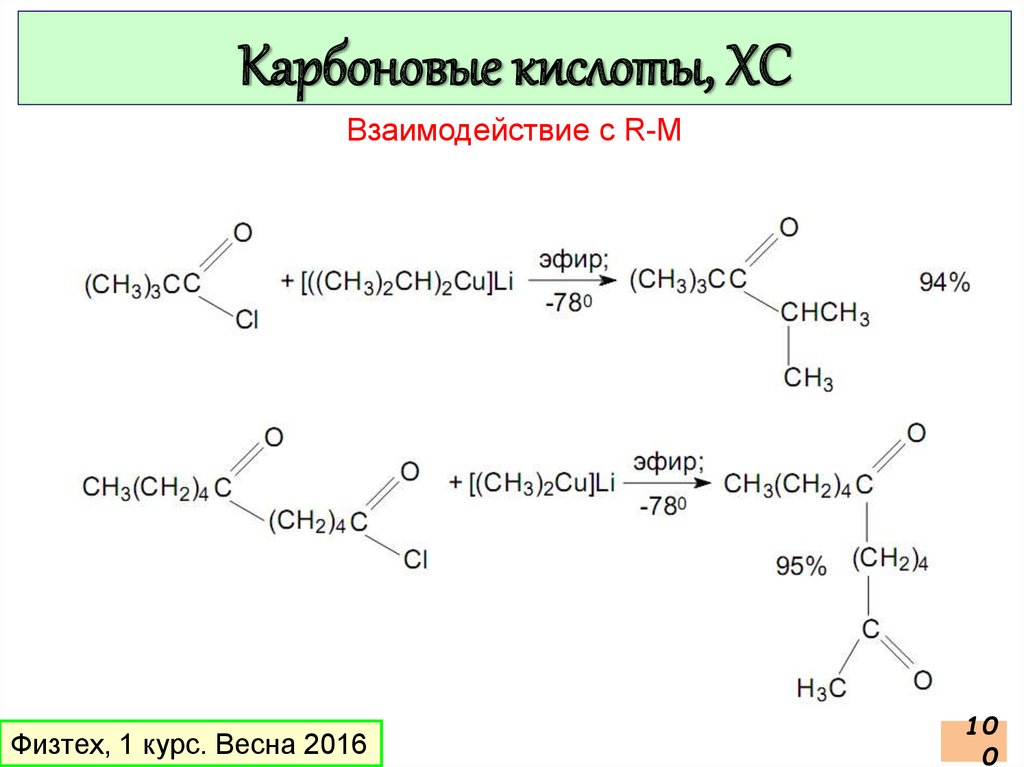
98.
Карбоновые кислоты, ХСВзаимодействие с R-M
Физтех, 1 курс. Весна 2016
10
0
99.
Карбоновые кислоты, ХССекстетные перегруппировки
Метод удлинения углеродной цепи по Арндту-Эйстерту (кетены)
Синтез через нитрен. Перегруппировки Курциуса (Шмидта), Гофмана
Физтех, 1 курс. Весна 2016
101
100.
Карбоновые кислоты, ХССекстетные перегруппировки
Физтех, 1 курс. Весна 2016
102
101.
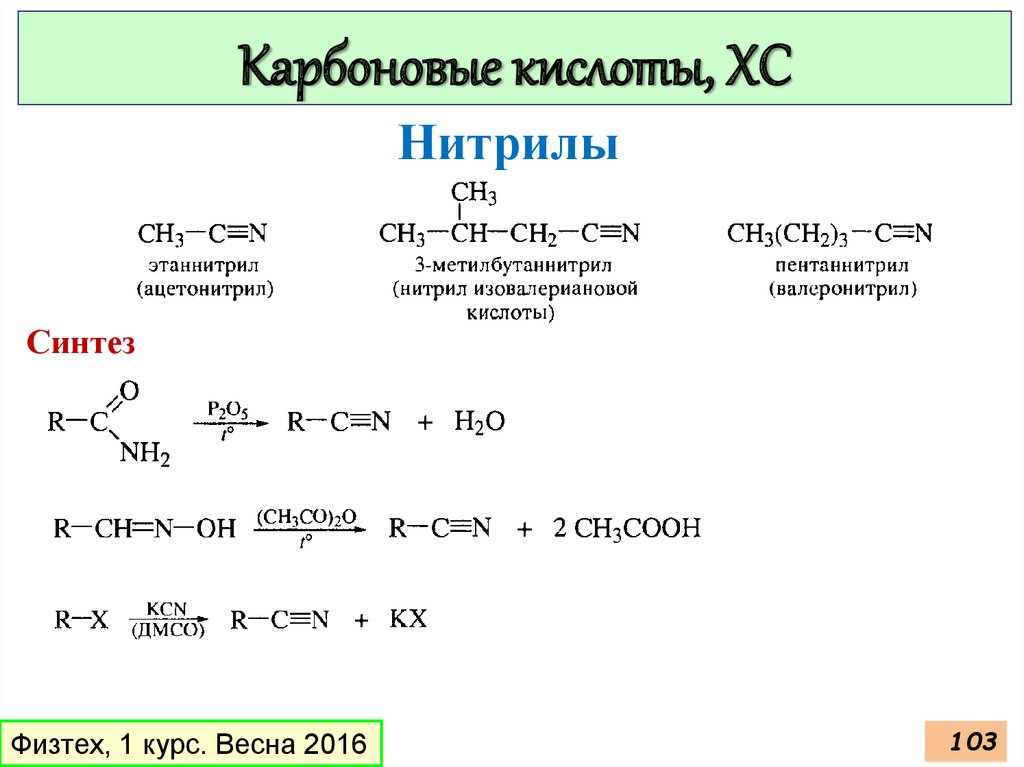
Карбоновые кислоты, ХСНитрилы
Синтез
Физтех, 1 курс. Весна 2016
103
102.
Карбоновые кислоты, ХСРеакция Риттера
Нитрилы
Гидролиз
Восстановление
Физтех, 1 курс. Весна 2016
104
103.
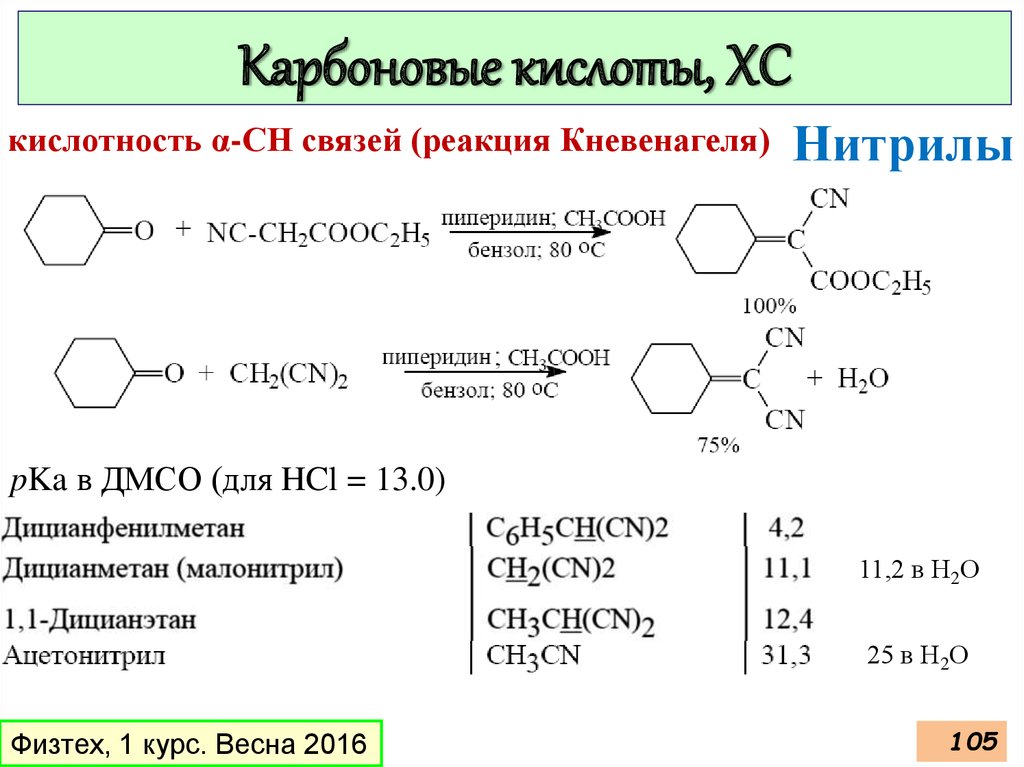
Карбоновые кислоты, ХСкислотность α-СН связей (реакция Кневенагеля)
Нитрилы
pKa в ДМСО (для HCl = 13.0)
11,2 в Н2О
25 в Н2О
Физтех, 1 курс. Весна 2016
105
104.
Оксокарбоновые кислоты, ПЛОксокислоты
Сложноэфирная конденсация Кляйзена
Физтех, 1 курс. Весна 2016
106
105.
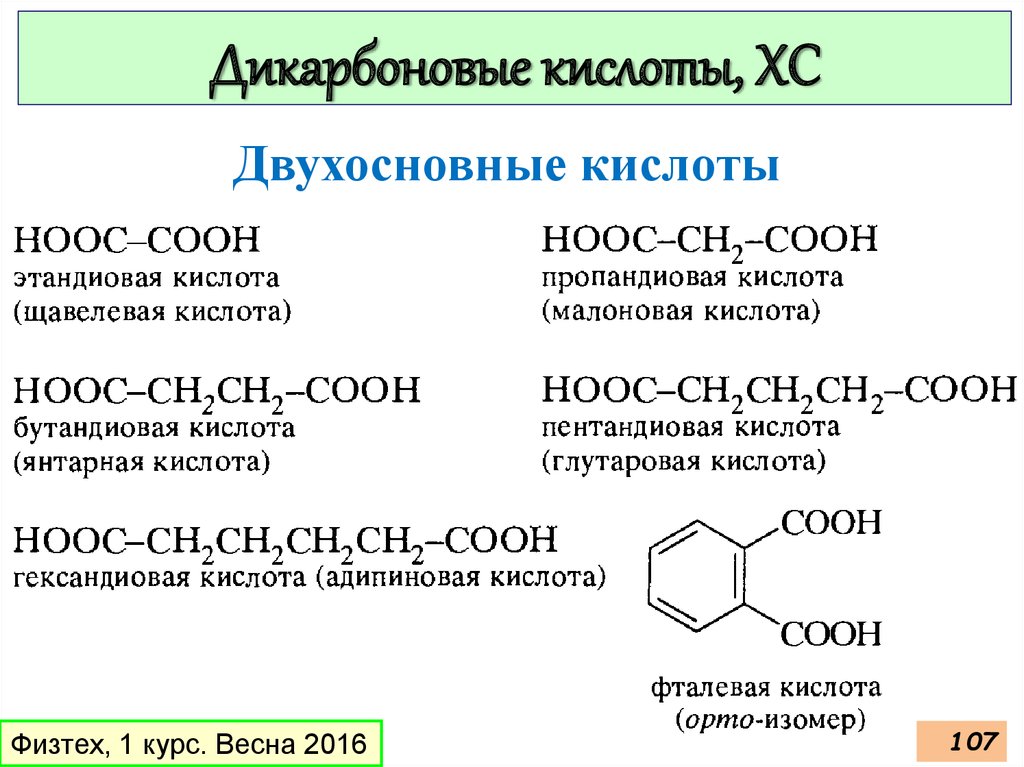
Дикарбоновые кислоты, ХСДвухосновные кислоты
Физтех, 1 курс. Весна 2016
107
106.
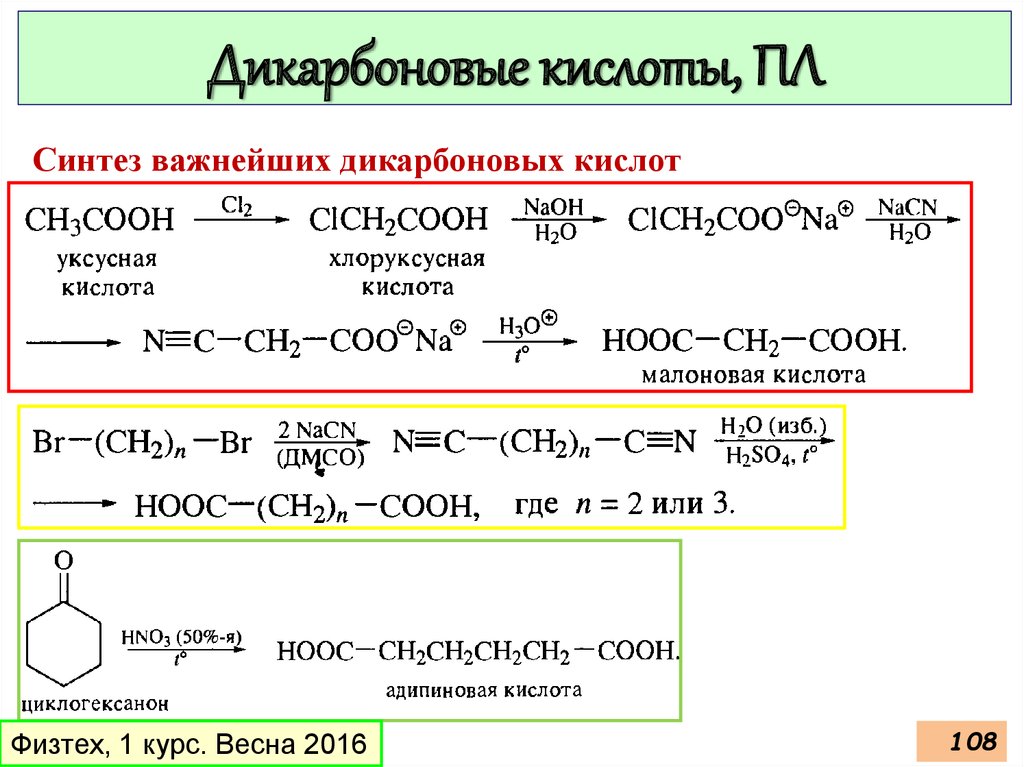
Дикарбоновые кислоты, ПЛСинтез важнейших дикарбоновых кислот
Физтех, 1 курс. Весна 2016
108
107.
Ди-Карбоновые кислоты, ХССложноэфирная конденсация Кляйзена
уходящая группа
109
Физтех, 1 курс. Весна 2016
109
108.
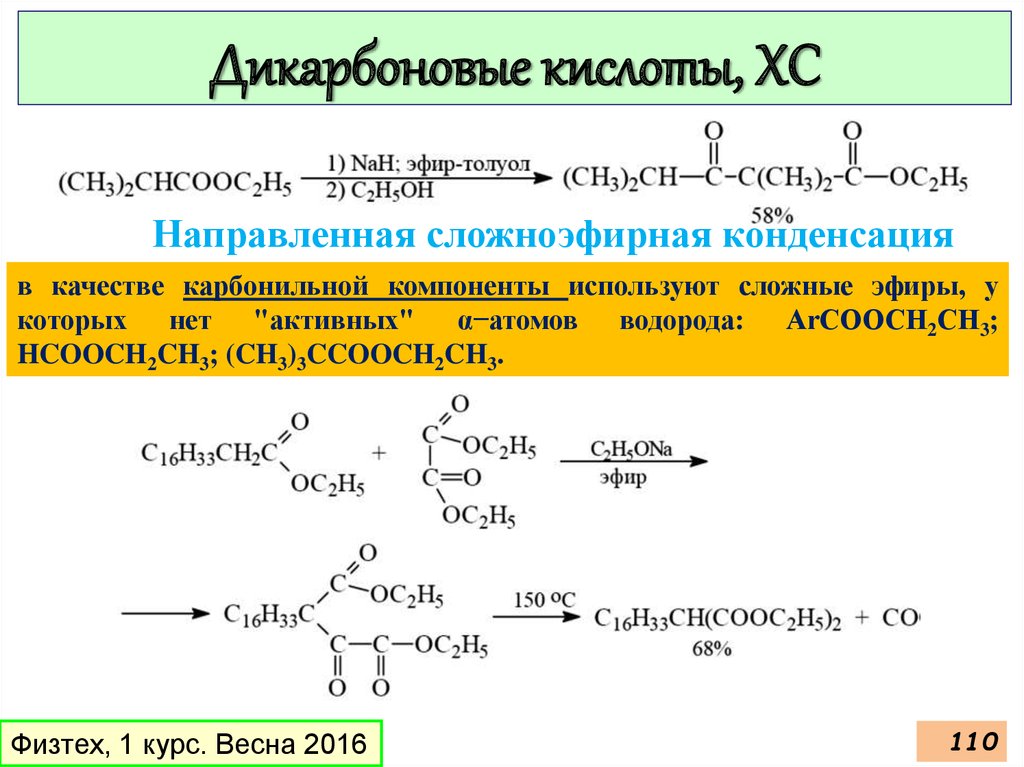
Дикарбоновые кислоты, ХСНаправленная сложноэфирная конденсация
в качестве карбонильной компоненты используют сложные эфиры, у
которых нет "активных" α−атомов водорода: ArСООСН2СН3;
HCOOCH2CH3; (CH3)3CCOOCH2CH3.
Физтех, 1 курс. Весна 2016
110
109.
Дикарбоновые кислоты, ХСКонденсация Дикмана
n = 4-5
Ацилоиновая конденсация эфиров дикарбоновых кислот
Физтех, 1 курс. Весна 2016
111
110.
Карбоновые кислоты, ХСАцилоиновая конденсация эфиров дикарбоновых кислот
Физтех, 1 курс. Весна 2016
112
111.
Карбоновые кислоты, ХСКонденсация сложного эфира и кетона
С-Н-кислотность кетонов в 105 раз превышает кислотность сложных эфиров:
кетоны играют роль метиленовой, а сложные эфиры – карбонильной компоненты,
присутствует конкуренция сложноэфирной и альдольной конденсаций
Физтех, 1 курс. Весна 2016
113
112.
Оксокарбоновые кислоты, ХССвойства ацетоуксусного эфира (АУЭ)
в воде
в гексане ~ 1:1
Физтех, 1 курс. Весна 2016
114
113.
Оксокарбоновые кислоты, ХСФизтех, 1 курс. Весна 2016
115
114.
Оксокарбоновые кислоты, ХСФизтех, 1 курс. Весна 2016
116
115.
Оксокарбоновые кислоты, ХСФизтех, 1 курс. Весна 2016
117
116.
Оксокарбоновые кислоты, ХСФизтех, 1 курс. Весна 2016
118
117.
Оксокарбоновые кислоты, ХСФизтех, 1 курс. Весна 2016
119
118.
Физтех, 1 курс. Весна 2016Дикарбоновые кислоты, ХС
Синтезы с использованием малонового эфира
120
119.
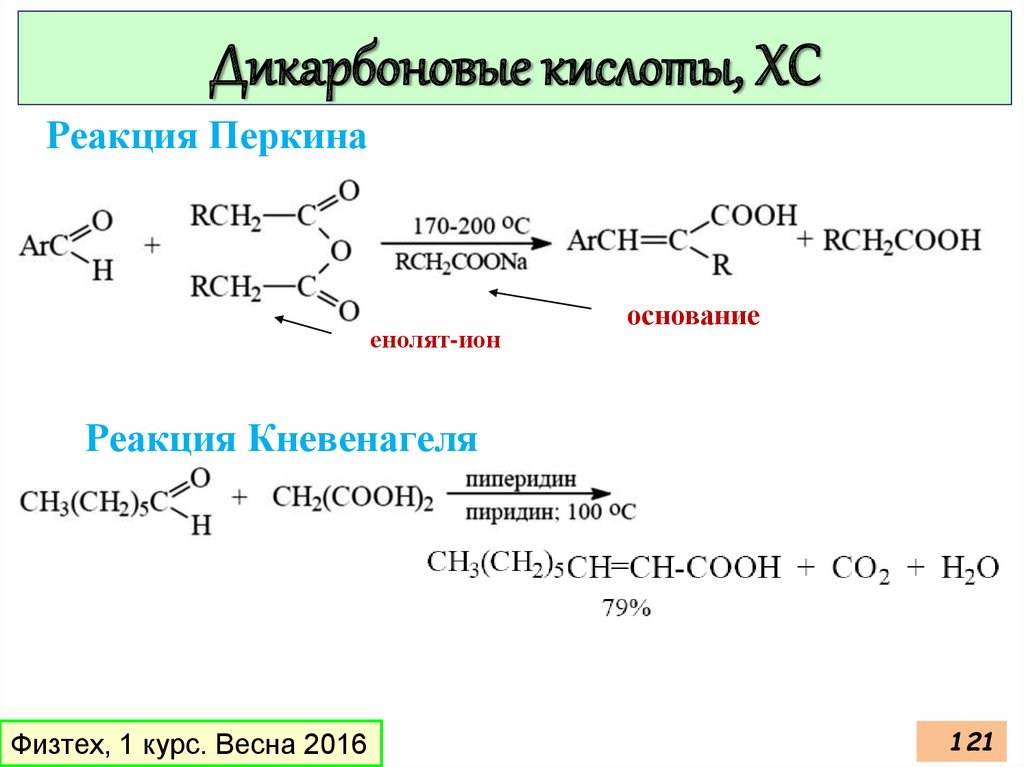
Дикарбоновые кислоты, ХСРеакция Перкина
енолят-ион
основание
Реакция Кневенагеля
Физтех, 1 курс. Весна 2016
121
120.
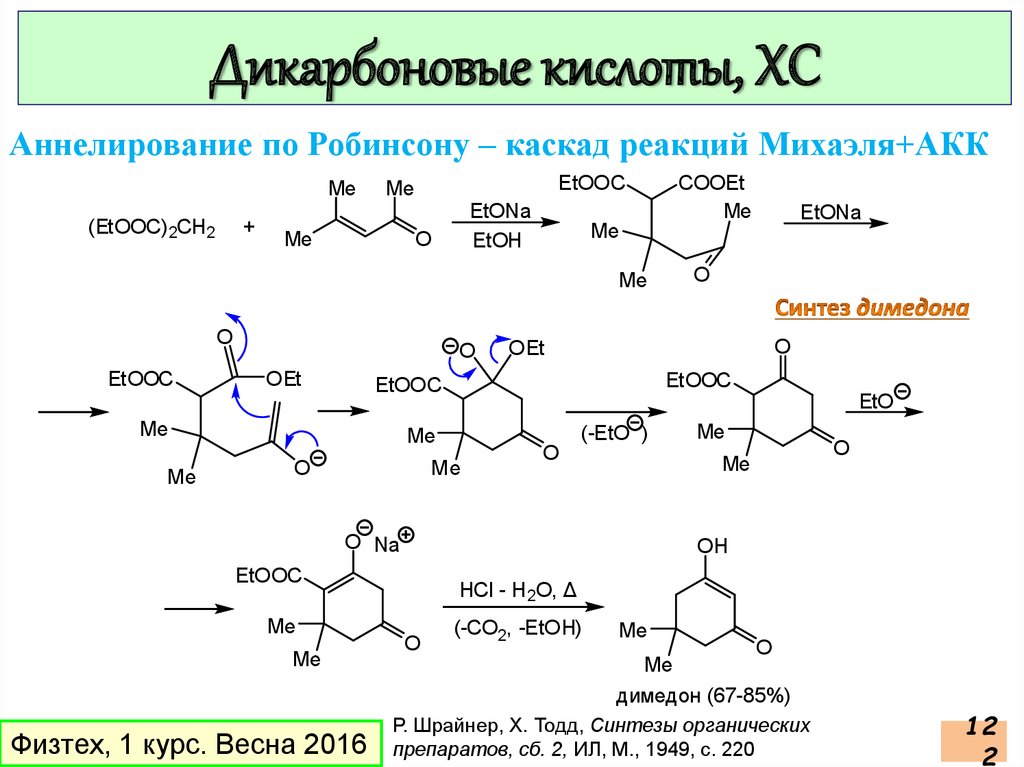
Дикарбоновые кислоты, ХСАннелирование по Робинсону – каскад реакций Михаэля+АКК
Me
(EtOOC)2CH2
+
EtOOC
Me
Me
EtONa
EtOH
O
Me
Me
O
EtOOC
O
OEt
Me
O
EtOOC
EtO
(-EtO )
Me
O
Me
O
Физтех, 1 курс. Весна 2016
O
OH
EtOOC
Me
Me
Me
O Na
Me
EtONa
O
OEt
EtOOC
Me
COOEt
Me
HCl - H2O, Δ
O
(-CO2, -EtOH)
Me
O
Me
димедон (67-85%)
Р. Шрайнер, Х. Тодд, Синтезы органических
препаратов, сб. 2, ИЛ, М., 1949, с. 220
12
2
121.
Коротко о главном1. Производные карбоновых кислот – максимально устойчивые
окисленные формы производных углеводородов.
2. Для карбоксильной функции характерны реакции протекающие по
механизмам AdN, в меньшей мере SE
3. Широкий спектр превращений для карбоновых составляют реакции
конденсации (Кляйзена (Дикмана), Кневенагеля, Перкина и
ацилоиновая конденсации)
4. Для нестабильных ацильных форм протекают перегруппировки в
кетены и изоцианаты – предшественники кислот и аминов
5. Большинство производных кислот можно получить из младших
представителей эфиров оксокислот – АУЭ и дикислот: щавелевой и
малоновой кислот.
Физтех, 1 курс. Весна 2016
123






























































 Химия
Химия








