Похожие презентации:
Физика фононов
1.
Карпов Сергей ВладимировичФИЗИКА ФОНОНОВ
Читает Михаил Борисович Смирнов
1
2.
Физика конденсированного состояния(condensed matter)
жидкости, кристаллы и аморфные тела - стекла, керамика и
полимеры (мягкие конденсированные среды)
Физика твердого тела = Физика кристаллов
(solid state)
1. Кристалл – основное состояние вещества при низких
температурах
2. Кристаллы имеют множество практических применений
(конструкционные материалы, оптика, электроника)
3. Наличие периодичности позволяет детально описать
пространственную и энергетическую структуру кристаллов и
связать их с физическими свойствами.
2
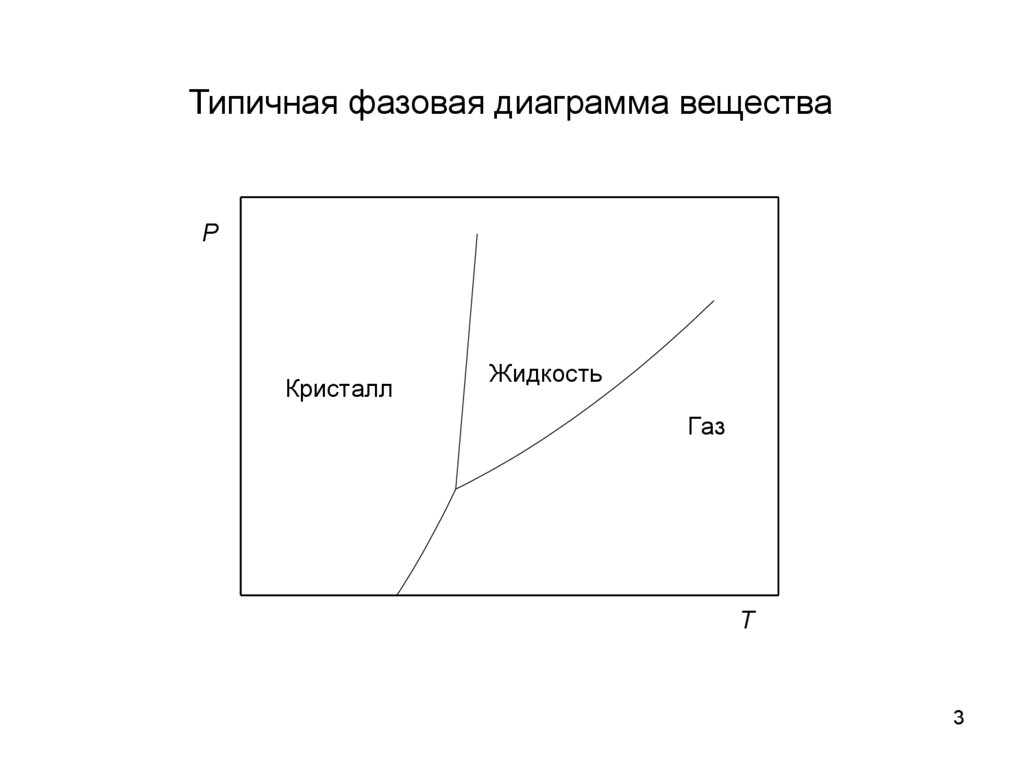
3.
Типичная фазовая диаграмма веществаP
Кристалл
Жидкость
Газ
T
3
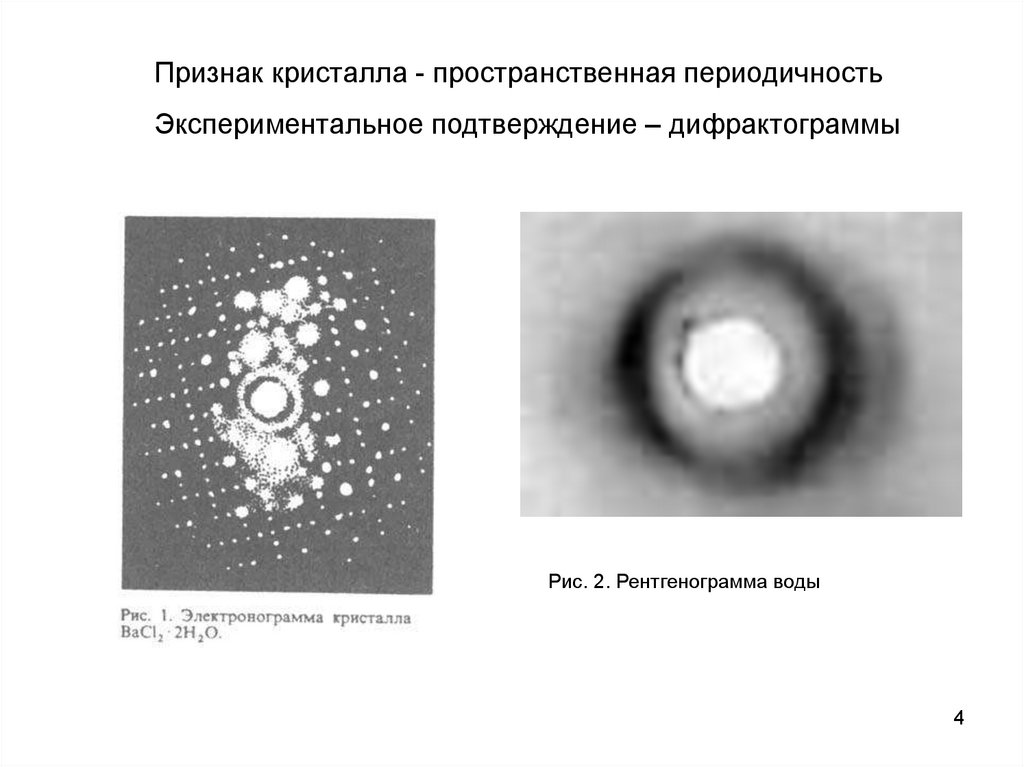
4.
Признак кристалла - пространственная периодичностьЭкспериментальное подтверждение – дифрактограммы
Рис. 2. Рентгенограмма воды
4
5.
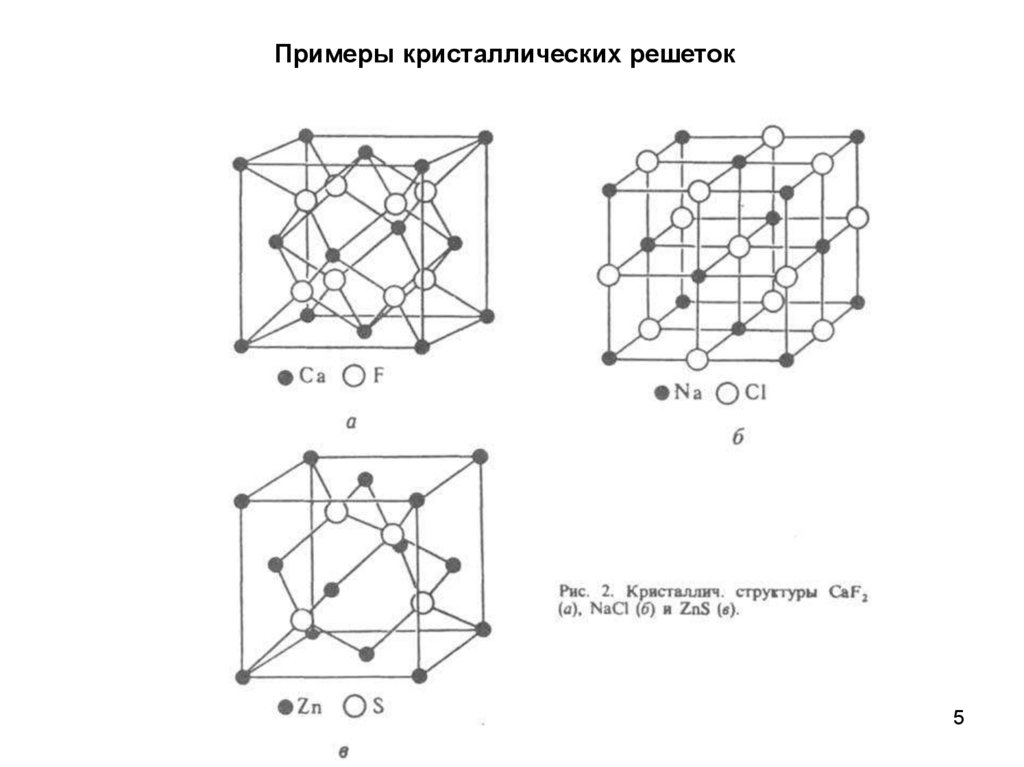
Примеры кристаллических решеток5
6.
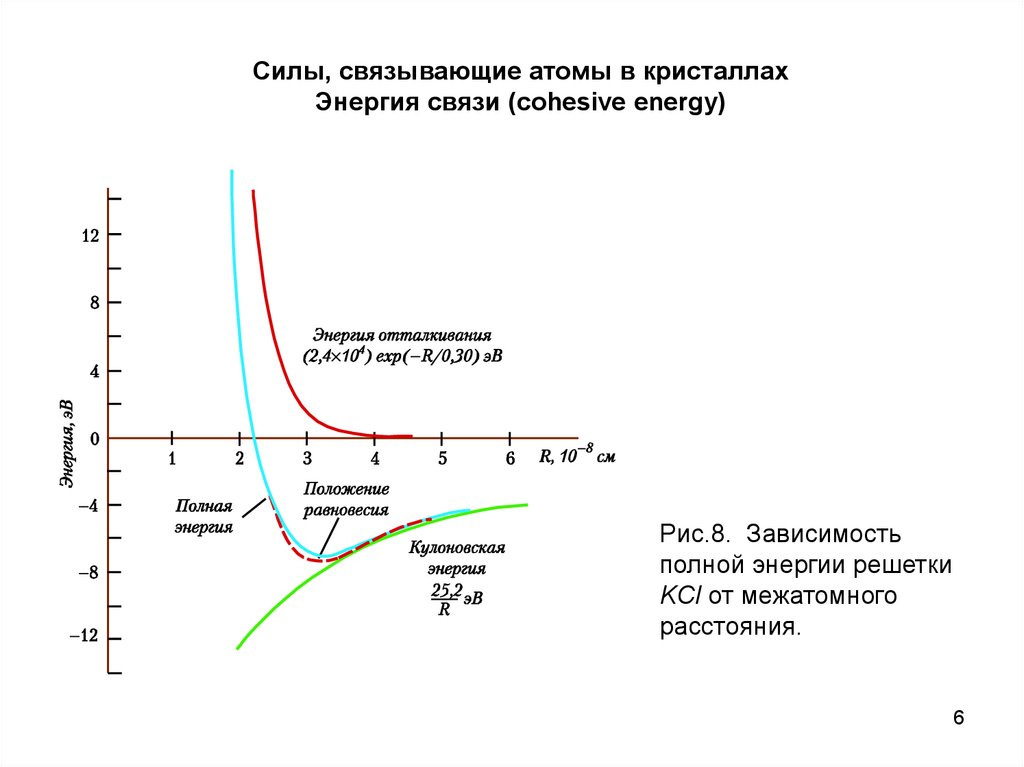
Силы, связывающие атомы в кристаллахЭнергия связи (cohesive energy)
Рис.8. Зависимость
полной энергии решетки
KCl от межатомного
расстояния.
6
7.
КЛАССИФИКАЦИЯ КРИСТАЛЛОВ ПО ТИПАМ СВЯЗИ (стр. 6)Тип
Кристалла
Примеры
Энергия
связи,
ккал/моль
Свойства
1. Ионные
CsI
NaCl
LiF
145
180
240
Диэлектрики
(при
высоких
температурах - ионная проводимость);
твердые, хрупкие.
2. Ковалентные
Алмаз
SiC
170
135
Диэлектрики,
высокая
твердость,
высокая температура плавления
3. Металлические
Na
Fe
26
94
Высокая электропроводность, высокий
коэффициент отражения, пластичные
4. Молекулярные
Ar
O2
CCl4
1,8
1,9
2,4
Диэлектрики, низкая точка плавления,
высокая сжимаемость.
5. С водородными
связями
HF
Лед
Глицин
7
12
80
Тенденция к полимеризации
+5 ккал/моль
7
8.
МОЛЕКУЛЯРНЫE КРИСТАЛЛЫ (стр. 12, п. Г)ЭНЕРГИИ СВЯЗИ И ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
НЕКОТОРЫХ МОЛЕКУЛЯРНЫХ КРИСТАЛЛОВ (стр15, таблица 7)
кристалл
Энергия связи
U, ккал/моль
Температура, oK
Температура, oK
плавления
кипения
Ne
0.59
–182.5
24.6
Ar
1.80
-
83.1
N2
1.86
5.5
–182.5 oC
Метан CH4
2.70
80
–161.6 oC
Cl2
7.43
216
-
Бензол C6H6
9.80
80.2 oC
Нафталин C10H8
15.90
218 oC
Антрацен C14H10
22.3
340 oC
8
9.
Структура кристалла глицина NH2CH2COOH9
10.
Атом-атомные потенциалы для молекулярных кристалловПотенциал Ленарда-Джонса-Девонашира (стр 14):
12 6
U (r ) 4
r
r
Отталкивание – обменные силы
Притяжение - силы Ван-дер-Ваальса
10
11.
Схема взаимодействия диполей,определяющих Ван-дер-Ваальсовы силы (стр 12, рис.7)
11
12.
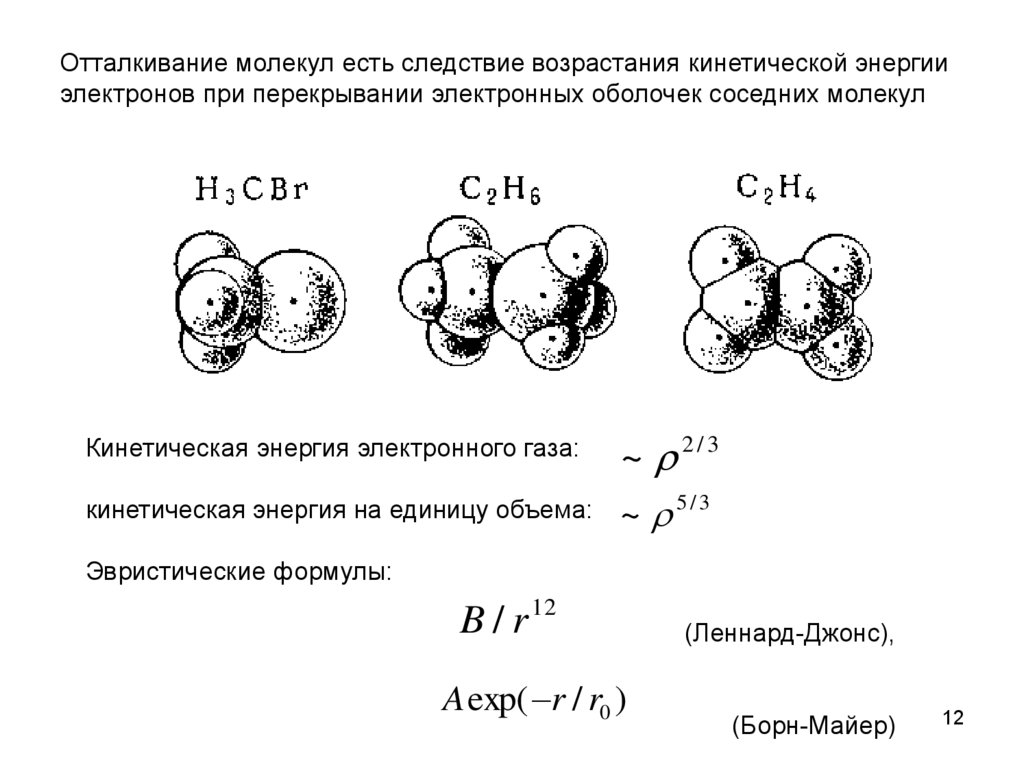
Отталкивание молекул есть следствие возрастания кинетической энергииэлектронов при перекрывании электронных оболочек соседних молекул
~ 2/3
кинетическая энергия на единицу объема: ~ 5 / 3
Кинетическая энергия электронного газа:
Эвристические формулы:
B/r
12
A exp( r / r0 )
(Леннард-Джонс),
(Борн-Майер)
12
13.
Ионные кристаллы A+B(A + I A+ + e )Атом В с высоким сродством к электрону (B + e B- + )
Атом А с низким потенциалом ионизации
Элемент
ε
Элемент
ε
Элемент
ε
Элемент
I (эВ)
H
0,75 Na
0,78
K
0,92
Na
5.1407
He
-0,30 Mg
-0,32
Ca
-0,40
Mg
7.64886
Li
0,58 Al
0,52
Sc
-0,14
Al
5.9802
Be
-0,19 Si
1,39
Ti
0,40
Si
8.14634
B
0,33 P
0,78
V
0,94
P
10.98616
C
1,12 S
2,07
Cr
0,98
S
10.36016
N
-0,27 Cl
3,61
Mn
-1,07
Cl
13.01757
О
1,47 Br
3,36
Fe
0,58
Ar
15.75374
F
Ne
3,45 I
-0,55
3,06
Co
Ni
0,94
1,28
13
14.
Причина электроположительности катионов (Na)и электроотрицательности анионов (Cl)
- устойчивость заполненных оболочек
Атом Na: 1s22s22p63s1 – e ион Na+: 1s22s22p6
оболочка Ne
Атом Cl: 1s22s22p63s23p5 + e
ион Cl–: 1s22s22p63s23p6
оболочка Ar
14
15.
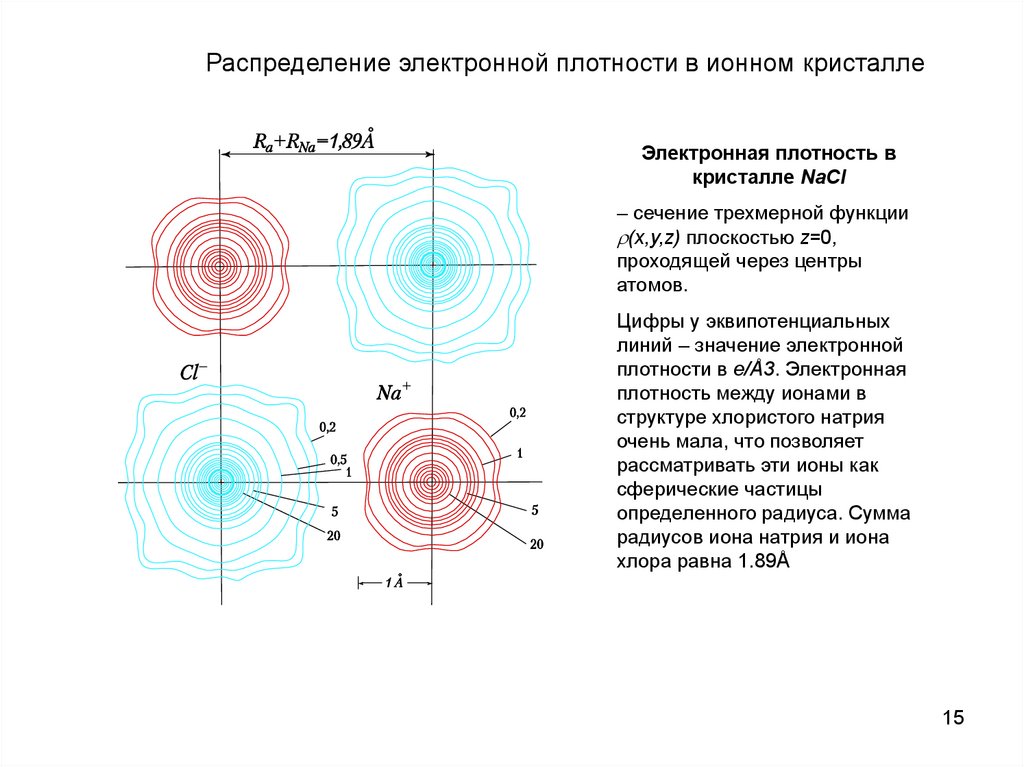
Распределение электронной плотности в ионном кристаллеЭлектронная плотность в
кристалле NaCl
– сечение трехмерной функции
(x,y,z) плоскостью z=0,
проходящей через центры
атомов.
Цифры у эквипотенциальных
линий – значение электронной
плотности в e/Å3. Электронная
плотность между ионами в
структуре хлористого натрия
очень мала, что позволяет
рассматривать эти ионы как
сферические частицы
определенного радиуса. Сумма
радиусов иона натрия и иона
хлора равна 1.89Å
15
16.
Энергия решетки ионных кристаллов АВZ2
ij n
rij
rij
rij pij R
- парный потенциал
- межатомные расстояния
2
2
2
Z
1
Z
1
A
Z
n n
Uo n n
n
pij R R i j pij
R i j pij R
R
i j pij R
1
A n ;
i j p ij
1
i j p ij
- постоянная Маделунга
16
17.
ПОСТОЯННАЯ МАДЕЛУНГАдля некоторых типов решеток
Решетка
NaCl
CsCl
Сфалерит
Вюрцит
1.747558
1.762670
1.63810
1.6410
17
18.
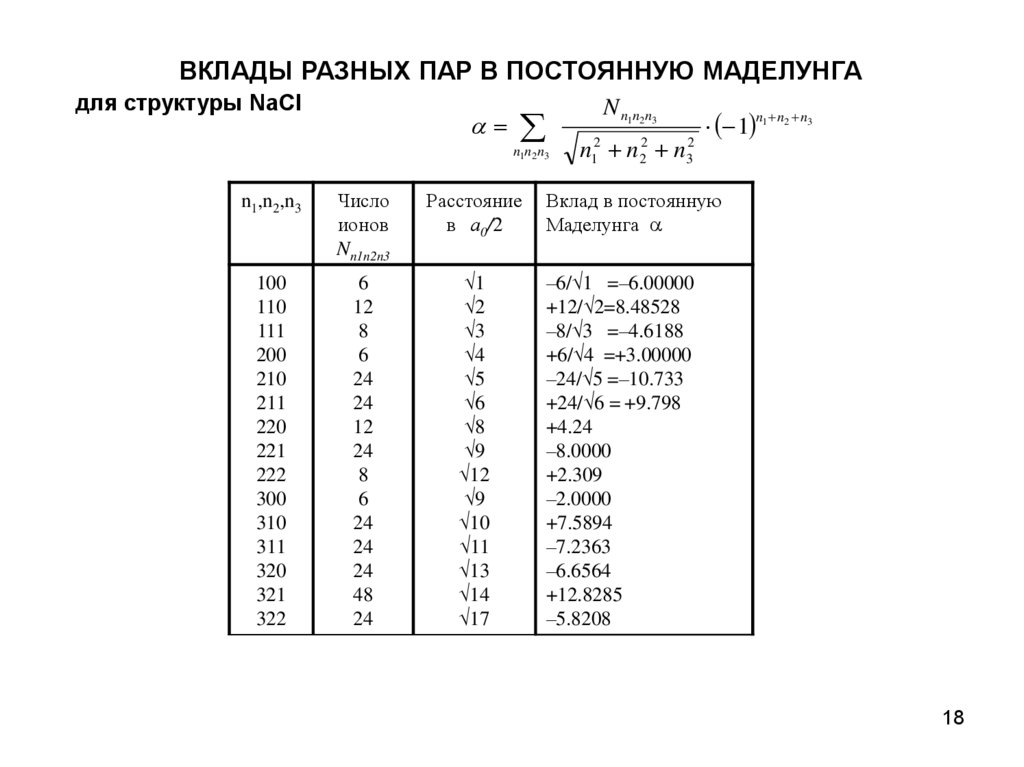
ВКЛАДЫ РАЗНЫХ ПАР В ПОСТОЯННУЮ МАДЕЛУНГАдля структуры NaCl
N n1n2 n3
n1n2 n3
n12 n22 n32
1 1
n1,n2,n3
Число
ионов
Nn1n2n3
Расстояние
в а0/2
Вклад в постоянную
Маделунга
100
110
111
200
210
211
220
221
222
300
310
311
320
321
322
6
12
8
6
24
24
12
24
8
6
24
24
24
48
24
1
2
3
4
5
6
8
9
12
9
10
11
13
14
17
–6/ 1 =–6.00000
+12/ 2=8.48528
–8/ 3 =–4.6188
+6/ 4 =+3.00000
–24/ 5 =–10.733
+24/ 6 = +9.798
+4.24
–8.0000
+2.309
–2.0000
+7.5894
–7.2363
–6.6564
+12.8285
–5.8208
n n2 n3
18
19.
Кулоновское поле в ионном кристалле. Идея метода Эвальда.Элементарная ячейка сложного кристалла содержит n атомов с
координатами xi и зарядами Zi. Пусть L – трехмерный вектор,
описывающий все трансляции ячейки. Тогда кулоновский потенциал в
точке x определяется выражением:
1
( x) Z i
i
L xi L x
Каждая сумма по L расходящаяся. Если добавить к системе точечных
зарядов Zi однородное распределении заряда противоположного
знака с плотностью i Z i / V , то мы получим электронейтральную
систему, потенциал которой определяется формулой Эвальда,
содержащей две абсолютно сходящиеся суммы по прямой и обратной
решетке.
19












 Физика
Физика