Похожие презентации:
Спирты одноатомные предельные
1. СПИРТЫ одноатомные предельные
2. Понятие
Спирты (алканолы) – органическиевещества, молекулы которых содержат
одну или несколько гидроксильных
групп (групп –ОН), соединенных с
углеводородным радикалом.
Общая формула одноатомных предельных
спиртов СnН2n+1ОН
3. Классификация спиртов
По числу атомности:- одноатомные
(СН3-CH2-ОН)
- двухатомные
(НО-СН2-СН2-ОН)
- трехатомные
- многоатомные
(СН2-СН-СН2)
|
|
|
ОН ОН ОН
По углеводородному
радикалу:
- предельные (СН3-СН2-ОН)
- непредельные (СН2=СН2-ОН)
(СН2-СН-СН-CH-CH-СН2)
|
|
|
|
|
|
- ароматические
ОН ОН ОН ОН OH OH
По характеру атома углерода:
- первичные (СН3-СН2-СН2-ОН)
- Вторичные
(СН3-СН-СН3)
|
ОН
- третичные
СН
3
|
СН3-C-ОН
|
ОН
-СН2-ОН
4. НОМЕНКЛАТУРА И ИЗОМЕРИЯ
При образовании названий спиртов к названию углеводорода,соответствующего спирту, добавляют (родовой) суффикс – ОЛ.
Цифрами после суффикса указывают положение гидроксильной группы в
главной цепи:
H
|
H- C – O H
|
H
метанол
H H
H
H
|3 |2 |1
H- C – C – C -OH
| | |
H H H
H
H
| 1 | 2 |3
пропанол-1
H - C – C – C -H
| | |
H OH H
пропанол -2
ВИДЫ ИЗОМЕРИИ:
1. Изомерия положения функциональной группы (пропанол–1 и пропанол–2)
2.Изомерия углеродного скелета
CH3-CH2-CH2-CH2-OH
бутанол-1
CH3-CH-CH2-OH
|
CH3 2-метилпропанол-1
3.Изомерия межклассовая – спирты изомерны простым эфирам:
СН3-СН2-ОН
этанол
СН3-О-СН3
диметиловый эфир
5. Способы получения
Лабораторные:
Гидролиз галогеналканов:
R-CL+NaOH
R-OH+NaCL
Гидратация алкенов: CH2=CH2+H2O C2H5OH
Гидрирование карбонильных соединений
Промышленные:
Синтез метанола из синтез-газа
CO+2H2
CH3-OH(при повышенном давлении, высокой
температуре и катализатора оксида цинка)
Гидратация алкенов
Брожение глюкозы: C6H12O6 2C2H5OH+2CO2
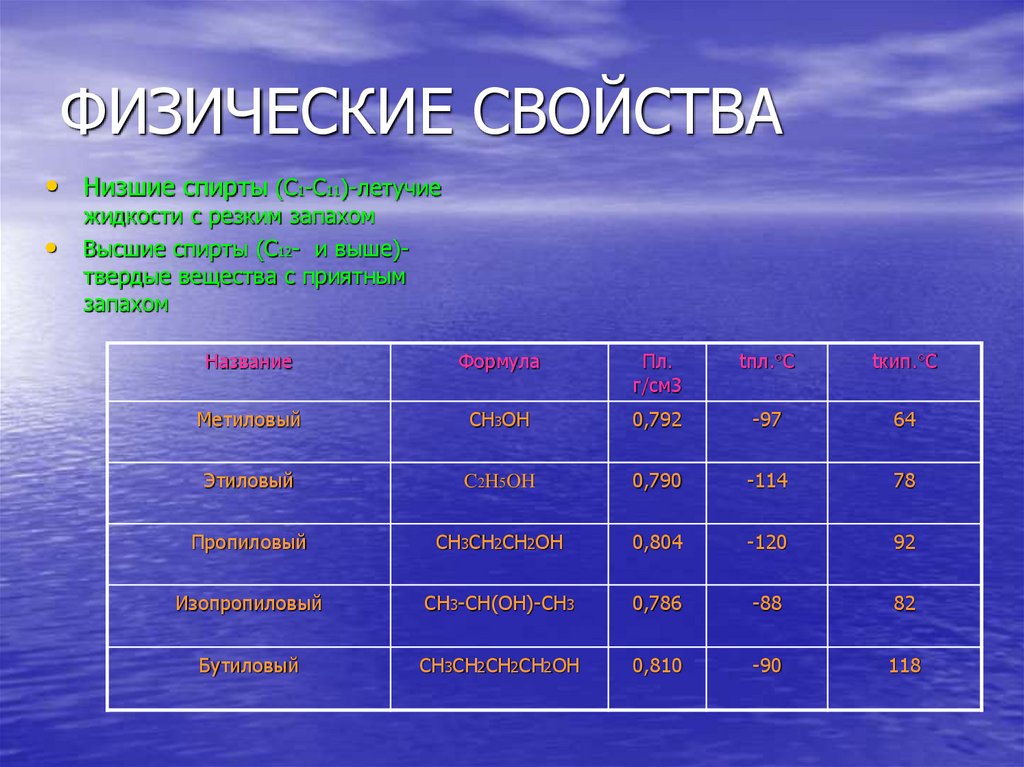
6. ФИЗИЧЕСКИЕ СВОЙСТВА
• Низшие спирты (С1-C11)-летучиежидкости с резким запахом
Высшие спирты (C12- и выше)твердые вещества с приятным
запахом
Название
Формула
Пл.
г/см3
tпл. C
tкип. C
Метиловый
CH3OH
0,792
-97
64
Этиловый
C2H5OH
0,790
-114
78
Пропиловый
CH3CH2CH2OH
0,804
-120
92
Изопропиловый
CH3-CH(OH)-CH3
0,786
-88
82
Бутиловый
CH3CH2CH2CH2OH
0,810
-90
118
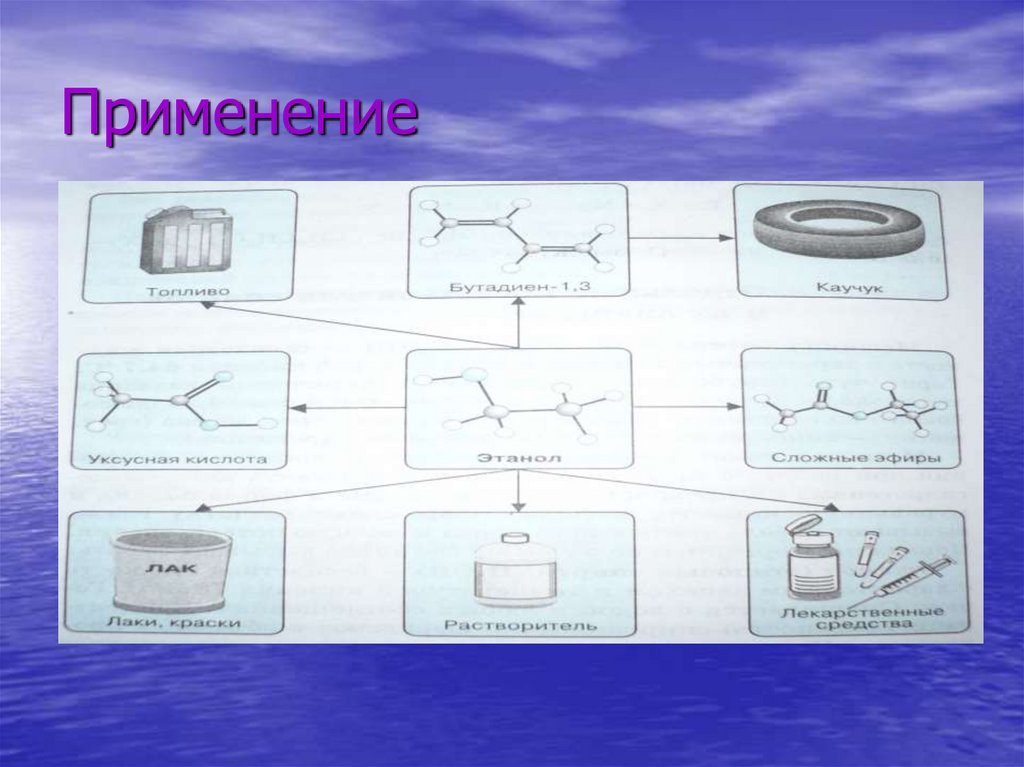
7. Химические свойства I. Реакции с разрывом связи RO–H
Спирты реагируют с щелочными и
щелочноземельными металлами, образуя
солеобразные соединения – алкоголяты.
2СH CH CH OH + 2Na 2СH CH CH ONa + H
2СH CH OH + Сa (СH CH O) Ca + H
• Взаимодействие с органическими кислотами (реакция
3
2
3
2
2
3
3
2
2
2
2
2
2
этерификации) приводит к образованию сложных
эфиров.
CH COОH + HOC H CH COОC H
(уксусноэтиловый эфир (этилацетат)) + H O
3
2
5
3
2
5
2
8.
II. Реакции с разрывом связи R–OH.С галогеноводородами:
R–OH + HBr R–Br + H2O
III. Реакции окисления
Спирты горят:
2С3H7ОH + 9O2 6СO2 + 8H2O
При действии окислителей:
–
первичные спирты превращаются в альдегиды
IV. Дегидратация
Протекает при нагревании с водоотнимающими
реагентами(конц. Н2SO4).
1. Внутримолекулярная дегидратация приводит к образованию
алкенов
CH3–CH2–OH CH2=CH2 + H2O
2. Межмолекулярная дегидратация даёт простые эфиры
R-OH + H-O–R R–O–R(простой эфир) + H2O







 Химия
Химия