Похожие презентации:
Предельные одноатомные спирты
1.
2.
Спиртами называются органическиевещества, молекулы которых
содержат одну или несколько
функциональных гидроксильных
групп, соединенных с
углеводородным радикалом.
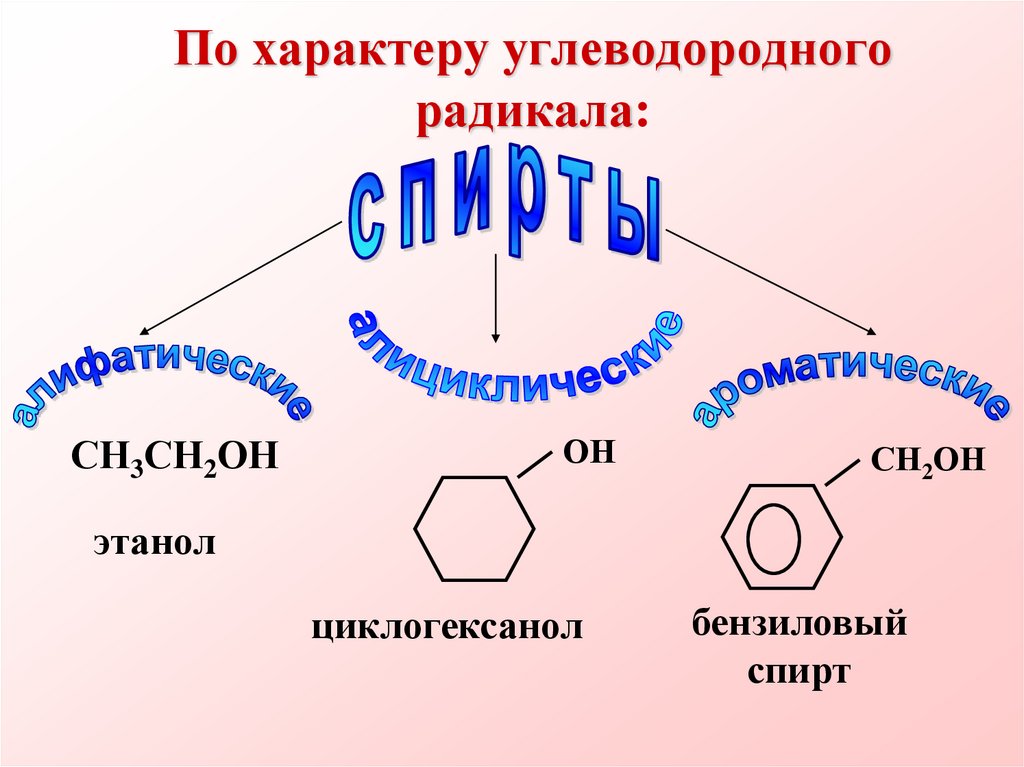
3. По характеру углеводородного радикала:
СН3СН2ОНОН
СН2ОН
этанол
циклогексанол
бензиловый
спирт
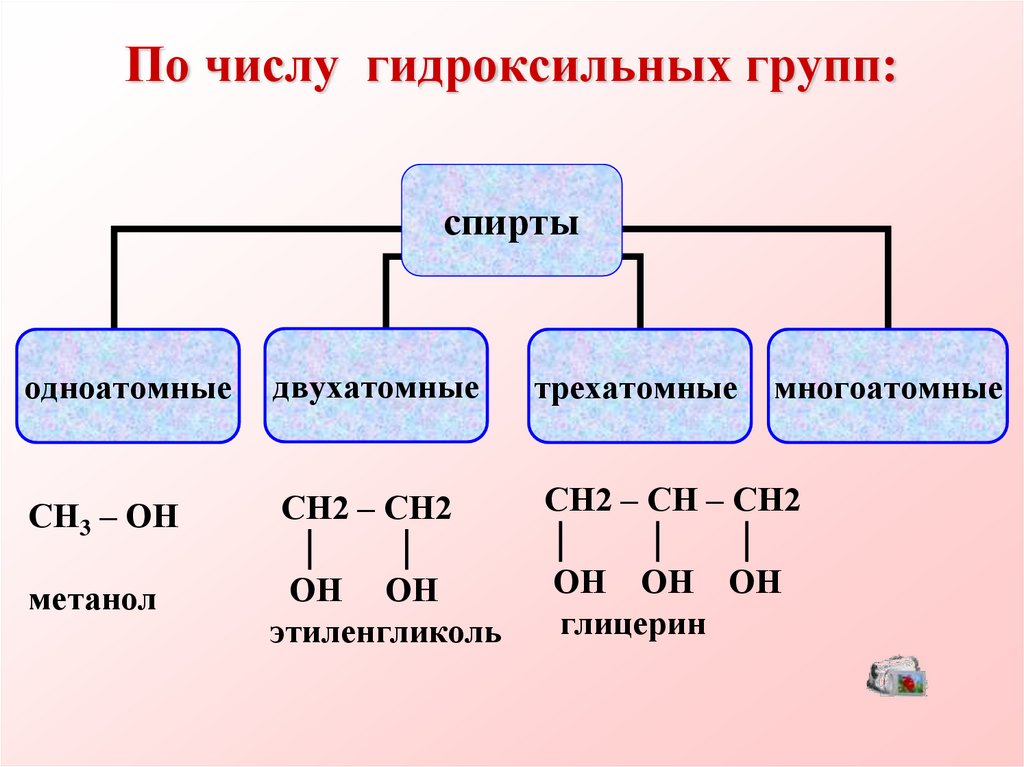
4. По числу гидроксильных групп:
спиртыодноатомные
двухатомные
трехатомные
СН3 – ОН
СН2 – СН2
СН2 – СН – СН2
метанол
ОН ОН
этиленгликоль
ОН ОН ОН
глицерин
многоатомные
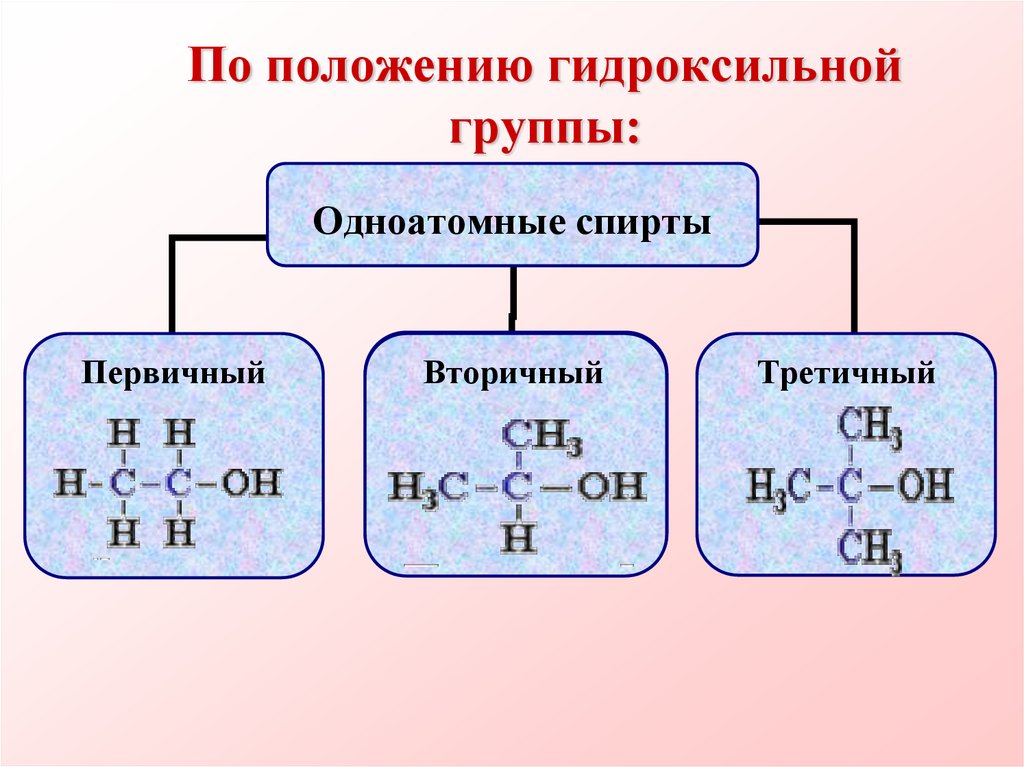
5. По положению гидроксильной группы:
Одноатомные спиртыПервичный
Вторичный
Третичный
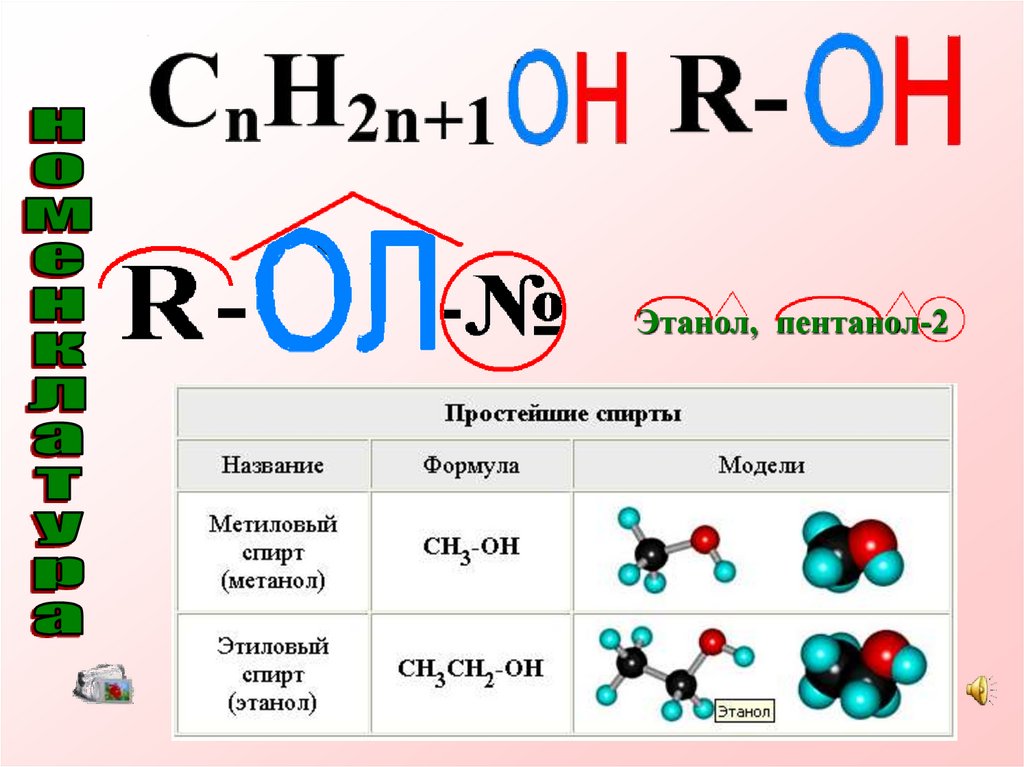
6.
7.
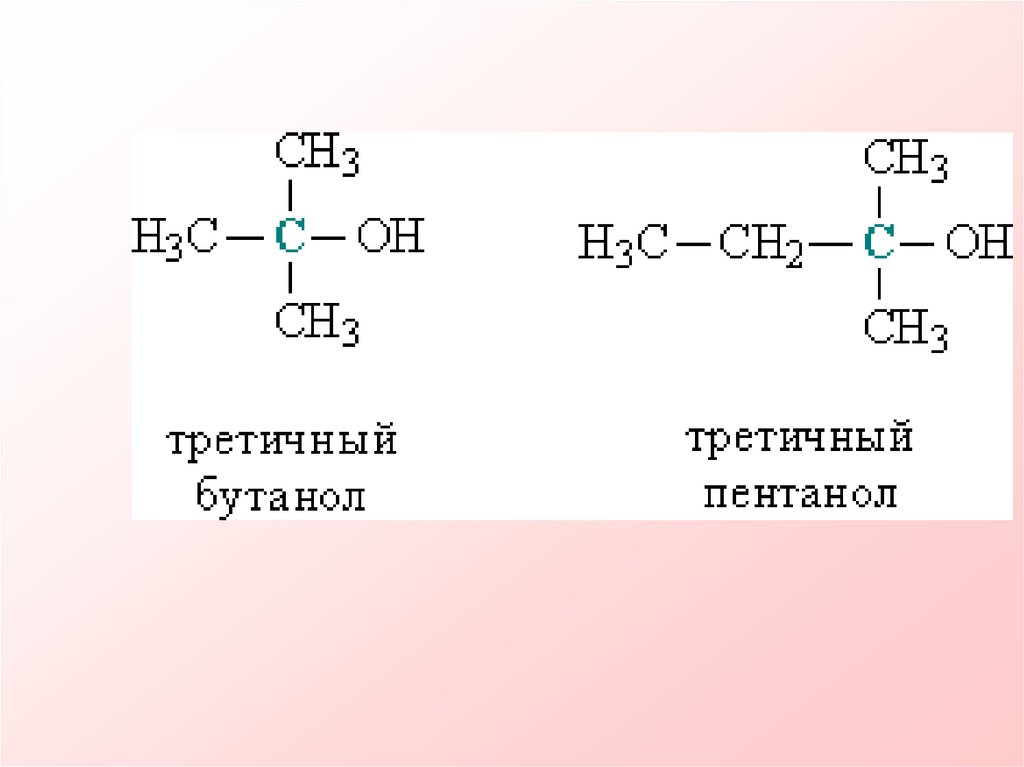
Этанол, пентанол-28.
9.
Вывод• Названия одноатомных спиртов
образуются из названия углеводорода с
самой длинной углеродной цепью,
содержащей гидроксильную группу, путём
добавления суффикса -ол.
• Для многоатомных спиртов перед
суффиксом -ол по-гречески (-ди-, -три-, ...)
указывается количество гидроксильных
групп.
• Например: CH3-CH2-OH этанол
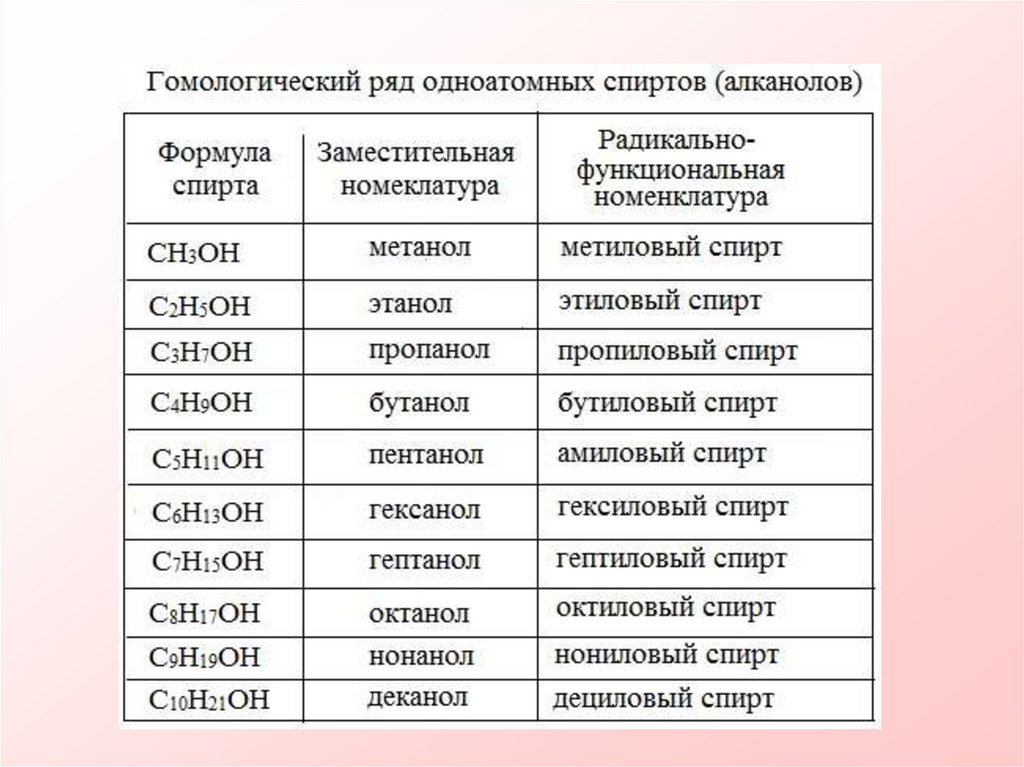
10.
11.
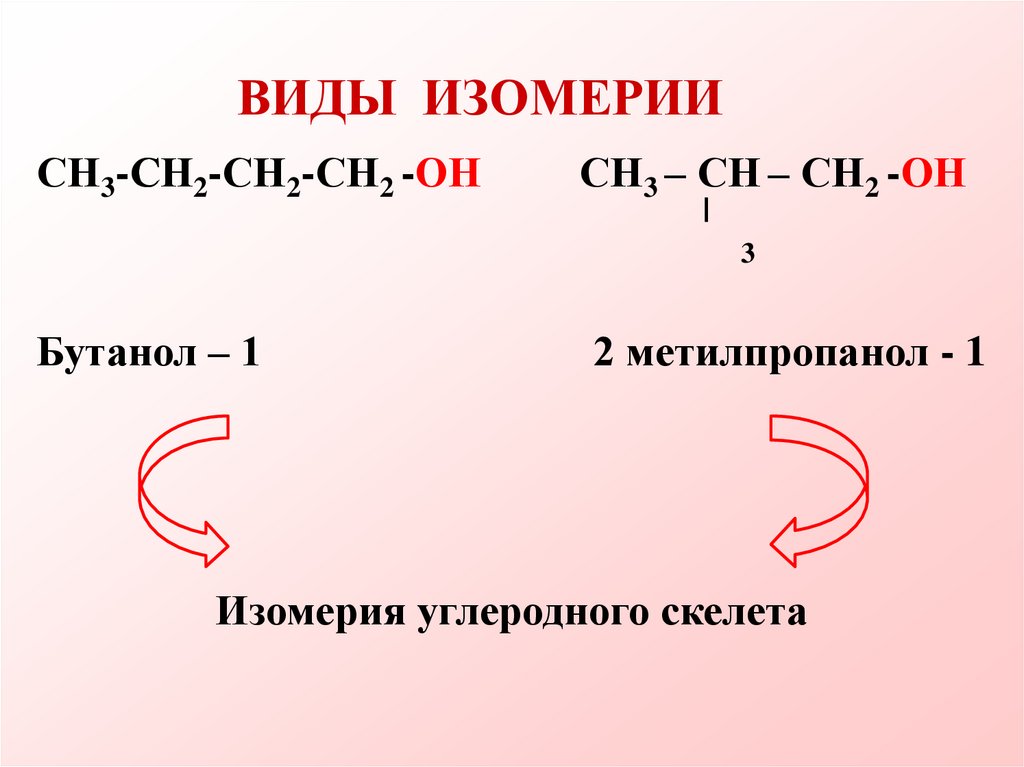
ВИДЫ ИЗОМЕРИИСН3-СН
СН2-СН2-СН2 -ОН
СН3 – СН – СН2 -ОН
3
Бутанол – 1
2 метилпропанол - 1
Изомерия углеродного скелета
12.
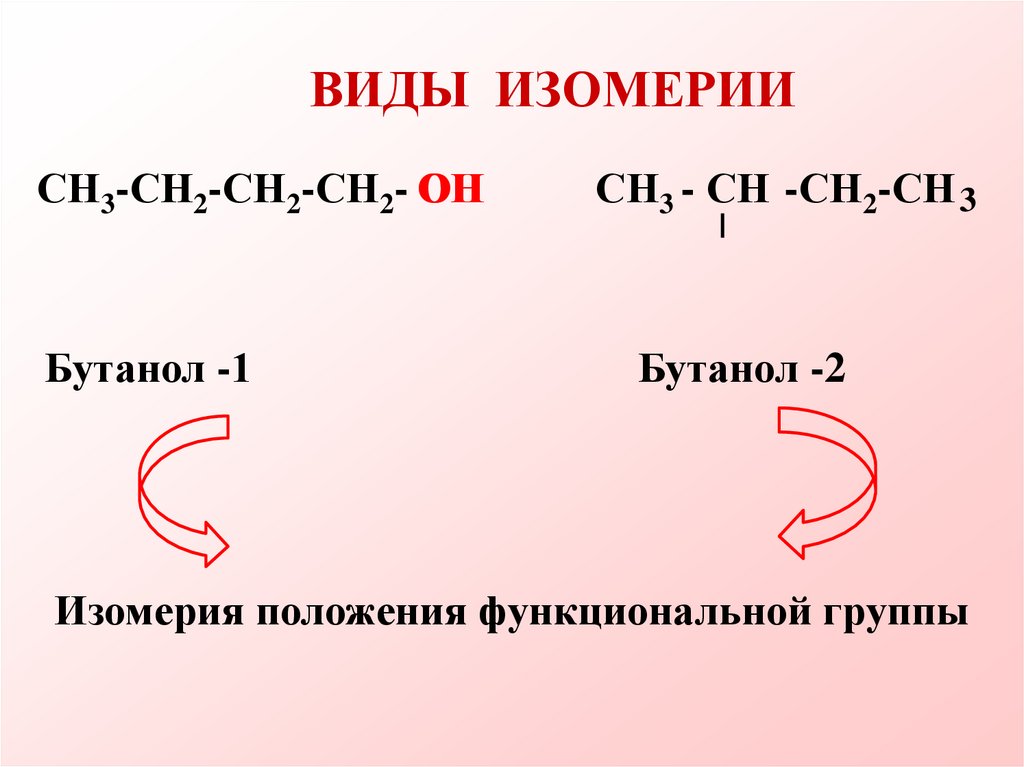
ВИДЫ ИЗОМЕРИИСН3-СН2-СН2-СН2- ОН
Бутанол -1
СН3 - СН -СН2-СН 3
Бутанол -2
Изомерия положения функциональной группы
13.
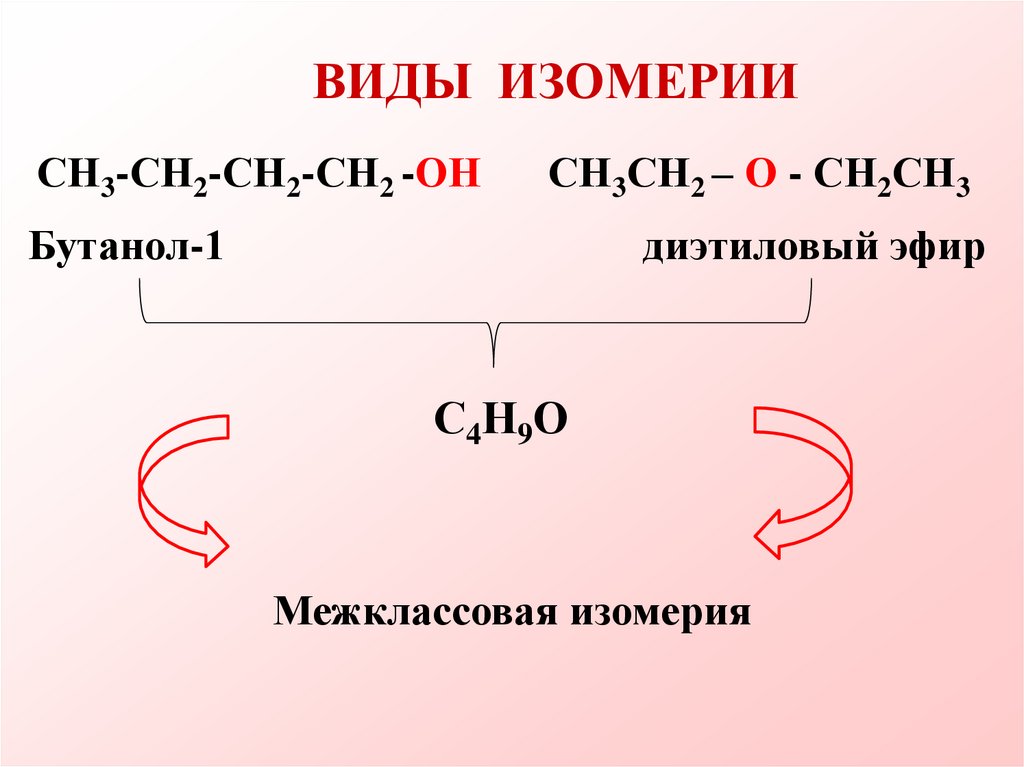
ВИДЫ ИЗОМЕРИИСН3-СН2-СН2-СН2 -ОН
СН3СН2 – О - СН2СН3
Бутанол-1
диэтиловый эфир
С4Н9О
Межклассовая изомерия
14. Физические свойства.
• Температура кипения спиртов вышетемпературы кипения соответствующих
углеводородов.
• Среди спиртов нет газов.
• С увеличением относительной молекулярной
массы спиртов повышаются их температуры
кипения, уменьшается растворимость в воде.
15.
Это объясняется наличием межмолекулярнойводородной связи, которая может
образовываться как между молекулами
спиртов, так и между молекулами спиртов и
воды.
R-O
R
Hδ+--- Oδ- H
R–O
H
Hδ+--- Oδ-
H
16.
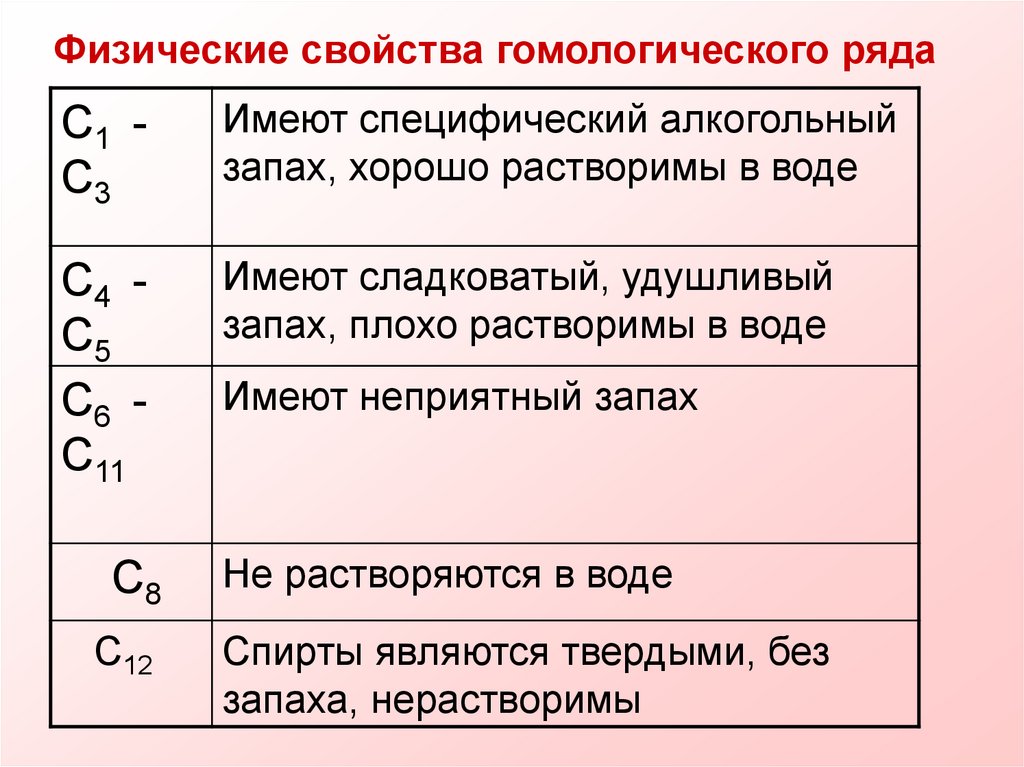
Физические свойства гомологического рядаC1 C3
Имеют специфический алкогольный
запах, хорошо растворимы в воде
C4 C5
C6 C11
Имеют сладковатый, удушливый
запах, плохо растворимы в воде
Имеют неприятный запах
C8
Не растворяются в воде
C12
Спирты являются твердыми, без
запаха, нерастворимы
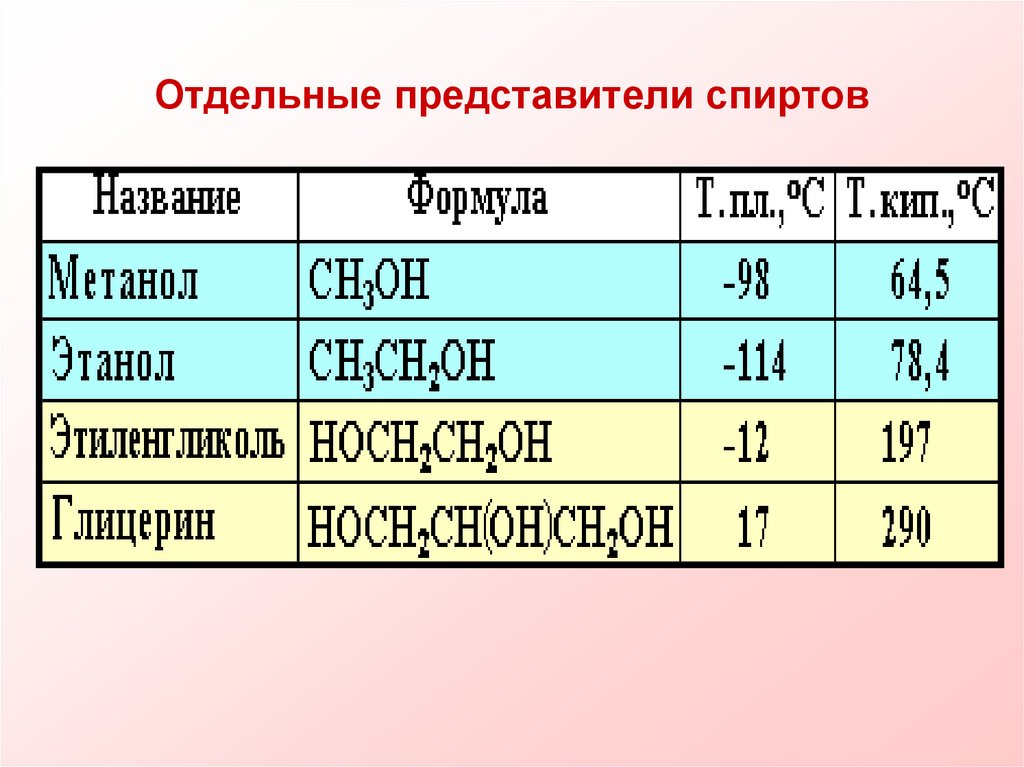
17. Отдельные представители спиртов
18.
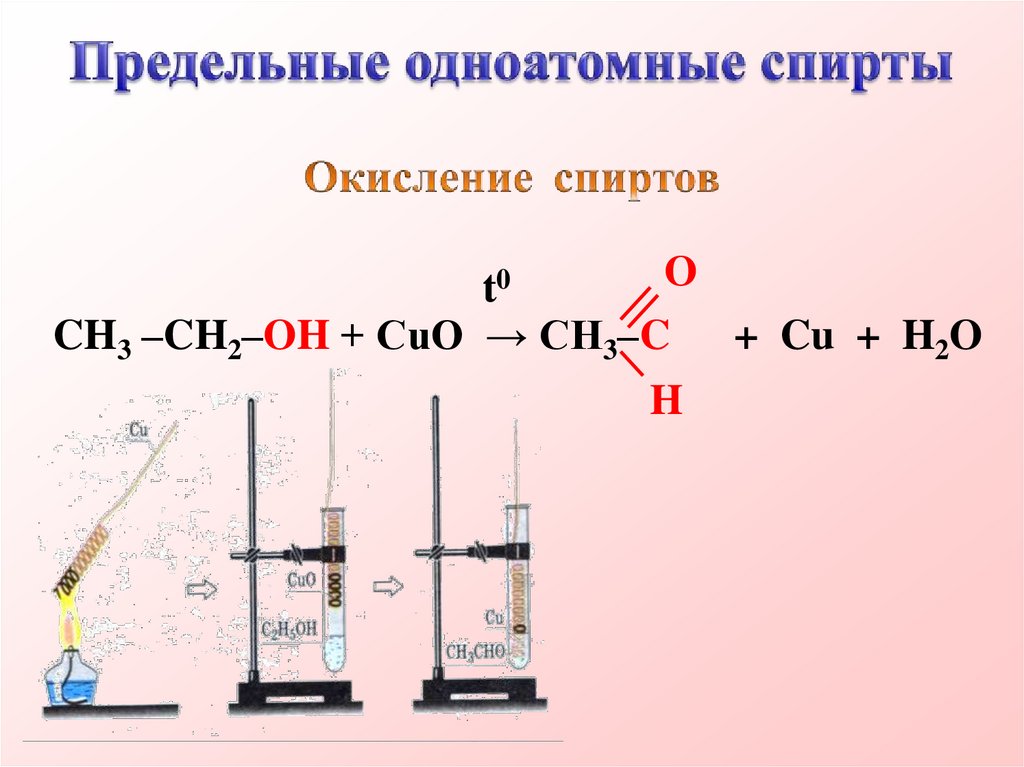
Ot0
CH3 –CH2–OH + CuO → CH3–C + Cu + H2O
H
19.
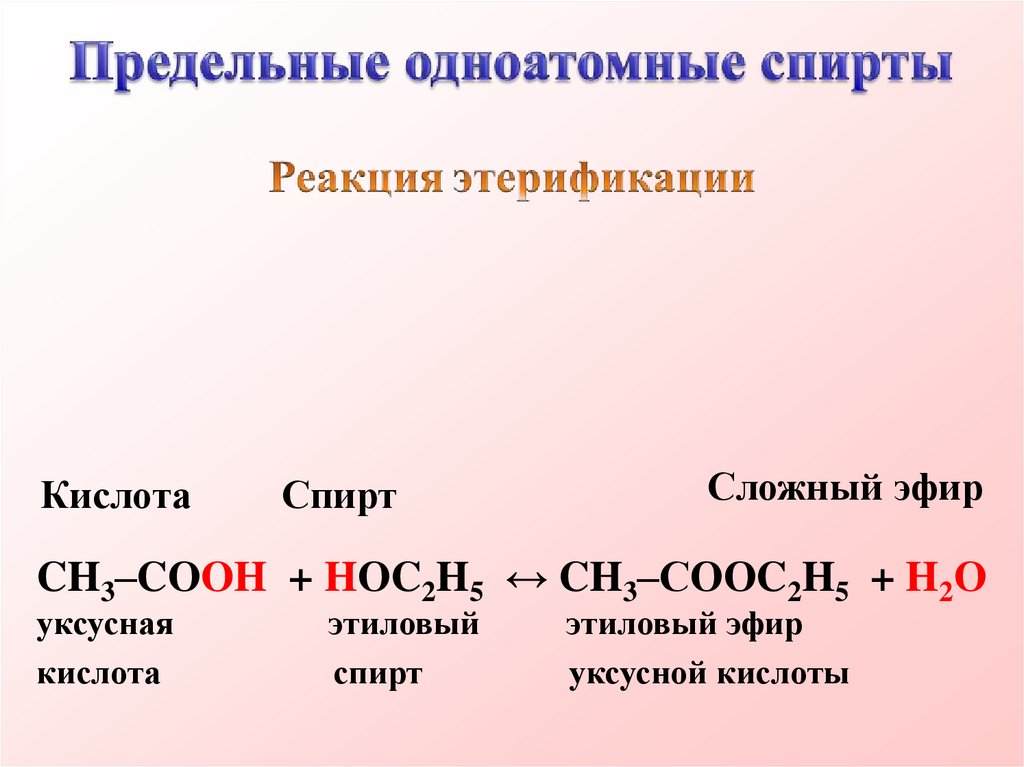
КислотаСпирт
Сложный эфир
CH3–CОOH + HОC2H5 ↔ CH3–СООC2H5 + H2О
уксусная
кислота
этиловый
спирт
этиловый эфир
уксусной кислоты
20.
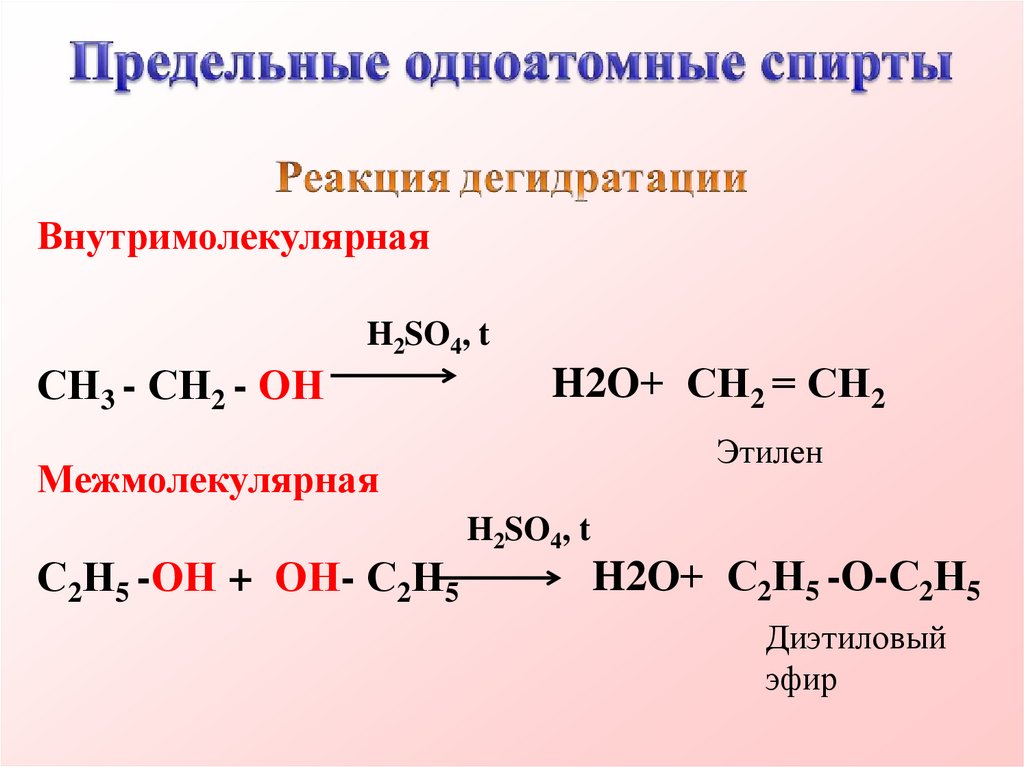
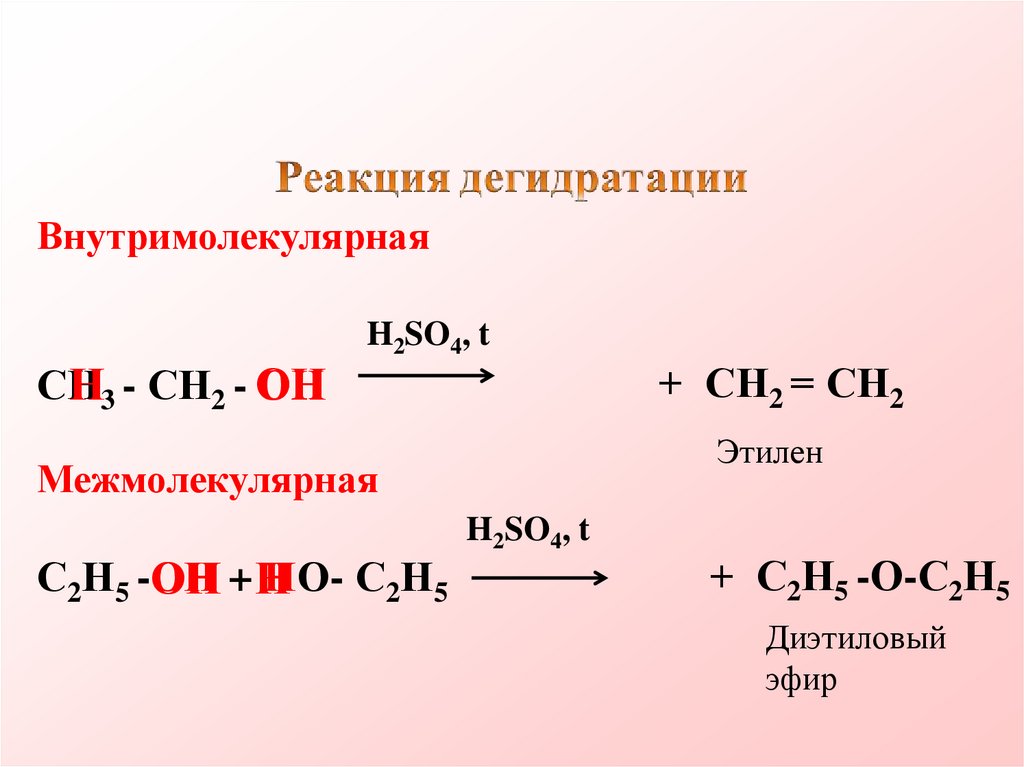
ВнутримолекулярнаяH2SO4, t
СН3 - СН2 - ОН
H2O+ СН2 = СН2
Этилен
Межмолекулярная
С2Н5 -ОН + ОН- С2Н5
H2SO4, t
H2O+ С2Н5 -О-С2Н5
Диэтиловый
эфир
21.
2CH3 –CH2–OH + 2Na → 2CH3 –CH2–ONa + H2 ↑Этилат натрия
22.
Реакция этерификации(от лат. ester –эфир) – образование сложных эфиров.
O
t,H2SO4
R - OH + HO - C – R|
О
H2O + R - O - C – R|
сложный эфир
23.
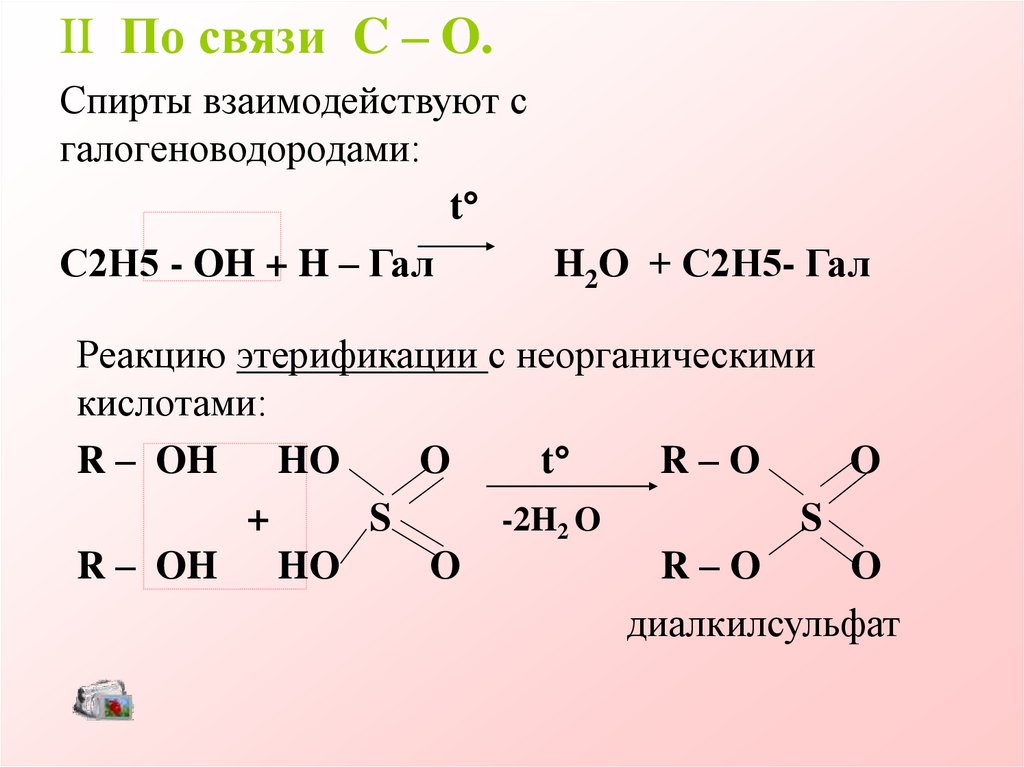
II По связи C – O.Спирты взаимодействуют с
галогеноводородами:
t
С2Н5 - OH + H – Гал
H2O + С2Н5- Гал
Реакцию этерификации с неорганическими
кислотами:
R – OH
HO
O
t
R–O
O
+
S
-2H2 O
S
R – OH
HO
O
R–O
O
диалкилсульфат
24.
ВнутримолекулярнаяH2SO4, t
СН
Н3 - СН2 - ОН
+ СН2 = СН2
Этилен
Межмолекулярная
С2Н5 -ОН
НО- С2Н5
ОН + Н
H2SO4, t
+ С2Н5 -О-С2Н5
Диэтиловый
эфир
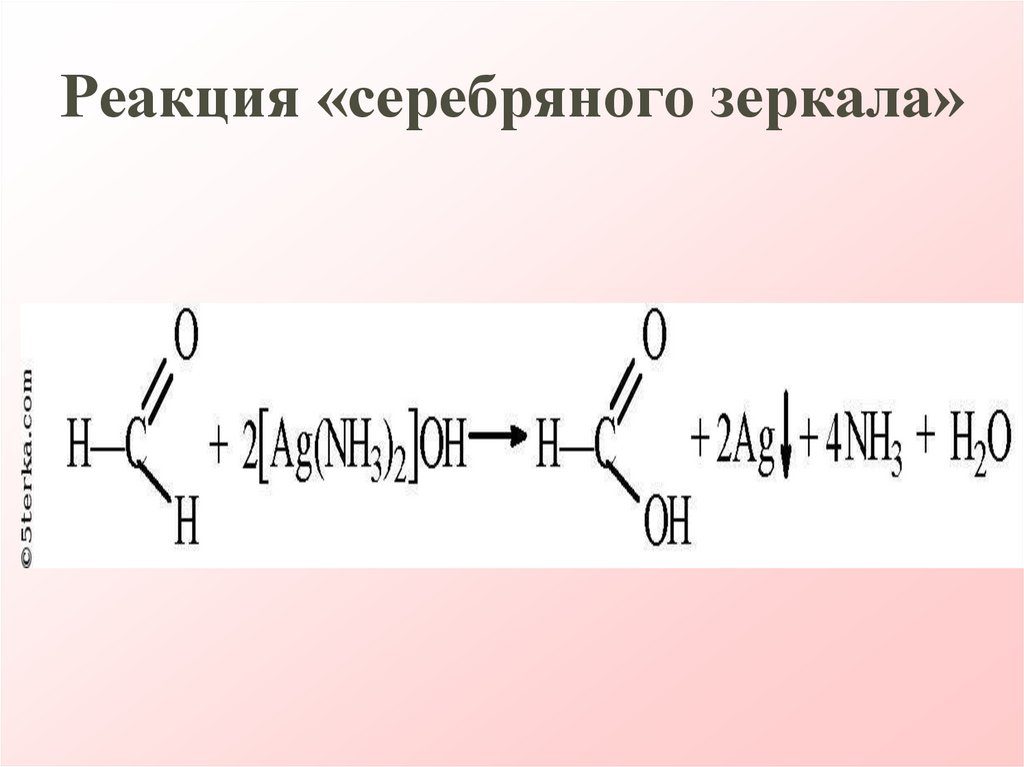
25. Реакция «серебряного зеркала»
26. Вредное воздействие этанола
• Изменения структуры мозга, вызванныемноголетней алкогольной
интоксикацией, почти необратимы, и
даже после длительного воздержания от
употребления спиртных напитков они
сохраняются. Если же человек не может
остановиться, то органические и,
следовательно, психические отклонения
от нормы идут по нарастающей.
27. Вредное воздействие этанола
• Алкоголь крайне неблагоприятно влияетна сосуды головного мозга. В начале
опьянения они расширяются, кровоток в
них замедляется, что приводит к
застойным явлениям в головном мозге.
Затем, когда в крови помимо алкоголя
начинают накапливаться вредные
продукты его неполного распада,
наступает резкий спазм, сужение сосудов,
развиваются такие опасные осложнения,
как мозговые инсульты, приводящие к
тяжелой инвалидности и даже смерти.
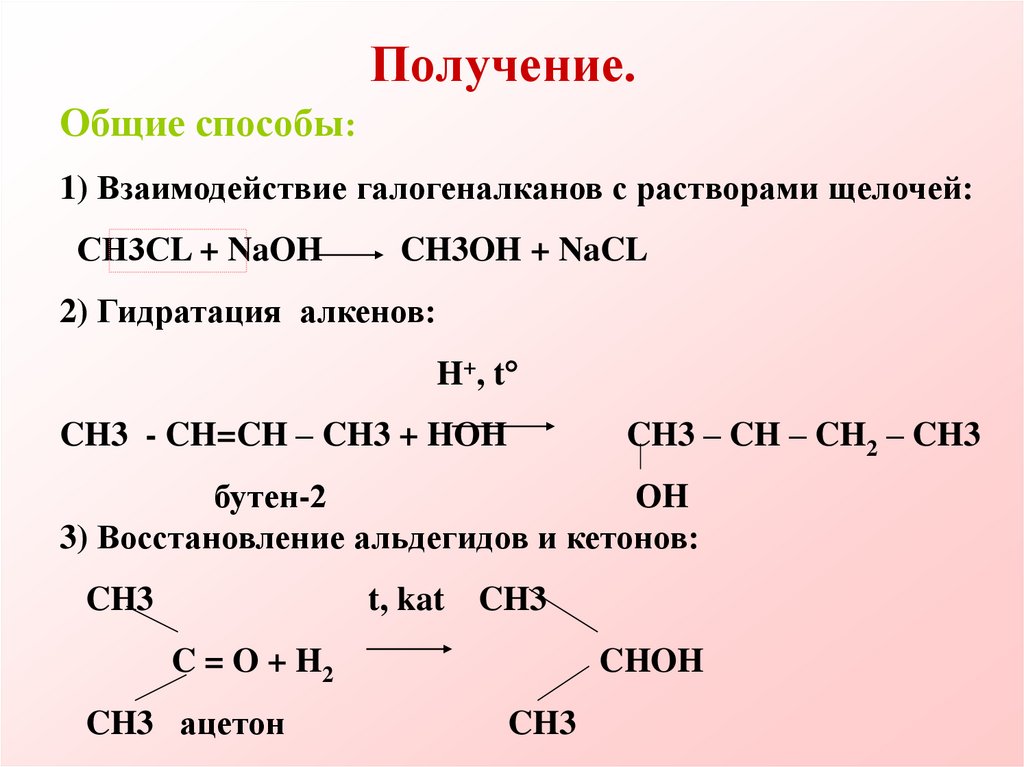
28. Получение.
Общие способы:1) Взаимодействие галогеналканов с растворами щелочей:
СН3СL + NaOH
CH3OH + NaCL
2) Гидратация алкенов:
H+, t
CH3 - CH=CH – CH3 + HOH
CH3 – CH – CH2 – CH3
бутен-2
ОH
3) Восстановление альдегидов и кетонов:
CH3
t, kat CH3
C = O + H2
CH3 ацетон
CHOH
CH3
29. Получение
Частные способы.Метанол получают из синтез – газа.
t, P, ZnO
CO + 2H2
CH3OH
Этанол получают брожением глюкозы.
дрожжи
C6H12O6
2CO2 + 2C2H5OH
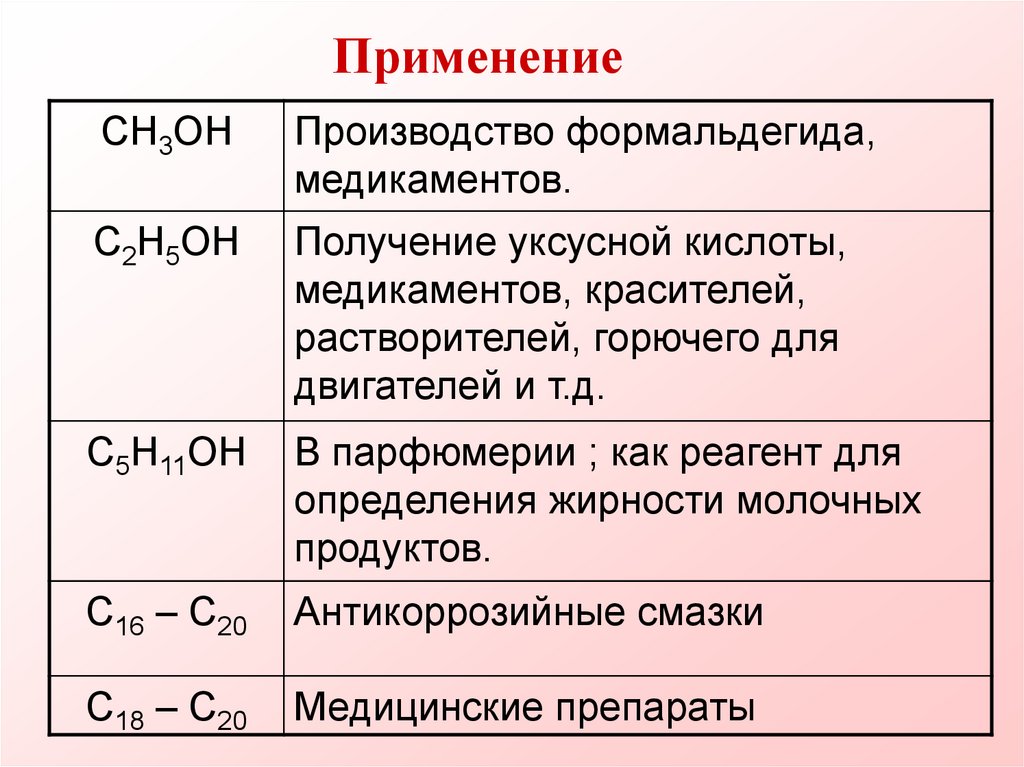
30. Применение
CH3OHПроизводство формальдегида,
медикаментов.
C2H5OH
Получение уксусной кислоты,
медикаментов, красителей,
растворителей, горючего для
двигателей и т.д.
C5H11OH
В парфюмерии ; как реагент для
определения жирности молочных
продуктов.
C16 – C20
Антикоррозийные смазки
C18 – C20
Медицинские препараты










 Химия
Химия








