Похожие презентации:
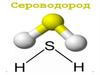
Сероводород, строение, физические и химические свойства
1.
9.12.Сероводород, строение,физические и химические
свойства
2.
Сделать план- конспект П. 143.
15.12. Оксиды серы.Серная кислота,
физические и химические
свойства, применение
4.
Выполнить задания на слайдах5.
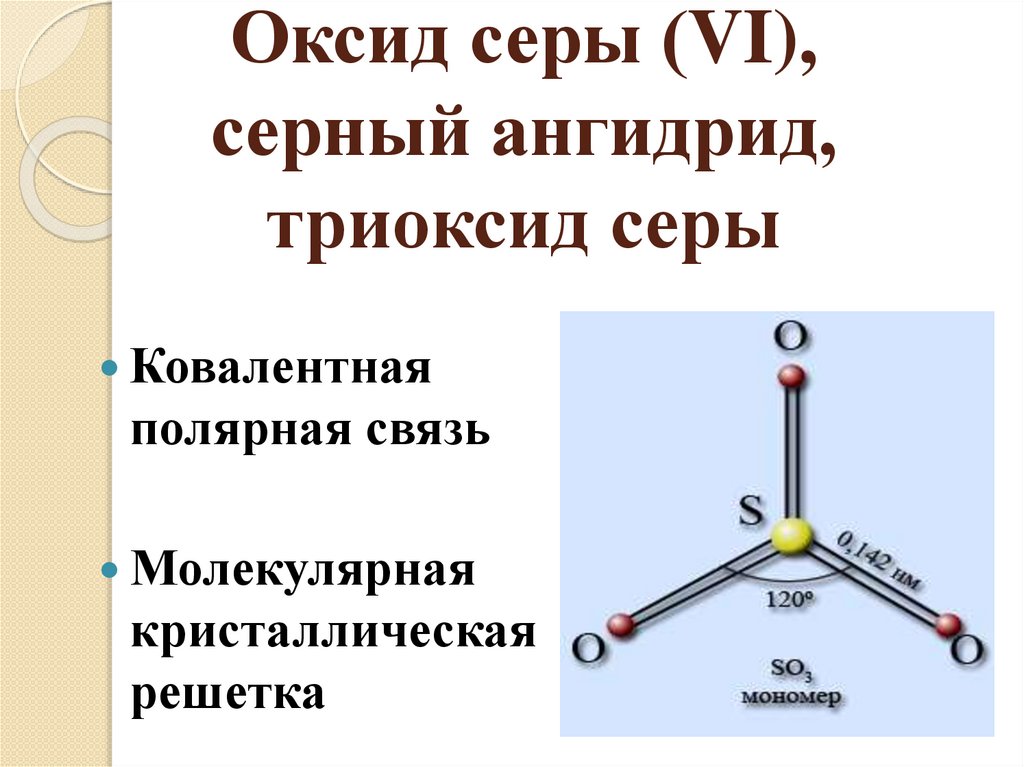
Оксид серы (VI),серный ангидрид,
триоксид серы
Ковалентная
полярная связь
Молекулярная
кристаллическая
решетка
6.
Физические свойствасерного ангидрида
Бесцветная, летучая, маслянистая
жидкость,
t° пл. = 17°C;
t° кип. = 45°С;
на воздухе «дымит», сильно поглощает
влагу (хранят в запаянных сосудах
7.
Химические свойстваI. -
SO3 кислотный оксид
1)…
2)…
3)…
8.
Получение оксида серы (VI)1. Окисление оксида серы (IV)
…
9.
H SO2
4
серная кислота
Дать классификацию
серной кислоте.
10.
H2SO4классификация
По основности:
По наличию кислорода:
По силе:
11.
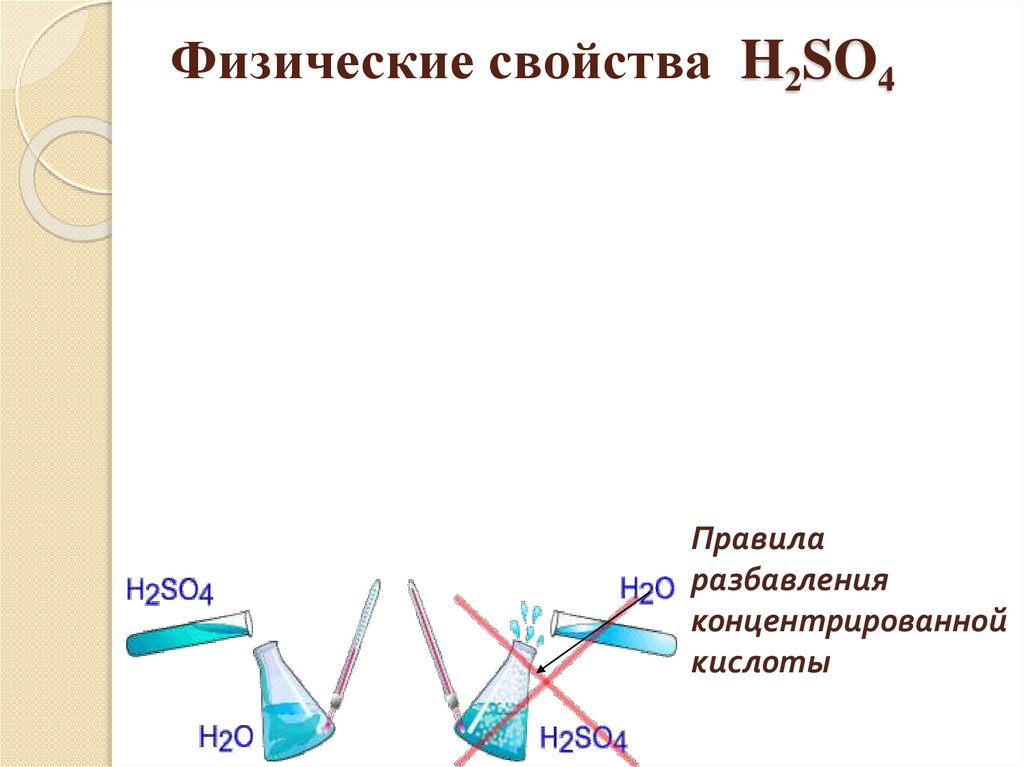
Физические свойства H2SO4Правила
разбавления
концентрированной
кислоты
12.
Химические свойства H2SO41. С металлами (в ряду активности металлов до Н):
H2SO4+Zn = … + …
2. С оксидами металлов:
H2SO4+K2O=… + …
3. С гидроксидами металлов:
H2SO4+NaOH=… + …
4. С солями:
H2SO4+MgCO3=… +… + …
13.
Качественная реакцияна ион SO42 Реактивом на серную кислоту и ее
соли является катион бария , т.к. с
ионами бария сульфат ион
образует белый нерастворимый
сульфат бария, выпадающий в
осадок.
Ва2++SO42- = BaSO4↓
14.
Концентрированная серная кислотаСерная кислота(конц) восстанавливается до
(Н2S,S,SO2) в зависимости от активности металла и условий
протекания реакции.
Железо и алюминий пассивируются кислотой, т.е покрываются
защитной пленкой, поэтому кислоту(конц) можно перевозить в
стальных и алюминиевых цистернах.
Сu+2H2SO4(конц)→CuSO4+2H2O+SO2
4Zn+5H2SO4(конц)→4ZnSO4+4H2O+H2S
Отнимает воду из молекул органических веществ, обугливая их.
Взаимодействие кислоты с сахарозой(C12H22O11)
C12H22O11 +2H2SO4(конц)=11C + 13H2O↑+2SO2↑+ CO2↑
15.
Автоцистерна для перевозкисерной кислоты












 Химия
Химия