Похожие презентации:
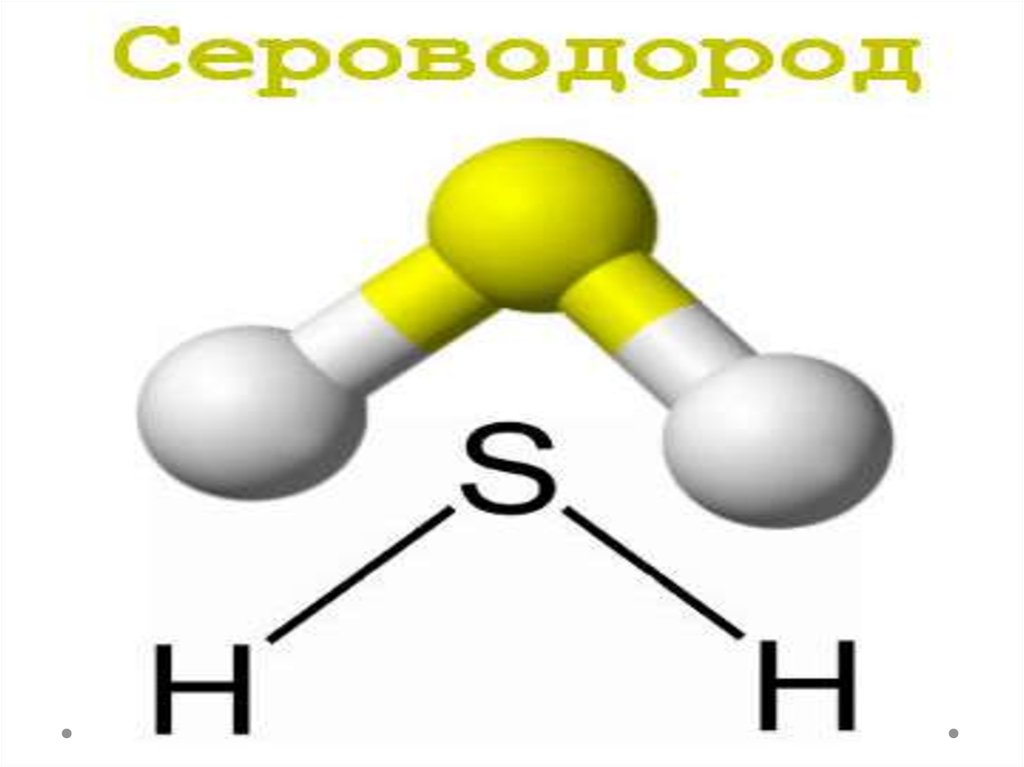
Сероводород. Физические и химические свойства
1.
2. Нахождение в природе
• В вулканических газах,• В месторождениях нефти и газа,
• В водах минеральных
источников, например,
в Нижне-Ивкино
• Растворен в глубоких слоях
(ниже 150 - 200 м) Черного моря
3. Физические свойства
• Бесцветный газ с характерным запахомгниющего белка
• В полтора раза тяжелее воздуха
• Снижается при температуре -60,3 ºС
• Затвердевает при -80,6 ºС
• Легко воспламеняется, смесь с воздухом
взрывает
4. Химические свойства
6е2Н₂S+3O₂=2H₂O+2SО₂ (при избытке
кислорода)
S (-2) S (+4) - восстановитель (отдаёт 6 электронов)
O₂ (0) O₂ (-2) - окислитель (принимает 4 электрона)
5.
Окисление до свободной серы,оседающей на чашке в виде
желтого налета:
4е
2Н₂S+O₂=2H₂O+2S (при недостатке
кислорода)
S (-2) S (0) - восстановитель (отдаёт 2
электрона)
O₂ (0) 2O (-2) - окислитель (принимает 4
электрона)
6.
При высокой температуре серавзаимодействует с водородом,
образуя газ сероводород:
2е
S+H₂=H₂S↑
S (0) S (-2) окислитель(принимает
2 электрона)
Н₂ (0) Н₂ (+) - восстановитель
(отдаёт 2 электрона)
7.
Реагирует с щелочами:H₂S + 2NaOH = Na₂S +2H₂O
(средняя соль при избытке NaOH)
H₂S + NaOH = NaHS + H₂O
(кислая соль при отношении: 1:1)
реакции ионного обмена
8.
Сероводород реагирует также сомногими другими окислителями:
3H₂S + 4HClO₃ = 3H₂SO₄
реакция ионного обмена
2H₂S + SO₂ = 2H₂O +2S
S (-2) S (0) - восстановитель (принимает 2 электрона)
S (+4) S (0) - окислитель (отдает 4 электрона)
реакция диспропорционирования
9.
Взаимодействие с солями свинцаH₂S + Pb(NO₃)₂=PbS + 2HNO₃
сульфид свинца
(чёрный осадок)
Качественная реакция на сероводородную
кислоту
10.
Получение сероводородадействием разбавленных кислот
на сернистые металлы,
например на сульфид железа:
FeS + 2HCl = FeCl₂ + H₂S↑
реакция ионного обмена
11. Применение сероводорода H₂S
• В аналитической химии сероводород исероводородная вода используются как реагенты для
осаждения тяжелых металлов, сульфиды которых
очень слаборастворимы.
• В медицине: в составе природных и искусственных
сероводородных ванн, а также некоторых
минеральных вод.
• Применяют для получения серной кислоты,
элементной серы, сульфидов.
• В последние годы рассматривается возможность
использования в качестве энергетического и
химического сырья.










 Химия
Химия