Похожие презентации:
Серная кислота
1.
2.
ТЕМА: «СЕРНАЯ КИСЛОТАH2SO4»ЦЕЛЬ УРОКА:
рассмотреть свойства и
применение серной кислоты.
3.
Проверка домашнегозадания.
4.
ТЕСТ1. В ряду
свойства:
химических
элементов
O-S-Se-Te
неметаллические
А) усиливаются
Б) не изменяются
В) ослабевают
Г) изменяются периодически
2. Определите формулы высшего оксида
химических элементов подгруппы кислорода:
А) RO3, H2R
Б) RO2, H2RO3
В) RO3, H2RO4
Г) RO3, H6RO6
и
гидроксида
для
5.
3. Найдите формулу, соответствующую электронной конфигурациивнешнего электронного слоя атома серы:
А) …3s23p4
Б) …4s24p4
В) …6s26p4
Г) …4s24p5
4. Выберите правильные суждения:
А) сера- твердое кристаллическое вещество жёлтого цвета, кристаллическая решётка состоит из кольцевых молекул S 8
Б) сера хорошо растворяется в воде
В) сера – хороший проводник тепла и
электричества
Г) сера встречается в природе как в свободном
состоянии, так и в связанном (сульфиды,
сульфаты)
6.
5. Взаимодействие серы с каким металлом происходит уже прикомнатной температуре? Это обстоятельство используется в
лаборатории для удаления разлитого металла:
А) железа
Б) ртути
В) цинка
Г) меди
6. Определите вещество, с которым оксид серы (VI) не будет
взаимодействовать:
А) гидроксид кальция
Б) оксид бария
В) вода
Г) оксид углерода (IV)
7. Как называются соединения серы с металлами:
А) сульфаты
Б) сульфиды
В) сульфиты
Г) серные ангидриды
7.
Химические свойствасерной кислоты.
8.
1. ВЗАИМОДЕЙСТВИЕ С ОКСИДАМИМЕТАЛЛОВ:
H2SO4+СuO → CuSO4+H2O
2H++SO42- +CuO→ Cu2+ +SO42- + H2O
2H++ CuO→ Cu2++ H2O
9.
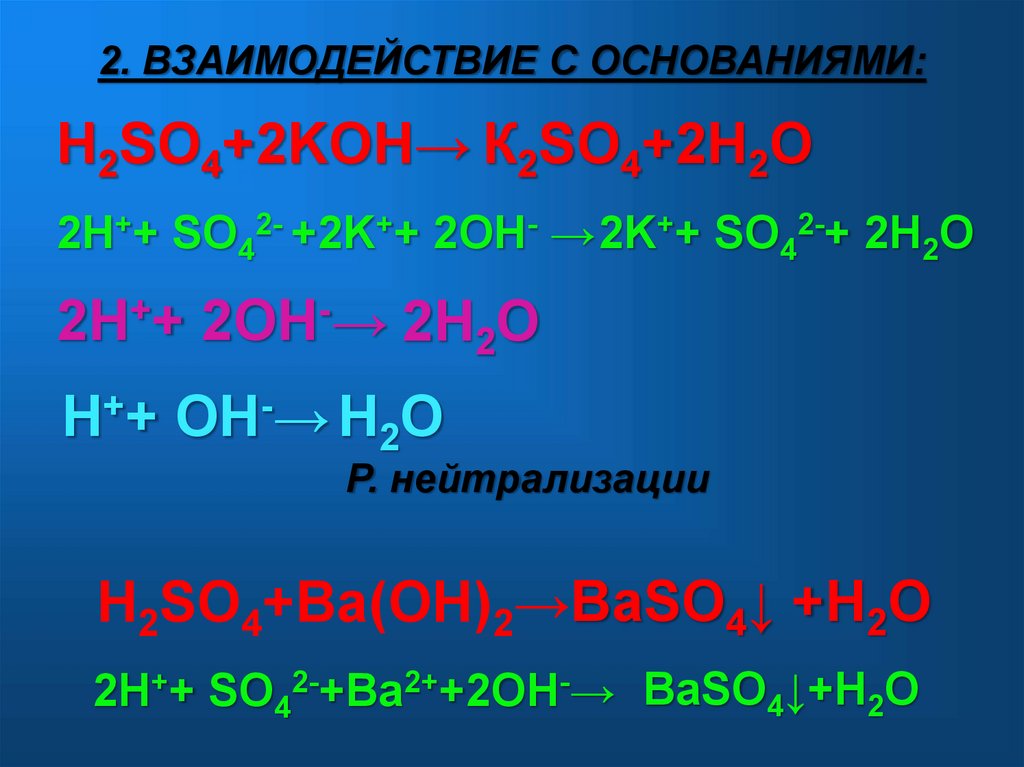
2. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ:H2SO4+2KOH→ К2SO4+2H2O
2H++ SO42- +2K++ 2OH- → 2K++ SO42-+ 2H2O
2H++ 2OH-→ 2H2O
H++ OH-→ H2O
Р. нейтрализации
H2SO4+Ba(OH)2→BaSO4↓ +H2O
2H++ SO42-+Ba2++2OH-→ BaSO4↓+H2O
10.
11.
3. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ:H2SO4 (разб.)+Zn→ ZnSO4 +H2↑
2H++1e∙2→ H20 восстановление, окислитель
окисление, восстановитель
Zn0-2e→ Zn2+
H2SO4 (разб.)+Cu→ не идет
2H2SO4 (конц.)+Zn→ ZnSO4+ SO2↑+2H2O
Zn0-2e→ Zn2+ окисление,
восстановитель
S+6+ 2e→ S4+ восстановление, окислитель
2H2SO4 (конц.)+Сu→ CuSO4+ SO2↑ +2H2O
Сu-2e→ Cu2+ окисление,
восстановитель
S+6+ 2e→ S4+ восстановление, окислитель
12.
13.
4. Взаимодействие конц. серной кислоты сорганическими соединениями:
Концентрированная серная
кислота -это
дегидратирующее средство.
На поглощении воды серной
кислотой основана осушка
газов.
14.
5. Взаимодействие серной кислоты ссолями:
ЗАДАНИЕ: В 3-х пронумерованных пробирках налиты
следующие кислоты HCl, HNO3, H2SO4.
Распознайте вещества с помощью химических
реакций и напишите уравнения
соответствующих химических реакций.
HCl+BaCl2→не идёт
2HNO3+BaCl2↔Ba(NO3)2+2HCl
H2SO4+BaCl2→BaSO4↓+2HCl
HCl+Ag(NO3)→AgCl↓+HNO3
HNO3+ Ag(NO3)→ не идёт
15.
Обобщение и выводы.Серная кислота обладает
всеми свойствами кислот:
вступает в реакции с
металлами, оксидами
металлов, основаниями,
солями. Качественной реакцией
на определение сульфат-иона
является ион Ba2+.
16.
ДОМАШНЕЕ ЗАДАНИЕ:1. Группе № 4 подготовить мини-доклады о
применении солей серной кислоты.
2. Расставьте коэффициенты методом
электронного баланса в следующих
окислительно-восстановительных реакциях:
H2SO4 (конц.)+Zn→ZnSO4+S +H2O
H2SO4 (конц.)+Zn→ZnSO4+H2S↑ +H2O














 Химия
Химия








