Похожие презентации:
Серная кислота
1.
Сернаякислота
Опыт – единственный верный путь спрашивать природу
и слышать ответ в ее лаборатории.
Д.И. Менделеев.
2.
Задачи урока1.Рассмотреть состав , строение ,
классификацию.(на основе ранее полученных
знаний).Физические свойства.
2.Рассмотреть общие свойства серной
кислоты.
3.Изучить специфические свойства серной
кислоты.
3.
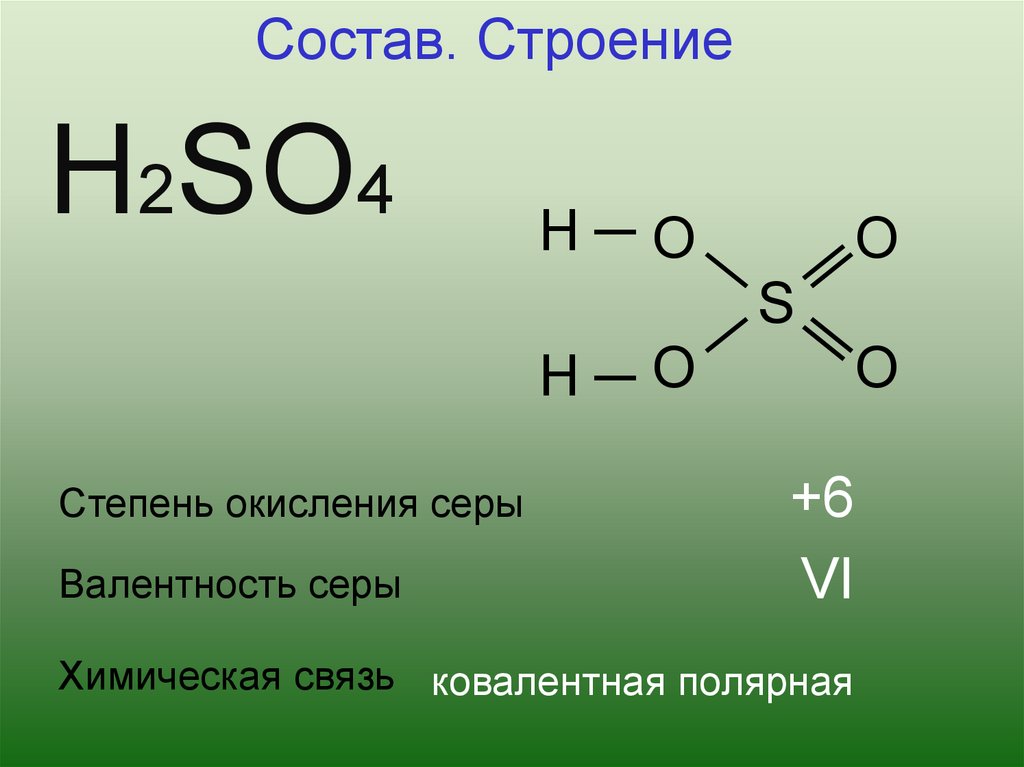
Состав. СтроениеН2SО4
Н─О
О
S
Н─О
Степень окисления серы
Валентность серы
О
+6
VI
Химическая связь ковалентная полярная
4.
Серная кислота (H2SO4).Классификация
Серная кислота по :
наличию кислорода:
основности:
растворимости в воде:
кислородсодержащая
двухосновная
растворимая
летучести:
нелетучая
степени электролитической диссоциации:
сильная
стабильности:
стабильная
5.
Физические свойства серной кислотыБесцветная
маслянистая жидкость
=1,84кг/л
Большая вязкость
Обладает сильным
гигроскопическим
свойством
t кип. = 340ºС
6.
Общие свойства растворов кислот7.
I. Химические свойства разбавленнойсерной кислоты
Взаимодействие с металлами ( до Н2 )
Zn + H2SO4 → ZnSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
8.
Взаимодействиес оксидами металлов
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
9.
Взаимодействие с основаниями2NaOH + H2SO4 → Na2SO4 +2 H2O
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Cu(OH)2 + H2SO4 → CuSO4 +2H2O
Cu(OH)2 + 2H+ → Cu2+ +2H2O
10.
Взаимодействие с солямиNa2CO3 + H2SO4 = Na2SO4 + H2CO3
2H++ CO32- = H2O + CO2
CO2↑
H2O
11.
Качественная реакцияH2SO4+Ba(NO3)2→BaSO4↓+2HNO3
Ba2++SO42- = BaSO4
Белый молочный
осадок
http://files.school-collection.edu.ru/dlrstore/d8932e1e-fc13-f1de-2ace288cbf49a4db/index.htm
12.
Правило разбавления кислотhttp://files.school-collection.edu.ru/dlrstore/6ae368db-1a38-5b5c-82c3aadd474e4be6/index.htm
Н2О
Сначала вода, потом кислота –
иначе случится большая беда!
13. Взаимодействие H2SO4 (к) с Ме
14.
Водоотнимающее свойствоH2SO4
http://files.school-collection.edu.ru/dlrstore/7c646dda-e274-b217-58cf1668d25430fb/index.htm
15.
Разрушающее действиеконцентрированной серной кислоты
(обугливание древесины)
http://files.school-collection.edu.ru/dlrstore/e5984256-0b18-c23b-985b397af5d9adbe/index.htm
16.
Взаимодействие конц.H2SO4с металлами
http://files.school-collection.edu.ru/dlrstore/9a897ea8-64e1-3877-def6aba916d777ee/index.htm
17.
Задачи урока1.Рассмотреть состав , строение ,
классификацию.(на основе ранее полученных
знаний)
2.Рассмотреть общие свойства серной
кислоты.
3.Изучить специфические свойства серной
кислоты.
Выполнено!
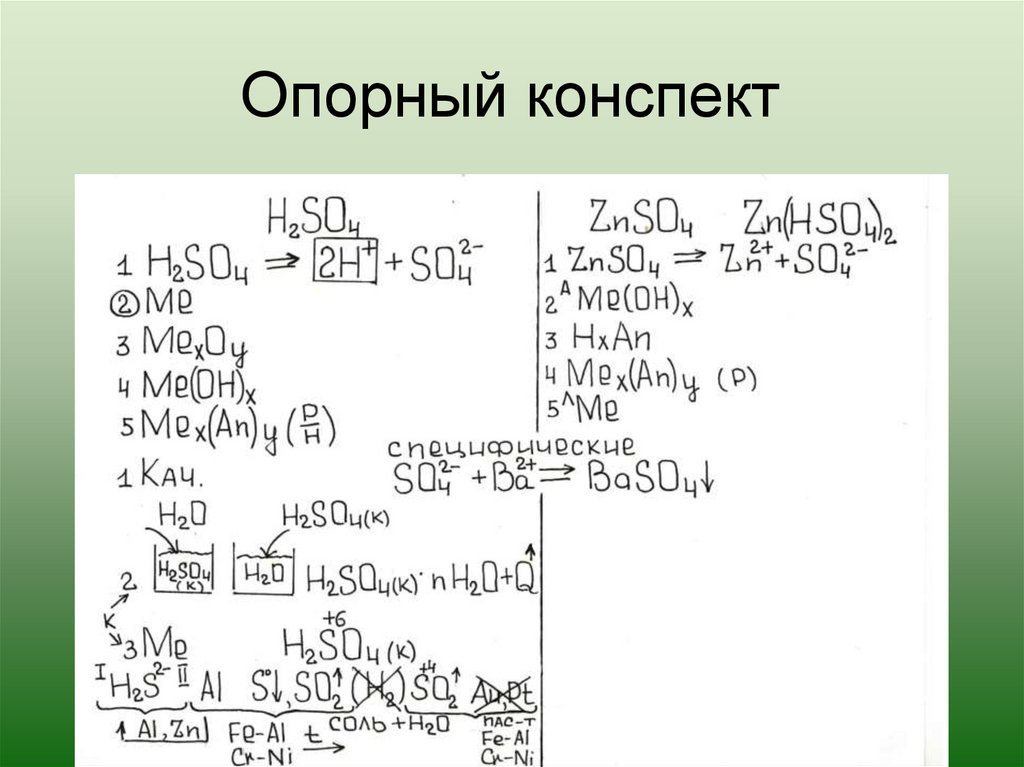
18. Опорный конспект
19.
Домашнее задание§ 23,
задание в тетради,
индивидуальное задание


















 Химия
Химия








