Похожие презентации:
Амины
1.
АминыУчитель химии
Маликова Салимат Алиевна
2.
План урока1. Понятие об аминах.
2. Номенклатура.
3. Классификация.
4. Изомерия.
5. Физические свойства.
6. Химические свойства.
7. Получение.
8. Применение.
3.
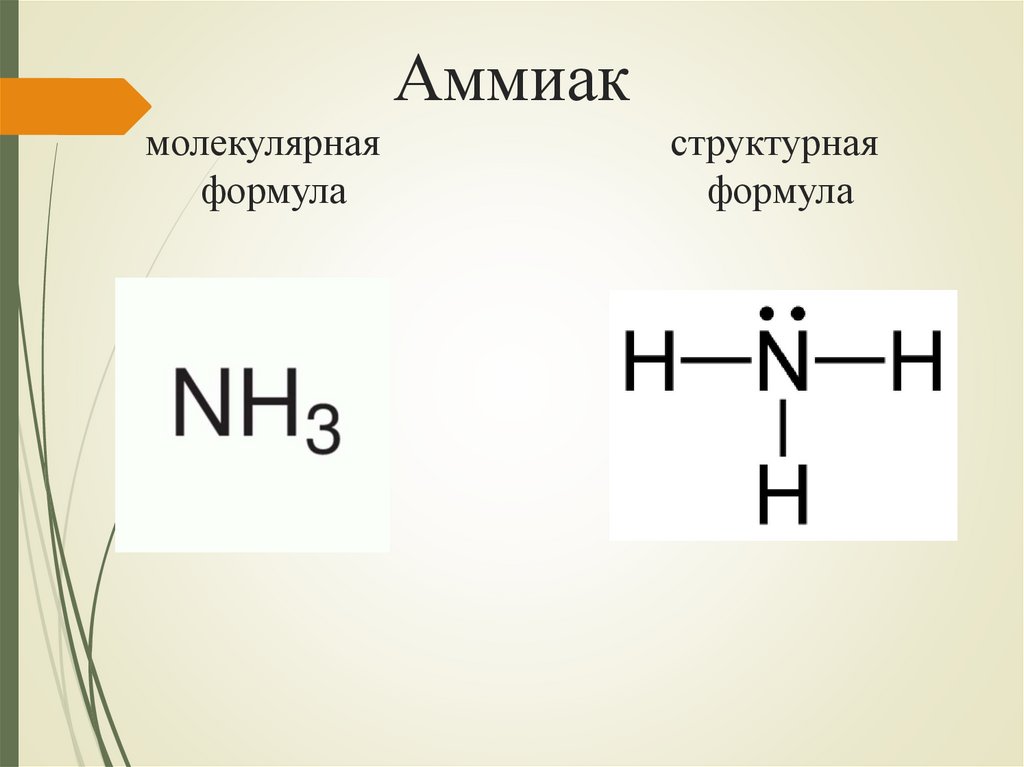
Аммиакмолекулярная
формула
структурная
формула
4.
5.
Амины – …?6.
Амины - это производные аммиака, в которых одинили несколько водородов заменены на
углеводородный радикал.
Общая формула аминов с углеводородным
радикалом алкил:
7.
Номенклатура аминов1. В большинстве случаев названия
аминов образуют из названий
углеводородных радикалов и
суффикса амин.
2. Различные радикалы перечисляются в
алфавитном порядке.
3. При наличии одинаковых радикалов
используют приставки ди и три.
8.
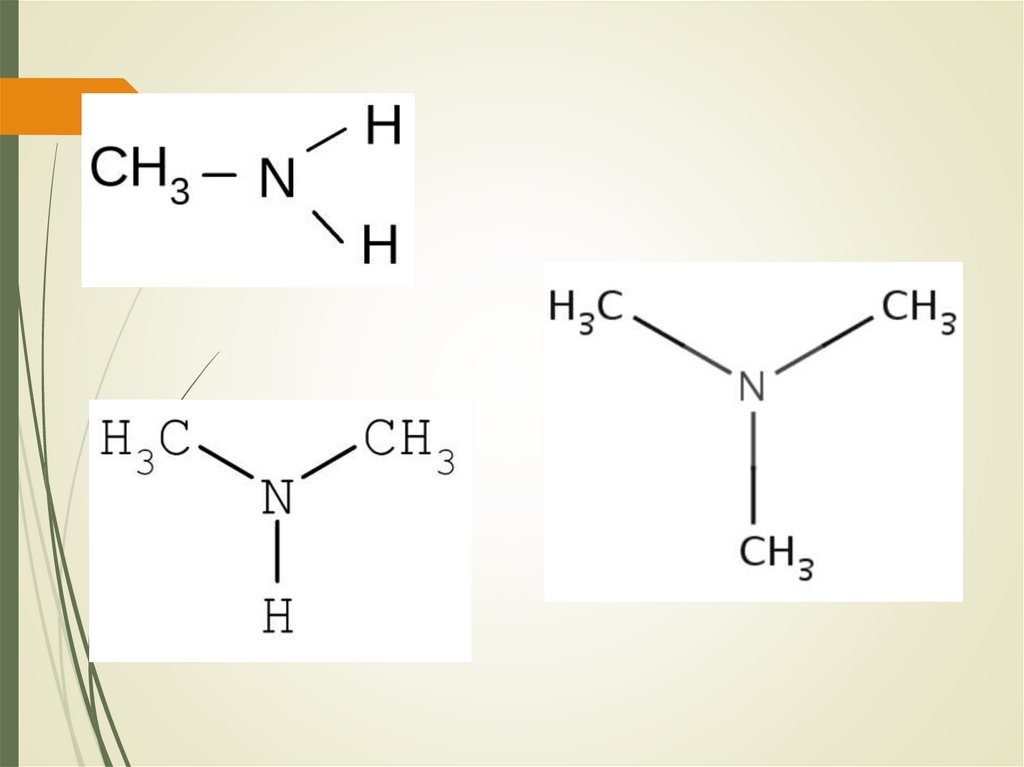
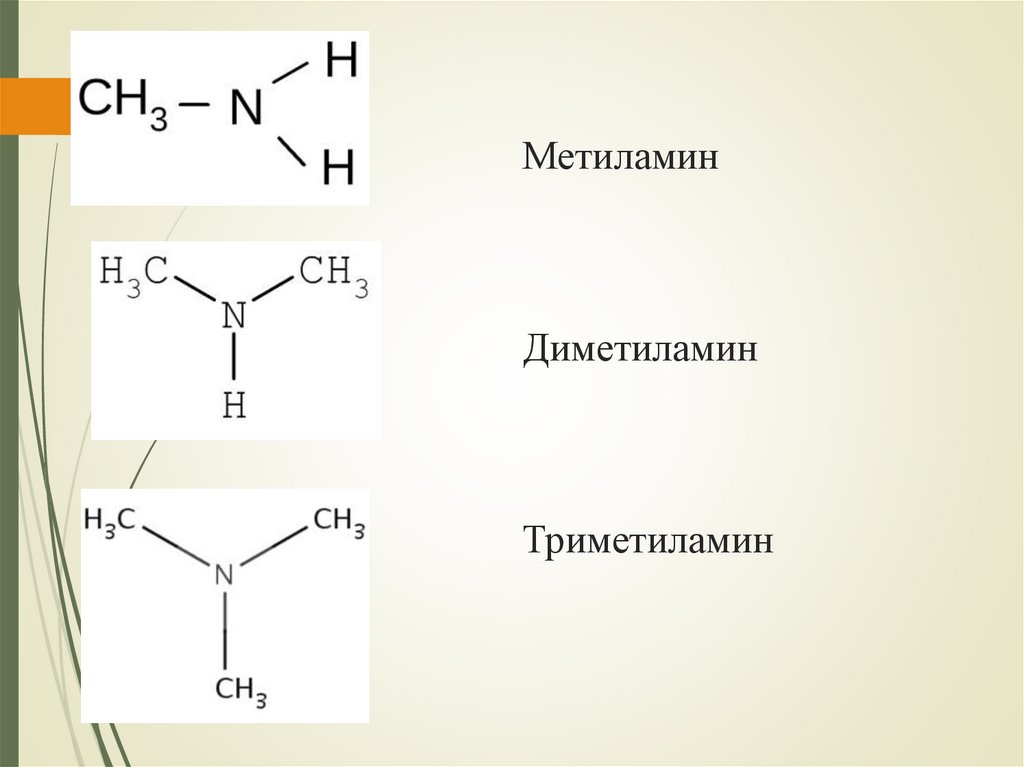
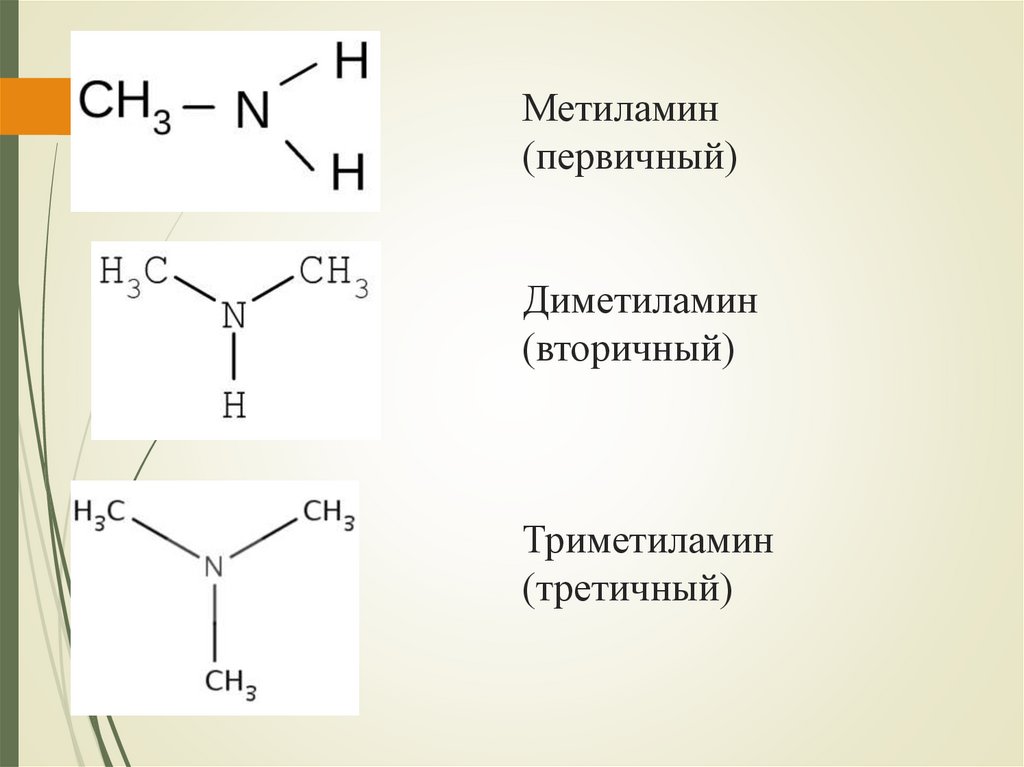
МетиламинДиметиламин
Триметиламин
9.
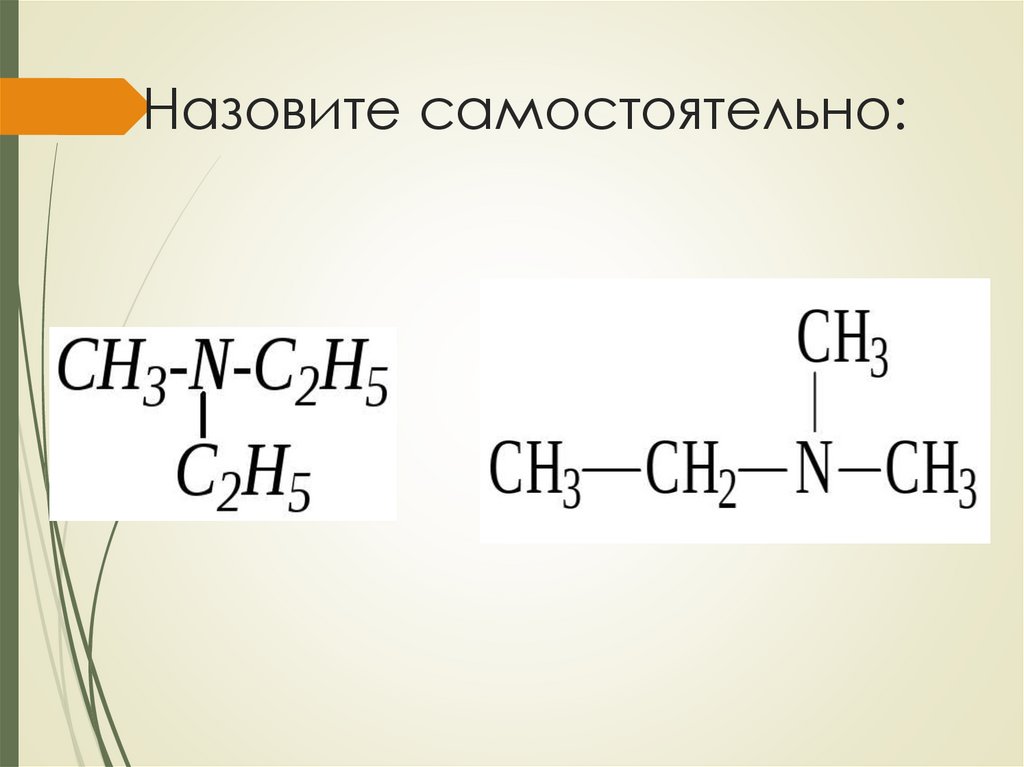
Назовите самостоятельно:10.
Классификация аминов по числузамещенных атома водорода:
1.Первичные (один углеводородный радикал);
2.Вторичные (два радикала);
3.Третичные (три радикала).
11.
Метиламин(первичный)
Диметиламин
(вторичный)
Триметиламин
(третичный)
12.
Классификация по строениюуглеводородного радикала:
1. Алифатические (не циклические, не содержат
ароматических связей).
2. Алициклические (содержат цикл в составе, без
ароматических связей).
3. Ароматические (содержат ароматическое
кольцо).
4. Смешанного типа.
13.
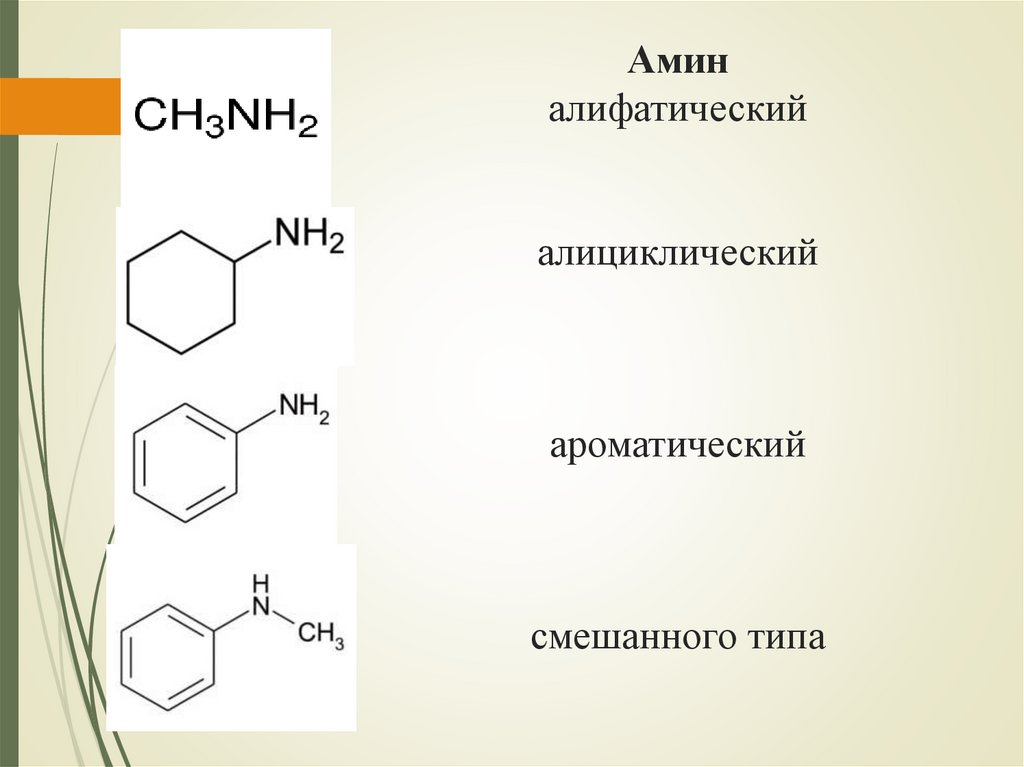
Аминалифатический
алициклический
ароматический
смешанного типа
14.
Изомерия аминов1) Изомерия углеводородного радикала;
2) Положения аминогруппы;
3) Изомерия аминогруппы, связанная с
изменением степени замещённости
атомов водорода при азоте.
15.
Задание:Составить по 2 возможные формулы
изомеров
и назвать их
(для каждого типа)
для амина с общей формулой
C4H11N
16.
Физические свойства:низшие амины (метиламин,
диметиламин, триметиламин) – газы.
Средние амины (при увеличении
атомов углерода в радикале, начиная с
трех, кроме триметиламина) –
жидкости.
высшие (более 10 атомов углерода в
радикале) – твердые вещества.
17.
Растворы аминов имеюткакую реакцию среды –
кислую, нейтральную или
щелочную, и почему?
18.
Химические свойства.19.
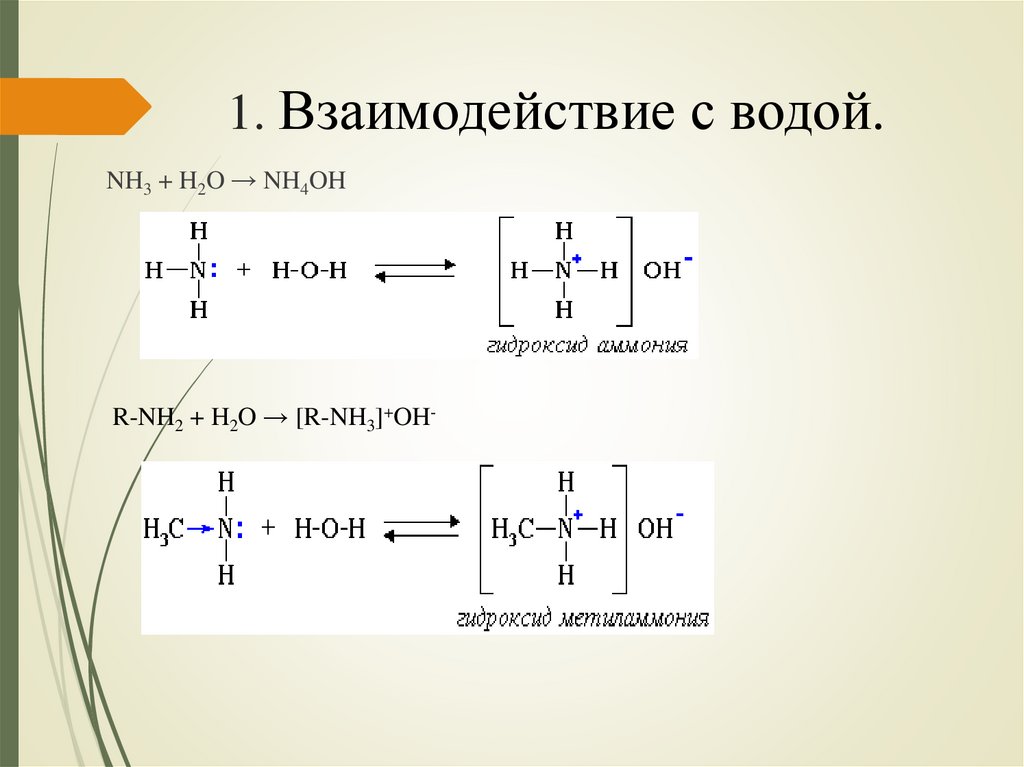
1. Взаимодействие с водой.NH3 + H2O → NH4OH
R-NH2 + H2O → [R-NH3]+OH-
20.
Алифатические аминысильнее или слабее
проявляют основные
свойства по сравнению с
аммиаком? Что скажете о
силе ароматического амина
как основания?
21.
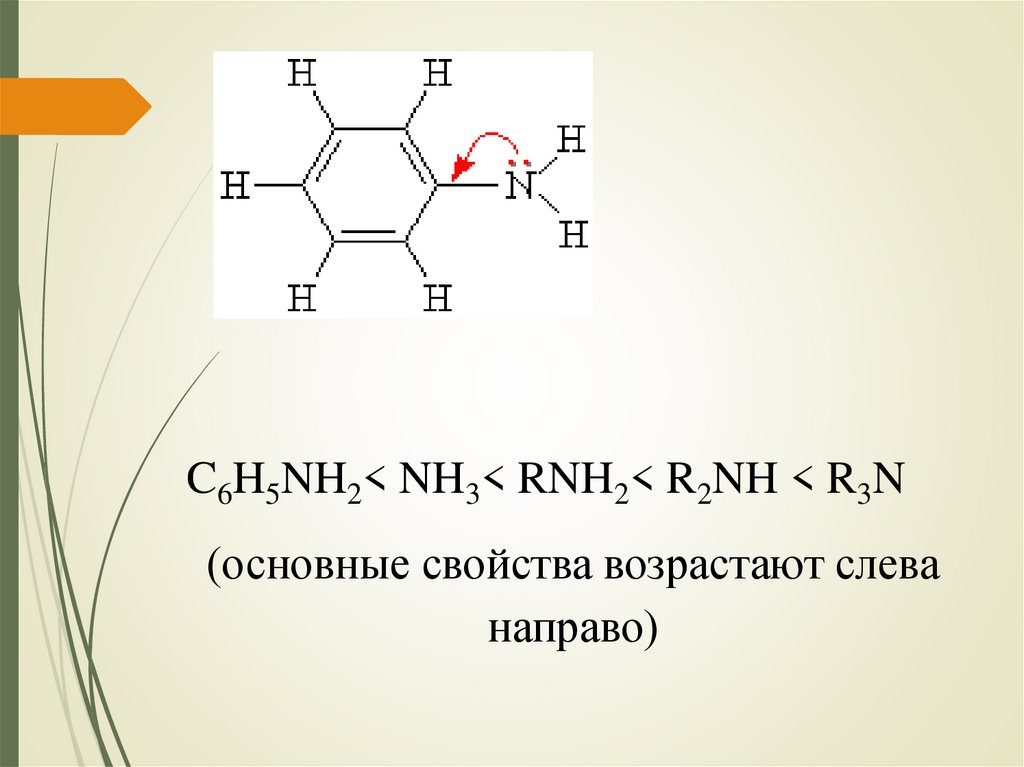
C6H5NH2< NH3< RNH2< R2NH < R3N(основные свойства возрастают слева
направо)
22.
2. Взаимодействие скислотами(донорно-акцепторный
механизм):
CH3-NH2 + H2SO4→ [CH3-NH3]HSO4 (соль гидросульфатметиламмония)
2CH3-NH2 + H2SO4→ [CH3-NH3]2SO4 (соль - сульфат
метиламмония)
Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH → 2CH3-NH2↑ + Na2SO4 + H2O
23.
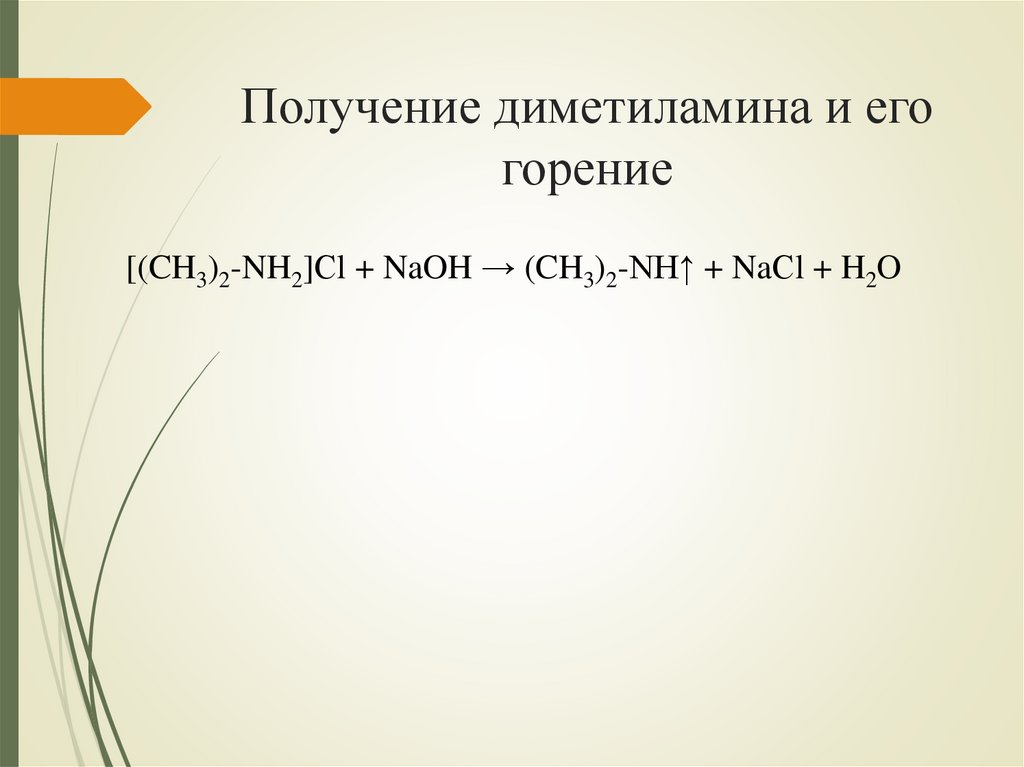
Получение диметиламина и егогорение
[(CH3)2-NH2]Сl + NaOH → (CH3)2-NH↑ + NaСl + H2O
24.
3. Реакция горения (полногоокисления)
4СH3NH2 + 9O2→ 4CO2 + 10H2O + 2N2
При горении аминов образуется
углекислый газ, пары воды и азот как
простое вещество.
25.
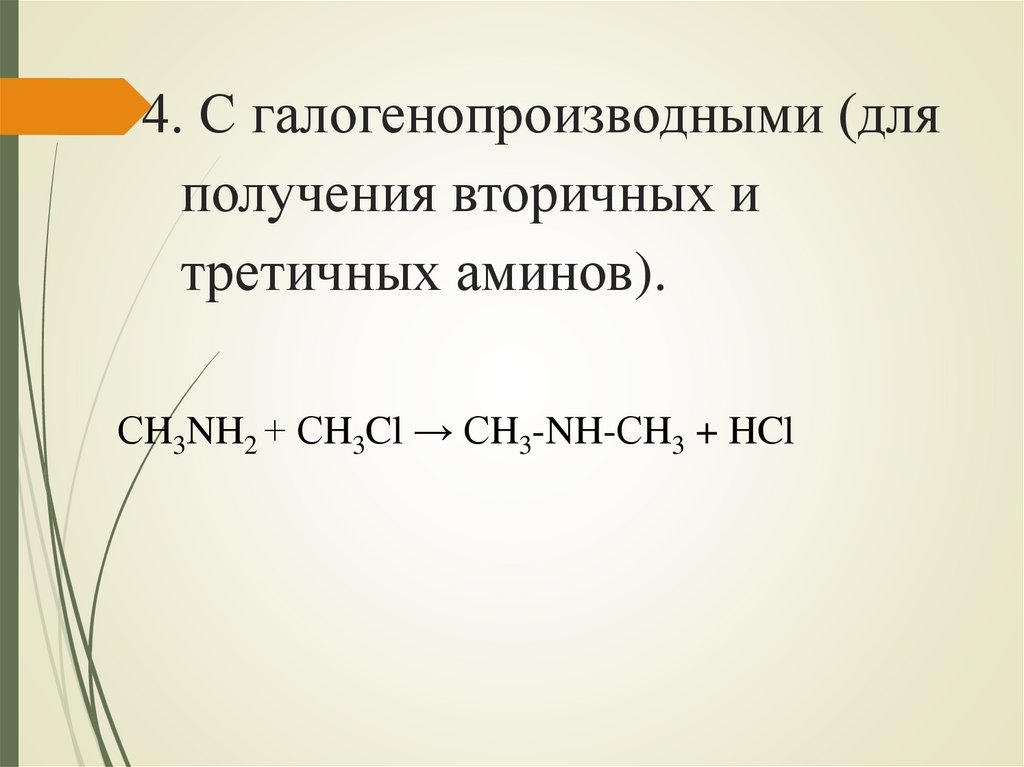
4. С галогенопроизводными (дляполучения вторичных и
третичных аминов).
СH3NH2 + СH3Cl → СH3-NH-СH3 + HCl
26.
5. С азотистой кислотой (HNO2):Первичные алифатические амины c HNO2
образуют спирты:
R-NH2 + HNO2→ R-OH + N2↑ + H2O
Вторичные амины (алифатические и
ароматические) под действием HNO2
превращаются в N-нитрозопроизводные
(вещества с характерным запахом):
R2NH + H-O-N=O → R2N-N=O + H2O
(диалкилнитрозамин)
27.
Получение аминов.28.
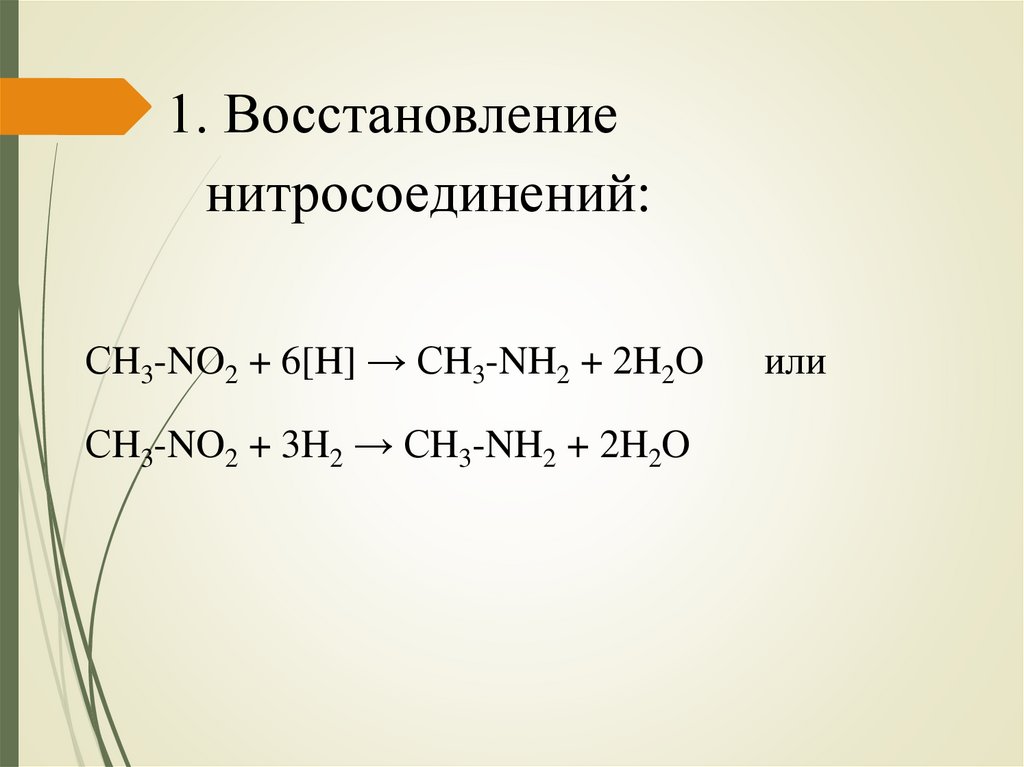
1. Восстановлениенитросоединений:
СH3-NO2 + 6[H] → СH3-NH2 + 2H2O
СH3-NO2 + 3H2 → СH3-NH2 + 2H2O
или
29.
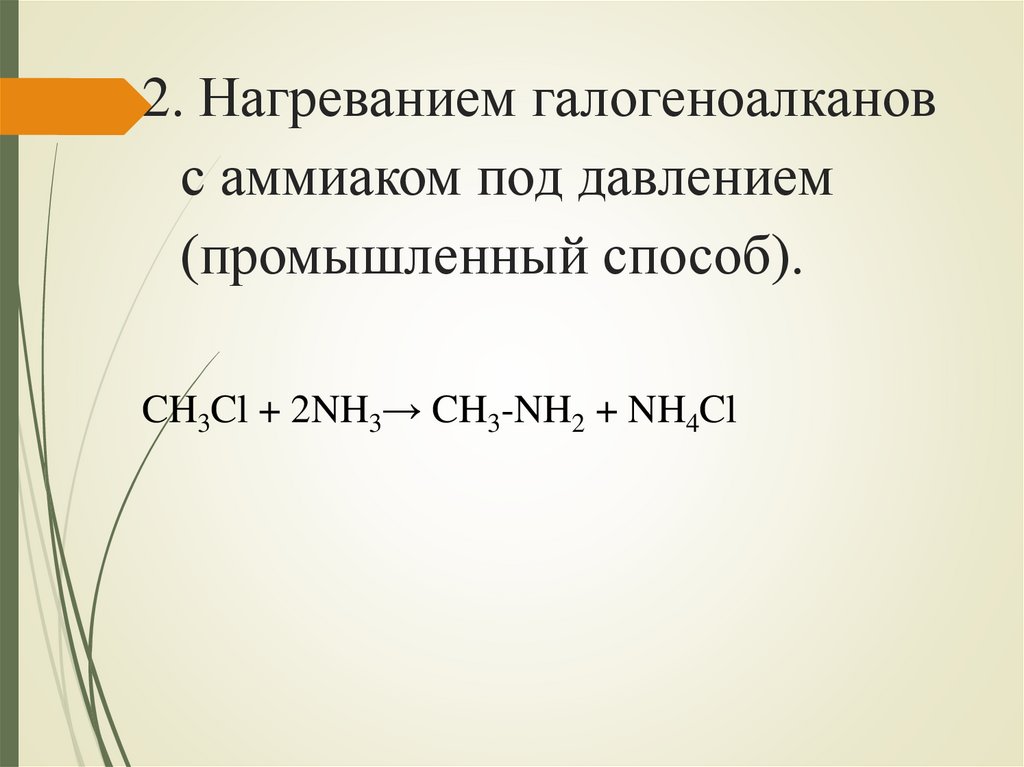
2. Нагреванием галогеноалкановс аммиаком под давлением
(промышленный способ).
CH3Cl + 2NH3→ CH3-NH2 + NH4Cl
30.
3. Действие щелочей на солиалкиламмония (лабораторный
способ) (получение первичных,
вторичных, третичных аминов):
[R-NH3]Сl + NaOH→ R-NH2 + NaCl + H2O
31.
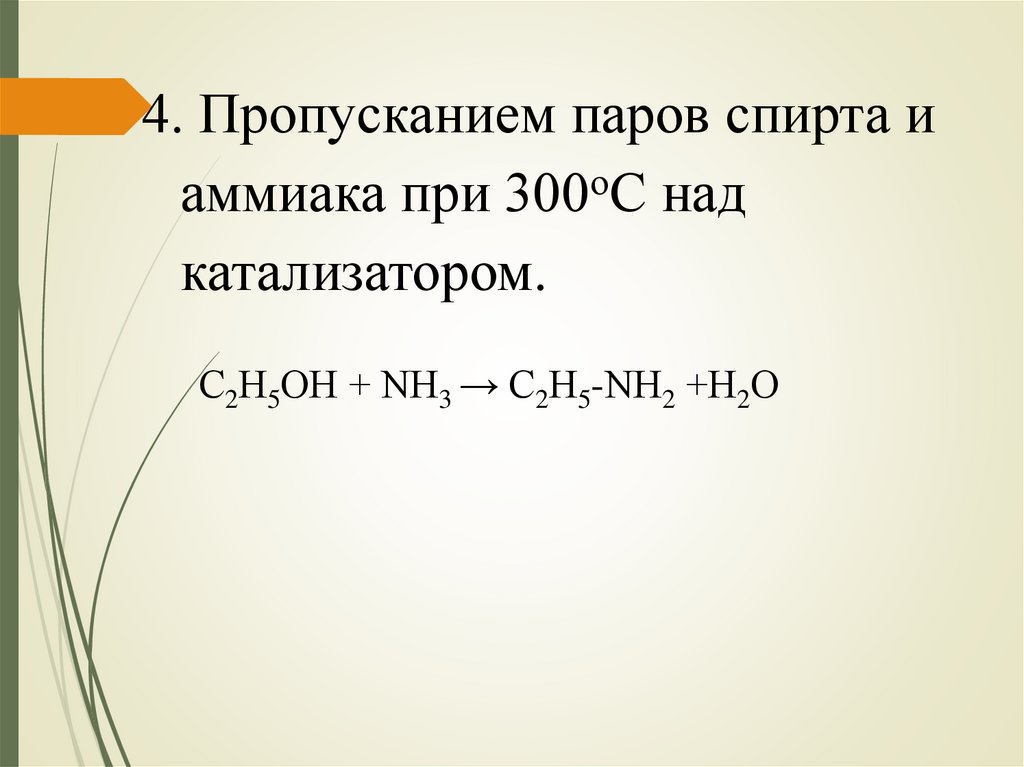
4. Пропусканием паров спирта иаммиака при 300оС над
катализатором.
С2Н5ОН + NН3 → С2Н5-NН2 +Н2О
32.
Применение.Амины используют при получении лекарственных
веществ, красителей и исходных продуктов для
органического синтеза. Гексаметилендиамин при
поликонденсации с адипиновой кислотой дает
полиамидные волокна.
Анилин находит широкое применение в качестве
полупродукта в производстве красителей, взрывчатых
веществ и лекарственных средств (сульфаниламидные
препараты).
33.
Домашнее задание:§ 16, задание № 7 (после параграфа)




















 Химия
Химия








