Похожие презентации:
Понятие скорости химических реакций
1.
ЧТО НАМГОТОВИТ
УРОК
ГРЯДУЩИЙ?!
2.
3.
Тема урока:«Понятие скорости
химических реакций»
Цель урока:
Изучить понятие
скорости химических
реакций.
4.
5.
Опыт 1.Просмотрите демонстрационный эксперимент.
Результаты наблюдения занесите в таблицу
Ключ
№
опыта
Краткий ход
эксперимента
Наблюдения
1.
H2O2 нагреваем и
добавляем MnO2
Выделение
кислорода,
лучинка
вспыхнула
Выводы и
уравнения
реакций*
MnO2 является
катализатором
6.
Опыт 2.В две пробирки поместите 2-3 гранулы Zn, в одну пробирку
налейте 2 мл раствора соляной кислоты (1:1), в другую
раствор соляной кислоты (1:3). Что вы наблюдаете?
Результаты наблюдения занесите в таблицу.
Ключ
№
Краткий ход
опыта
эксперимента
HCl (1:1) + Zn
2.
HCl (1:3) + Zn
Наблюдения
Выводы и
уравнения реакций*
выделение газа На скорость реакции
без цвета и
влияет концентрация
запаха в первой веществ
пробирке с
Zn + 2HCl ZnCl2 + H2
большей
скоростью
7.
Опыт 3.В одну пробирку поместите две стружки магния, в другую -
две гранулы цинка. Прилейте в ту и другую пробирки по 2
мл раствора соляной кислоты. Что вы наблюдаете?
Результаты наблюдения занесите в таблицу.
Ключ
№
Краткий ход
опыта
эксперимента
3.
Mg + HCl
Zn + HCl
Наблюдения
Выводы и
уравнения реакций*
выделение газа На скорость реакции
без цвета и
влияет природа
запаха в первой реагирующих веществ
пробирке с
Mg + 2HCl MgCl2 + H2
большей
Zn + 2HCl ZnCl2 + H2
скоростью
8.
Опыт 4.В одну пробирку поместите кусочек мела, в другую –
измельченный мел. Прилейте в ту и другую пробирки по 2 мл
раствора соляной кислоты. Что вы наблюдаете?
Результаты наблюдения занесите в таблицу.
Ключ
№
Краткий ход
опыта
эксперимента
4.
CaCO3
(измельченный) +
HCl
CaCO3 (кусочек) +
HCl
Наблюдения
Выводы и
уравнения реакций*
выделение газа
На скорость реакции
без цвета и запаха влияет площадь
в первой пробирке соприкосновения
с большей
веществ
скоростью
CaCO3 + 2HCl CaCl2 +
H2O + CO2
9.
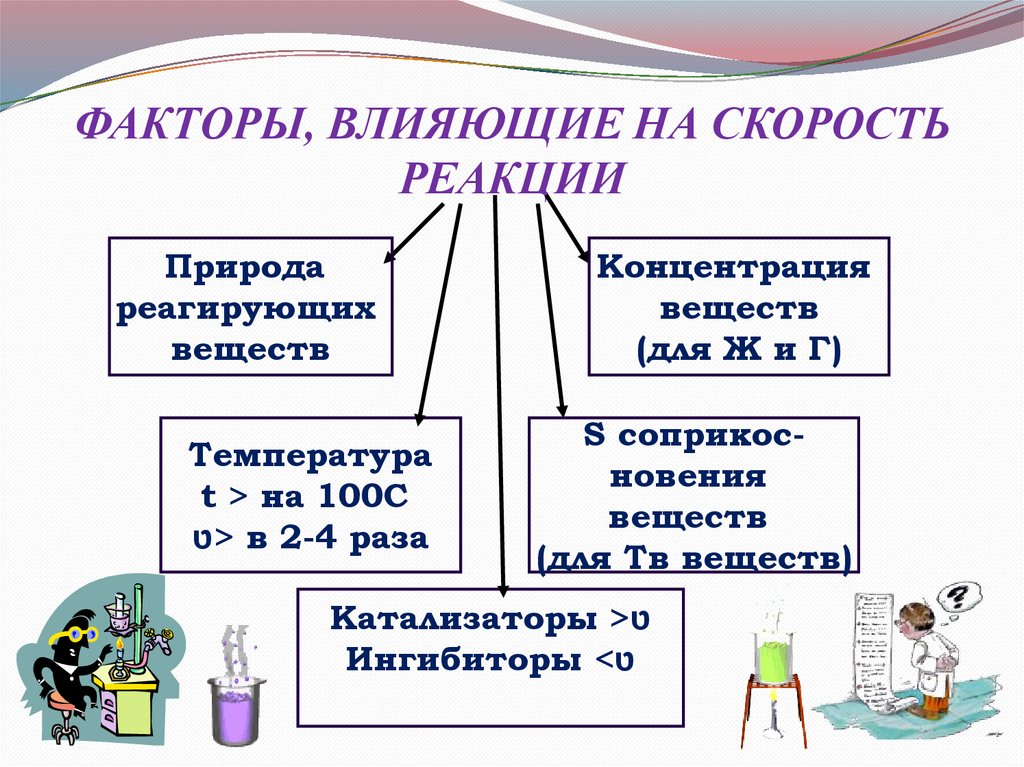
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬРЕАКЦИИ
Природа
реагирующих
веществ
Температура
t > на 100С
>טв 2-4 раза
Концентрация
веществ
(для Ж и Г)
S соприкосновения
веществ
(для Тв веществ)
Катализаторы >ט
Ингибиторы <ט
10.
11.
12.
13.
14.
УЧИМСЯ ДАВАТЬ САООЦЕНКУПроанализируйте выполненную работу и
оцените ее.
Критерии оценивания:
Самостоятельно описал(а) ход эксперимента,
наблюдения, сформулировал(а) выводы и
составил(а) уравнения химических реакций, не
допустив ошибок – «5»
Самостоятельно описал(а) ход эксперимента,
наблюдения, сформулировал(а) выводы и
составил(а) уравнения химических реакций,
допустив 1-3 ошибки – «4»
15.
ДОМАШНЕЕ ЗАДАНИЕДля творческих натур: написать
эссе на тему «Химические реакции и
их скорость вокруг нас»
Для экспериментаторов:
привести как можно больше
жизненных примеров, которые
демонстрируют понятие скорости
химической реакции














 Химия
Химия








