Похожие презентации:
Соединения галогенов
1. Соединения галогенов
2. Экспресс опрос класса:
1. Какие элементы называются галогенами?2. Охарактеризуйте положение галогенов в
Периодической системе Д.И.Менделеева.
3. Каково строение атомов галогенов?
4. Какой из галогенов является самым
электроотрицательным?
5. Как изменяются окислительные свойства
галогенов с увеличением порядкового номера?
3. Галогеноводороды:
HF - фтороводородная кислота ( плавиковая)HCl - хлороводородная кислота (соляная)
HBr - бромоводородная кислота
HI - йодоводородная кислота
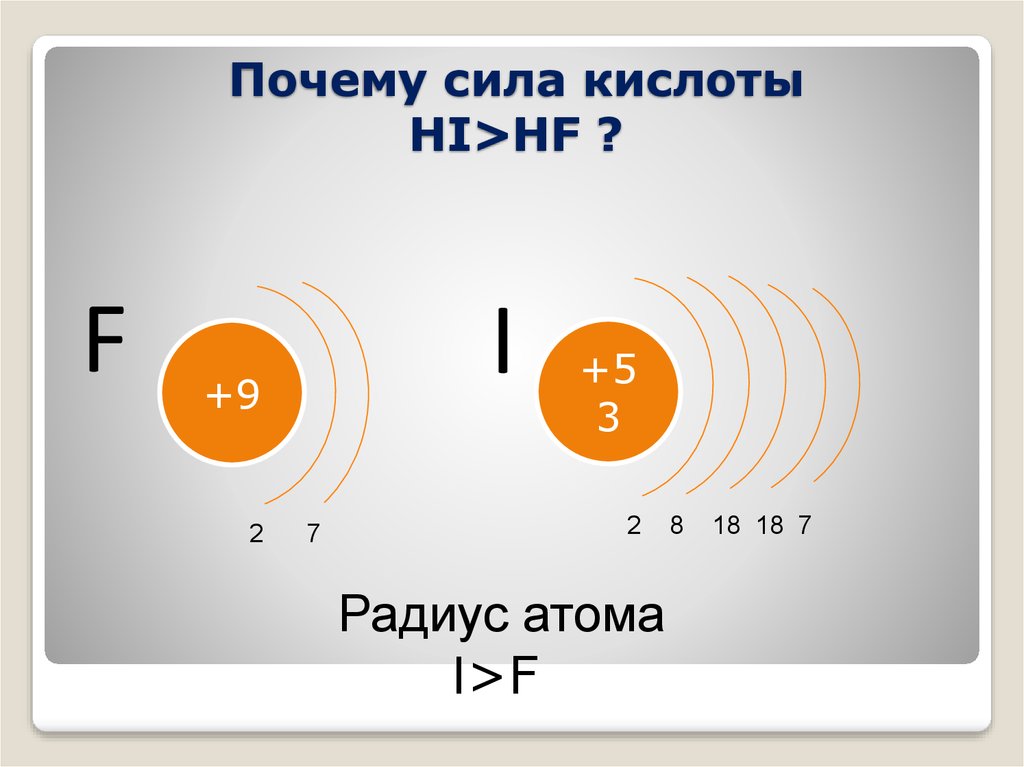
4. Почему сила кислоты HI>HF ?
Почему сила кислотыHI>HF ?
F
I
+9
2
7
+5
3
2
Радиус атома
I>F
8
18 18 7
5.
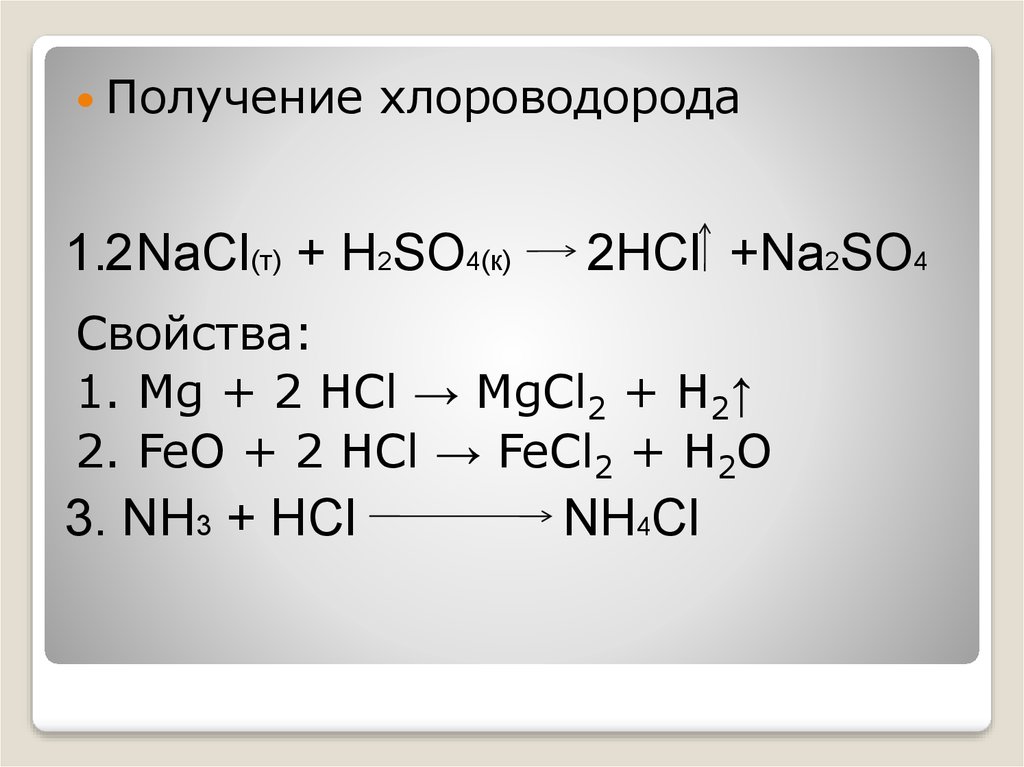
Получениехлороводорода
1.2 NaCl(т) + H2SO4(к)
2HCl +Na2SO4
Свойства:
1. Mg + 2 HCl → MgCl2 + H2↑
2. FeO + 2 HCl → FeCl2 + H2O
3. NH3 + HCl
NH4Cl
6. Взаимодействие плавиковой кислоты и стекла:
SiO2+ 4HF(газ)
= SiF4+ 2H2O
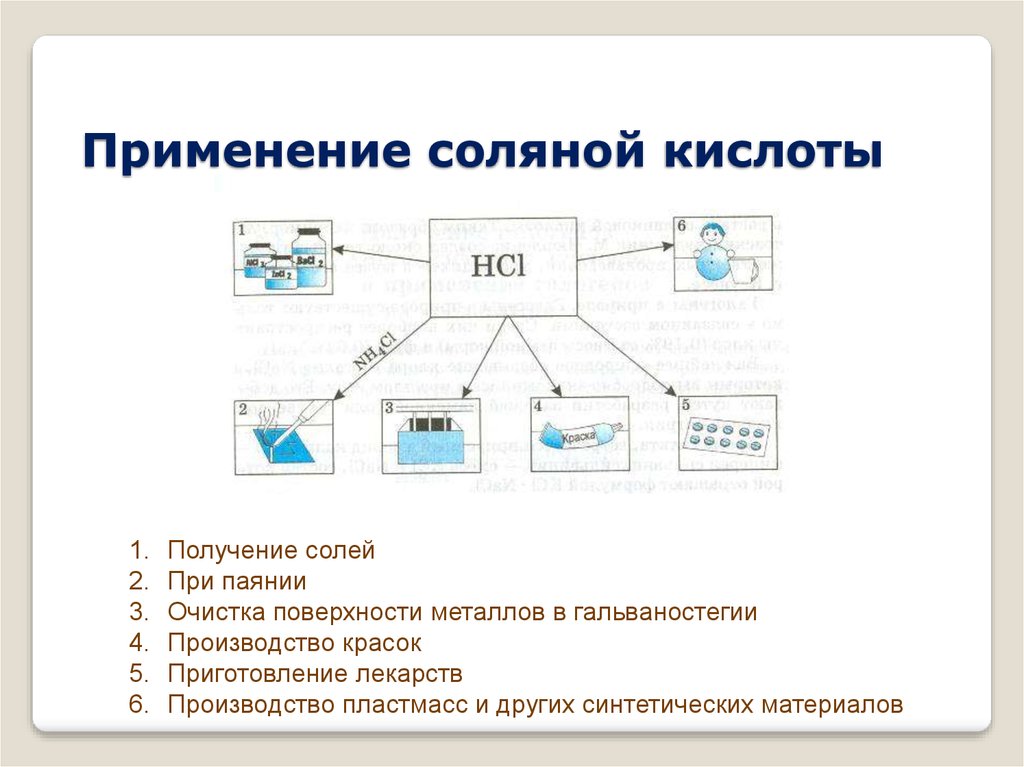
7. Применение соляной кислоты
1.2.
3.
4.
5.
6.
Получение солей
При паянии
Очистка поверхности металлов в гальваностегии
Производство красок
Приготовление лекарств
Производство пластмасс и других синтетических материалов
8. Соли:
FCL
Соли:
фториды
хлориды
Br бромиды
J
йодиды
фторид кальция(флюорид) CaF2
хлорид натрия(галит)
NaCl
бромид серебра
AgBr
йодид калия
КJ
9.
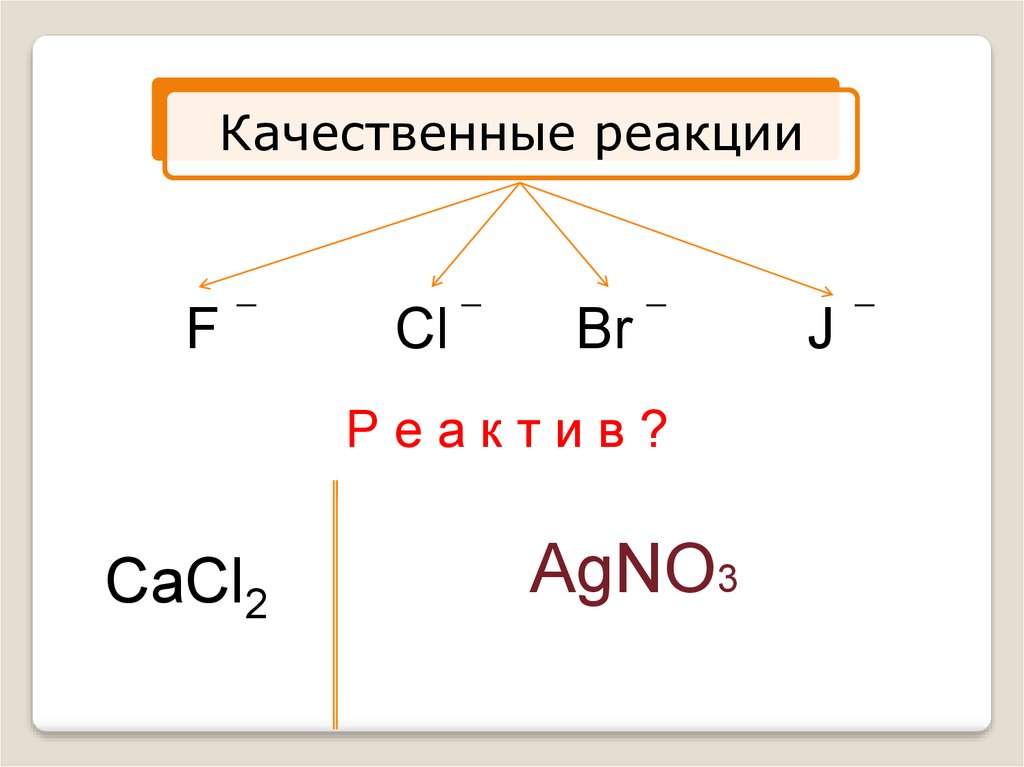
Качественные реакцииF
Cl
Br
Реактив?
CaCl2
AgNO3
J
10. Качественные реакции
NaCl + AgNO3 =AgCl + NaNO3
Ag + Cl¯ = AgCl
белый
NaBr + AgNO3 =
AgBr + NaNO3
+
+
Ag + Br¯ = AgBr
NaJ + AgNO3 =
+
Ag + J¯ = AgJ
светло-желтый
AgJ + NaNO3
желтый
11.
ХФУ1970 г.
Аэрозольные
распылители
Охлаждающие
Вещества
(хладагены)
Разрушение озонового слоя
CI + O3 = CIO + O2
Один атом хлора уничтожает 100000 молекул O3 и может
существовать до 300 лет.
Слепота из-за катаракты
Раковые заболевания кожи
Подавление иммунной системы организма








 Химия
Химия








