Похожие презентации:
Галогены и их соединения
1. Соединения галогенов.
Презентация Савинова ЕвгенияСтудента группы СБк-101
2. Соединения галогенов
Галогеноводороды, – Это едкие газы срезким запахом, хорошо раствормые в воде
HF
фтороводород
HCl
хлороводород
HBr
бромоводород
HI
йодоводород
3.
Получениехлороводорода
NaСl(тв) + Н2SО4(конц) = НСl↑ + КНSО4.
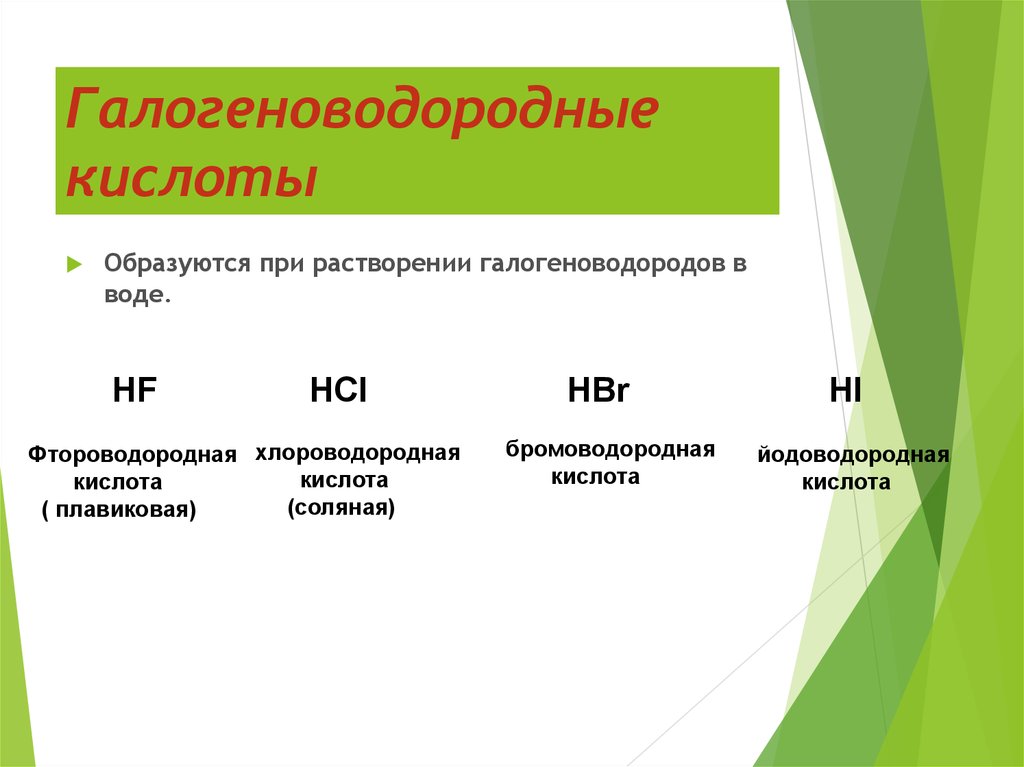
4. Галогеноводородные кислоты
Образуются при растворении галогеноводородов вводе.
HF
HCl
Фтороводородная хлороводородная
кислота
кислота
(соляная)
( плавиковая)
HBr
бромоводородная
кислота
HI
йодоводородная
кислота
5. Оксокислоты
Хлорная –НСlO4
Сl2O7
Хлорноватая – НСlO3
Сl2O5
Хлористая –
Хлорноватистая- НСlO
НСlO2
Сl2O3
Сl2O
6. Качественная реакция на галогенид - ионы
Взаимодействие с ионом серебра: (AgNO3)AgNO3 + KCl = KNO3 + AgCl (белый )
AgNO3 + KВr = KNO3 + AgBr(Светло-желтый)
AgNO3 + KI = KNO3 + AgI( желтый)
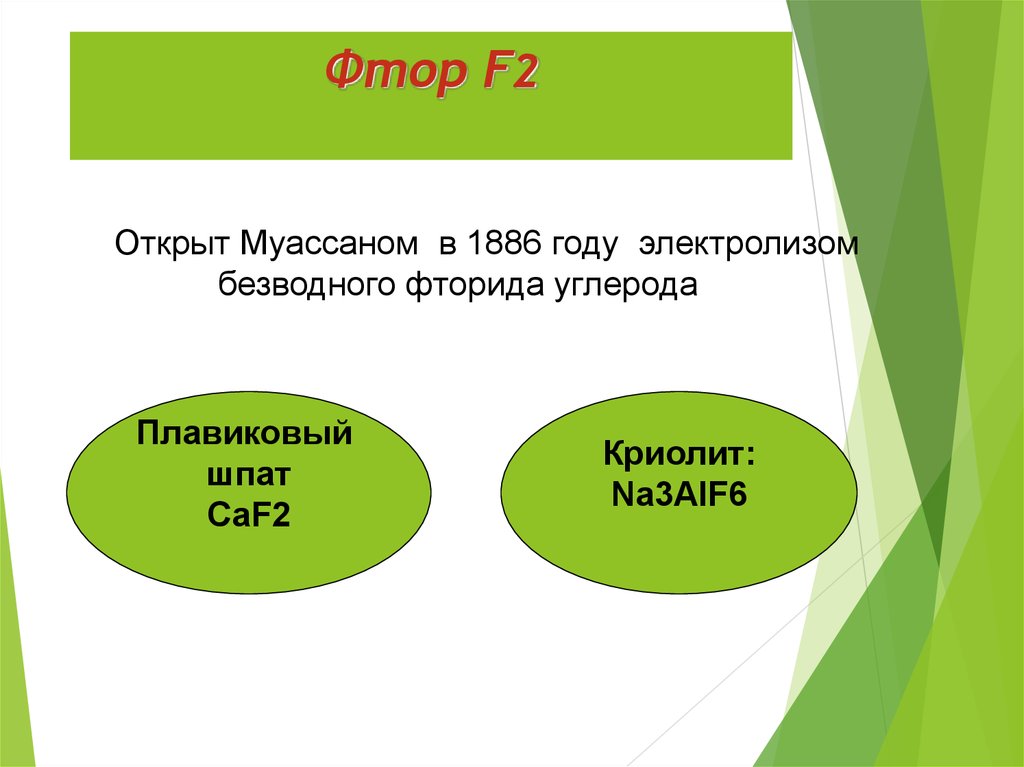
7. Фтор F2
Открыт Муассаном в 1886 году электролизомбезводного фторида углерода
Плавиковый
шпат
СаF2
Криолит:
Na3AlF6
8. Соединения фтора
n(-CF2-CF2-)Тефлон устойчив
к действию всех
известных кислот
и их смесей. Он
выдерживает
температуры от 269 до +200°С.
Плавиковая кислота:
HF
Разъедает стекло
Зарин и зоман-
Боевые отравляющие
вещества
9. Хлор
Галит (NaCl )ДДТ (дихлородифенилтрихлорэтан)
KClO3 - Бертолетова соль.
2KClO3 + 3S = 2KСl + 3SO2↑.
10. Бром
AgBr- фотографияNaBr- дубление кожи
KBr- линзы
LiBr- используется в кондиционерах.
11. Йод
Получил Б.Куртуа. (1811 г)2NaI + 2H2SO4 = I2 + SO2↑ + Na2SO4
+ 2H2O
3I2 + 5NH3 = I3N∙NH3↓ + 3NH4↑.
моноаммиакат нитрида трииода I3N∙NH3.









 Химия
Химия








