Похожие презентации:
Химия - великая наука
1.
Химия - великаянаука
2.
Расшифруйте:,,
,
АТОМ
3.
Вспомните:1. Что такое атом?
2. Из каких частиц состоит
атом?
3. Какой заряд имеют эти
частицы?
4. Чему равно общее количество
электронов в атоме?
4.
Проверь свои знанияЗадания
1. По данным
определить, какой
это элемент,
записать
химический знак
Вариант 1
а) 12 e
б) 7 e
в) 19 е
Вариант 2
а) 20 e
б) 14 e
в) 16 e
2. Определить
а) 2 период 6 группа а) 2 период 3 группа
элемент по его
б) 3 период 2 группа б) 3 период 6 группа
положению в ПСХЭ
5.
Проверь себяЗадания
Вариант 1
Вариант 2
1. По данным
а) Mg (12 e)
определить, какой б) N (7 e)
это элемент
в) Ca (19 e)
а) Ca (20 e)
б) Si (14 e)
в) S (16 e)
2. Определить
элемент по его
положению в
ПСХЭ
а) B
б) S
а) O
б) Mg
6.
Химическая формулаH2O CuSO4
H2SO4 NaOH
7.
Электронная формула8.
«Строение электронныхоболочек атомов химических
элементов»
Цель: научиться составлять электронные формулы
атомов элементов №1-20.
9.
Электронная оболочка.Энергетический уровень
Ядро
Электроны
Электронная оболочка –
это совокупность всех
электронов в атоме,
окружающих ядро.
Электроны в атоме, в
зависимости от запаса
энергии, располагаются на
энергетических уровнях
или электронных слоях.
Энергетический уровень
10.
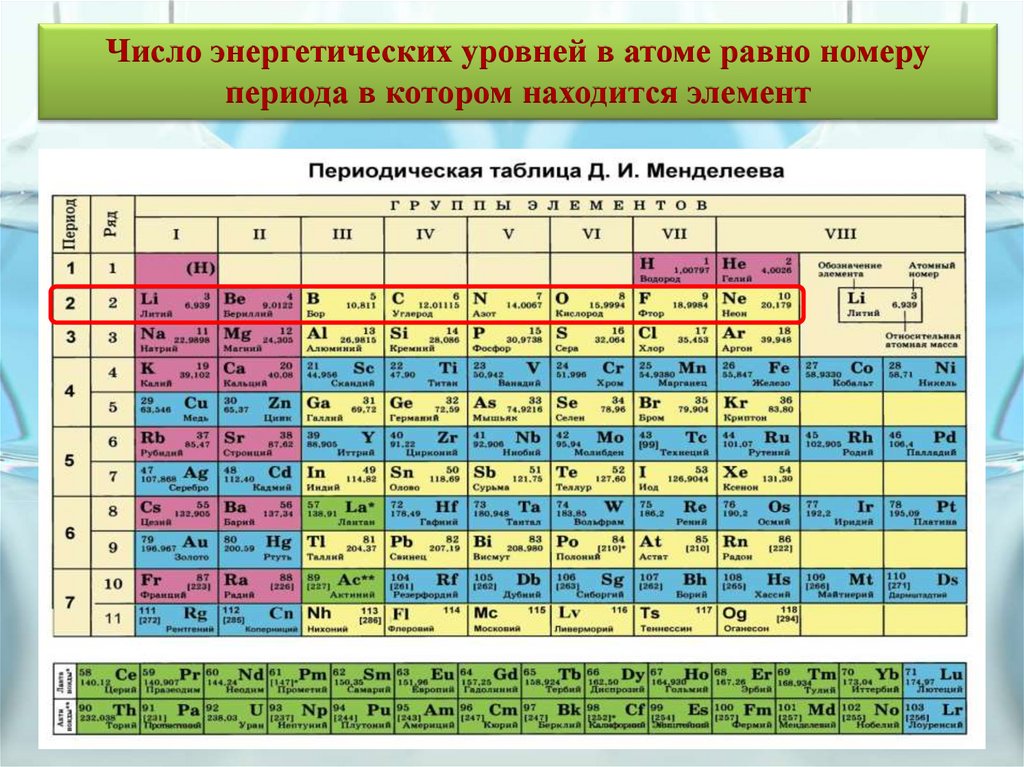
Число энергетических уровней в атоме равно номерупериода в котором находится элемент
11.
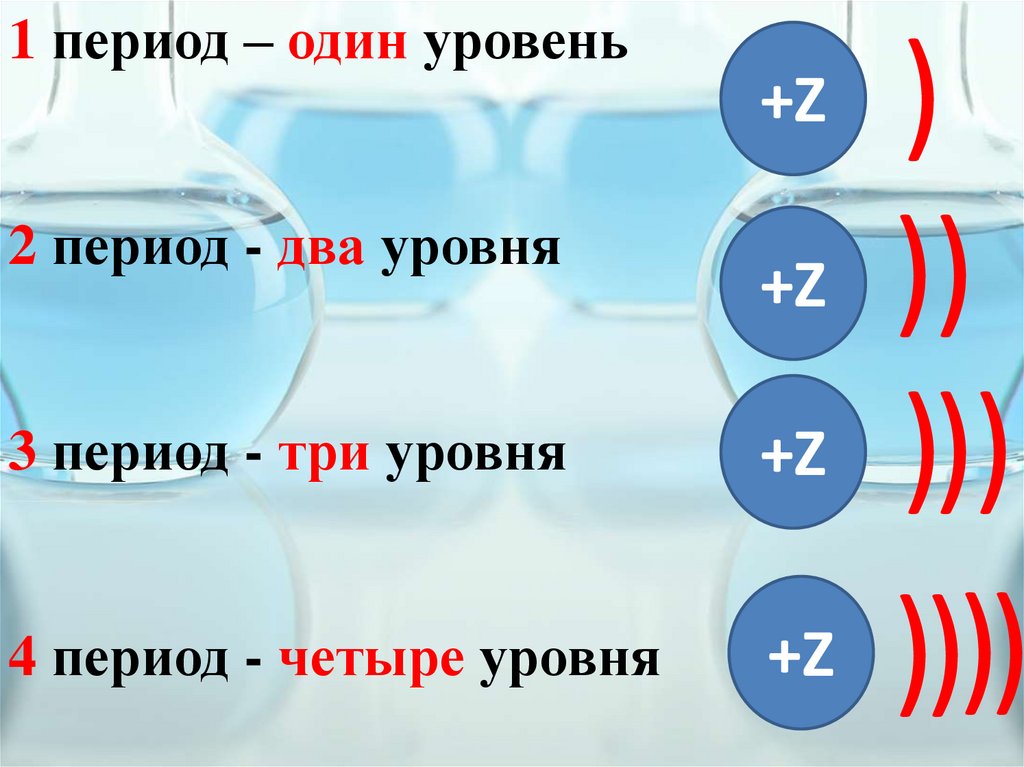
1 период – один уровень2 период - два уровня
+Z
+Z
3 период - три уровня
+Z
4 период - четыре уровня
+Z
)
))
)))
))))
12.
Максимальное число электронов,находящихся на энергетическом уровне
можно определить по следующей формуле:
2
N=2n
1 эн.ур. :
2 эн.ур. :
3 эн.ур. :
4 эн.ур. :
2 • 12 = 2
2 • 22 = 8
2 • 32 = 18
2 • 42 = 32
номер энергетического уровня
13.
Число электронов на внешнемуровне определяется номером
группы, в которой находится
химический элемент (не может
быть больше 8).
I группа - один электрон
+Z
))
))
1e-
II группа - два электрона
+Z
2e-
14.
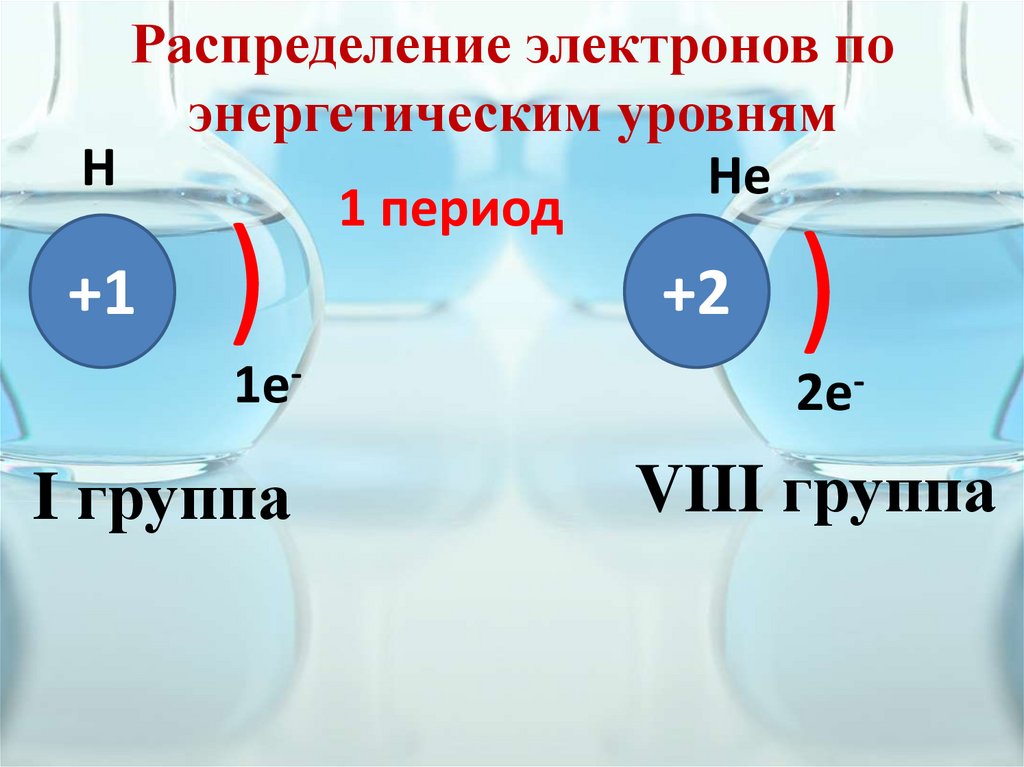
Распределение электронов поэнергетическим уровням
Н
Не
1 период
+1
)
1e-
I группа
+2
)
2e-
VIII группа
15.
Электронная орбиталь(энергетический подуровень)
- это область пространства вокруг
ядра атома химического элемента
в которой наиболее вероятно
находится электрон.
16.
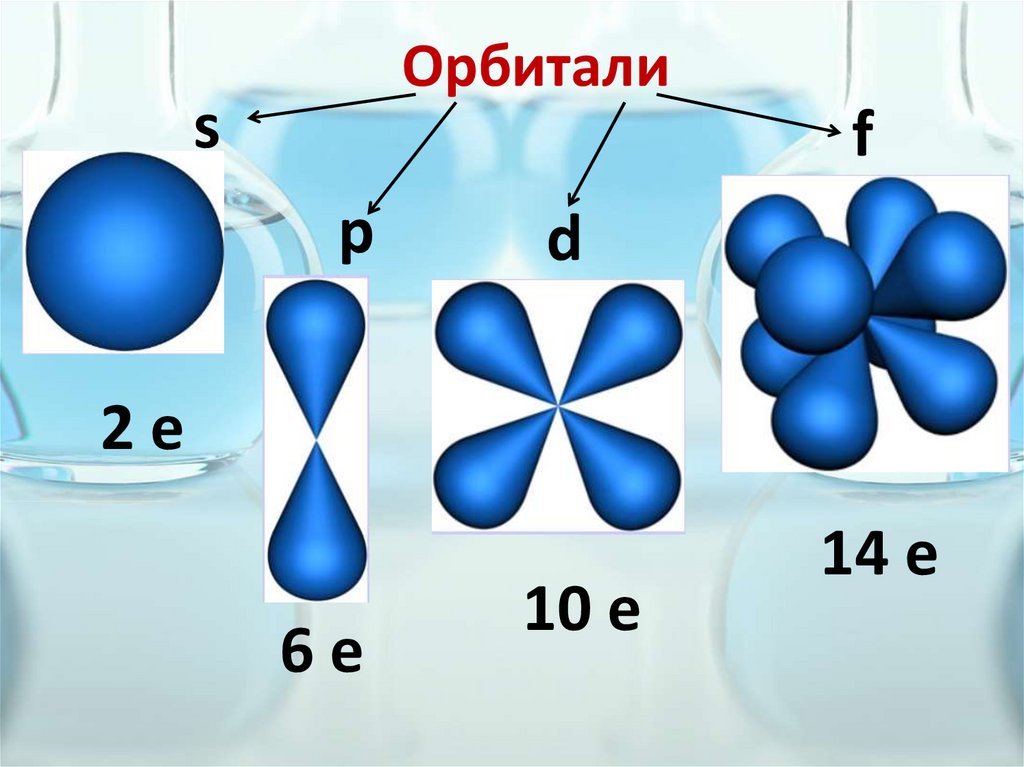
Орбиталиs
f
p
d
2е
6е
10 е
14 е
17.
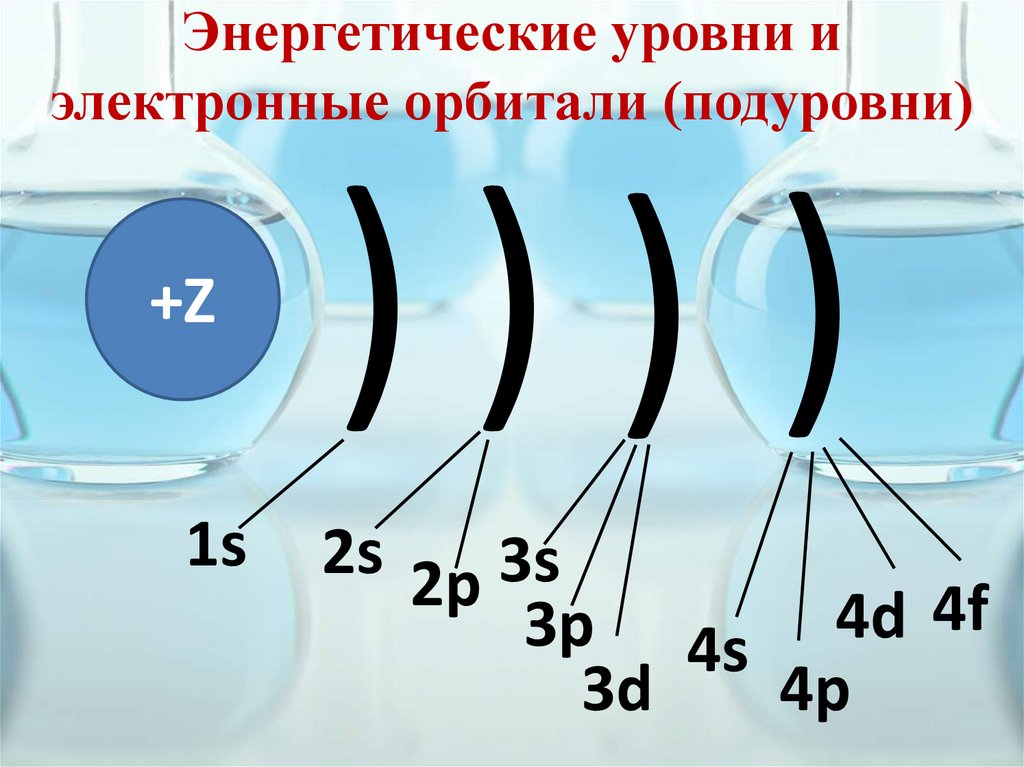
Энергетические уровни иэлектронные орбитали (подуровни)
+Z
1s
))) )
2s 2p 3s
3p 4s 4d 4f
4p
3d
18.
СПИННЕР19.
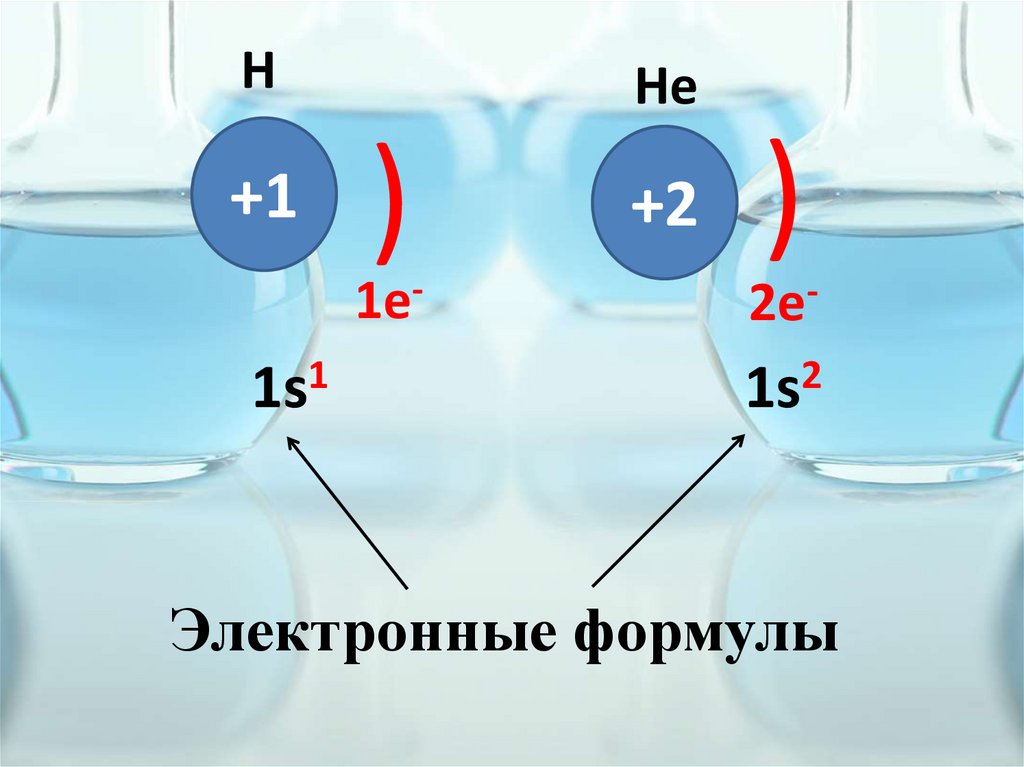
Н+1
He
)
1e-
1s1
+2
)
2e-
1s2
Электронные формулы
20.
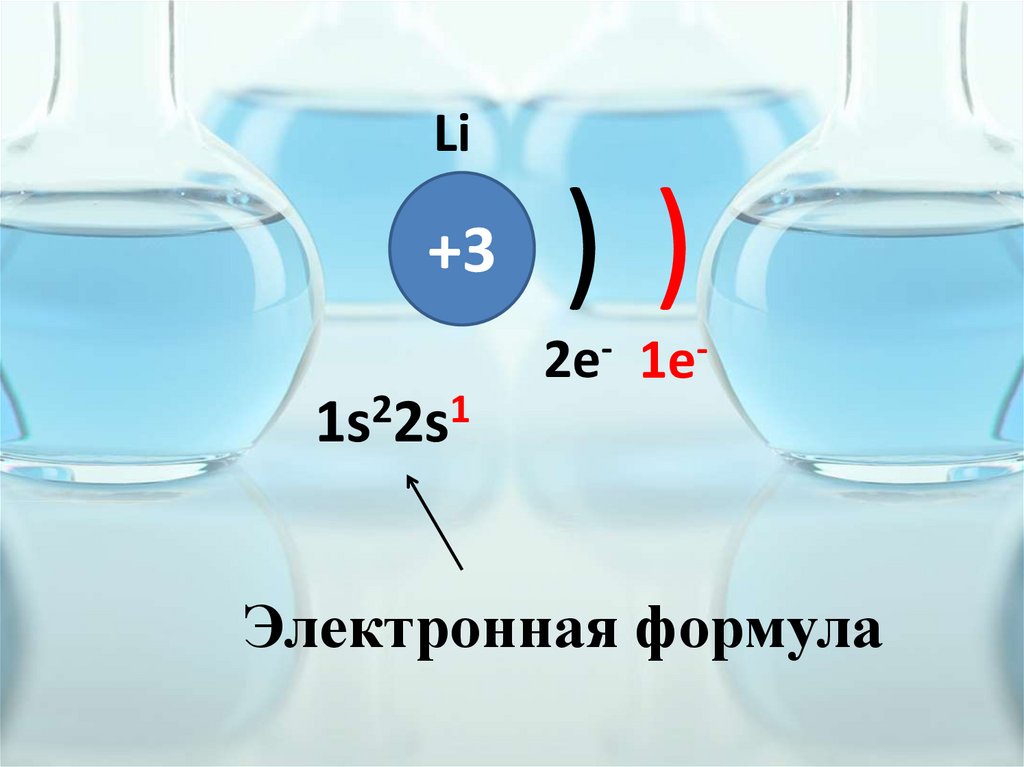
Li+3
1s22s1
))
2e- 1e-
Электронная формула
21.
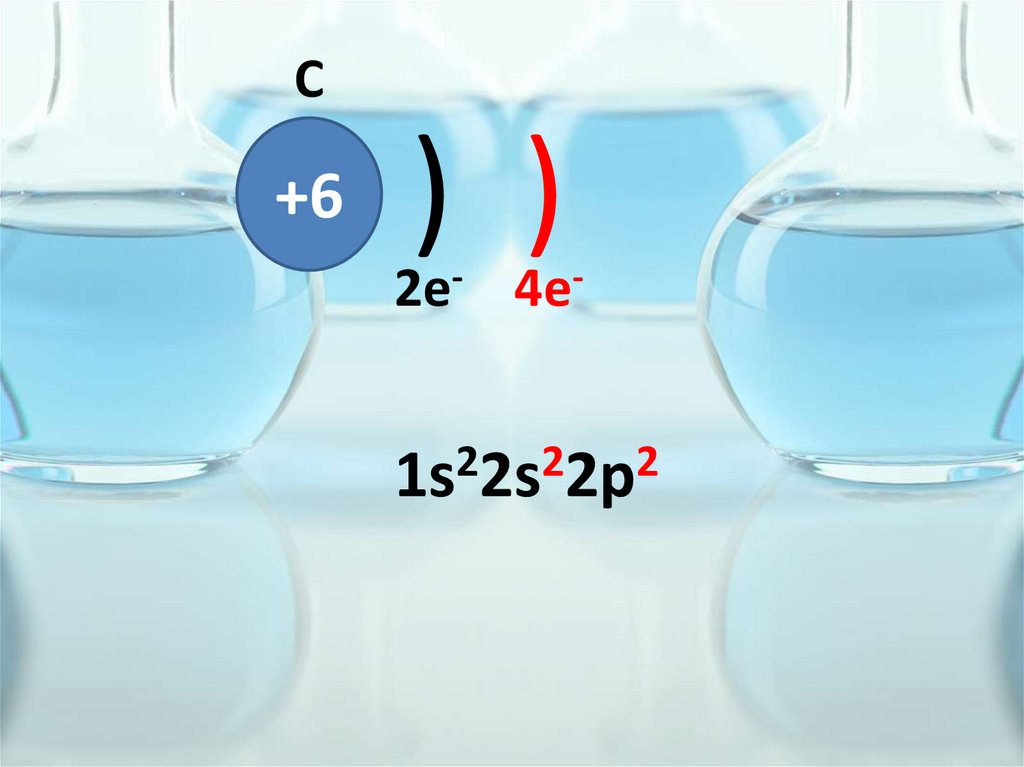
C+6
) )
2e- 4e2
2
2
1s 2s 2p
22.
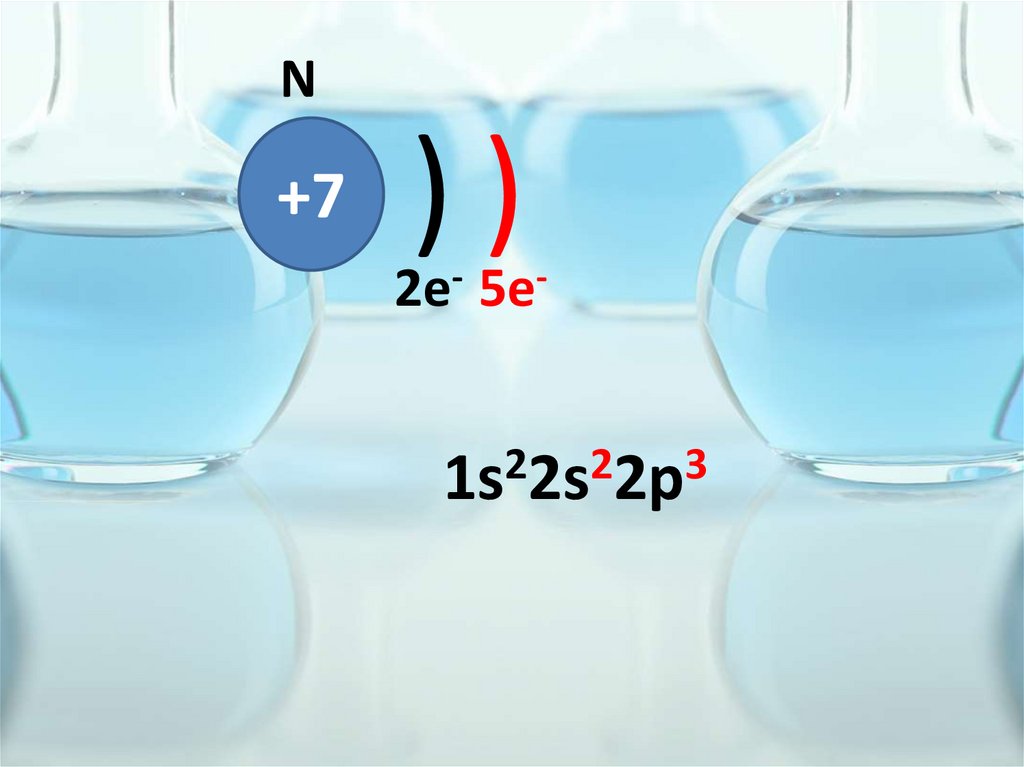
N+7
))
2e- 5e-
1s22s22p3
23.
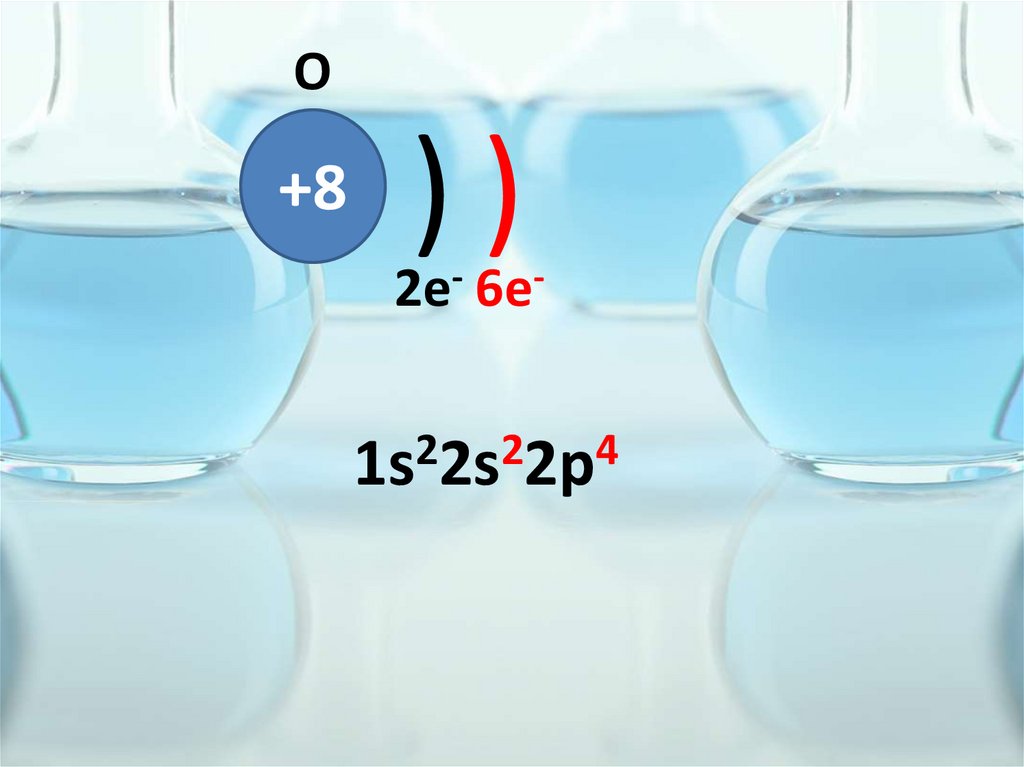
O+8
))
2e- 6e2
2
4
1s 2s 2p
24.
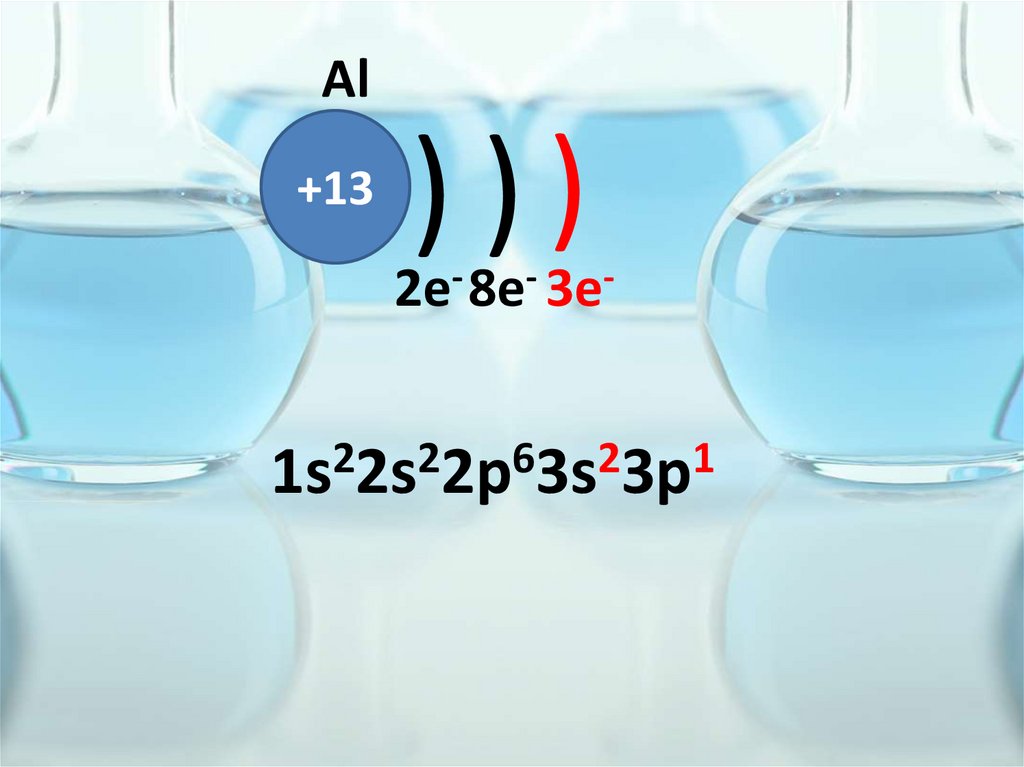
Al+13
)))
2e- 8e- 3e-
1s22s22p63s23p1
25.
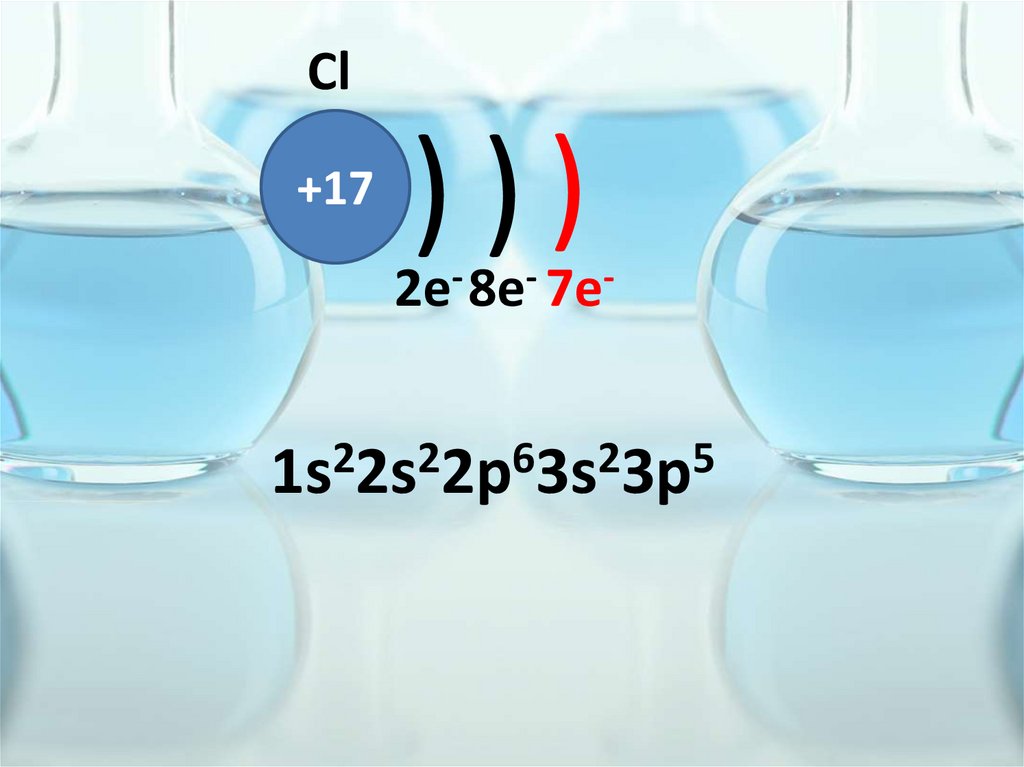
Cl+17
)))
2e- 8e- 7e-
1s22s22p63s23p5
26.
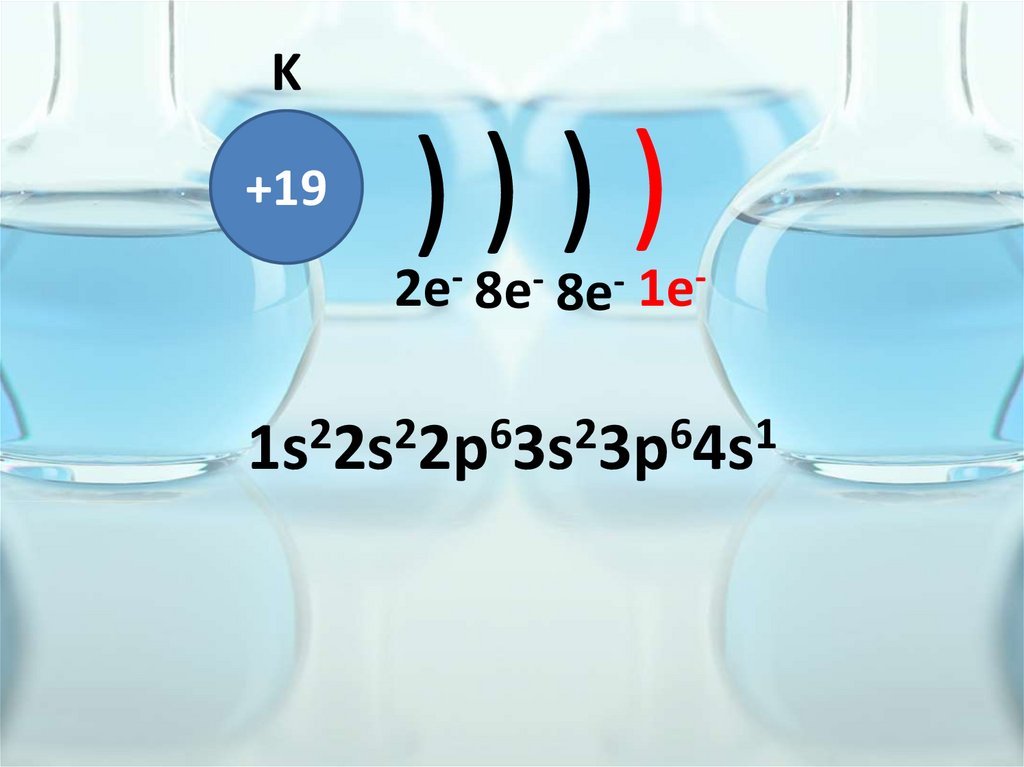
K+19
))))
2e- 8e- 8e- 1e2
2
6
2
6
1
1s 2s 2p 3s 3p 4s
27.
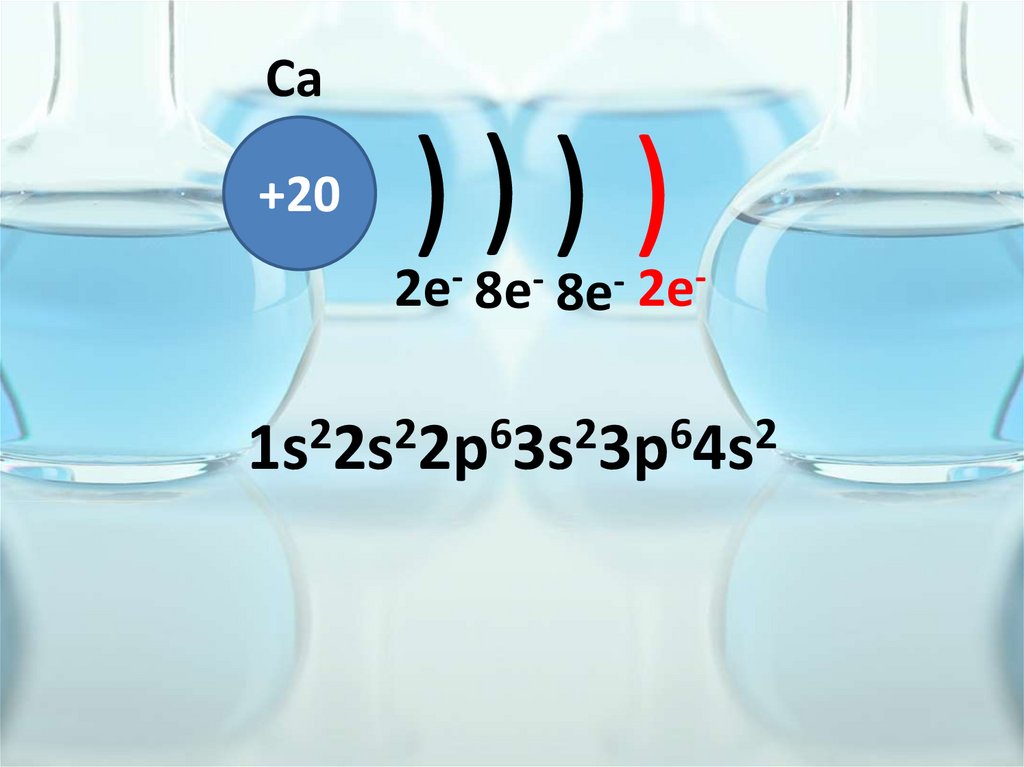
Ca+20
))) )
2e- 8e- 8e- 2e2
2
6
2
6
2
1s 2s 2p 3s 3p 4s
28.
«Синквейн»1 строка обозначает тему одним словом (обычно
существительным),
2 строка описывает тему (2 прилагательных),
3 строка называет действия, относящиеся к теме
(3глагола),
4 строка выражает отношение автора к теме (фраза
из 4 слов),
5 строка – повторение сути, “синоним” темы
29.
РефлексияЯ все понял, могу
объяснить другому
По данной теме у меня
остались вопросы
Недостаточно понял тему,
сам ошибаюсь
30.
Молодцы!Вы сегодня хорошо
потрудились!
Спасибо за урок!
















 Химия
Химия








