Похожие презентации:
Типы химических реакций
1.
Типы химических реакций2.
На сегодняшний день известно 118химических элементов. Эти элементы
образуют огромное количество различных
соединений, многие из которых могут
вступать в химические реакции друг с
другом.
3.
Что мы знаем о химических реакциях?Давайте с вами вспомним
1. Что же такое химические превращения или
химические реакции?
2. Назовите признаки химических реакций.
3.Какие же условия необходимы для того,
чтобы произошла химическая реакция?
4.
4. Можно ли условно записать химическуюреакцию?
5. Что такое химическое уравнение?
6. На основании какого закона составляют
уравнения химических реакций?
5.
Изучение нового материалаНикакой, даже самый современный
компьютер, не смог бы подсчитать число
возможных химических реакций. В
природе, технике, в организмах растений и
животных, в лабораториях и на заводах
совершается множество медленных и
быстрых химических взаимодействий. От
образования минералов, которое протекают
миллионы лет, до ядерных реакций,
которые завершаются в доли секунды.
6.
Ржавление железа, окисление резины –примеры медленно протекающих реакций.
Взрыв пороха, вспышка паров бензина в
двигателе автомобиля – примеры быстро
протекающих реакций.
7.
Химических реакций известно в мире многоИ каждая в отдельности важна, я вам скажу.
Реакции мы делим на типы очень строго
Какие это типы? Сейчас я расскажу.
8.
2H2 + O2 = 2H2OCaO + H2O = Ca(OH)2
Cu(OH)2 = CuO + H2O
2HgO =2Hg + O2
Zn + 2HCl = ZnCl2 + H2
AgNO3 + HCl = AgCl + HNO3
Можно ли выделить признак, по
которому эти реакции, возможно,
разделить на группы?
Различаются ли между собой реакции
одной группы?
9.
10.
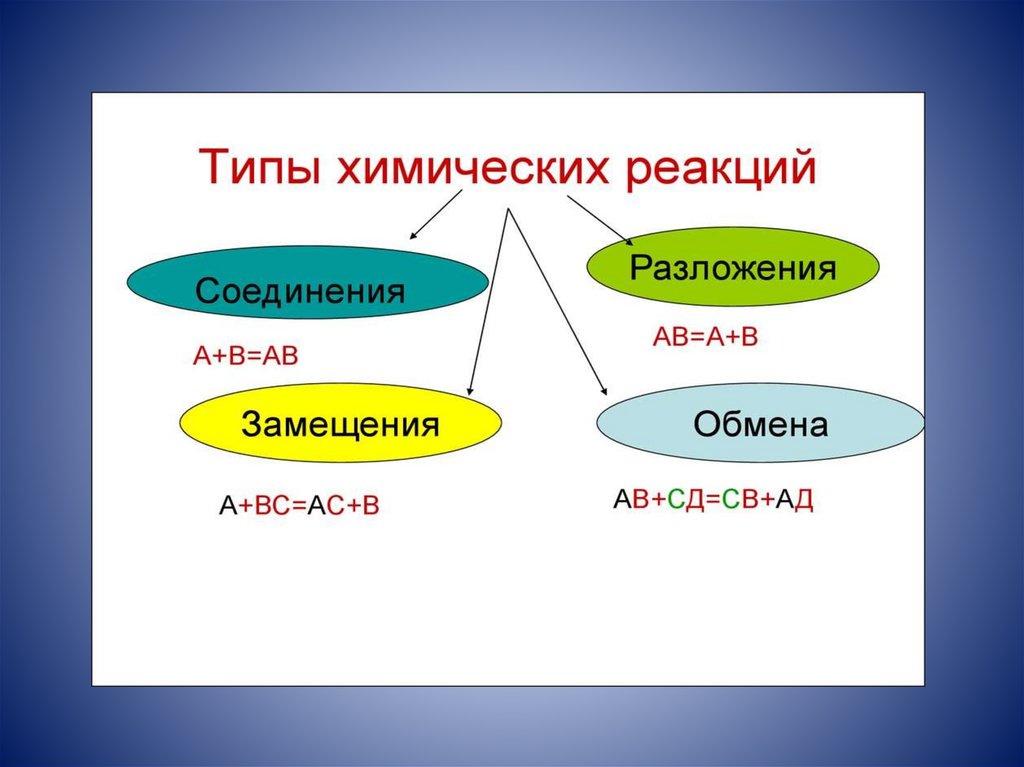
Реакции соединенияРеакции соединения – реакции, в
результате которых из двух или нескольких
исходных веществ образуется одно сложное
вещество.
Примеры реакций соединения:
• C + O2 = CO2↑;
• Na2O + CO2 = Na2CO3.
11.
Реакции разложенияРеакции разложения – реакции, при
которых из одного сложного вещества
образуется несколько новых веществ.
Примеры реакций разложения:
• СaCO3↓ = CaO + CO2↑;
• 2H2O = 2H2↑ + O2.
12.
Реакции замещенияРеакции замещения – реакции между
простыми и сложными веществами, в
результате которых атомы простого
вещества замещают атомы одного из
элементов в сложном веществе.
Примеры реакций замещения:
• CuSO4+ Fe = FeSO4+ Cu;
• 2KI+ Cl2= 2KCl + I2.
13.
Реакции обменаРеакции обмена – реакции между двумя
сложными веществами, в результате
которых они обмениваются своими
составными частями.
Примеры реакций обмена:
• Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑;
• 3KOH + H3PO4 → K3PO4 + 3H2O.













 Химия
Химия








