Похожие презентации:
Карбоновые кислоты. Классификация карбоновых кислот
1.
Карбоновые кислотыПреподаватель Инжинирингового колледжа Гуржиева А.А.
2.
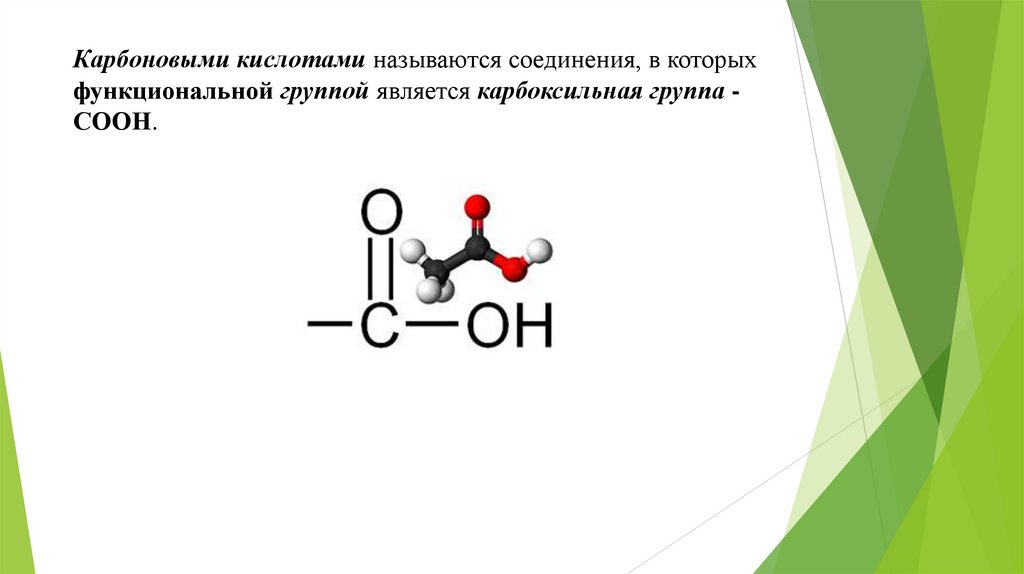
Карбоновыми кислотами называются соединения, в которыхфункциональной группой является карбоксильная группа СООН.
3.
Классификация карбоновых кислотПо числу карбоксильных групп в молекуле различают
монокарбоновые, дикарбоновые, трикарбоновые и т.д.
кислоты
В зависимости от строения углеводородного радикала,
связанного с карбоксильной группой, кислоты подразделяются
на алифатические (насыщенные и ненасыщенные),
алициклические, ароматические, гетероциклические
4.
Номенклатура.1. В систематических названиях карбоновых кислот карбоксильная
группа обозначается сочетанием -овая кислота.
2. В тех случаях, когда карбоксильная группа не входит в состав
углеродной основы, используется сочетание -карбоновая кислота,
выполняющая роль суффикса в заместительной номенклатуре:
5.
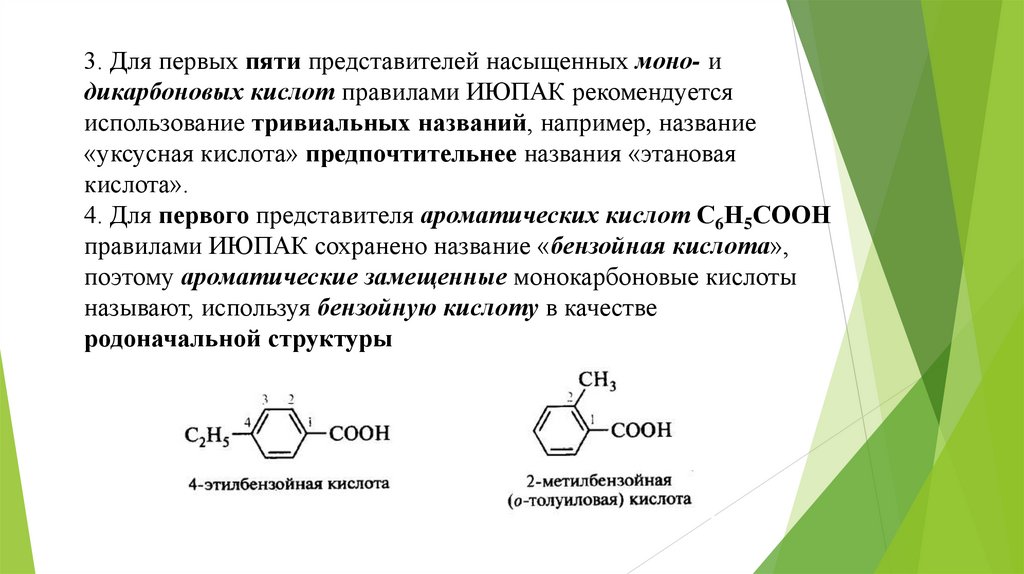
3. Для первых пяти представителей насыщенных моно- идикарбоновых кислот правилами ИЮПАК рекомендуется
использование тривиальных названий, например, название
«уксусная кислота» предпочтительнее названия «этановая
кислота».
4. Для первого представителя ароматических кислот С6Н5СООН
правилами ИЮПАК сохранено название «бензойная кислота»,
поэтому ароматические замещенные монокарбоновые кислоты
называют, используя бензойную кислоту в качестве
родоначальной структуры
6.
Физические свойстваМонокарбоновые кислоты с числом атомов углерода от 1 до 9
представляют собой бесцветные жидкости; высшие
алифатические – твердые вещества
Муравьиная, уксусная и пропионовая кислоты имеют резкий
раздражающий запах, при попадании на слизистые оболочки
вызывают ожоги.
Температуры кипения монокарбоновых кислот выше
температур кипения соответствующих спиртов и альдегидов
из-за того, что кислоты образуют ассоциаты за счет
водородных связей.
7.
Способы получения.Атом углерода карбоксильной группы находится в наивысшей
для органических соединений степени окисления, поэтому
многие методы получения карбоновых кислот основаны на
окислении углеводородов, спиртов, альдегидов, кетонов,
соединений других классов.
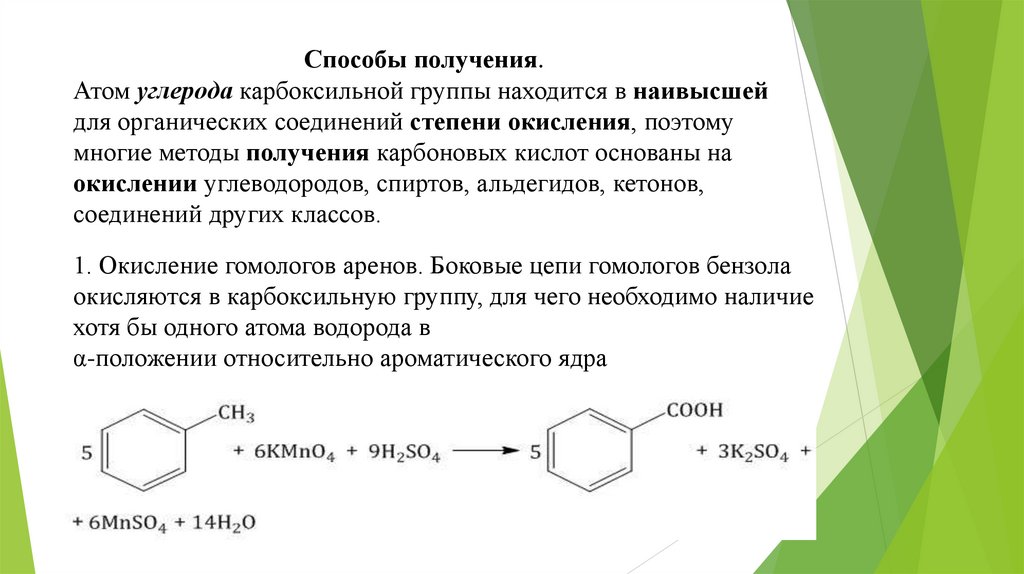
1. Окисление гомологов аренов. Боковые цепи гомологов бензола
окисляются в карбоксильную группу, для чего необходимо наличие
хотя бы одного атома водорода в
α-положении относительно ароматического ядра
8.
2. Окисление первичных спиртов альдегидов и кетонов.Первичные спирты и альдегиды окисляются в карбоновые
кислоты:
3. Омыление (гидролиз) сложных эфиров
9.
Химические свойства1. Изменение окраски индикатора
Карбоновые кислоты являются слабыми электролитами, поэтому
растворимые карбоновые кислоты изменяют окраску
индикаторов (метилоранжа и лакмуса).
2. Взаимодействие с активными металлами с выделением
водорода
10.
3. Взаимодействие с основными и амфотерными оксидамиметаллов
4. Карбоновые кислоты реагируют с большинством
оснований. При взаимодействии карбоновых кислот с
основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
11.
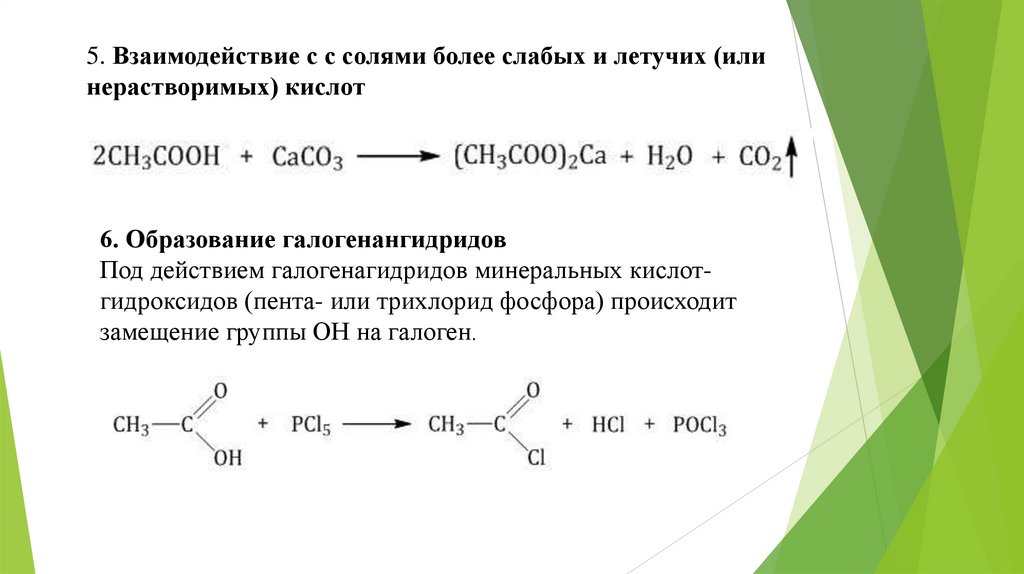
5. Взаимодействие с с солями более слабых и летучих (илинерастворимых) кислот
6. Образование галогенангидридов
Под действием галогенагидридов минеральных кислотгидроксидов (пента- или трихлорид фосфора) происходит
замещение группы ОН на галоген.
12.
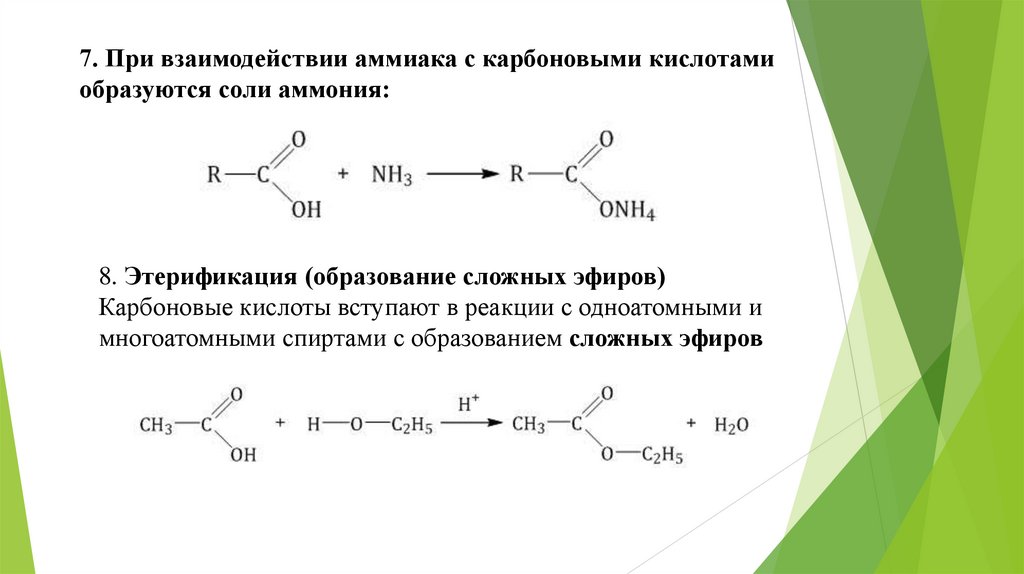
7. При взаимодействии аммиака с карбоновыми кислотамиобразуются соли аммония:
8. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и
многоатомными спиртами с образованием сложных эфиров
13.
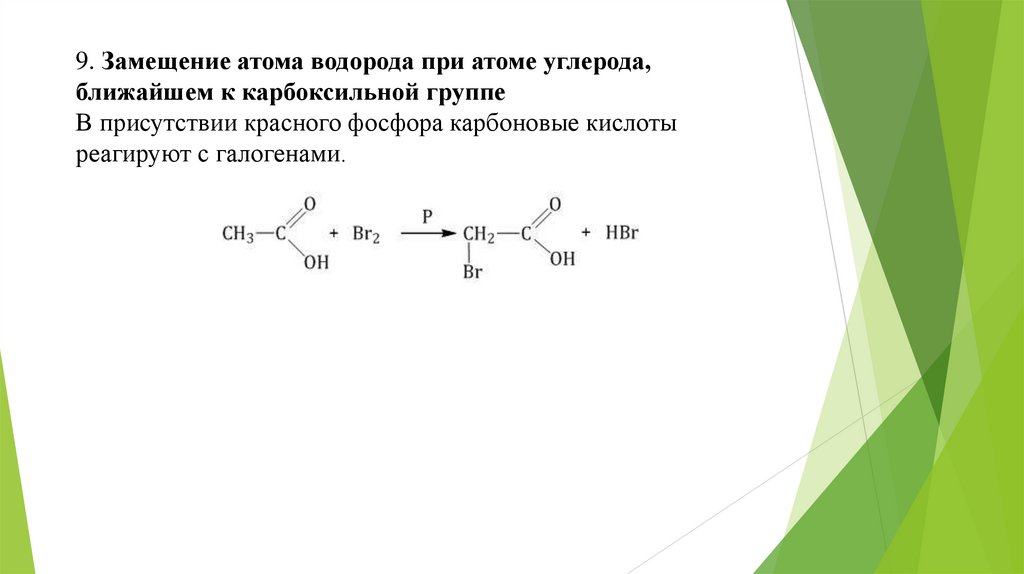
9. Замещение атома водорода при атоме углерода,ближайшем к карбоксильной группе
В присутствии красного фосфора карбоновые кислоты
реагируют с галогенами.







 Химия
Химия








