Похожие презентации:
Химия производных карбоновых кислот
1. Учебная презентация по теме: «Химия производных карбоновых кислот»
2. Составьте формулы веществ
• 2,3-диметилмасляная кислота• Бутен-3-овая кислота
• 3,3,4- триметил-2-этилгептановая кислота
• 2-метилпропеновая кислота (метакриловая
кислота)
• 2,3 – диметилвалериановая кислота
• о-гидроксибензойная кислота (салициловая
кислота)
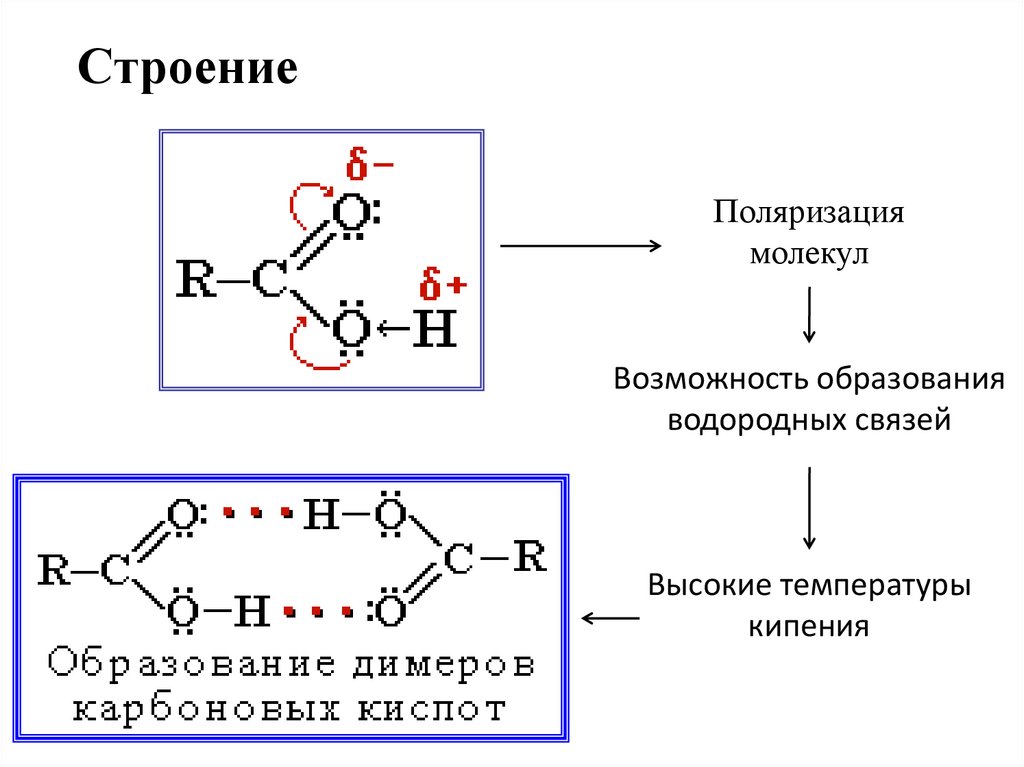
3. Строение
Поляризациямолекул
Возможность образования
водородных связей
Высокие температуры
кипения
4. Применение
Из всех карбоновых к-т уксусная к-та находитнаиболее широкое применение. К-ту и ее
производные широко используют в химической
промышленности для получения
искусственного волокна, пластических масс,
негорючей кинопленки, красителей,
медикаментов и т.д. Солями уксусной к-ты
протравливают ткани при крашении, они
способствуют закреплению красителей на
волокне. Ацетат свинца применяют для
изготовления свинцовых белил и свинцовых
примочек в медицине. В пищевой
промышленности уксусную к-ту применяют
для консервирования продуктов и в качестве
приправы. Ряд сложных эфиров уксусной к-ты
используют в кондитерском производстве.
5.
Сложные эфиры карбоновых кислот – этосоединения, образующиеся при взаимодействии
органических кислот со спиртами.
С n H 2 n O2
O
Систематическая номенклатура сложных эфиров
R1
С
O
O
Кислотная
часть
H3C
СН 2 С
O СН 2 CH3
радикал + алкан + оат:
этилпропаноат
Спиртовая
часть
R2
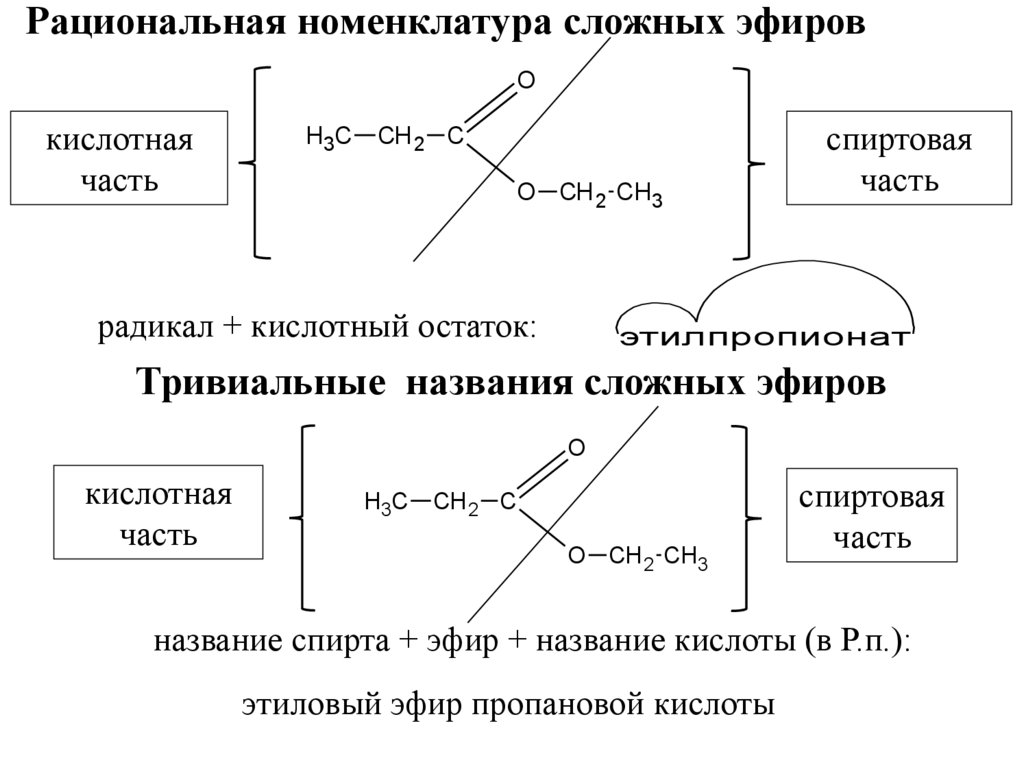
6. Рациональная номенклатура сложных эфиров
Oкислотная
часть
H3C
СН 2 С
O СН 2 CH3
радикал + кислотный остаток:
спиртовая
часть
этилпропионат
Тривиальные названия сложных эфиров
O
кислотная
часть
H3C
СН 2 С
O СН 2 CH3
спиртовая
часть
название спирта + эфир + название кислоты (в Р.п.):
этиловый эфир пропановой кислоты
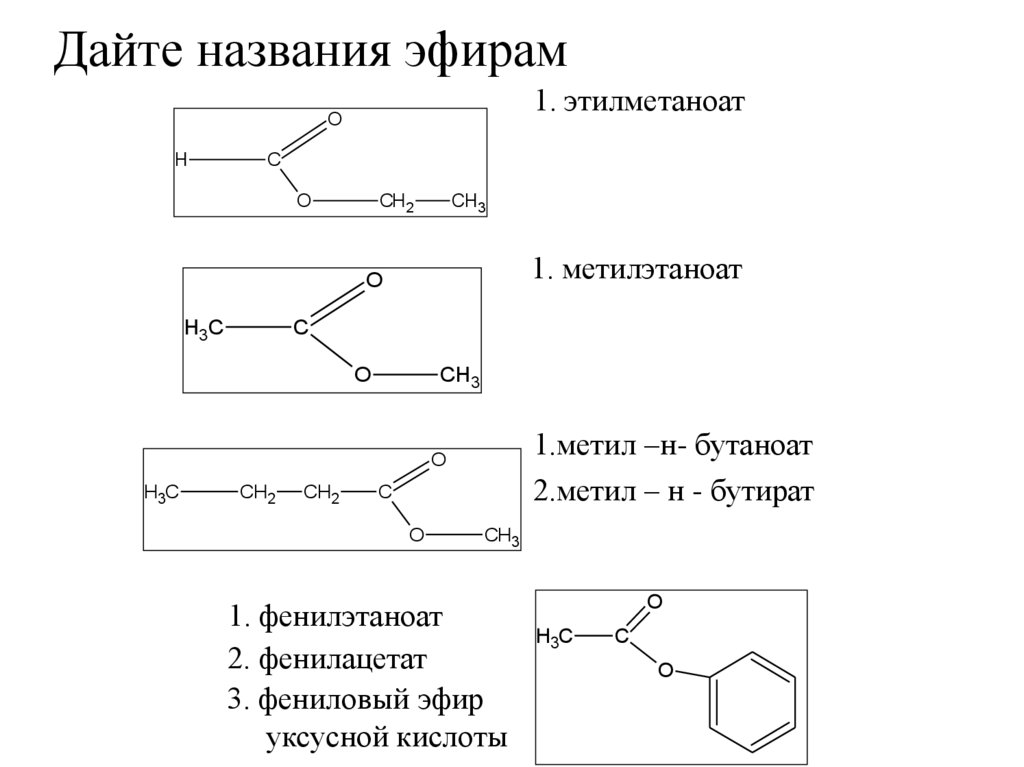
7. Дайте названия эфирам
1. этилметаноатO
H
С
СН 2
O
CH3
1. метилэтаноат
O
С
H3C
O
CH3
1.метил –н- бутаноат
2.метил – н - бутират
O
H3C
СН2
СН2
С
O
CH3
1. фенилэтаноат
2. фенилацетат
3. фениловый эфир
уксусной кислоты
O
H3C
С
O
8. Изомерия
• Изомерия углеродного скелета:O
O
CH3- C
CH3-C
O-CH2-CH2-CH3
пропилацетат
O-CH-CH3
изопропилацетат
CH3
• Изомерия положения функциональной группы:
O
C2H5-C
O
CH3-CH2-CH2-C
O-C2H5
метилбутират
O-CH3
этилпропионат
• Межклассовая изомерия (сложные эфиры изомерны
карбоновым кислотам)
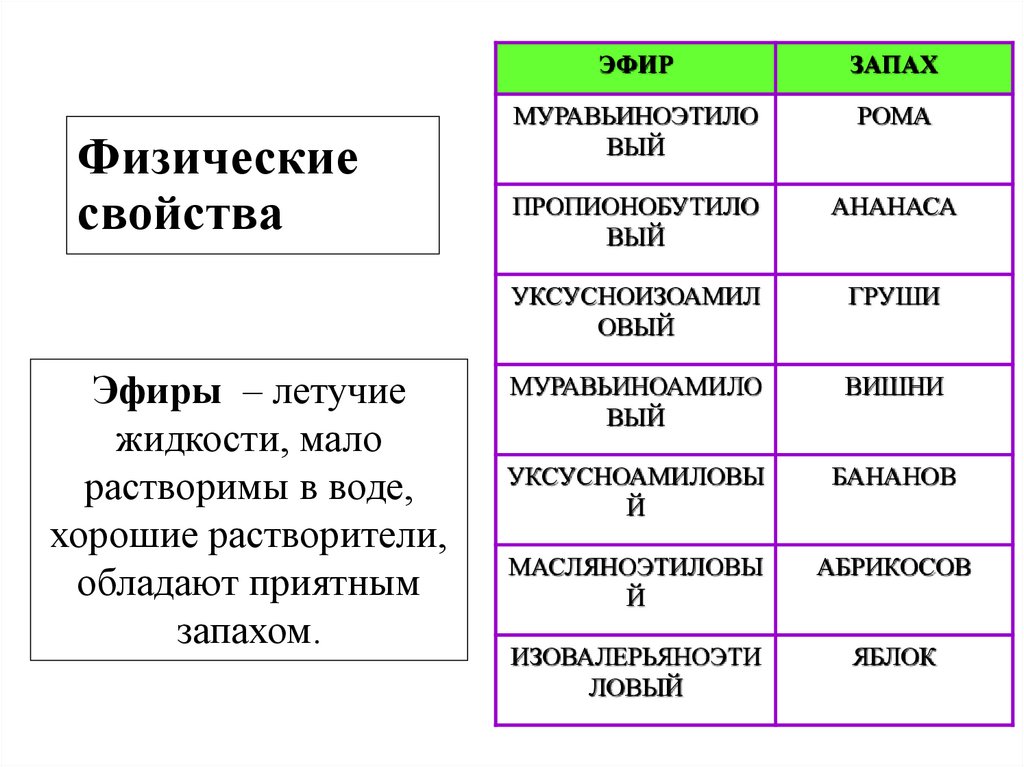
9. Физические свойства
Эфиры – летучиежидкости, мало
растворимы в воде,
хорошие растворители,
обладают приятным
запахом.
ЭФИР
ЗАПАХ
МУРАВЬИНОЭТИЛО
ВЫЙ
РОМА
ПРОПИОНОБУТИЛО
ВЫЙ
АНАНАСА
УКСУСНОИЗОАМИЛ
ОВЫЙ
ГРУШИ
МУРАВЬИНОАМИЛО
ВЫЙ
ВИШНИ
УКСУСНОАМИЛОВЫ
Й
БАНАНОВ
МАСЛЯНОЭТИЛОВЫ
Й
АБРИКОСОВ
ИЗОВАЛЕРЬЯНОЭТИ
ЛОВЫЙ
ЯБЛОК
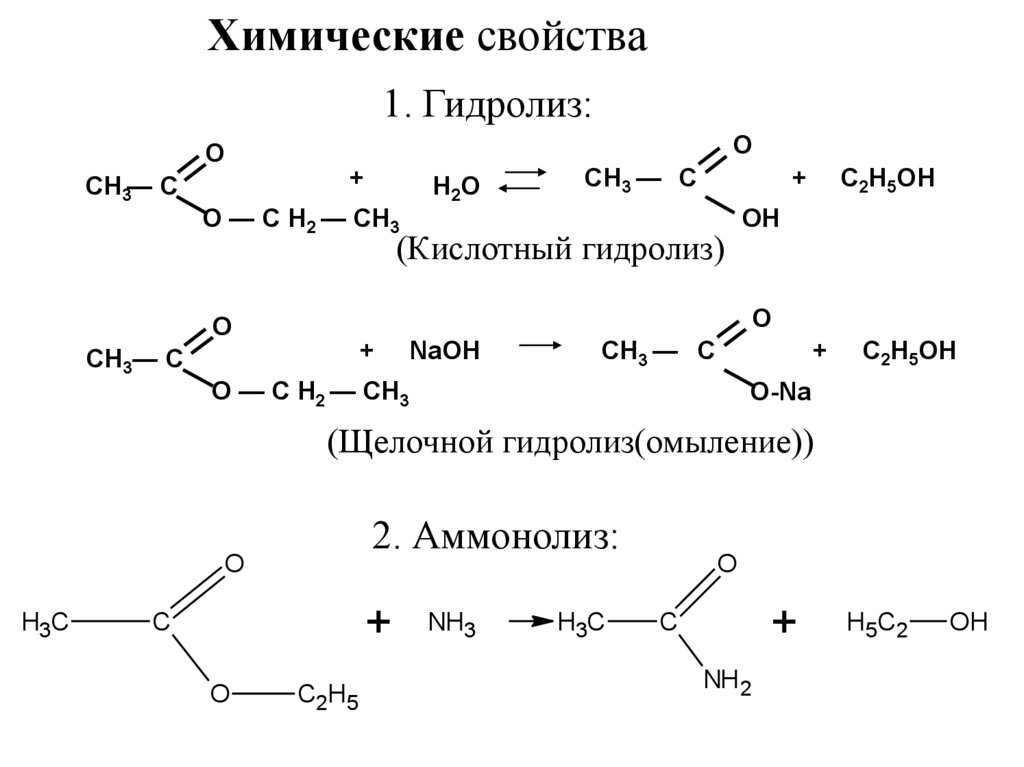
10. Химические свойства
1. Гидролиз:O
O
CH3— C
+
H2O
O — C H2 — CH3
CH3 — C
+
(Кислотный гидролиз)
OH
O
O
CH3— C
C2H5OH
+
NaOH
CH3 — C
+
O — C H2 — CH3
C2H5OH
O-Na
(Щелочной гидролиз(омыление))
2. Аммонолиз:
O
H3C
+
C
O
C2 H5
NH3
H3C
O
+
C
NH 2
H5 C 2
OH
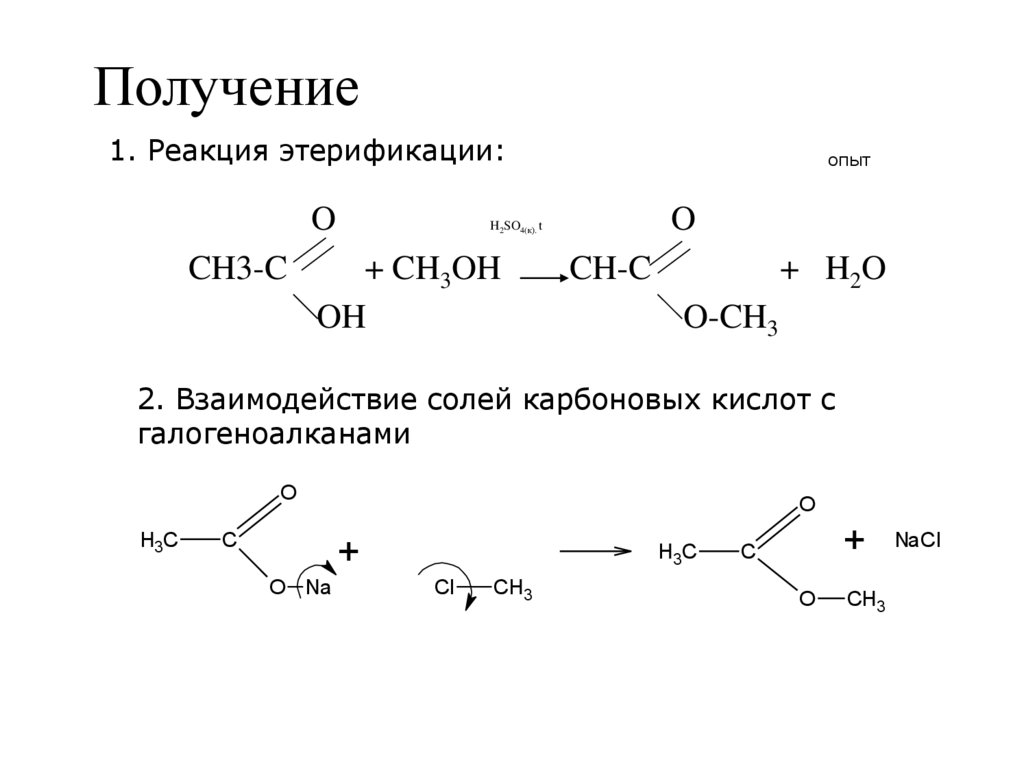
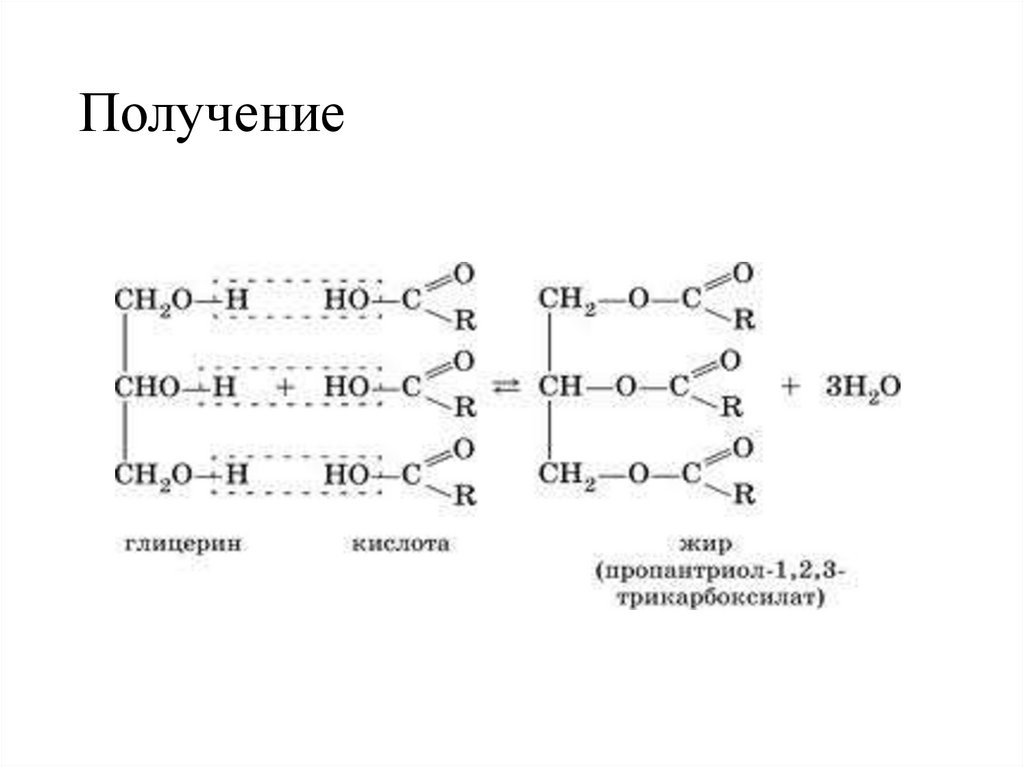
11. Получение
1. Реакция этерификации:O
CH3-C
опыт
O
H2SO4(к). t
+ CH3OH
OH
CH-C
+ H2 O
O-CH3
2. Взаимодействие солей карбоновых кислот с
галогеноалканами
O
H3C
С
O
+
O Na
H3C
Cl
CH3
+
С
O
CH3
NaCl
12.
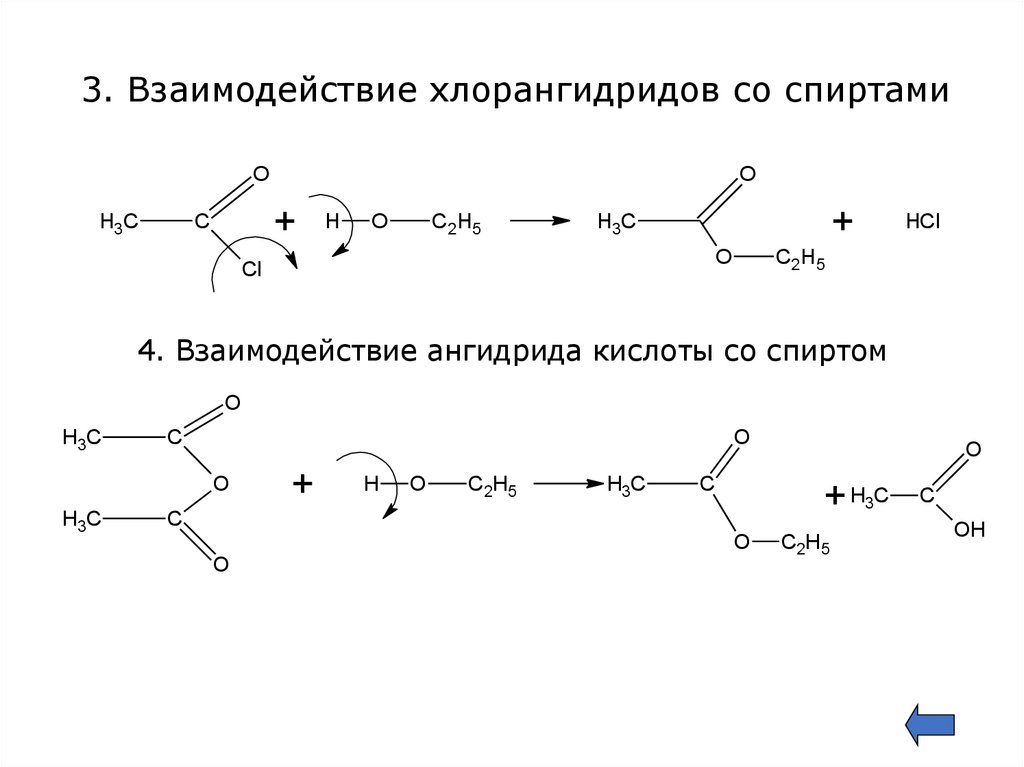
3. Взаимодействие хлорангидридов со спиртамиO
+
С
H3C
O
H
С 2 Н5
O
+
H3C
С 2 Н5
O
Cl
HCl
4. Взаимодействие ангидрида кислоты со спиртом
O
H3C
С
O
O
H3C
+
H
O
С2Н5
H3C
C
+ H3C
С
O
O
O
С2Н5
С
OH
13.
Применение сложных эфировСложные эфиры используются:
• Как растворители, пластификаторы, ароматизаторы (этилформиат,
изобутилформиат, бензилформиат, фенилэтилформиат, изоамилацетат, ноктилацетат, изоамилизовалерат)
• В пищевой промышленности (создание фруктовых эссенций)
• В парфюмерно-косметической промышленности (линалилацетат,
терпинилацетат, бензилацетат, метилсалицилат)
• В лекарственных препаратах (нитроглицерин)
• Как взрывчатое вещество (нитроглицерин, основа динамита)
• Политуры, смазки, пропиточные составы для бумаги и кожи (воски)
14.
•Жиры – это сложные эфирытрёхатомного спирта глицерина и
высших карбоновых кислот.
15. Номенклатура
По тривиальной номенклатуре глицеридыназывают, добавляя окончание -ид к сокращенному
названию кислоты и приставку, показывающую,
сколько гидроксильных групп в молекуле глицерина
проэтерифицировано
Тристеарат глицерина
(тристеарин)
16. Физические свойства
• Жиры не растворимы в воде• Плотность их меньше 1г/см3
• Если при комнатной температуре они имеют твердое агрегатное
состояние, то их называют жирами, а если жидкое, то – маслами.
• У жиров низкие температуры кипения.
17.
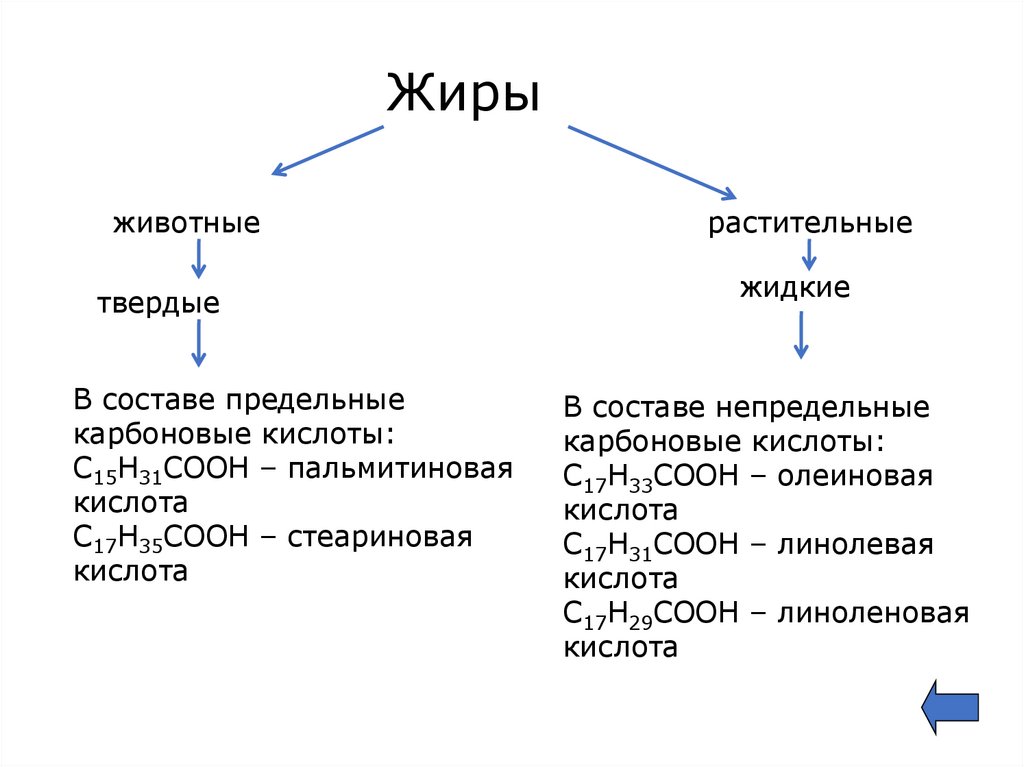
Жирыживотные
твердые
В составе предельные
карбоновые кислоты:
С15Н31СООН – пальмитиновая
кислота
С17Н35СООН – стеариновая
кислота
растительные
жидкие
В составе непредельные
карбоновые кислоты:
С17Н33СООН – олеиновая
кислота
С17Н31СООН – линолевая
кислота
С17Н29СООН – линоленовая
кислота
18. Химические свойства жиров:
1. Водный гидролиз:С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH
2. Щелочной гидролиз(омыление):
С3H5(COO)3-(C17H35)3 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
3. Гидрогенизация (гидрирование) жиров:
С3H5(COO)3-(C17H33)3 + 3H2 → C3H5(СОO)3C17H35
19. Применение
• Пищевая промышленность (в частности, кондитерская).• Фармацевтика
• Производство мыла и косметических изделий
• Производство смазочных материалов











 Химия
Химия








