Похожие презентации:
Карбоновые кислоты, альдегиды
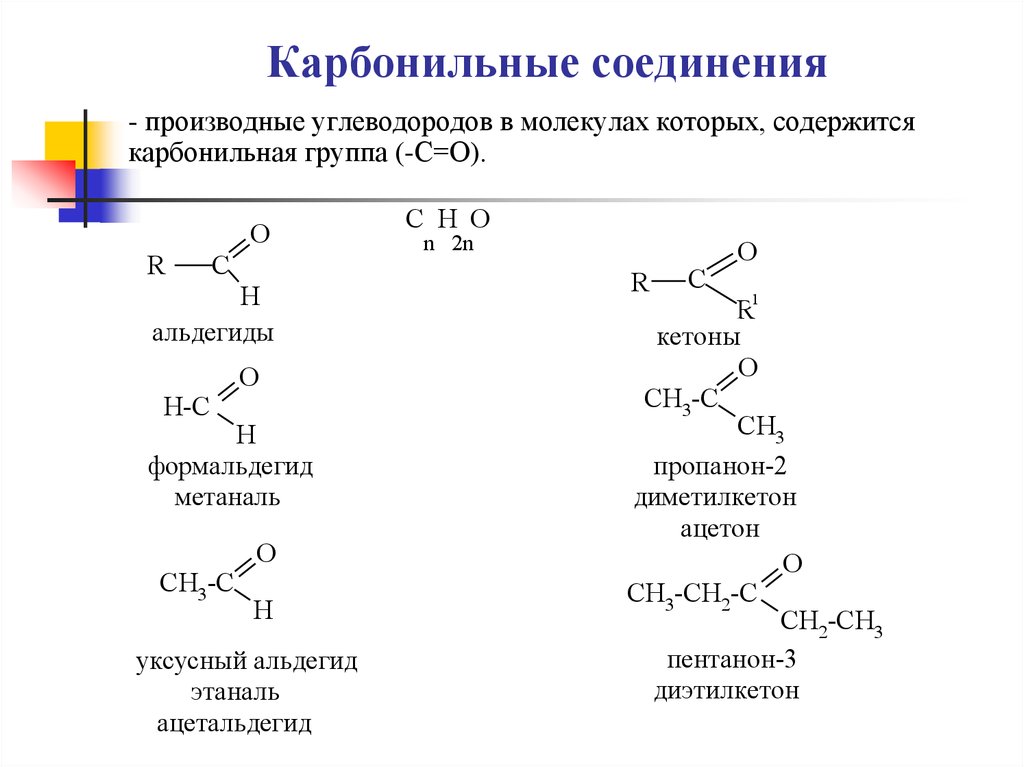
1. Карбонильные соединения
- производные углеводородов в молекулах которых, содержитсякарбонильная группа (-С=О).
O
R
C
H
альдегиды
H-C
O
H
формальдегид
метаналь
CH3-C
O
H
уксусный альдегид
этаналь
ацетальдегид
C H O
n 2n
R
C
O
1
R
кетоны
O
CH3-C
CH3
пропанон-2
диметилкетон
ацетон
O
CH3-CH2-C
CH2-CH3
пентанон-3
диэтилкетон
2.
Строение карбонильной группы-
OH
E
+
O
R-CH2-C
H
Nu-
Особенность строения карбонильной группы >C=O, заключается в
полярности связи между атомами С и О. Двойная связь карбонильной группы по
физическим свойствам близка к двойной связи между атомами С, но электронная
плотность распределена неравномерно, сдвинута к более электроотрицательному
атому О. В результате карбонильная группа приобретает повышенную реакционную
способность, что проявляется в разнообразных реакциях присоединения по двойной
связи.
Во всех случаях кетоны менее реакционноспособные, чем альдегиды,
наиболее активным является формальдегид Н2С=О.
3. Физические свойства
Муравьиный альдегид – в обычных условиях – газ,уксусный альдегид – летучая жидкость,
ацетон – жидкость,
остальные карбонильные соединения – жидкости и твердые вещества.
Все альдегиды и кетоны имеют характерные запахи.
Альдегиды, как правило, раздражают слизистые оболочки глаз и
дыхательных путей, вредно влияют на нервную систему.
Растворимость в воде:
формальдегид, ацетальдегид, ацетон – хорошо растворимы в воде,
с увеличением молекулярной массы растворимость уменьшается.
4.
Качественная реакция на альдегиды:а) окисление аммиачным раствором оксида серебра реакция серебряного зеркала
2 AgNO3 + 2NH4 OH
Ag 2 O
H-C
O
H
+ 4NH3 + H2 O
Ag2 O + 2NH4 NO3 + H2 O
+
[Ag(NH3)2] OH
+ 2 [Ag(NH3)2 OH]
H-C
O
H
+ 2Ag + 4NH3 + H2 O
б) окисление гидроксидом меди – реакция медного зеркала
O
CH3-C
+
2 Cu(OH)2
H
уксусный альдегид
O
t
CH3-C
+
OH
уксусная кислота
2 CuOH
желтый
Cu2O
красный
Кетоны не вступают в реакции окисления.
+ H2 O
H2 O
5.
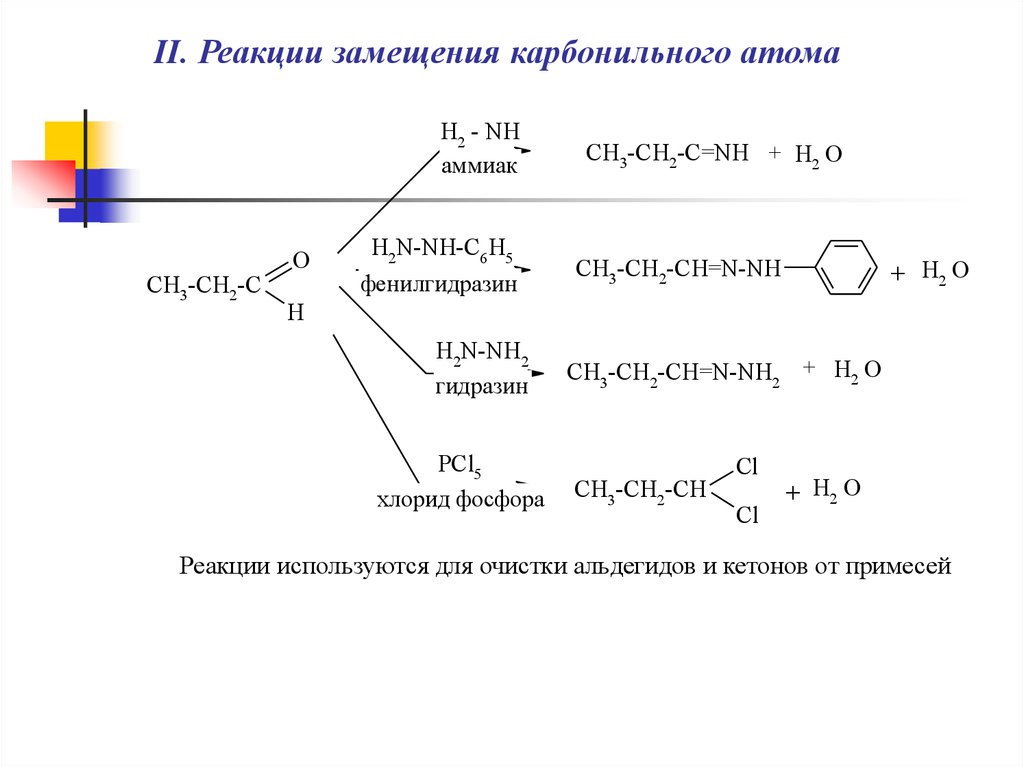
II. Реакции замещения карбонильного атомаH2 - NH
аммиак
CH3-CH2-C
O
H2N-NH-C6 H5
фенилгидразин
CH3-CH2-C=NH + H2 O
CH3-CH2-CH=N-NH
+ H2 O
H
H2N-NH2
гидразин
PCl5
хлорид фосфора
CH3-CH2-CH=N-NH2 + H2 O
CH3-CH2-CH
Cl
Cl
+ H2 O
Реакции используются для очистки альдегидов и кетонов от примесей
6.
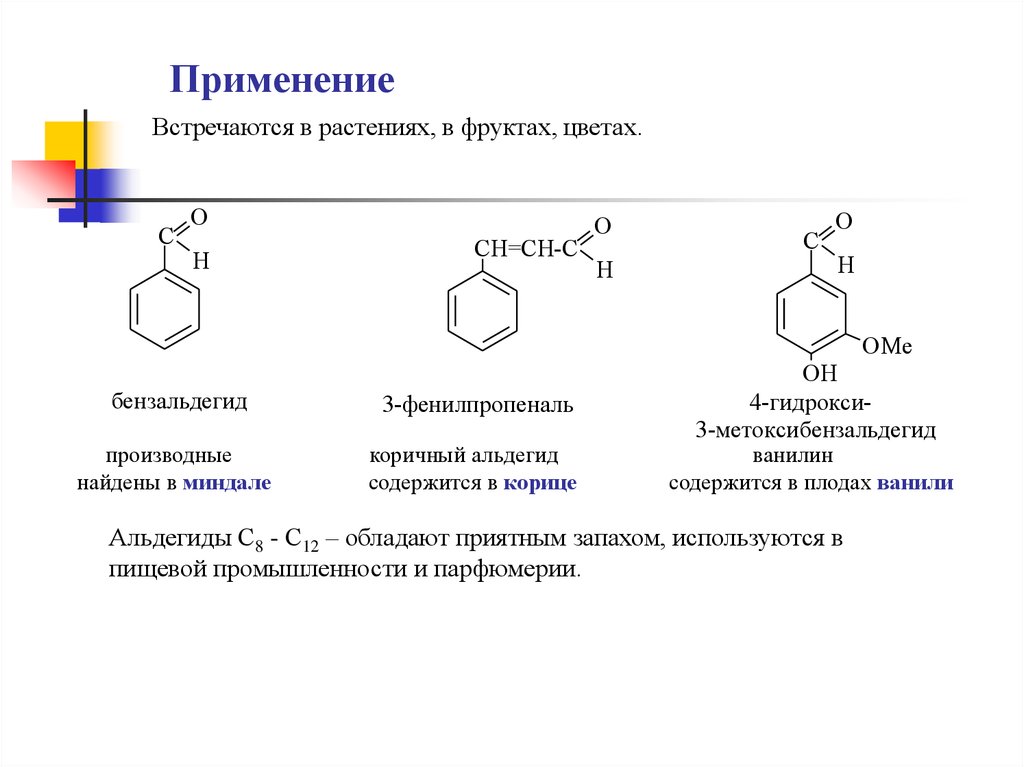
ПрименениеВстречаются в растениях, в фруктах, цветах.
C
O
H
CH=CH-C
O
H
C
O
H
OMe
бензальдегид
3-фенилпропеналь
производные
найдены в миндале
коричный альдегид
содержится в корице
OH
4-гидрокси3-метоксибензальдегид
ванилин
содержится в плодах ванили
Альдегиды С8 - С12 – обладают приятным запахом, используются в
пищевой промышленности и парфюмерии.
7.
Формальдегид НСНО используется:Водный раствор – формалин, для хранения анатомических препаратов;
В сельском хозяйстве для дезинфекции зерно- и овощехранилищ,
парников и теплиц, протравливания зерна;
В кожевенном производстве для обработки кожи;
В фармакологии – производство лекарственных препаратов (уротропин);
Ингибитор кислотной коррозии металлов;
В производстве синтетических материалов – полиформальдегид, фенолформальдегидные смолы, для изготовления электротехнических изделия,
предметы быта.
Ацетон СН3СОСН3 используется:
• растворитель многих органических веществ;
• в производстве ацетатного шелка;
• в производстве фото- и кинопленки;
• входит в состав небьющегося органического стекла.
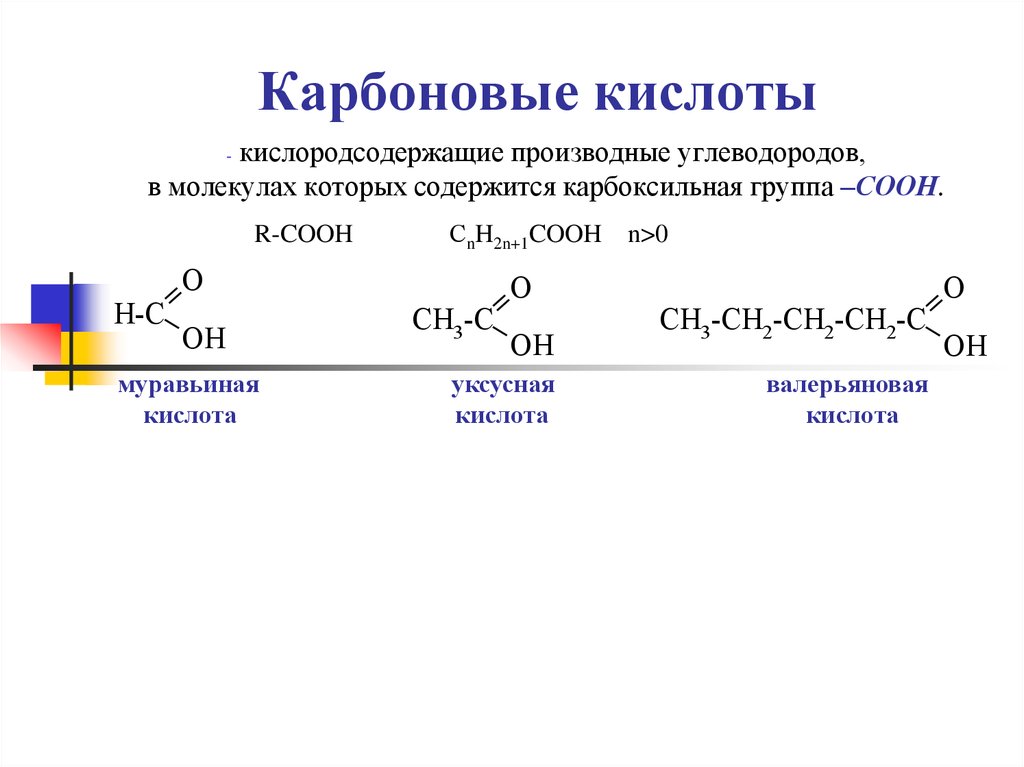
8. Карбоновые кислоты
кислородсодержащие производные углеводородов,в молекулах которых содержится карбоксильная группа –СООН.
-
R-COOH
СnH2n+1COOH
O
H-C
OH
муравьиная
кислота
CH3-C
O
OH
уксусная
кислота
n>0
CH3-CH2-CH2-CH2-C
валерьяновая
кислота
O
OH
9.
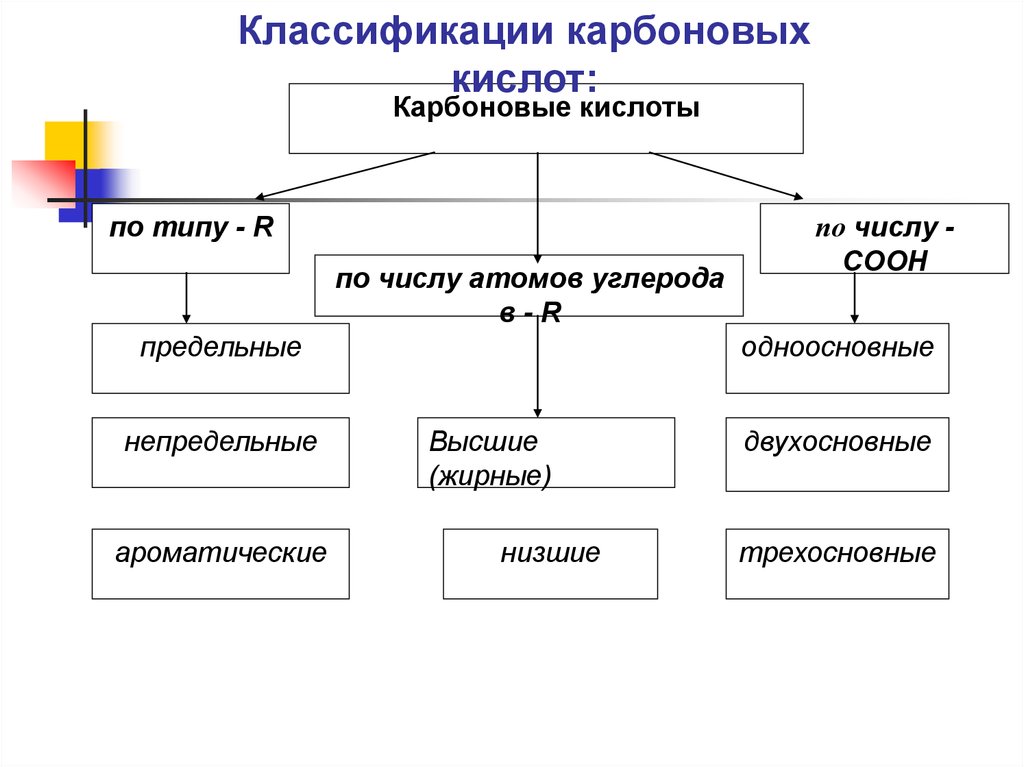
Классификации карбоновыхкислот:
Карбоновые кислоты
по типу - R
по числу атомов углерода
в-R
предельные
непредельные
ароматические
по числу COOH
одноосновные
Высшие
(жирные)
низшие
двухосновные
трехосновные
10.
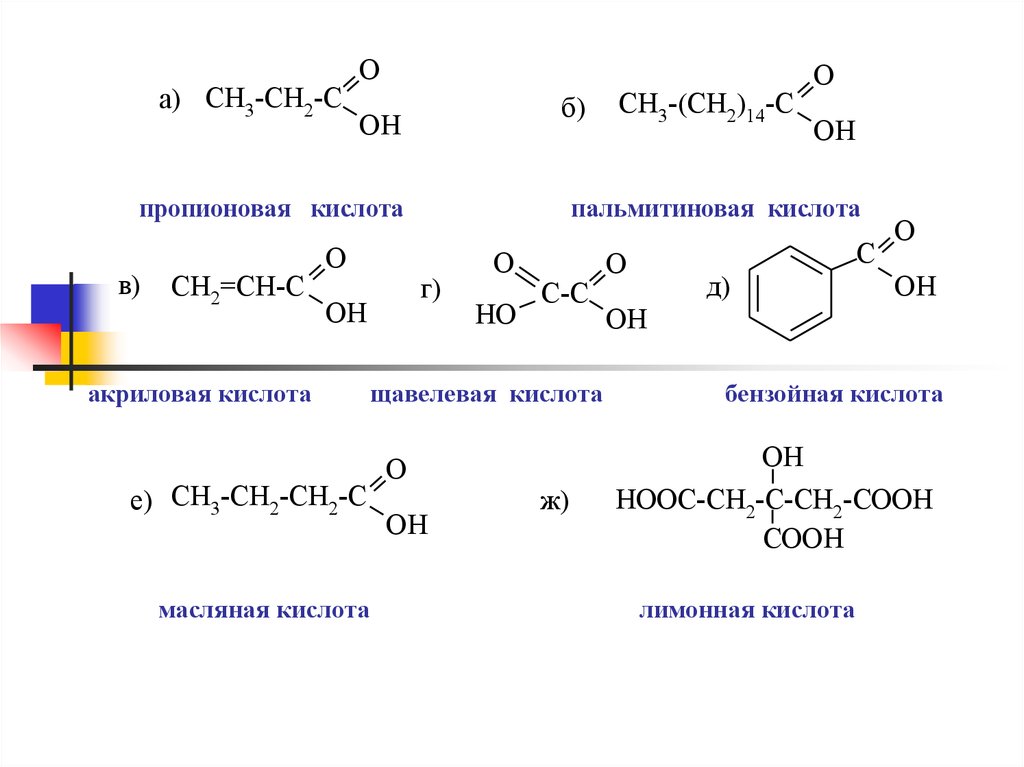
а) CH3-CH2-CO
б)
OH
пропионовая кислота
в)
CH2=CH-C
O
акриловая кислота
е) CH3-CH2-CH2-C
масляная кислота
OH
пальмитиновая кислота
г)
OH
CH3-(CH2)14-C
O
O
HO
C-C
щавелевая кислота
O
OH
ж)
C
O
д)
O
OH
OH
бензойная кислота
OH
HOOC-CH2-C-CH2-COOH
COOH
лимонная кислота
11. Название по систематической (международной) номенклатуре:
1. Выбираем главную цепь, в которой находиться карбоксильная группа.2. Нумеруем эту цепь, начиная от функциональной группы.
3. Перечисляем радикалы в алфавитном порядке, указывая цифрой
их местоположение в главной цепи.
4. При наличии кратных связей, добавляем суффикс –ен, указываем
цифрой положение в главной цепи.
5. Записываем название соединения, заканчивая окончанием –овая кислота.
O
CH2-CH2-CH=CH-CH-C
OH
CH3
6
5
4
3
2
1
2-метил-6-фенилгексен-3-овая кислота
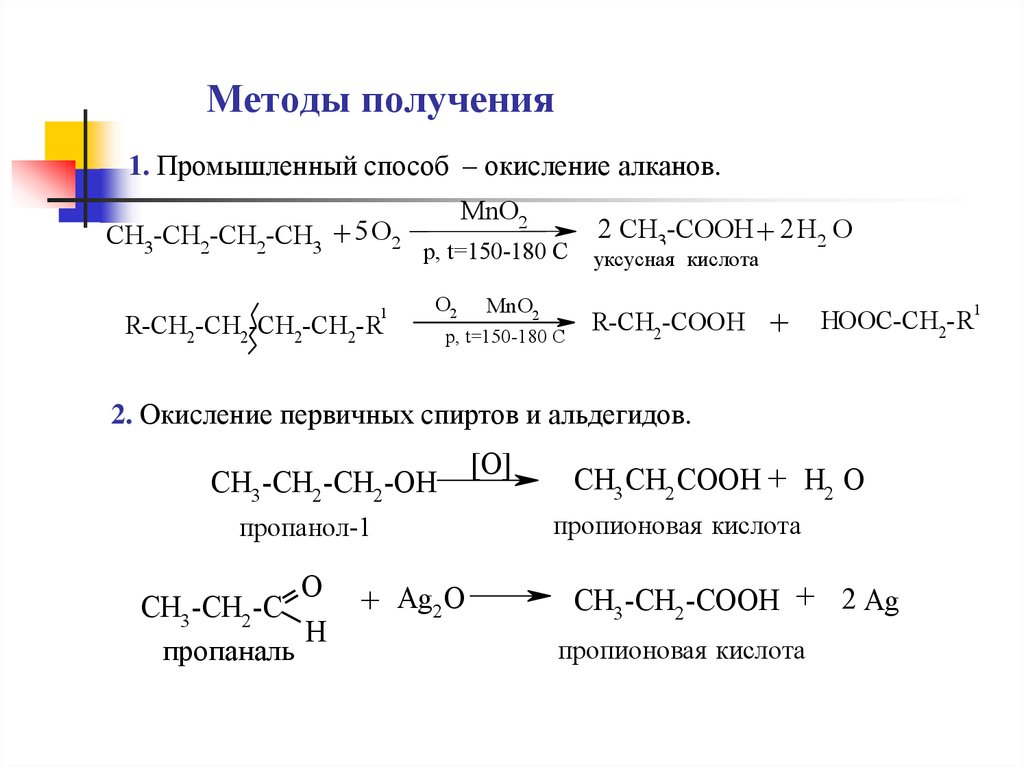
12. Методы получения
1. Промышленный способ – окисление алканов.CH3-CH2-CH2-CH3 + 5 O2
1
R-CH2-CH2-CH2-CH2-R
MnO2
p, t=150-180 C
O2
MnO2
p, t=150-180 C
2 CH3-COOH + 2 H2 O
уксусная кислота
R-CH2-COOH
+
2. Окисление первичных спиртов и альдегидов.
CH3 -CH2 -CH2 -OH
пропанол-1
O
CH3 -CH2 -C
H
пропаналь
+ Ag2 O
[O]
CH3 CH2 COOH + H2 O
пропионовая кислота
CH3 -CH2 -COOH + 2 Ag
пропионовая кислота
1
HOOC-CH2-R
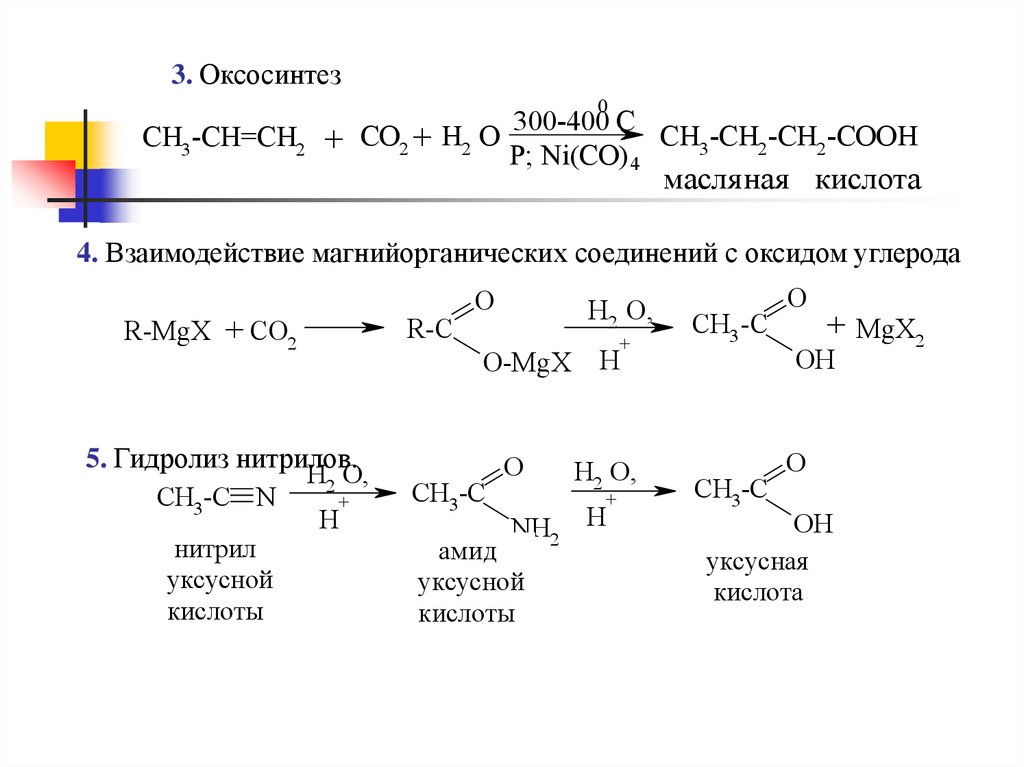
13.
3. Оксосинтез0
300-400 C
CH3-CH2-CH2-COOH
CH3-CH=CH2 + CO2 + H2 O
P; Ni(CO) 4
масля ная кислота
4. Взаимодействие магнийорганических соединений с оксидом углерода
R-MgX + CO2
5. Гидролиз нитрилов.
H2 O,
CH3-C N
+
H
нитрил
уксусной
кислоты
R-C
O
H2 O,
O-MgX
CH3-C
O
+
H
H2 O,
+
NH2
амид
уксусной
кислоты
H
CH3 -C
CH3-C
O
+ MgX2
OH
O
OH
уксусная
кислота
14.
Физические свойства уксусной кислоты:Агрегатное состояние жидкое
Цвет бесцветная прозрачная жидкость
Запах резкий уксусный
Растворимость в воде хорошая
Температура кипения 1180С
Температура плавления 170С
Зависимость физических свойств карбоновых кислот от строения молекулы:
Низшие карбоновые кислоты – жидкости; высшие – твердые вещества
Чем больше относительная молекулярная масса кислоты, тем меньше ее запах.
С увеличением относительной молекулярной массы кислоты растворимость
уменьшается
Чем больше относительная масса кислоты, тем выше температура кипения
Температура кипения кислот с нормальным строением углеродного радикала
выше, чем температура кипения кислот изомерного строения.
15. Химические свойства
Карбоновые кислоты обладают большей кислотностью, чем спирты,но являются более слабыми, чем минеральные кислоты.
1. Образование солей, при взаимодействии с металлами, их оксидами и
гидроксидами, карбонатами и гидрокарбонатами.
2 CH3 COOH + Mg
CH3 CH2 COOH + NaOH
2 CH3 COOH + MgO
2CH3 COOH + Na2 CO3
(CH3 COO)2 Mg + H 2
CH3 CH2 COONa + H2 O
пропиноат натрия
(CH3 COO)2 Mg + H2 O
ацетат магния
2 CH3 COONa + CO2 + H2 O
16.
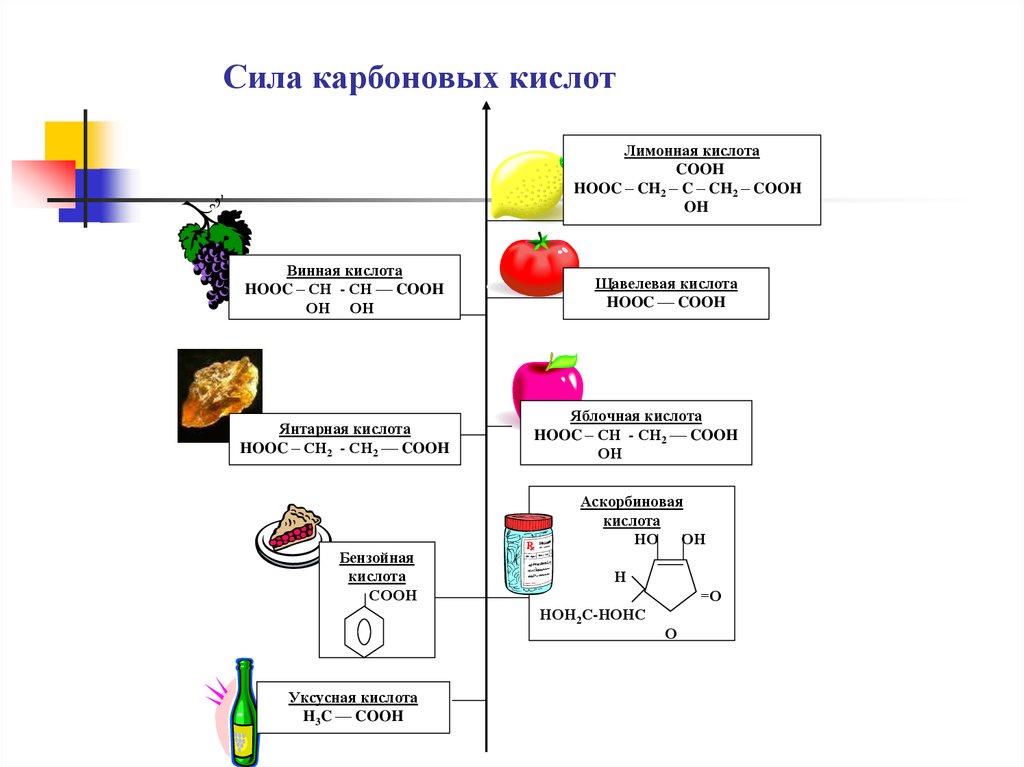
Сила карбоновых кислотЛимонная кислота
COOH
HOOC – CH2 – C – CH2 – COOH
OH
Винная кислота
HOOC – СН - СН –– COOH
ОН ОН
Янтарная кислота
HOOC – СН2 - СН2 –– COOH
Щавелевая кислота
HOOC –– COOH
Яблочная кислота
HOOC – СН - СН2 –– COOH
ОН
Аскорбиновая
кислота
НО ОН
Бензойная
кислота
СООН
Н
=О
НОН2С-НОНС
Уксусная кислота
H3C –– COOH
О
17.
2. Взаимодействие с солями более слабых кислот.Уксусная кислота вытесняет стеариновую из стеарата натрия и угольную
из карбоната калия.
CH3COOH + C17 H35COONa
CH3COONa + C17 H35COOH
2 CH3COOH + K2CO3
2 СH3COOK + H2 O + CO2
3. Реакция этерификации – взаимодействие карбоновых кислот со спиртами,
с образованием сложных эфиров.
CH3 -C
O
+
OH
уксусная к-та
CH3 -CH2 -C
O
H
+ HO-CH3
метиловый спирт
+
+ Cl-CH3
ONa
H
CH3-C
O
+ H2 O
O-CH3
метиловый эфир
уксусной к-ты
CH3 -CH2 -C
O
+ NaCl
O-CH3
18.
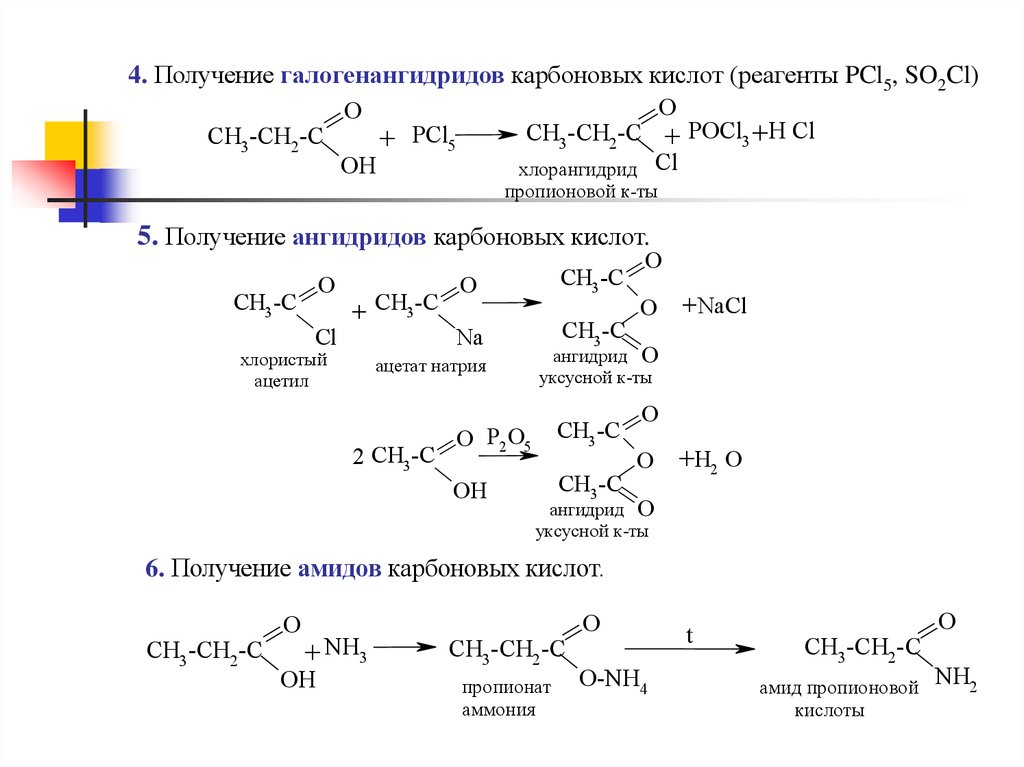
4. Получение галогенангидридов карбоновых кислот (реагенты PCl5, SO2Cl)O
O
CH3 -CH2 -C + POCl3 +H Cl
CH3 -CH2 -C
+ PCl5
OH
хлорангидрид Cl
пропионовой к-ты
5. Получение ангидридов карбоновых кислот.
O
CH3 -C
Cl
+ CH3 -C
хлористый
ацетил
O
CH3 -C
Na
CH3 -C
ацетат натрия
2 CH3 -C
O
O
+ NaCl
ангидрид O
уксусной к-ты
O P2 O5
CH3 -C
OH
CH3 -C
O
O
+H2 O
ангидрид O
уксусной к-ты
6. Получение амидов карбоновых кислот.
CH3 -CH2 -C
O
+ NH3
OH
CH3 -CH2 -C
пропионат
аммония
O
O-NH4
t
CH3 -CH2 -C
амид пропионовой
кислоты
O
NH2
19.
III. Индивидуальные свойства карбоновых кислот.7. Окисление муравьиной кислоты, в условиях реакции серебряного зеркала.
8. Полимеризация непредельных кислот.
9. Разложение при нагревании двухосновных кислот.
10. Качественная реакции на наличие непредельных свойств кислот –
окисление или бромирование в мягких условиях,
сопровождающиеся обесцвечиванием раствора.
20.
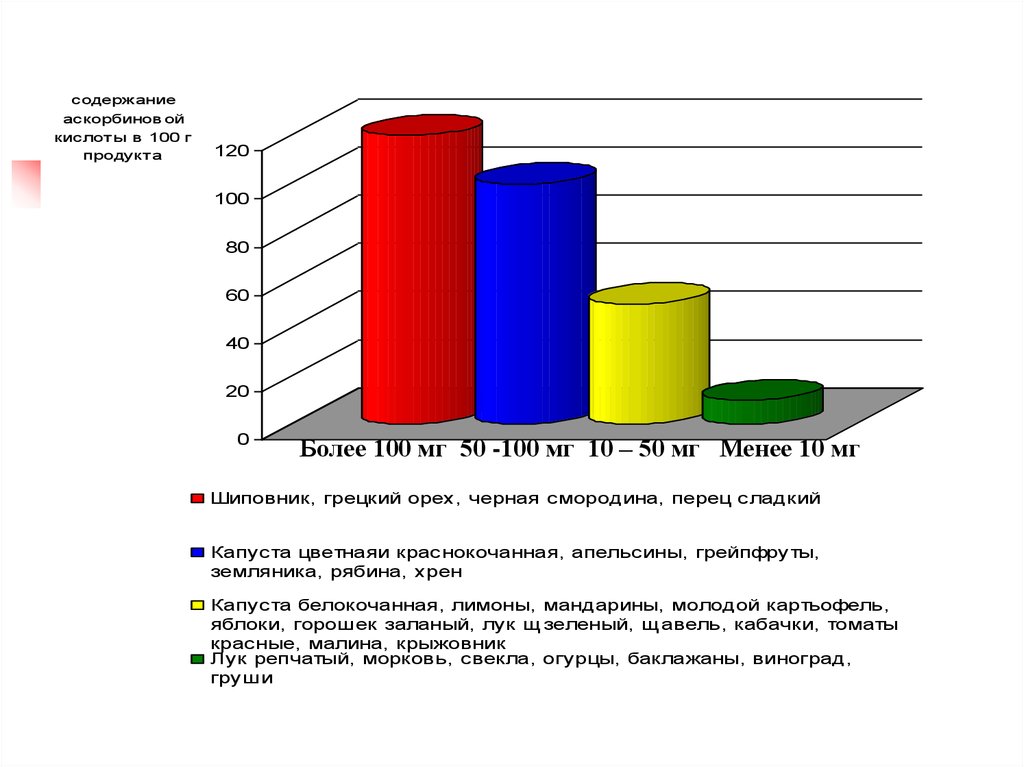
содержаниеаскорбинов ой
кислот ы в 100 г
продукт а
120
100
80
60
40
20
0
Более 100 мг 50 -100 мг 10 – 50 мг Менее 10 мг
Шиповник, грецкий орех, черная смородина, перец сладкий
Капуста цветнаяи краснокочанная, апельсины, грейпфруты,
земляника, рябина, хрен
Капуста белокочанная, лимоны, мандарины, молодой картьофель,
яблоки, горошек заланый, лук щ зеленый, щ авель, кабачки, томаты
красные, малина, крыжовник
Лук репчатый, морковь, свекла, огурцы, баклажаны, виноград,
груши
21.
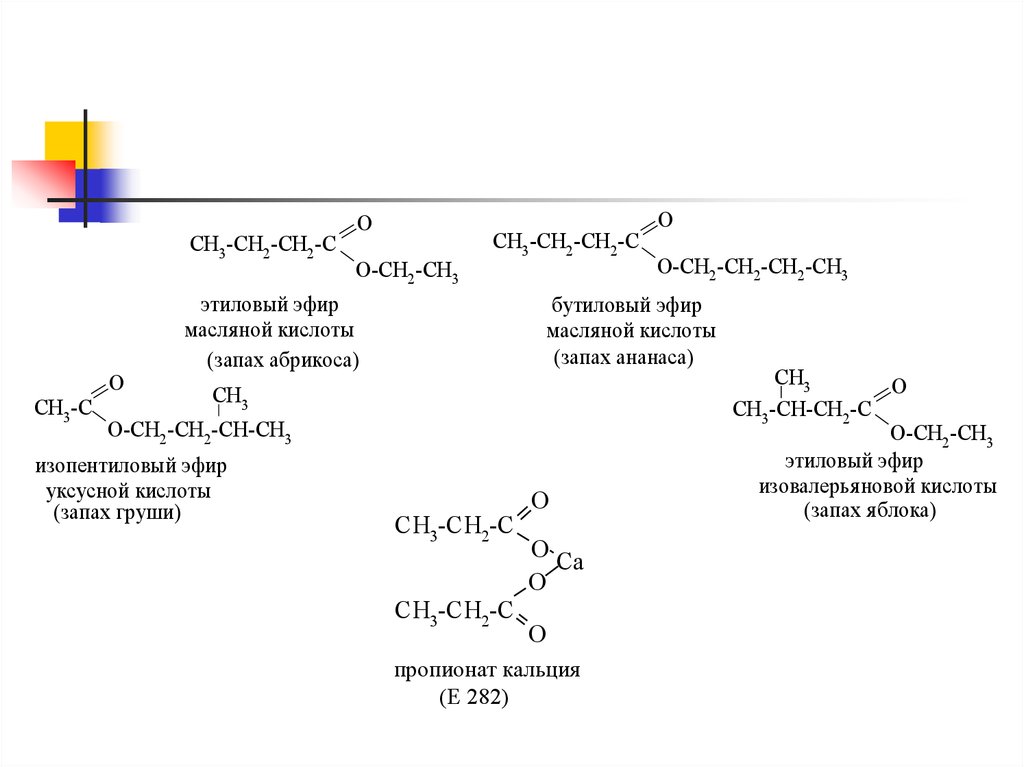
CH3 -CH2 -CH2 -CCH3 -C
O
O
O-CH2 -CH3
CH3 -CH2 -CH2 -C
этиловый эфир
масля ной кислоты
(запах абрикоса)
O-CH2 -CH2 -CH2 -CH3
бутиловый эфир
масля ной кислоты
(запах ананаса)
CH3
O-CH2 -CH2 -CH-CH3
изопентиловый эфир
уксусной кислоты
(запах груши)
O
CH3-CH2-C
CH3-CH2-C
O
O Ca
O
O
пропионат кальция
(Е 282)
CH3
O
CH3 -CH-CH2 -C
O-CH2 -CH3
этиловый эфир
изовалерья новой кислоты
(запах я блока)









 Химия
Химия








