Похожие презентации:
Изомерия органических соединений
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
ИЗОМЕРИЯ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
1. Структурная изомерия, ее виды
2. Пространственная изомерия, ее виды.
Энантиомерия. σ-Диастереомерия.
π-Диастереомерия. Конформационная изомерия
Составитель: доктор биологических наук, профессор,
зав. кафедрой химии Ирина Петровна Степанова
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о видах
изомерии органических соединений.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний, развить
логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию
у обучающихся устойчивого интереса к изучению
дисциплины.
3.
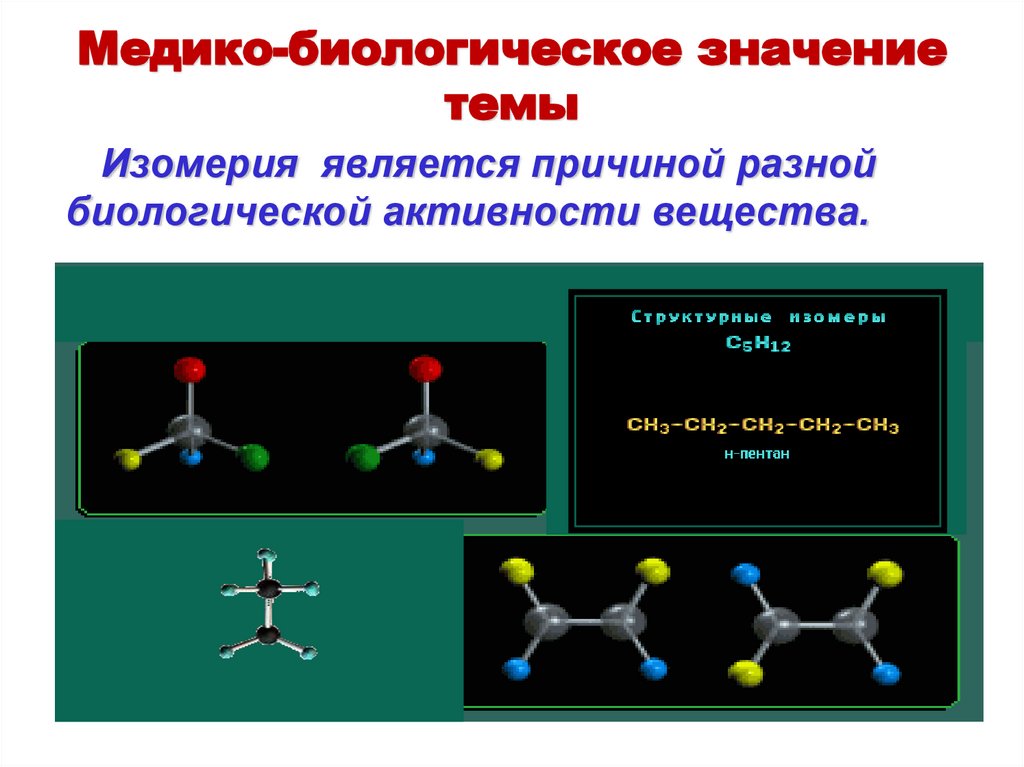
Медико-биологическое значениетемы
Изомерия является причиной разной
биологической активности вещества.
4.
Медико-биологическое значениетемы
Только
определенные
изомеры
проявляют биологическую активность,
которая может исчезнуть в процессе
изомеризации,
что
вызывает
патологические изменения в организме
человека.
5.
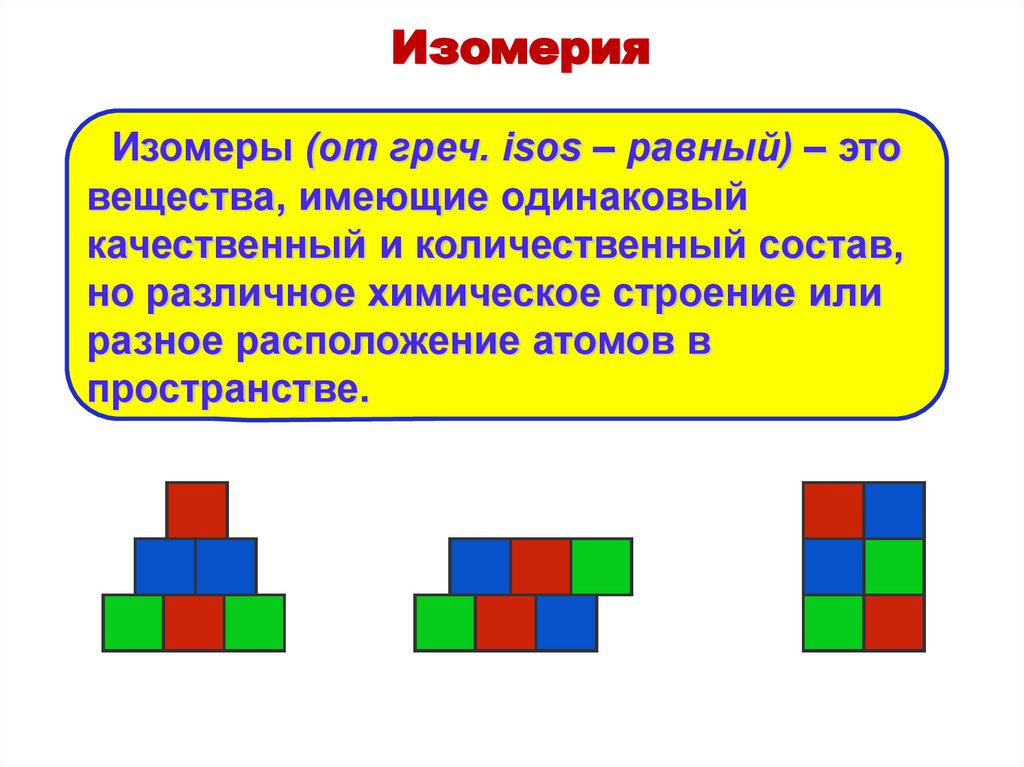
ИзомерияИзомеры (от греч. isos – равный) – это
вещества, имеющие одинаковый
качественный и количественный состав,
но различное химическое строение или
разное расположение атомов в
пространстве.
6.
ИзомерияСтруктурная
Пространственная
(стерео)
7.
Структурная изомерияСтруктурные изомеры отличаются друг
от друга химическим строением и,
следовательно,
обладают
разными
химическими свойствами.
8.
Структурная изомерияРазличают виды структурной изомерии:
• Изомерия углеродного скелета
• Изомерия положения кратной связи
• Изомерия положения функциональных
групп
• Изомерия функциональной
принадлежности (межклассовая изомерия)
• Валентная изомерия
9.
Изомерия углеродного скелетаАлканы: этан (CH3CH3)
H H
H C C H
H H
этан
C2H6
Структурных
изомеров нет
10.
Изомерия углеродного скелетаАлканы: пропан C3H8, (CH3CH2CH3)
H H
H C C H
H H
этан
пропан
C23H68
H
C H
H
11.
Изомерия углеродного скелетаАлканы: пропан C3H8, (CH3CH2CH3)
H H H
H C C C H
H H H
пропан Структурных
C3H8
изомеров
нет
12.
Изомерия углеродного скелетаАлканы: бутан C4H10, CH3CH2CH2CH3
H
C H
H
H
C H
или
H
H H H
H C C C H
H H H
пропан
C3H8
13.
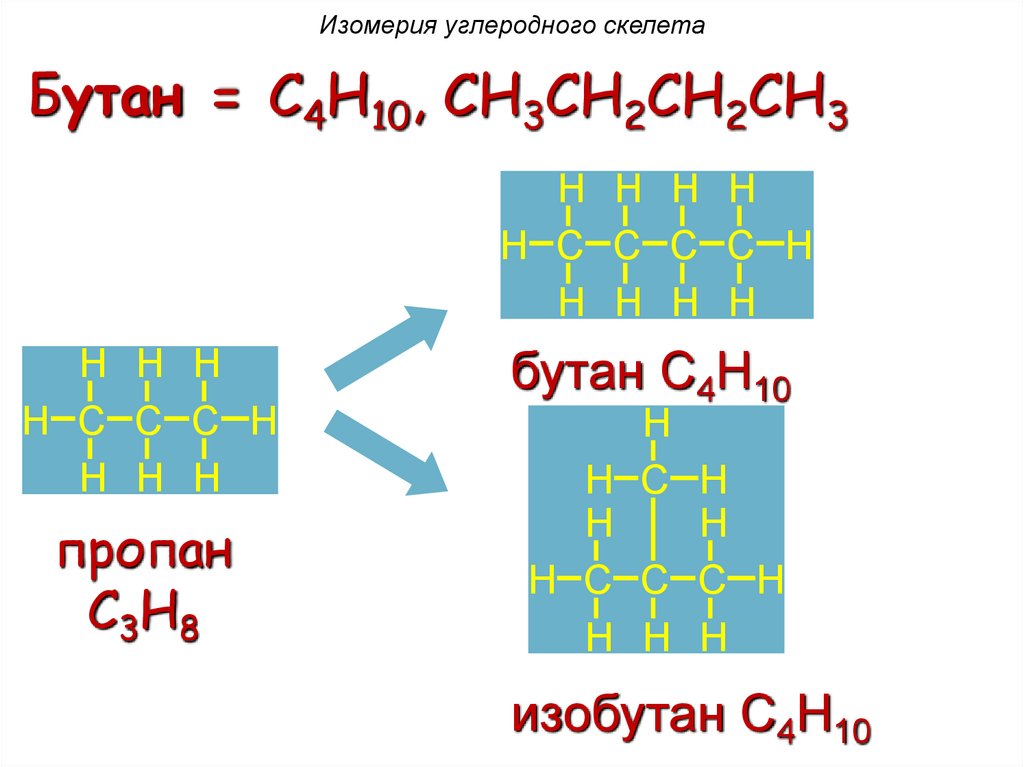
Изомерия углеродного скелетаБутан = C4H10, CH3CH2CH2CH3
H H H H
H C C C C H
H H H H
H H H
H C C C H
H H H
пропан
C3H8
бутан C4H10
H
H C H
H
H
H C C C H
H H H
изобутан C4H10
14.
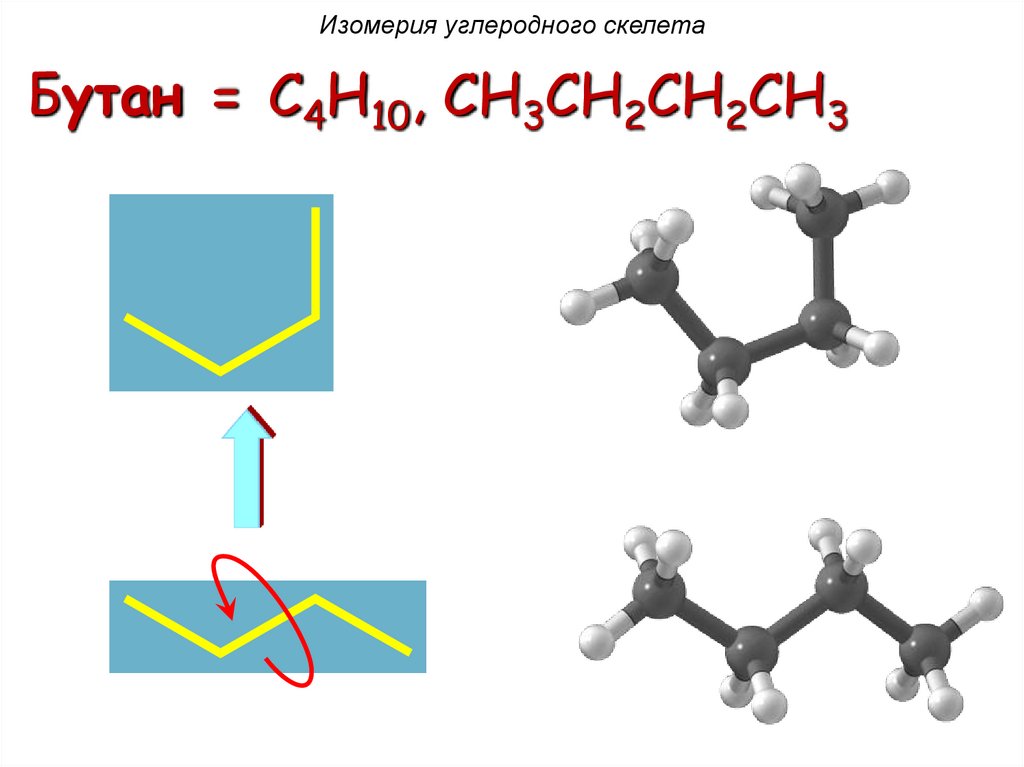
Изомерия углеродного скелетаБутан = C4H10, CH3CH2CH2CH3
H H H H
H C C C C H
H H H H
H HH H
H
H
HH H H
15.
Изомерия углеродного скелетаБутан = C4H10, CH3CH2CH2CH3
16.
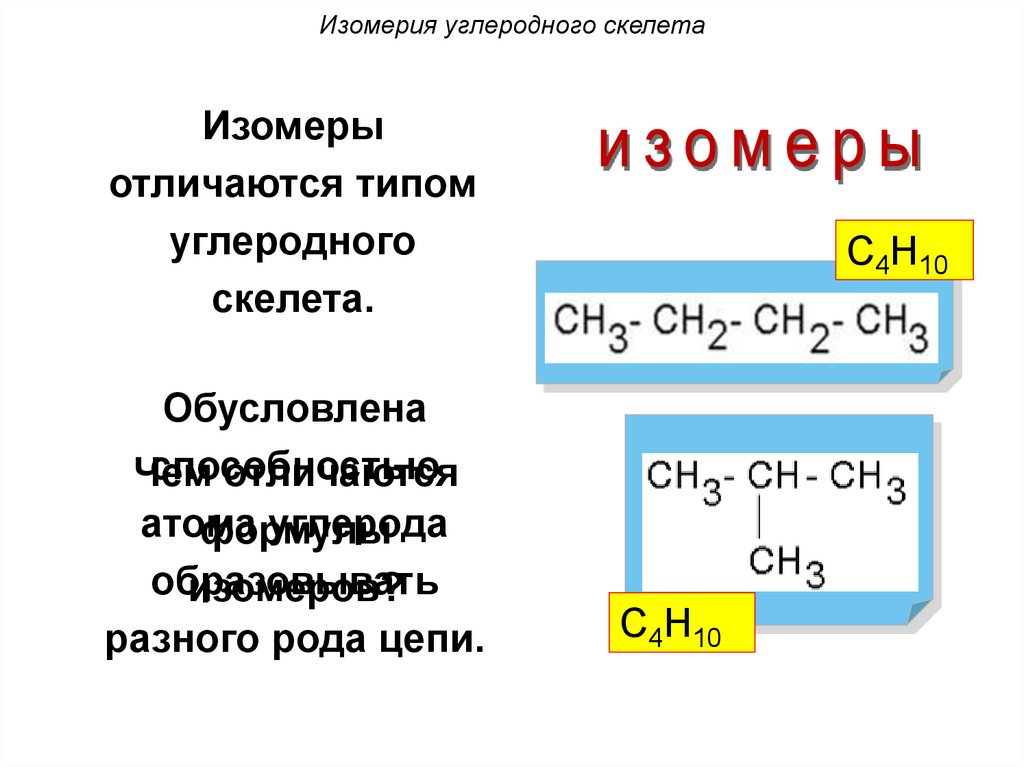
Изомерия углеродного скелетаИзомеры
отличаются типом
углеродного
скелета.
Обусловлена
способностью
Чем
отличаются
атома
углерода
формулы
образовывать
изомеров?
разного рода цепи.
С4Н10
С4Н10
17.
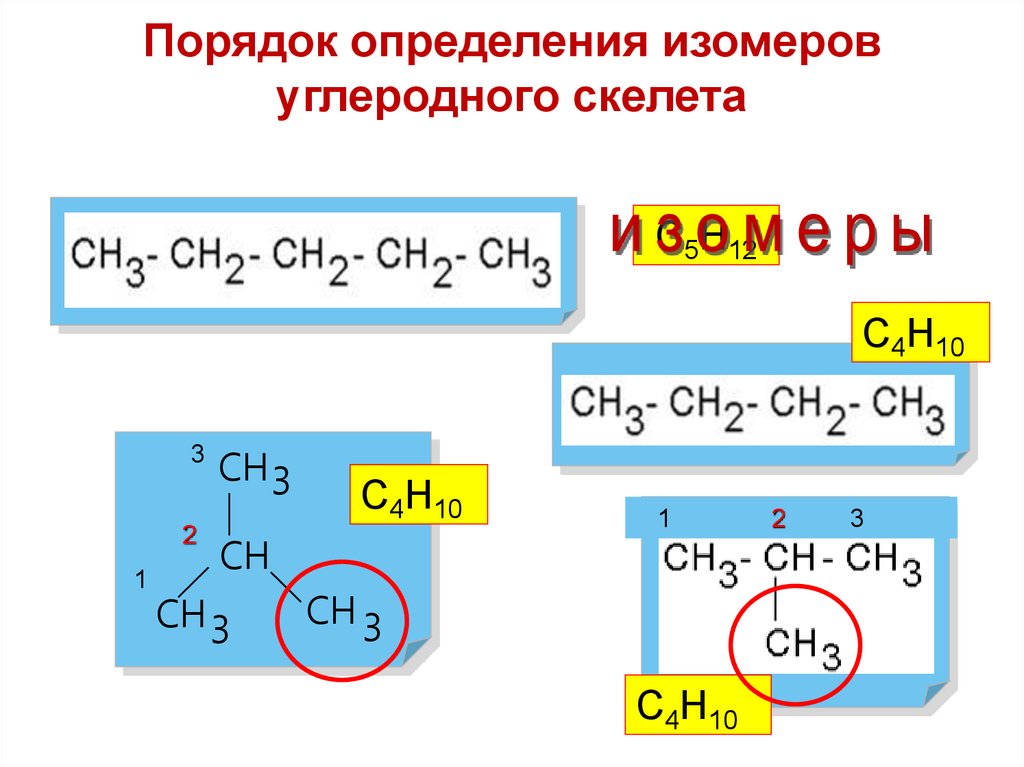
Порядок определения изомеровуглеродного скелета
С5Н12
С4Н10
3
2
1
СН3
С4Н10
СН
СН 3
1
СН 3
С4Н10
2
3
18.
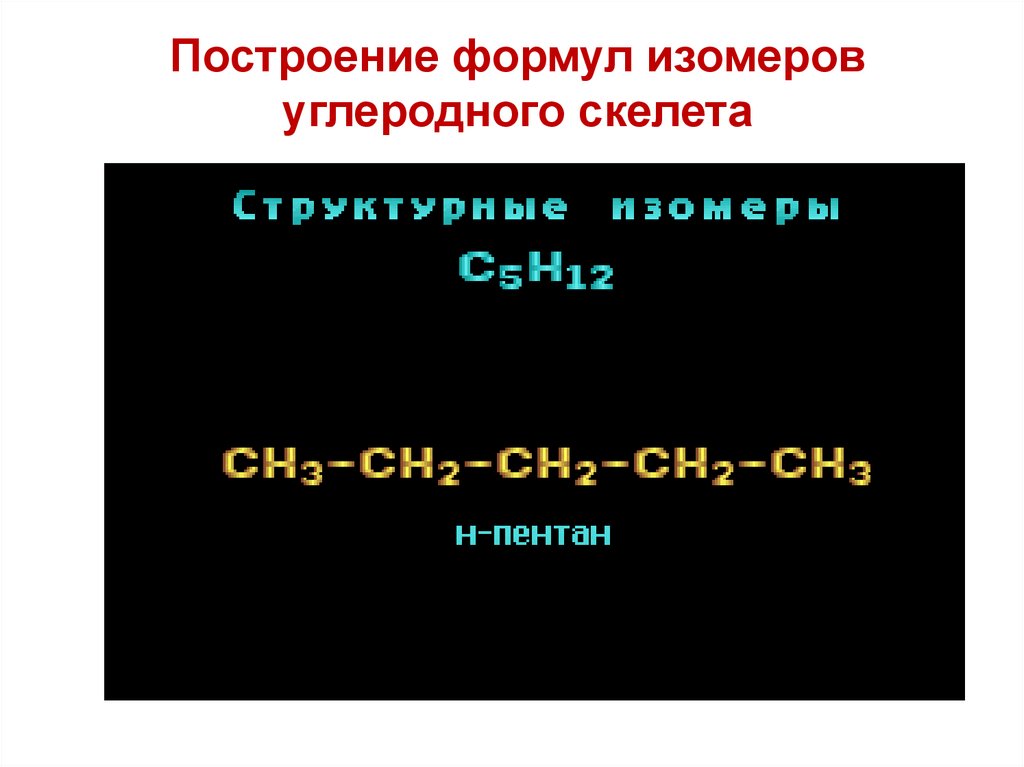
Построение формул изомеровуглеродного скелета
19.
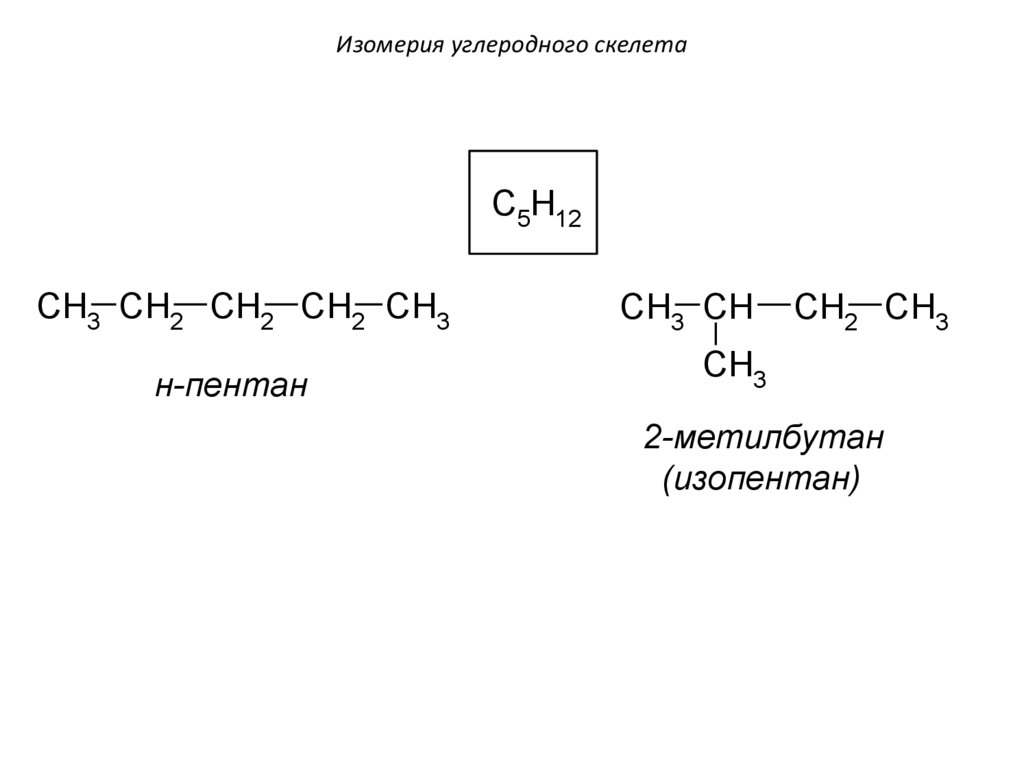
Изомерия углеродного скелетаC5H12
CH3 CH2 CH2 CH2 CH3
н-пентан
CH3 CH
CH2 CH3
CH3
2-метилбутан
(изопентан)
20.
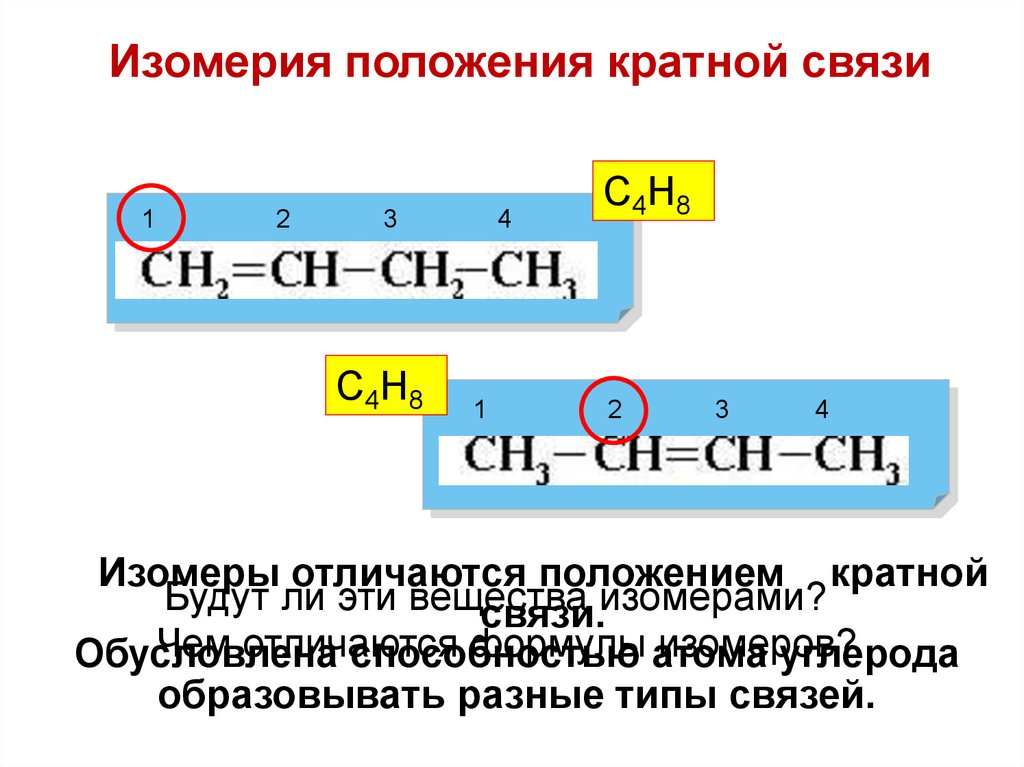
Изомерия положения кратной связи1
2
3
С4Н8
4
1
С4Н8
2
3
4
Изомеры отличаются положением кратной
Будут ли эти вещества
связи.изомерами?
Чем отличаются
формулы атома
изомеров?
Обусловлена
способностью
углерода
образовывать разные типы связей.
21.
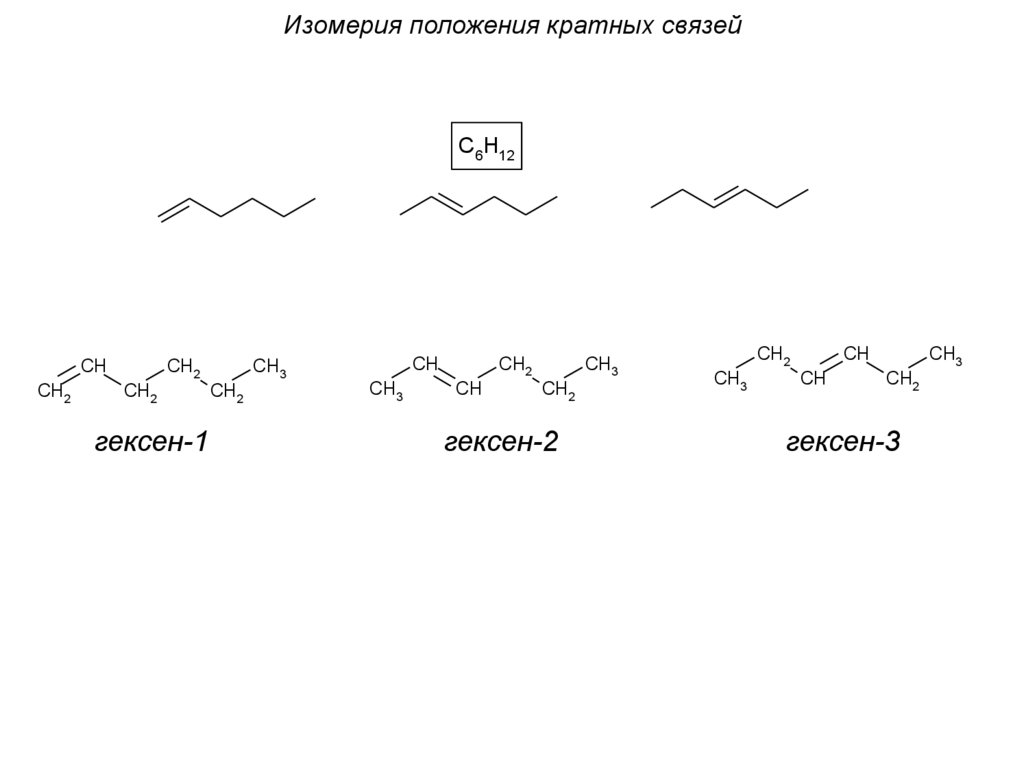
Изомерия положения кратных связейC6H12
CH
CH2
CH2
CH2
гексен-1
CH
CH3
CH2
CH3
CH2
CH
CH3
CH2
гексен-2
CH2
CH3
CH
CH
CH3
CH2
гексен-3
22.
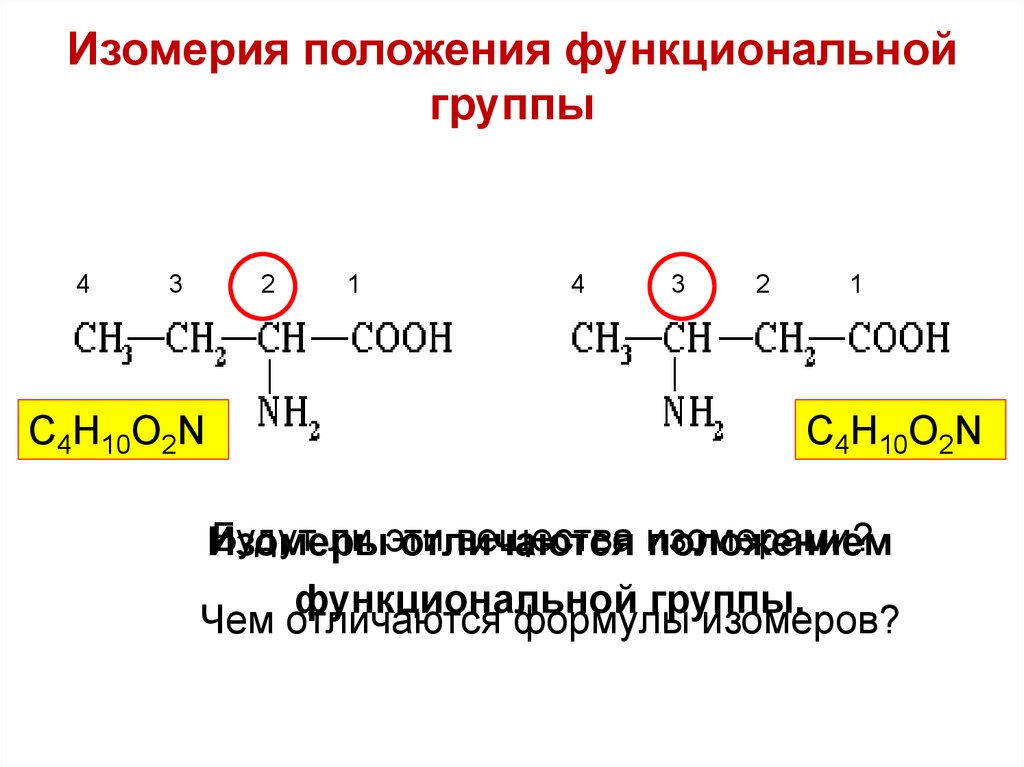
Изомерия положения функциональнойгруппы
4
3
2
С4Н10О2N
1
4
3
2
1
С4Н10О2N
Будут ли эти
вещества изомерами?
Изомеры
отличаются
положением
функциональной группы.
Чем отличаются формулы изомеров?
23.
Изомерия функциональнойпринадлежности
Алкены изомерны циклоалканам:
С4Н8
алкен
С4Н8
циклоалкан
Изомеры относятся к разным классам
соединений.
24.
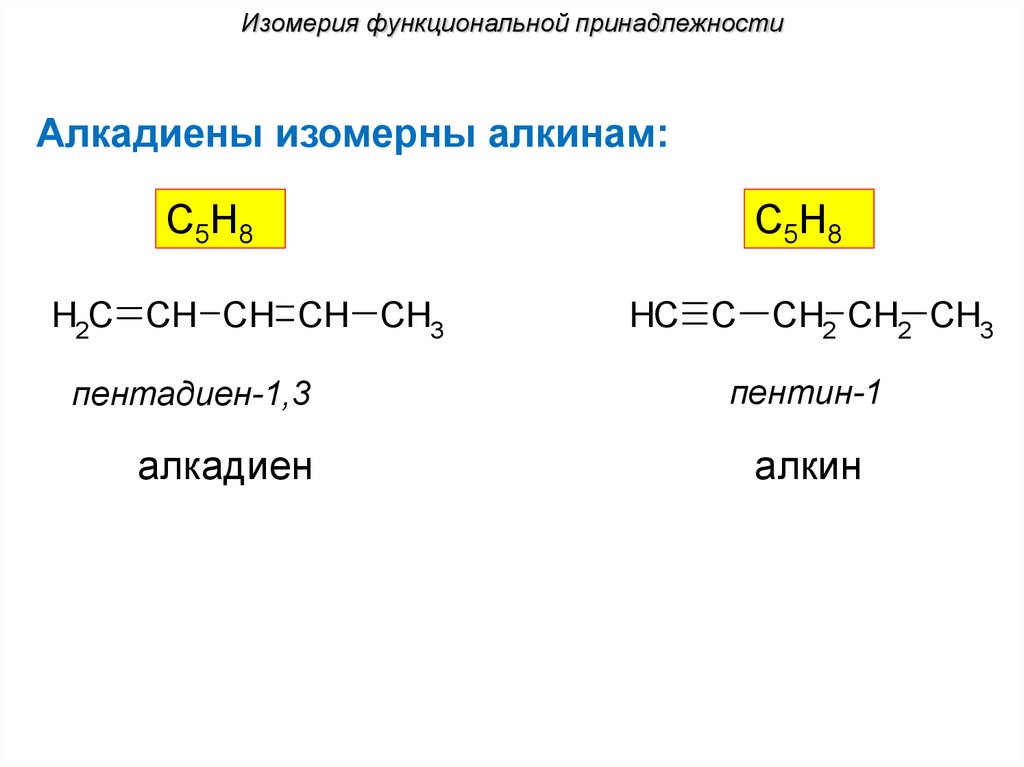
Изомерия функциональной принадлежностиАлкадиены изомерны алкинам:
С5Н8
H2C CH CH CH CH3
С5Н8
HC C CH2 CH2 CH3
пентадиен-1,3
пентин-1
алкадиен
алкин
25.
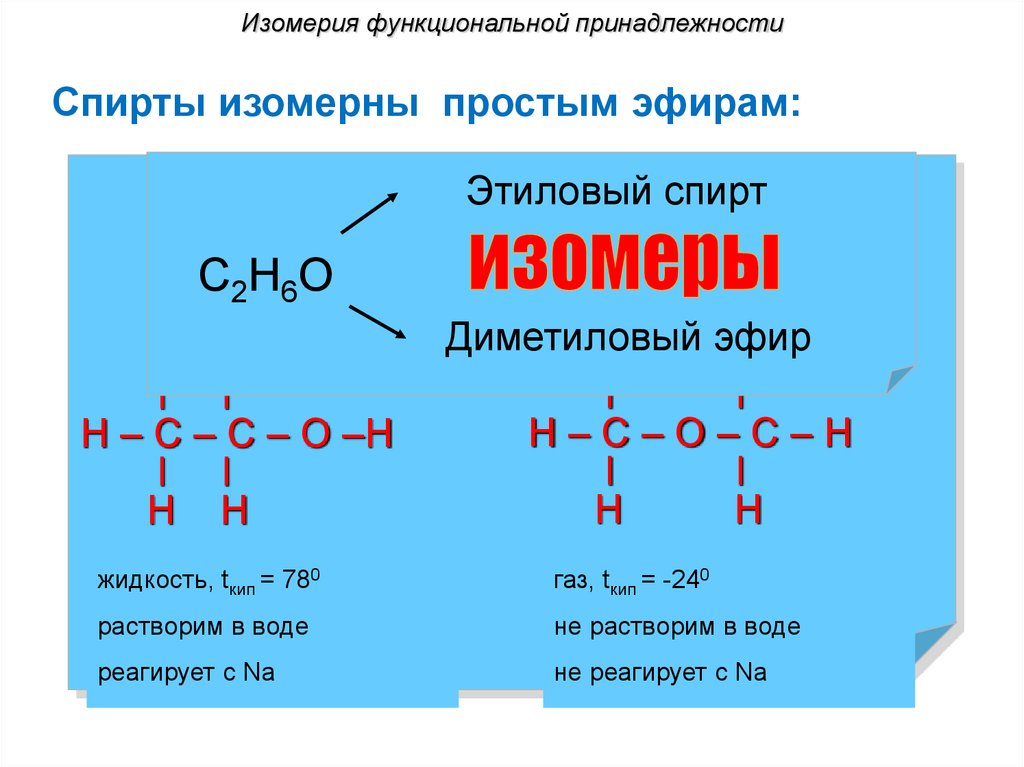
Изомерия функциональной принадлежностиСпирты изомерны простым эфирам:
Этиловый спирт
С2Н6О
Н Н
l l
Н – С – С – О –Н
l l
Н Н
С2Н6О
Диметиловый
эфир
Н
Н
l
l
Н–С–О–С–Н
l
l
Н
Н
жидкость, tкип = 780
газ, tкип = -240
растворим в воде
не растворим в воде
реагирует с Na
не реагирует с Na
26.
Изомерия функциональной принадлежностиКарбоновые кислоты изомерны сложным
эфирам:
27.
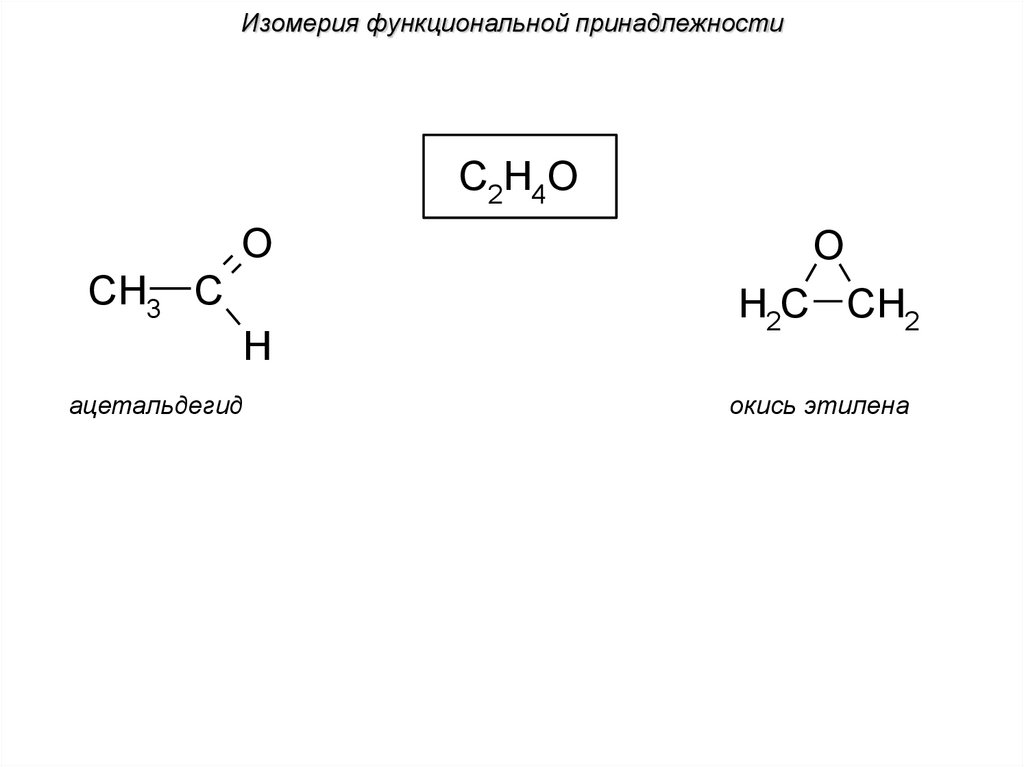
Изомерия функциональной принадлежностиC2H4O
O
CH3 C
H
ацетальдегид
O
H2C CH2
окись этилена
28.
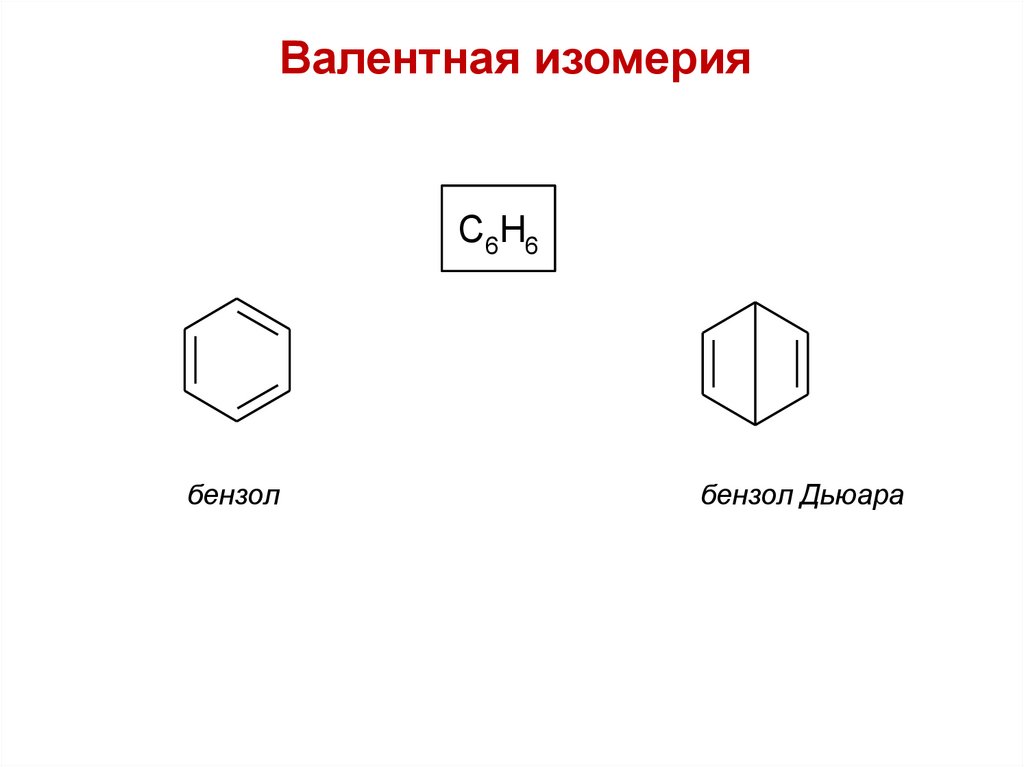
Валентная изомерияC6H6
бензол
бензол Дьюара
29.
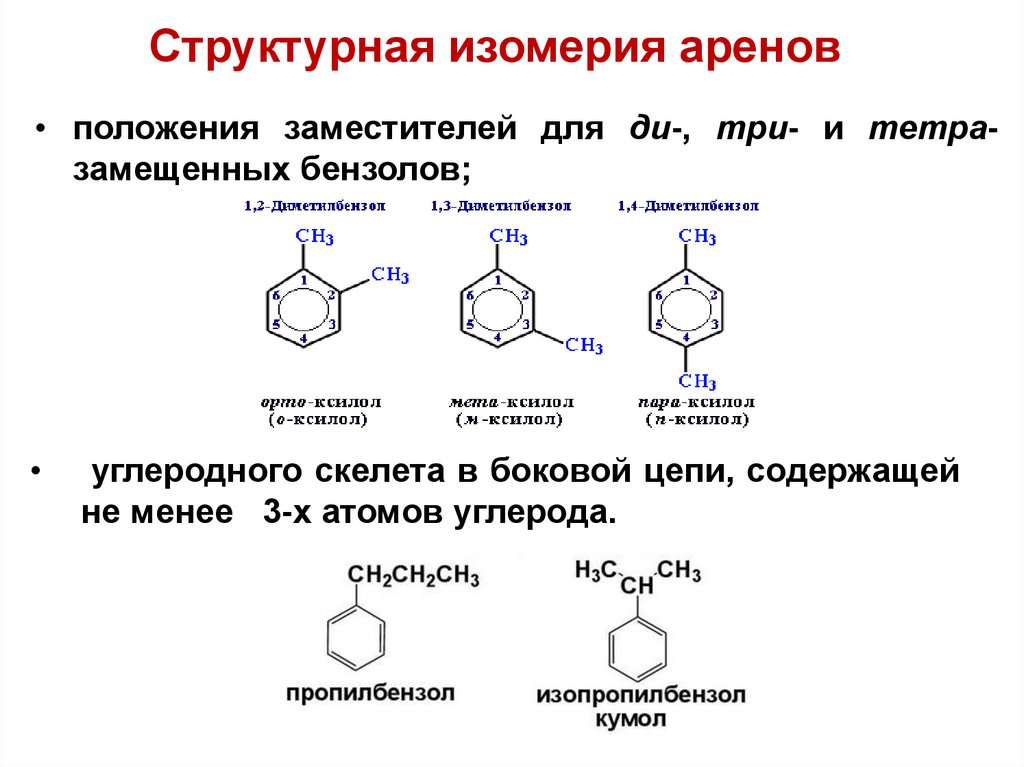
Структурная изомерия аренов• положения заместителей для ди-, три- и тетразамещенных бензолов;
углеродного скелета в боковой цепи, содержащей
не менее 3-х атомов углерода.
30.
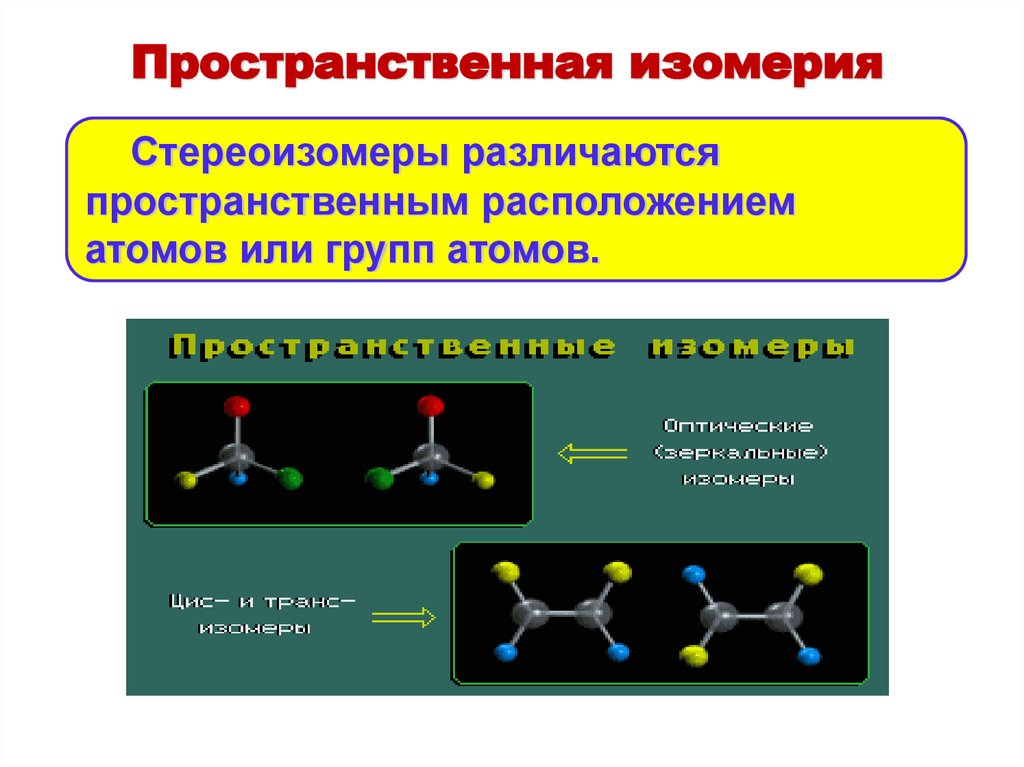
Пространственная изомерияСтереоизомеры различаются
пространственным расположением
атомов или групп атомов.
31.
Пространственная изомерияРазличают виды стереоизомерии:
• энантиомерия
• σ-диастереомерия
• π-диастереомерия (геометрическая)
• конформационная изомерия
32.
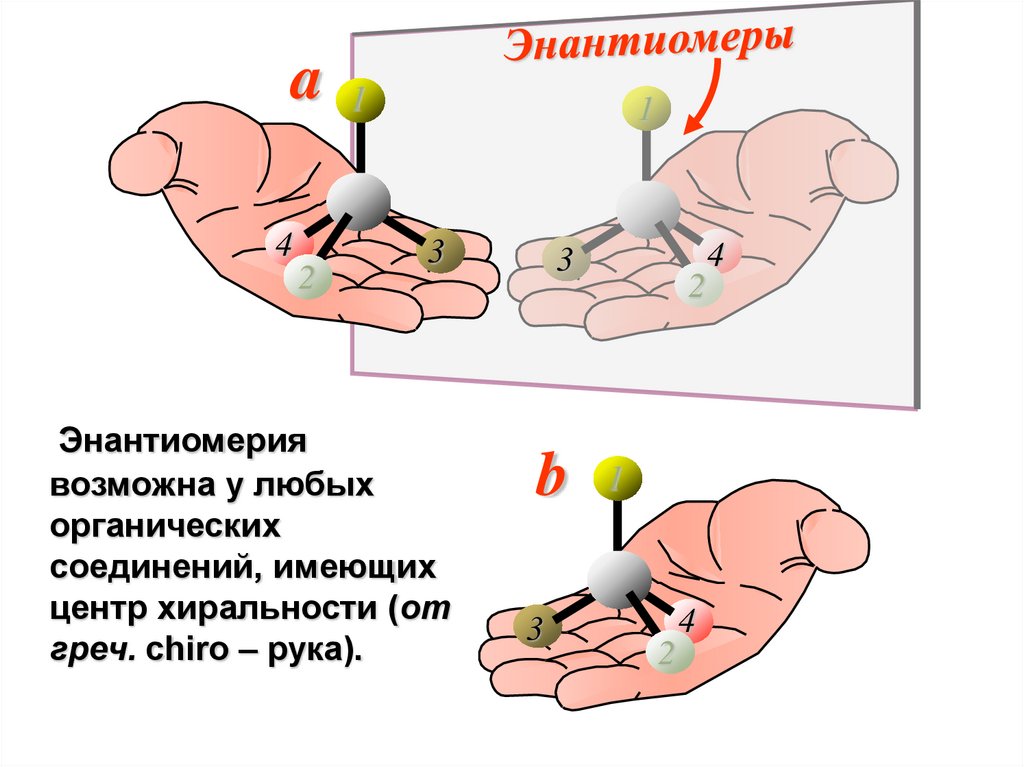
ЭнантиомерияЭнантиомеры – это
изомеры, которые
относятся друг к другу как
предмет и несовместимое
с ним в пространстве
зеркальное отражение.
Энантиомеры –
близнецы органического
мира.
33.
a 14
2
1
3
Энантиомерия
возможна у любых
органических
соединений, имеющих
центр хиральности (от
греч. сhiro – рука).
4
3
2
b 1
3
4
2
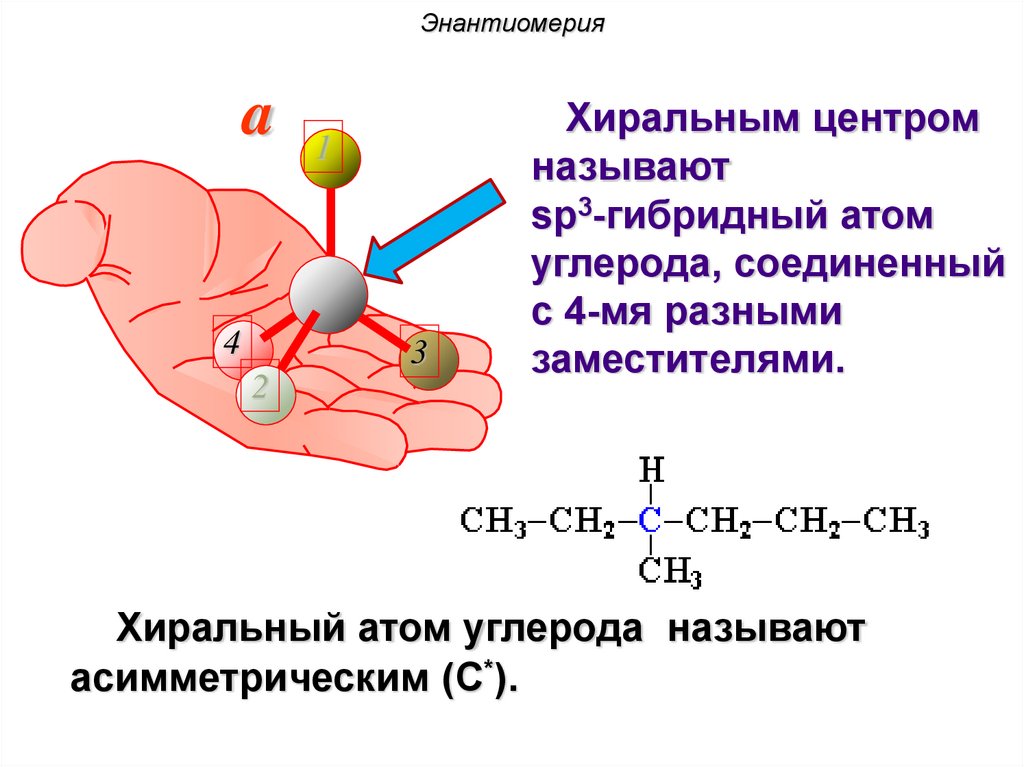
34.
Энантиомерияa 1
4
3
2
Хиральным центром
называют
sp3-гибридный атом
углерода, соединенный
с 4-мя разными
заместителями.
Хиральный атом углерода называют
асимметрическим (C*).
35.
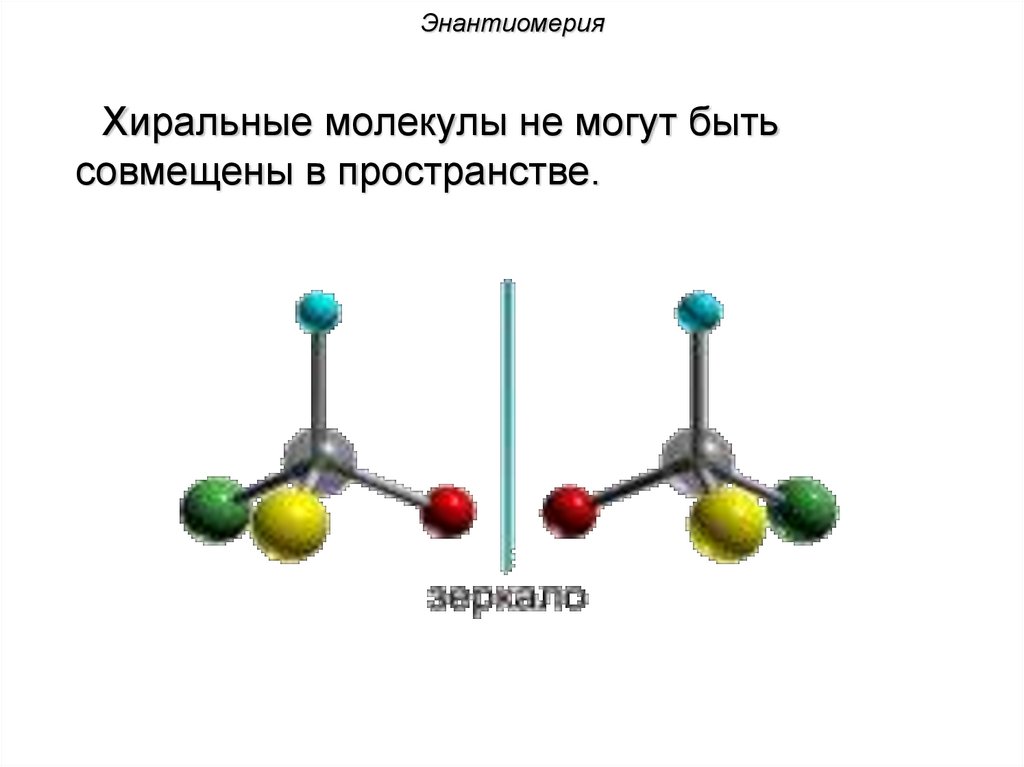
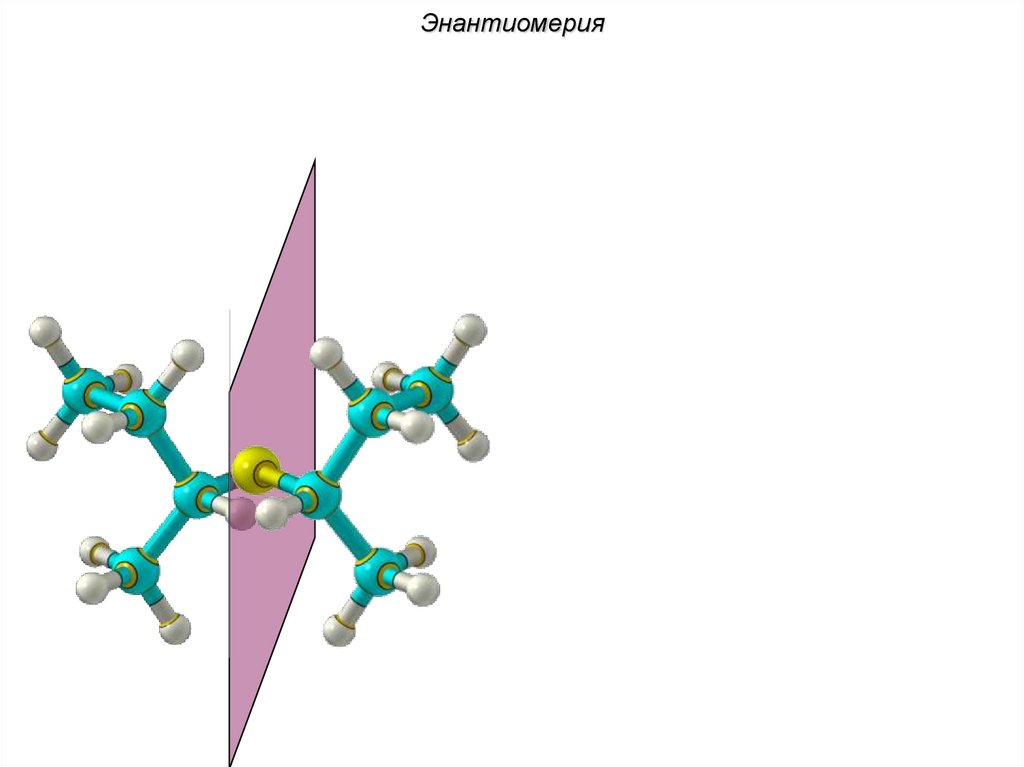
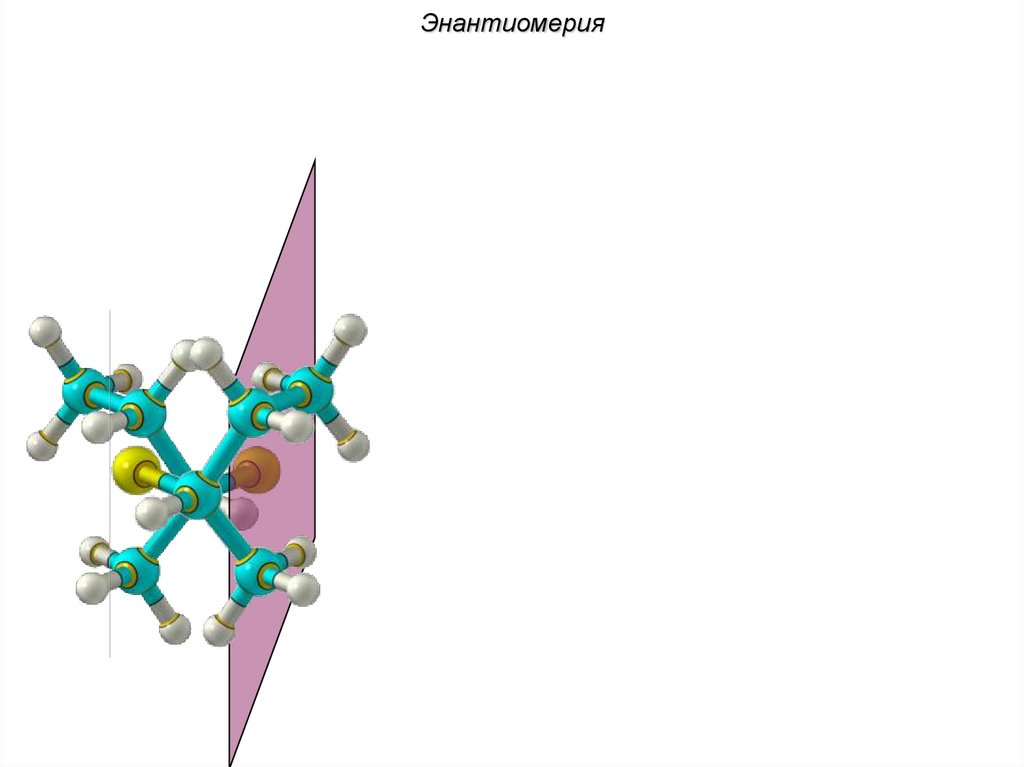
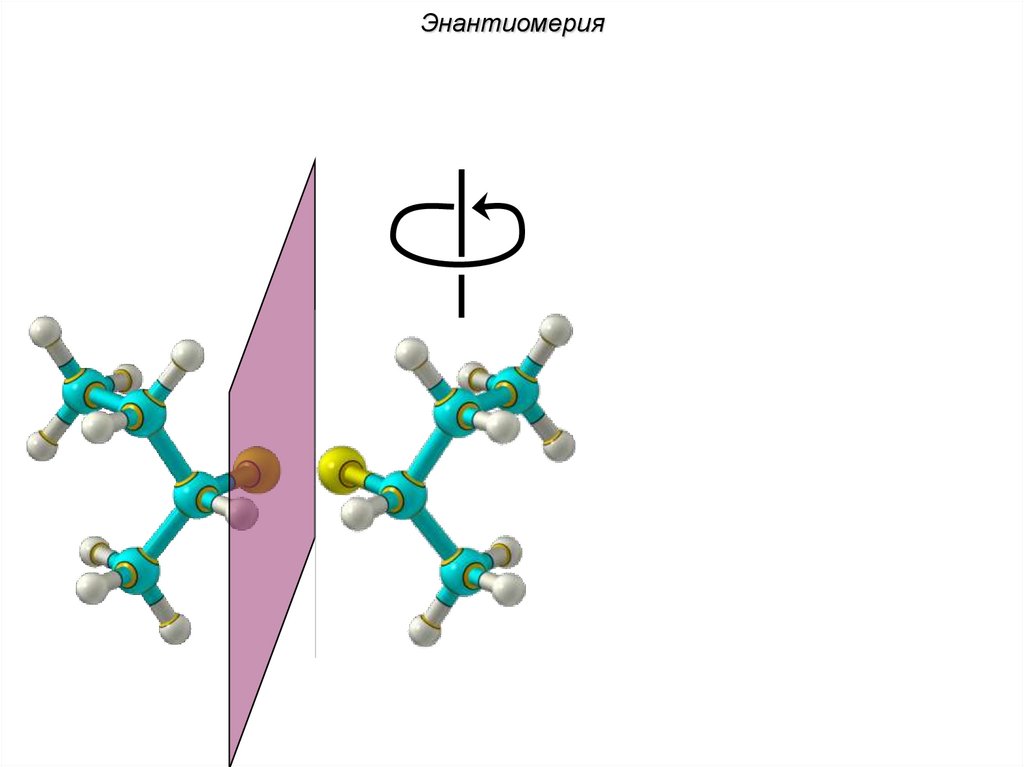
ЭнантиомерияХиральные молекулы не могут быть
совмещены в пространстве.
36.
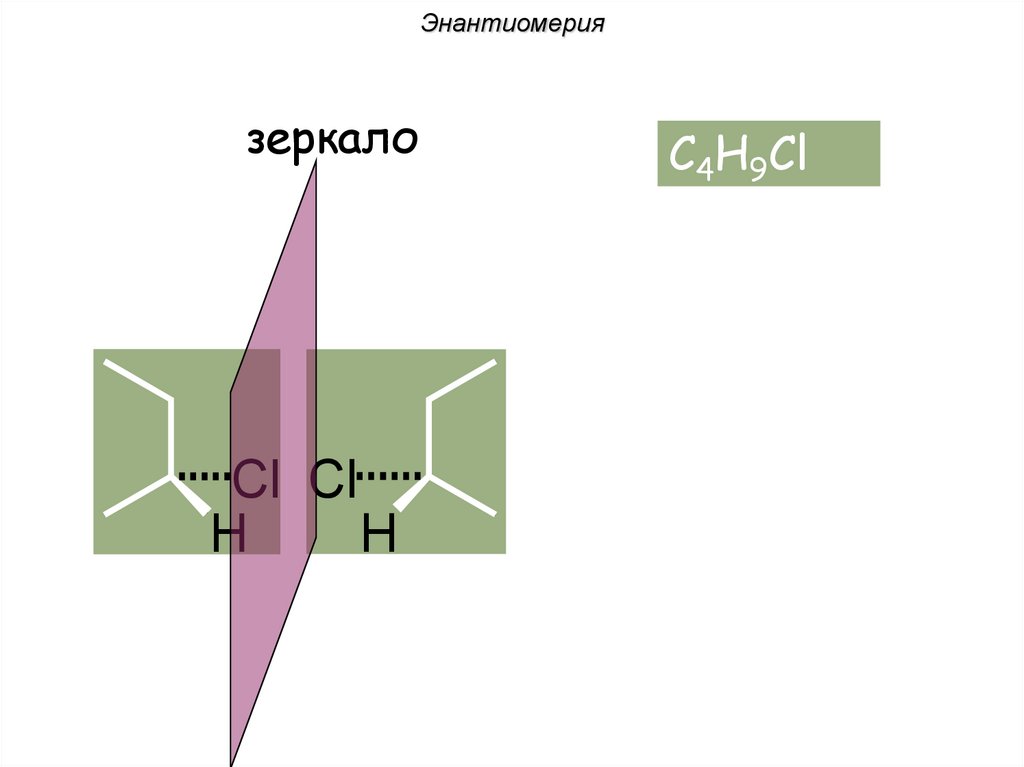
Энантиомериязеркало
Cl Cl
H
H
C4H9Cl
37.
Энантиомерия38.
Энантиомерия39.
Энантиомерия40.
Энантиомерия41.
Энантиомерия42.
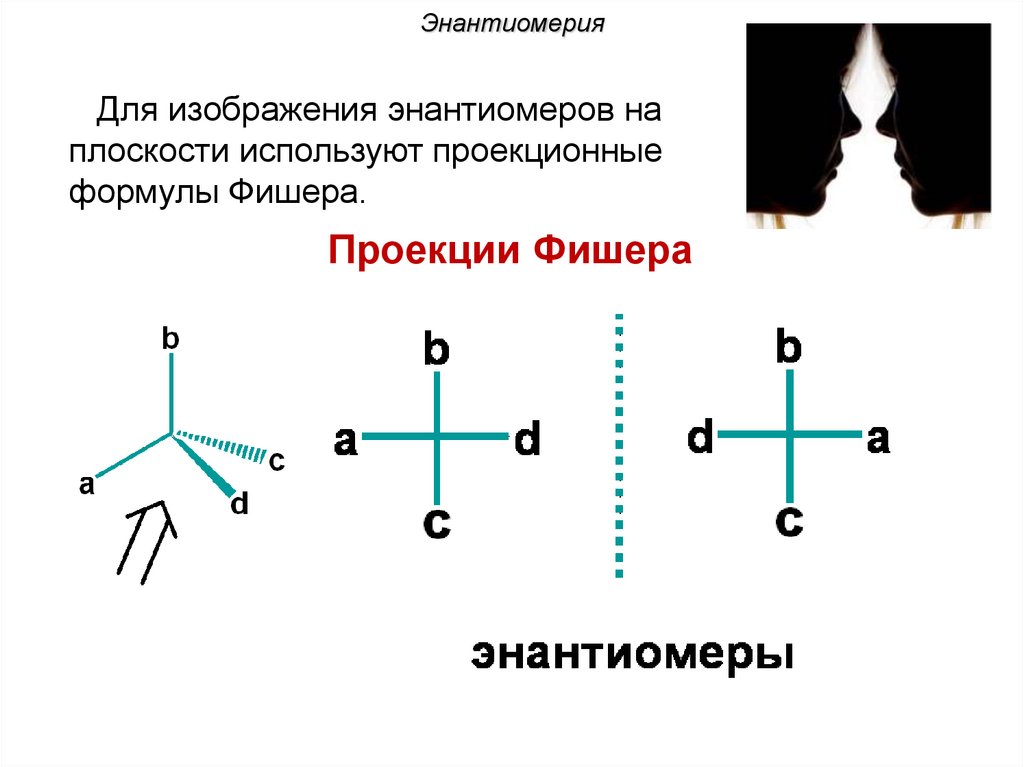
ЭнантиомерияДля изображения энантиомеров на
плоскости используют проекционные
формулы Фишера.
Проекции Фишера
43.
ЭнантиомерияВ зависимости от конфигурации хирального центра
различают D- и L-конфигурации (формы).
Конфигурационный стандарт –
глицеральдегид
CHO
H C OH
CH2OH
CHO
HO C H
CH2OH
D-глицеральдегид
L-глицеральдегид
D-Gliceraldehido
L-Gliceraldehido
44.
ЭнантиомерияСравнение конфигурации исследуемого
соединения с глицериновым альдегидом производят
путем серии химических превращений, не
затрагивающих центр хиральности.
В D-форме функциональная группа (-ОН)
хирального центра располагается справа от
углеродной цепи, в L-форме – слева.
D- и L- – это относительная конфигурация.
45.
ЭнантиомерияЭнантиомеры 2-гидроксипропановой кислоты
COOH
COOH
H
OH HO
H
CH3
CH3
D-мясомолочная кислота
L-молочная кислота
46.
ЭнантиомерияЭнантиомеры обладают оптической
активностью. Они способны вращать
плоскость поляризации света.
Оптическая активность энантиомеров
исследуется с помощью прибора –
поляриметра, в котором луч света, пройдя
через специальную призму Николя колеблется
только в одной плоскости, т. е. становится
плоскополяризованным.
47.
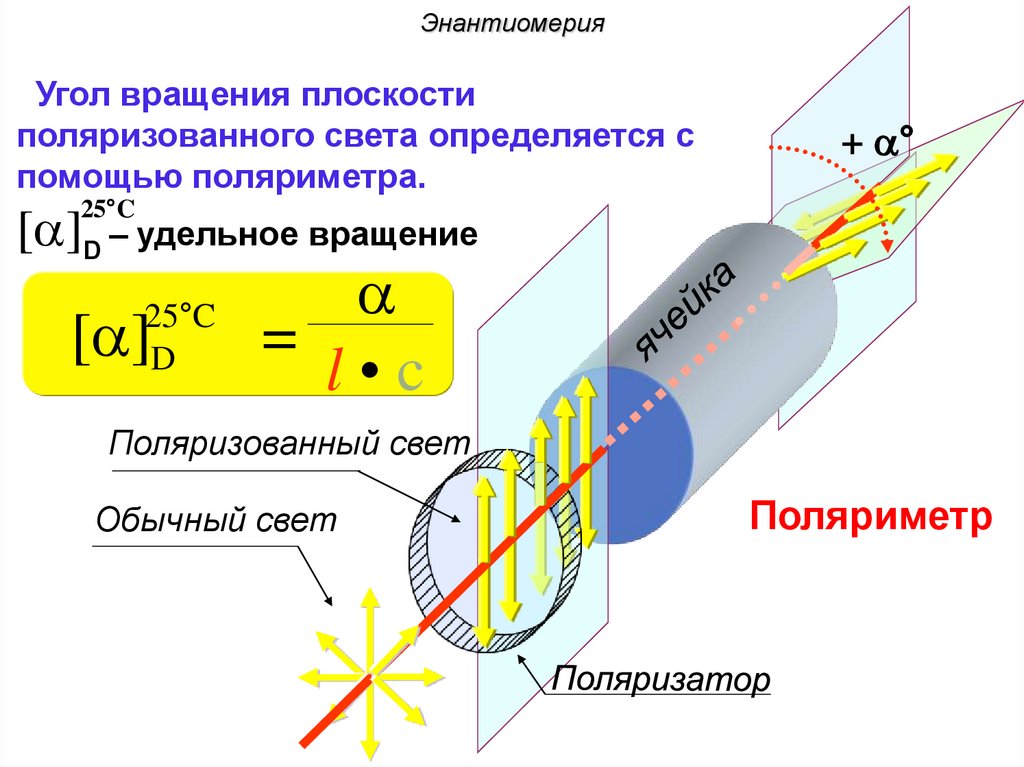
ЭнантиомерияУгол вращения плоскости
поляризованного света определяется с
помощью поляриметра.
+ a°
25°C
[a]D – удельное вращение
25°C
D
[a]
a
=
l•c
Поляризованный свет
Обычный свет
Поляриметр
48.
ЭнантиомерияЭнантиомеры способны отклонять
поляризованный луч либо влево, либо
вправо, т.е. они являются оптическими
антиподами.
У энантиомеров угол вращения плоскости
поляризации света одинаковый, но направление
вращения противоположное.
Один энантиомер – левовращающий, знак
(-), а другой правовращающий, знак (+).
Знак вращения плоскости поляризации света
не связан с принадлежностью к D- или L-ряду. Он
определяется экспериментально.
49.
ЭнантиомерияУ 2-гидроксипропановой кислоты
D-изомер является левовращающим:
D(-); a= -2,6 .
L-изомер является правовращающим:
L(+); a= +2,6 .
Смесь энантиомеров называется
рацематом. Рацемат не обладает оптической
активностью.
50.
ЭнантиомерияЭнантиомеры 2-гидроксипропановой кислоты
COOH
COOH
H
OH HO
CH3
D (-) – мясомолочная
кислота
H
CH3
L(+) – молочная кислота
51.
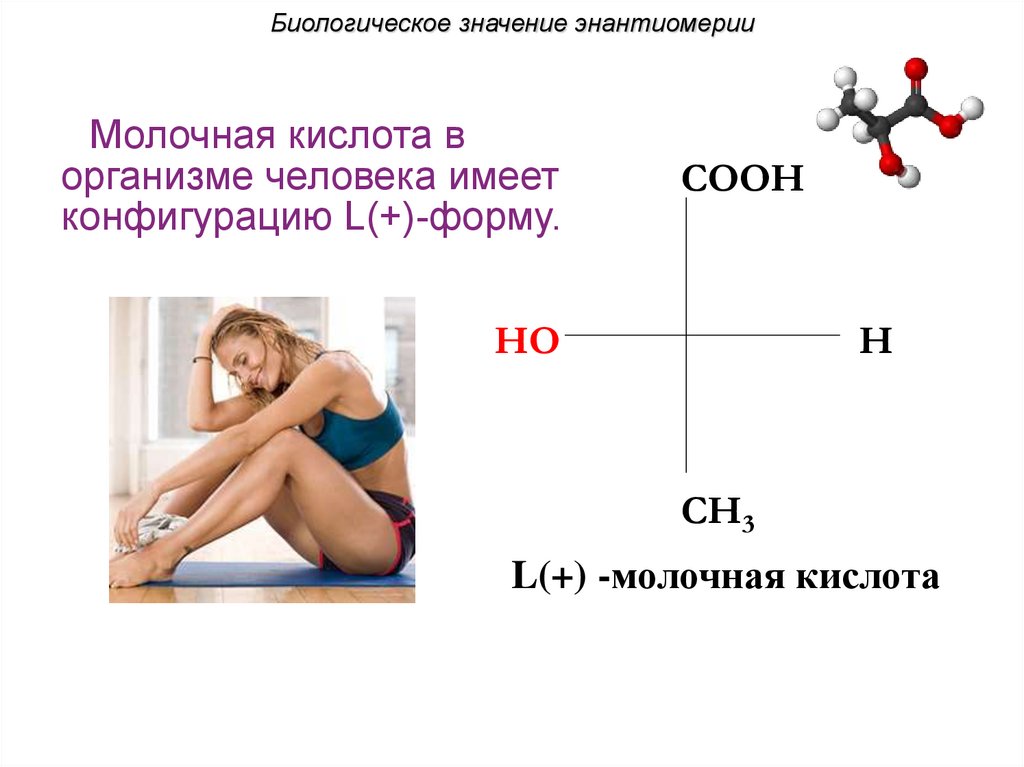
Биологическое значение энантиомерииМолочная кислота в
организме человека имеет
конфигурацию L(+)-форму.
COOH
HO
H
CH3
L(+) -молочная кислота
52.
ЭнантиомерияЭнантиомеры обладают одинаковыми
физическими и химическими свойствами, но
являются оптическими антиподами, т.е. имеют
противоположную оптическую активность и
имеют различную физиологическую
активность.
53.
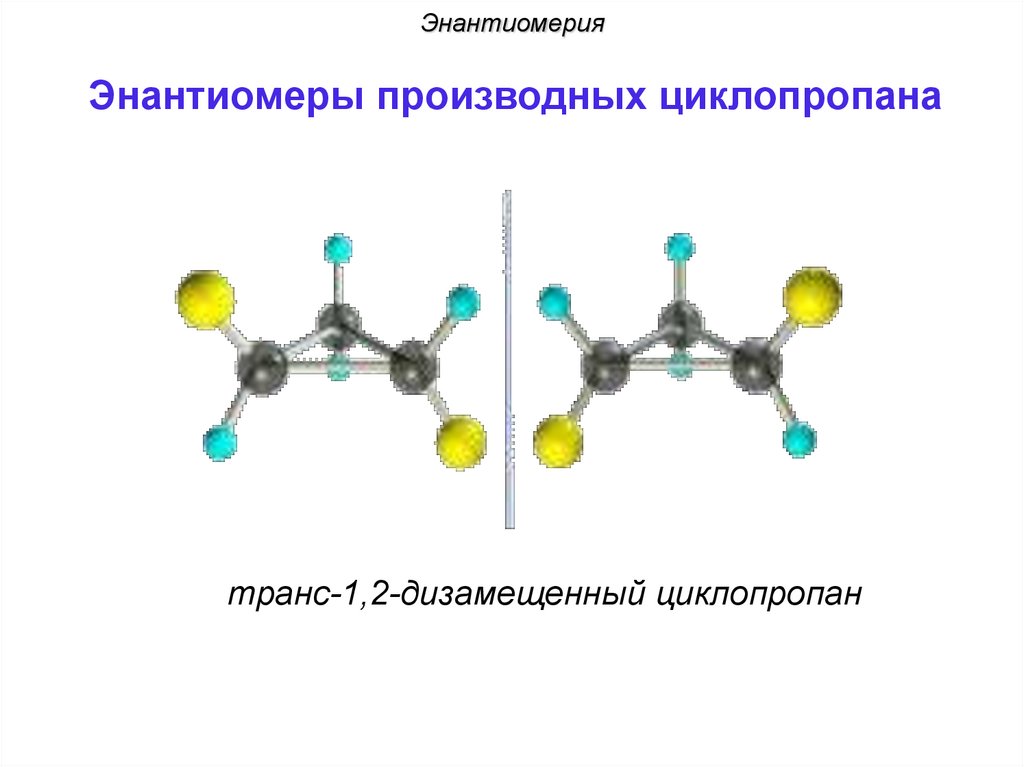
ЭнантиомерияЭнантиомеры производных циклопропана
транс-1,2-дизамещенный циклопропан
54.
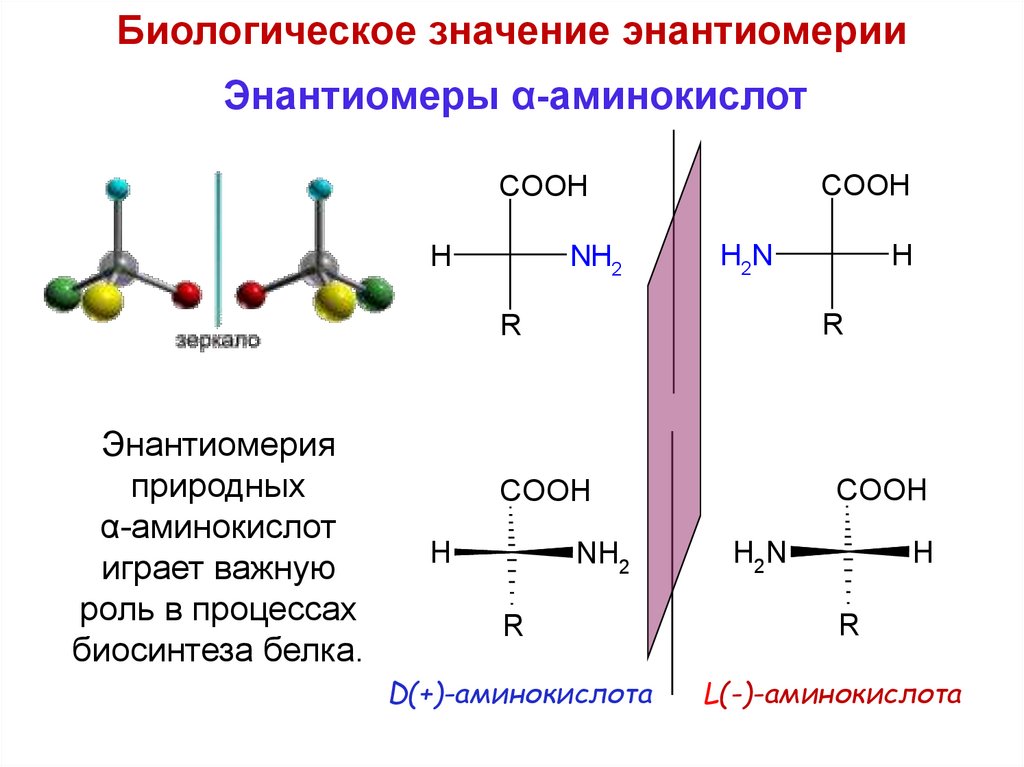
Биологическое значение энантиомерииЭнантиомеры α-аминокислот
COOH
COOH
H
Энантиомерия
природных
α-аминокислот
играет важную
роль в процессах
биосинтеза белка.
NH2
H2N
H
R
R
COOH
COOH
H
NH2
H2N
H
R
R
D(+)-аминокислота
L(-)-аминокислота
55.
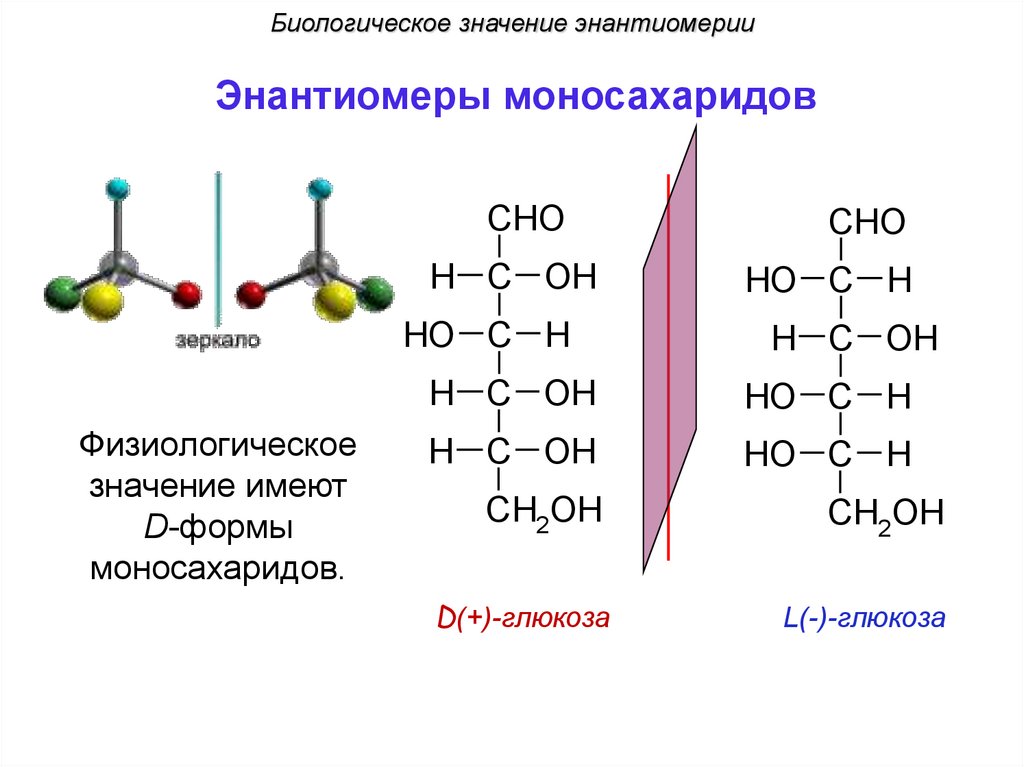
Биологическое значение энантиомерииЭнантиомеры моносахаридов
CHO
H C OH
HO C H
Физиологическое
значение имеют
D-формы
моносахаридов.
CHO
HO C H
H C OH
H C OH
HO C H
H C OH
HO C H
CH2OH
CH2OH
D(+)-глюкоза
L(-)-глюкоза
56.
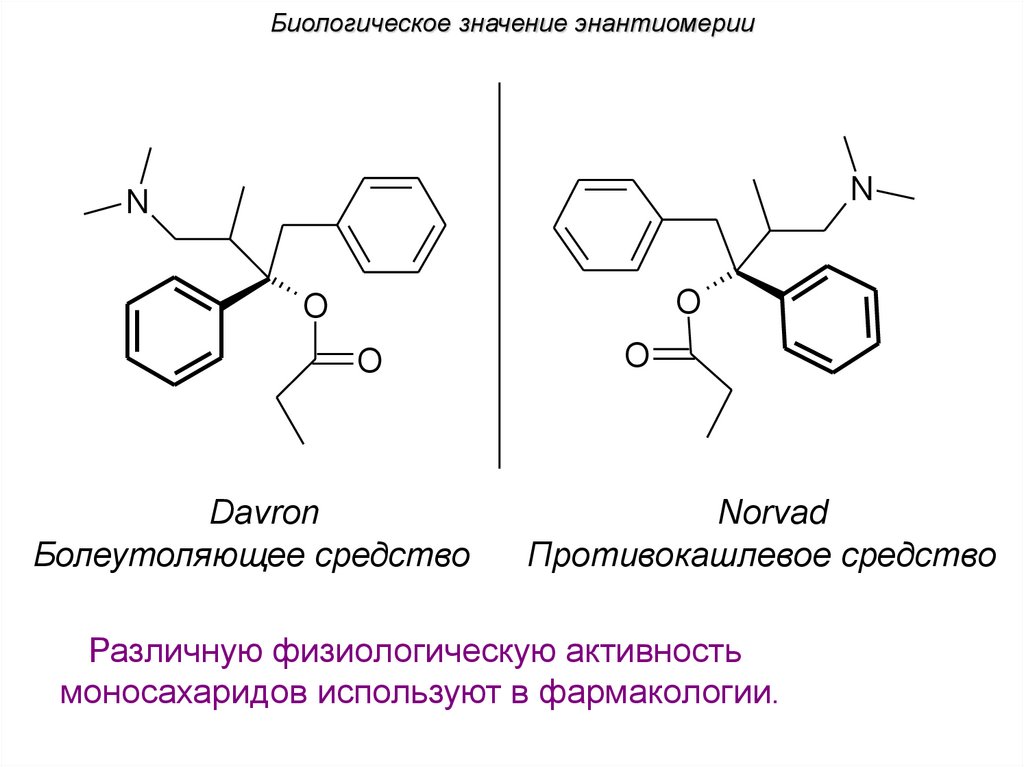
Биологическое значение энантиомерииN
N
O
O
O
Davron
Болеутоляющее средство
O
Norvad
Противокашлевое средство
Различную физиологическую активность
моносахаридов используют в фармакологии.
57.
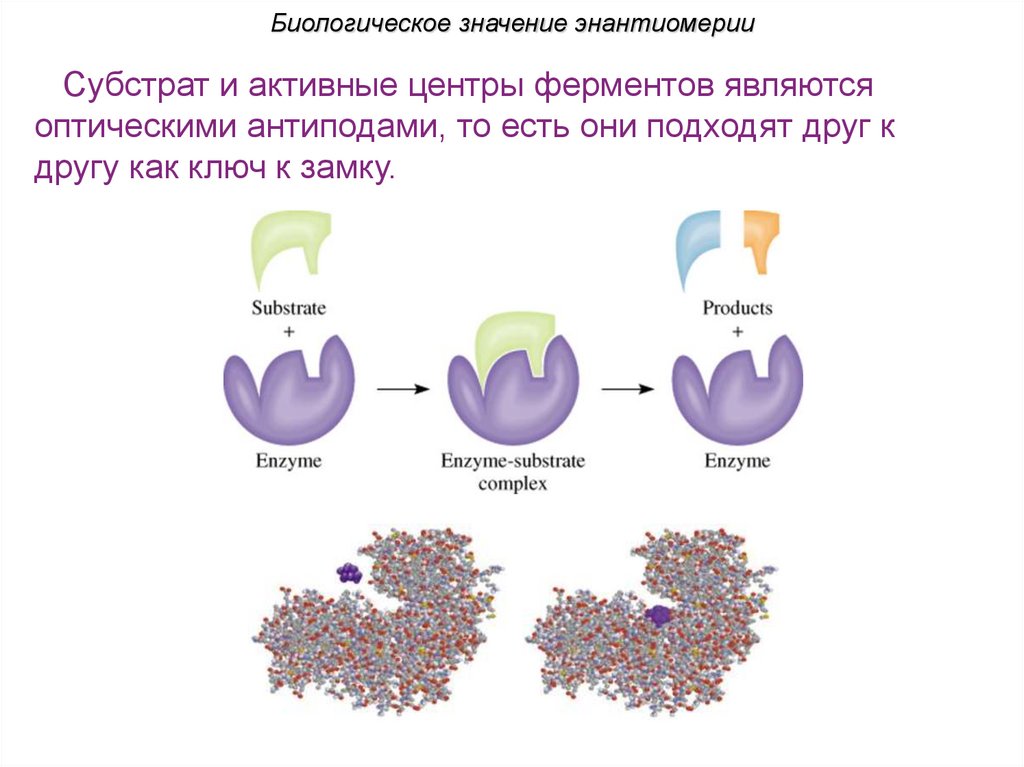
Биологическое значение энантиомерииСубстрат и активные центры ферментов являются
оптическими антиподами, то есть они подходят друг к
другу как ключ к замку.
58.
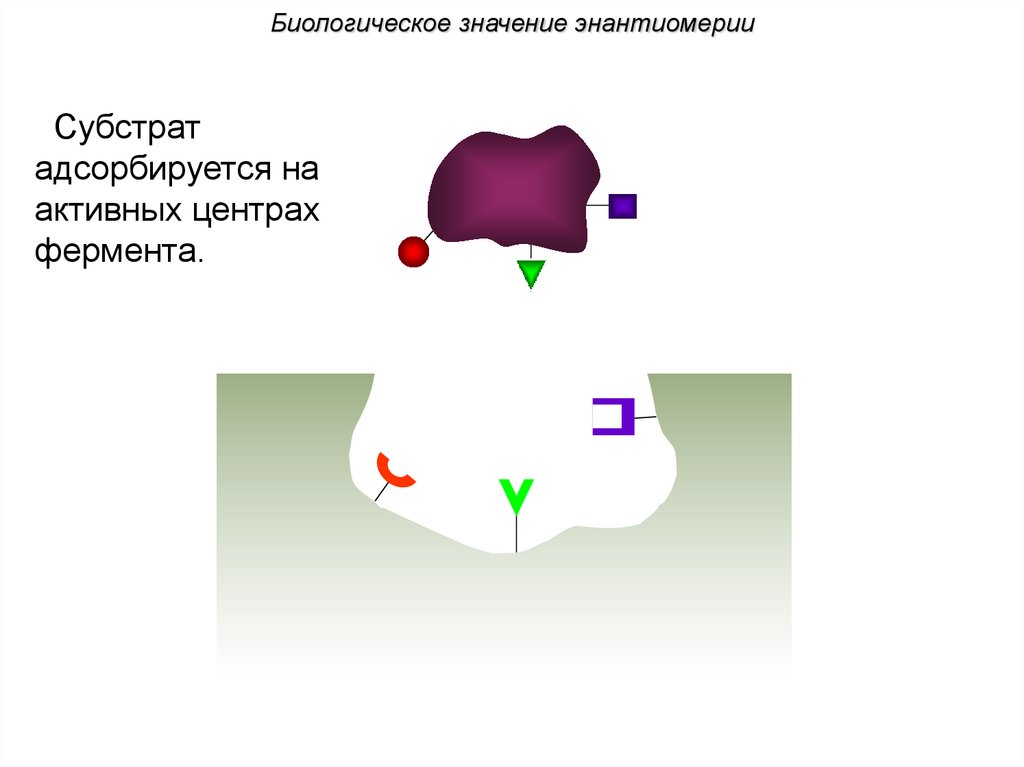
Биологическое значение энантиомерииСубстрат
адсорбируется на
активных центрах
фермента.
59.
Биологическое значение энантиомерииЦис-ретиналь и белок опсин являются оптическими
антиподами. В этом случае они взаимодействуют и
образуют комплекс родопсин, который участвует в
процессе зрения.
R CH
NH
OC
HN
HC
CO
N
CH
OC
HN
HC
CO
Родопсин в клеточной
мембране
HC R
NH
R
60.
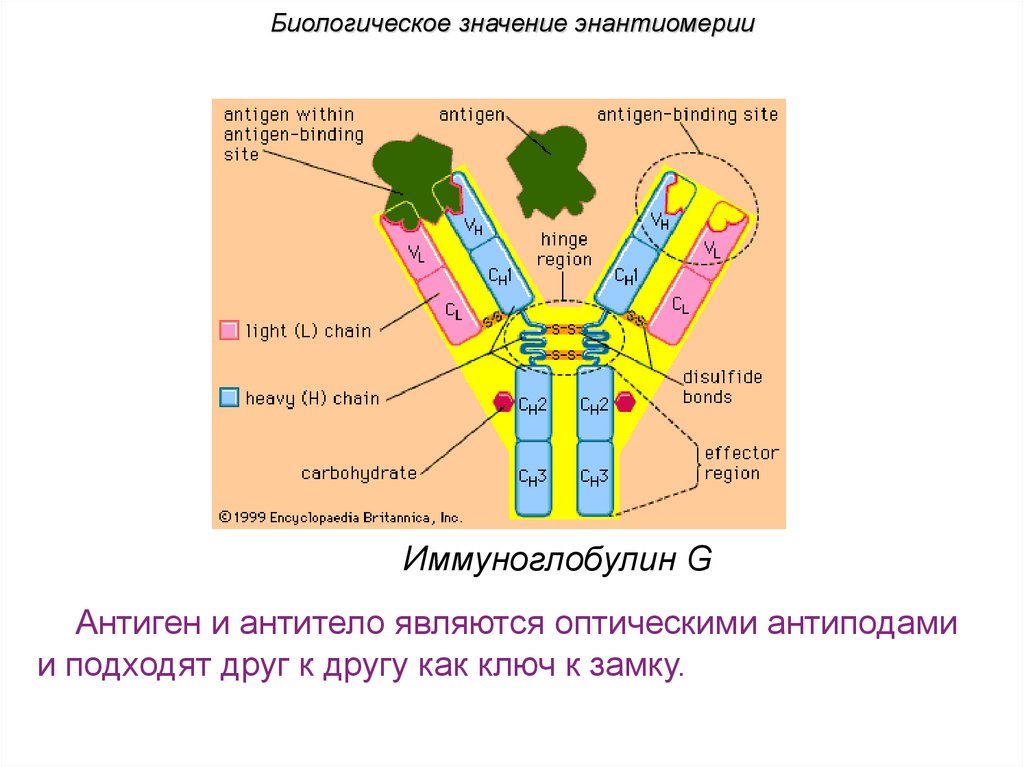
Биологическое значение энантиомерииИммуноглобулин G
Антиген и антитело являются оптическими антиподами
и подходят друг к другу как ключ к замку.
61.
σ-Диастереомерияσ-Диастереомерия
возникает в
молекулах с 2 и
более центрами
хиральности.
σ-Диастереомеры – оптические изомеры, не
являющиеся зеркальным отображение друг друга.
друг друга
62.
σ-ДиастереомерияЧисло стереоизомеров (Z)
рассчитывают по формуле Фишера:
Z =2n ,
где n-число центров хиральности.
63.
σ-ДиастереомерияD-, L-определяющим является гидроксил
при нижнем асимметрическом атоме
углерода (кроме гидроксикислот и
аминокислот).
Если заместители находятся по одну
сторону углеродной цепи, то такой изомер
называется эритро-формой, по разные –
трео-формой.
64.
σ-ДиастереомерияПример: 2,3,4 – тригидроксибутаналь
СН2(ОН)-СН(ОН)-СН(ОН)-СОН
n = 2; Z = 22 = 4 стереоизомера,
две пары энантиомеров.
65.
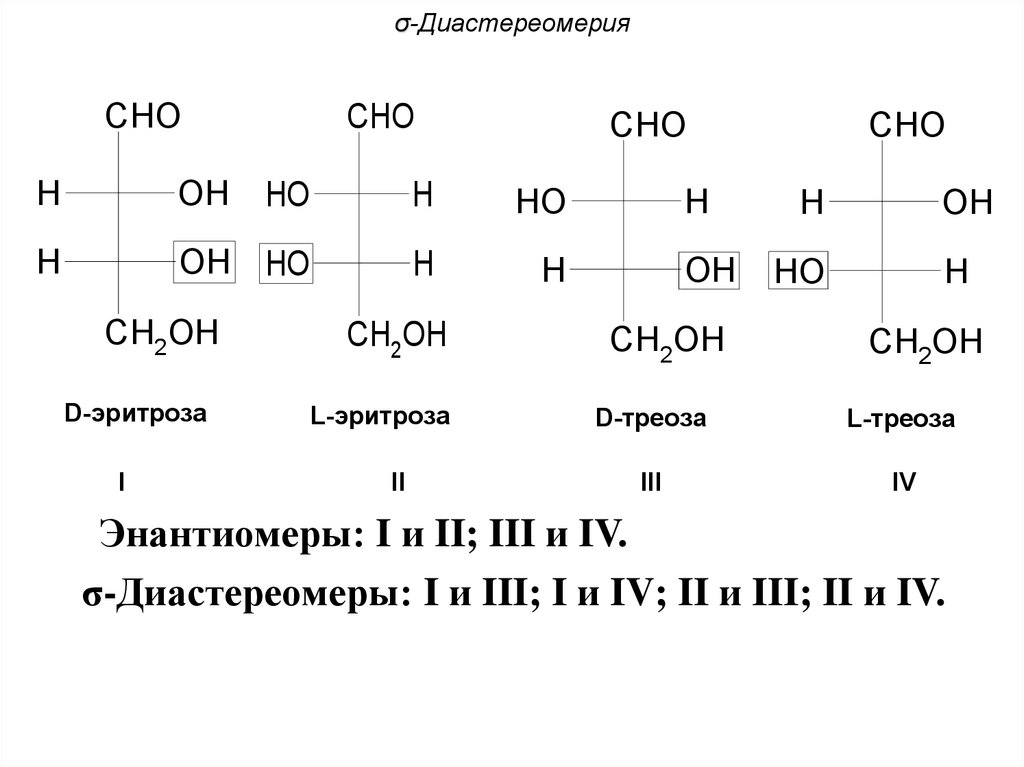
σ-ДиастереомерияCHO
CHO
CHO
CHO
H
OH
HO
H
HO
H
H
OH
H
OH HO
H
H
OH
HO
H
CH2OH
CH2OH
CH2OH
D-эритроза
L-эритроза
D-треоза
L-треоза
III
IV
I
II
CH2OH
Энантиомеры: I и II; III и IV.
σ-Диастереомеры: I и III; I и IV; II и III; II и IV.
66.
σ-Диастереомерияσ-Диастереомеры имеют разные
физические и химические свойства,
и физиологическое действие.
67.
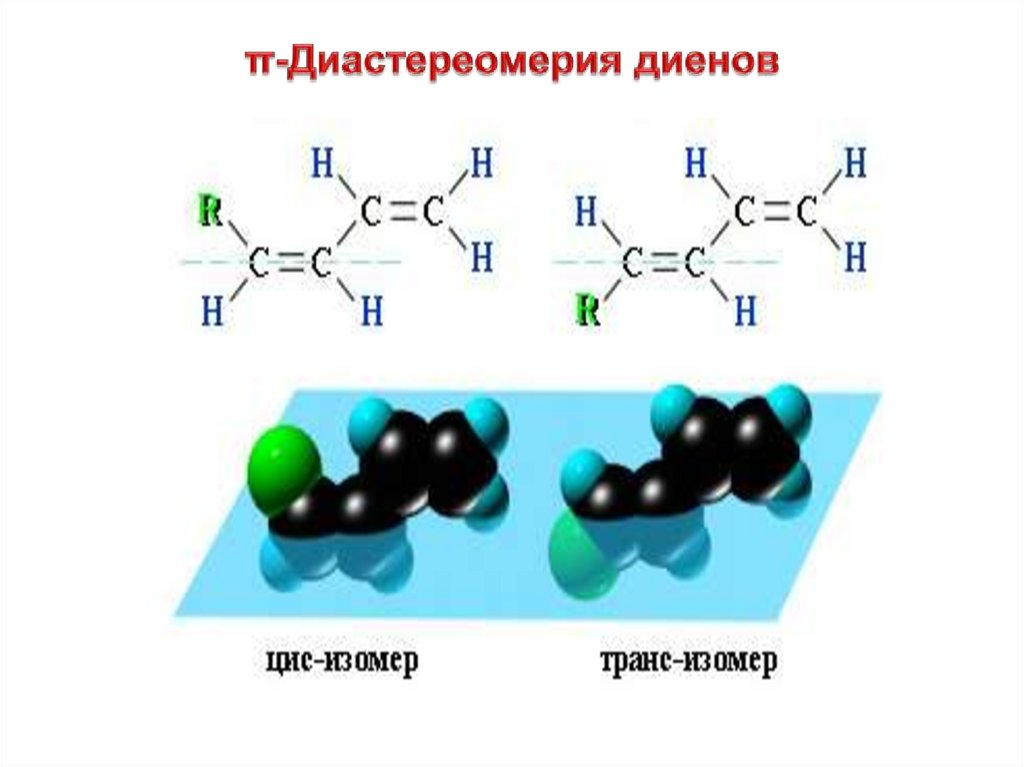
π-Диастереомерияπ-Диастереомеры (цис- и транс-) –
это стереоизомеры, отличающиеся
друг от друга различным
пространственным расположением
одинаковых заместителей
относительно плоскости π-связи.
68.
π-Диастереомерия69.
π-ДиастереомерияВ цис-изомерах заместители находятся по одну сторону от
плоскости -связи, в транс-изомерах – по разные:
.
70.
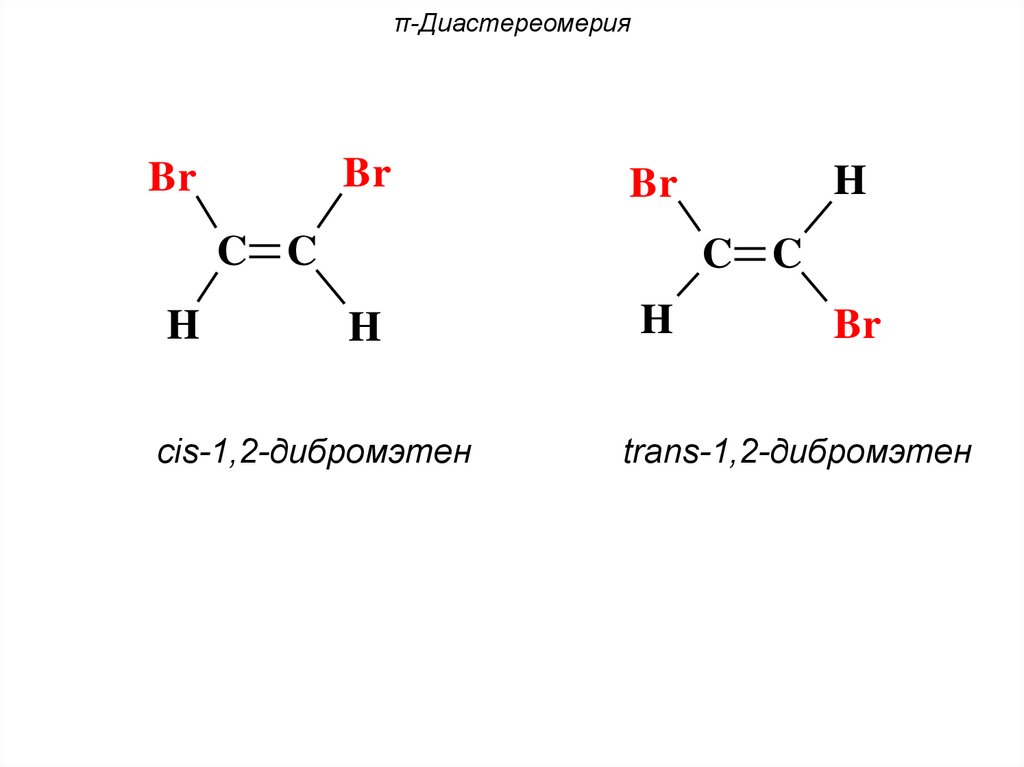
π-ДиастереомерияBr
Br
C C
H
H
Br
C C
H
cis-1,2-дибромэтен
H
Br
trans-1,2-дибромэтен
71.
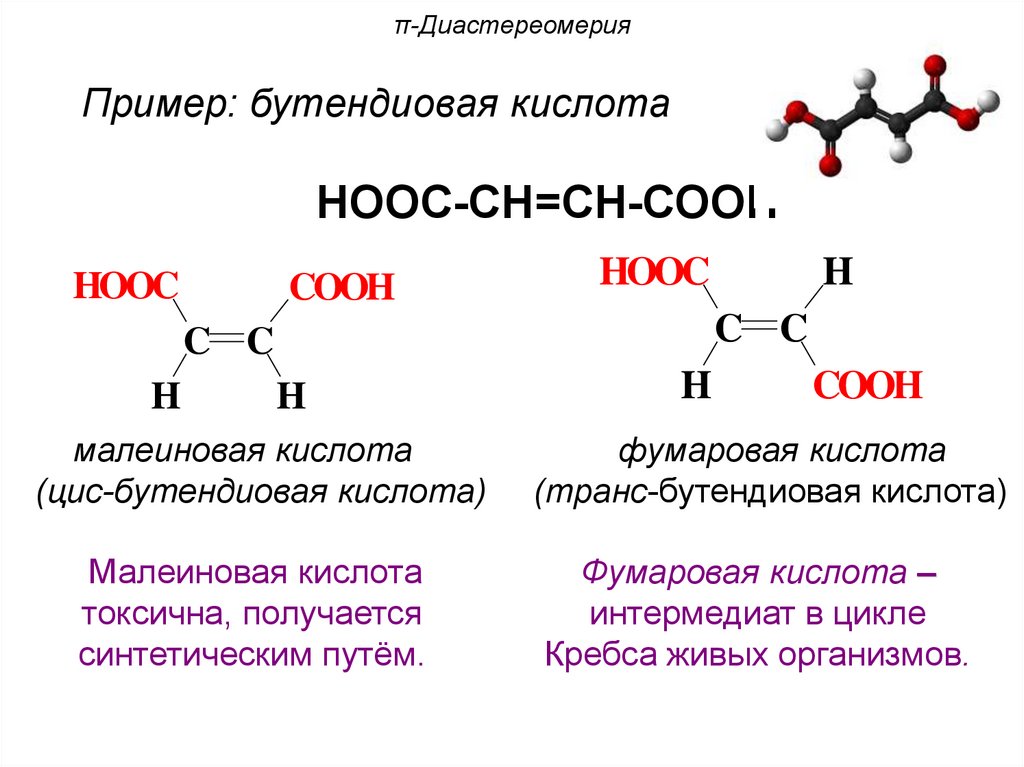
π-ДиастереомерияПример: бутендиовая кислота
НООС-СН=СН-СООН
HOOC
COOH
HOOC
C C
C C
H
H
H
H
COOH
малеиновая кислота
(цис-бутендиовая кислота)
фумаровая кислота
(транс-бутендиовая кислота)
Малеиновая кислота
токсична, получается
синтетическим путём.
Фумаровая кислота –
интермедиат в цикле
Кребса живых организмов.
72.
π-Диастереомерия-Диастереомеры отличаются друг от
друга по физическим и химическим
свойствам, а также по физиологическому
действию.
Более устойчивыми являются
транс- -диастереомеры.
73.
74.
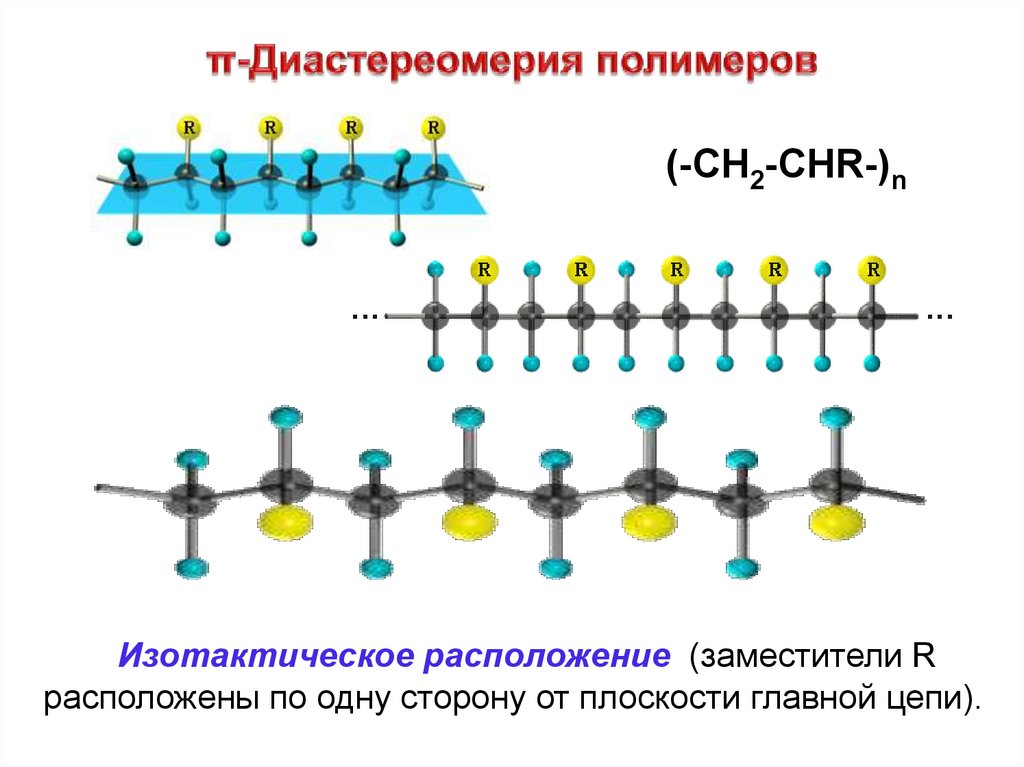
(-CH2-CHR-)nИзотактическое расположение (заместители R
расположены по одну сторону от плоскости главной цепи).
75.
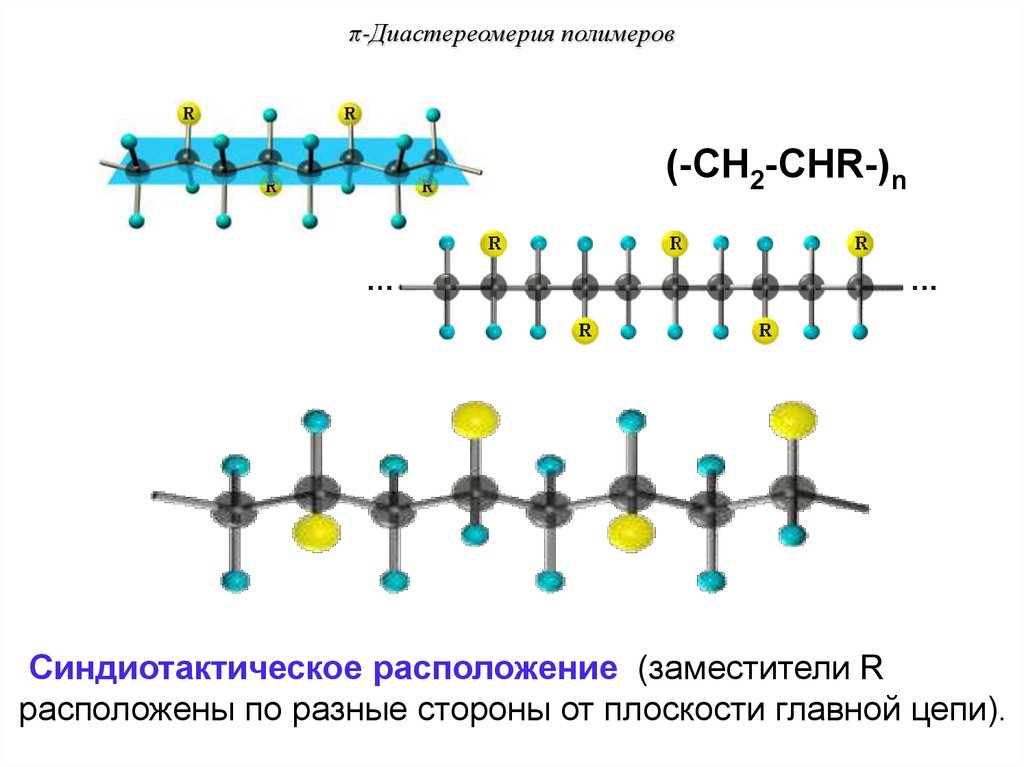
π-Диастереомерия полимеров(-CH2-CHR-)n
Синдиотактическое расположение (заместители R
расположены по разные стороны от плоскости главной цепи).
76.
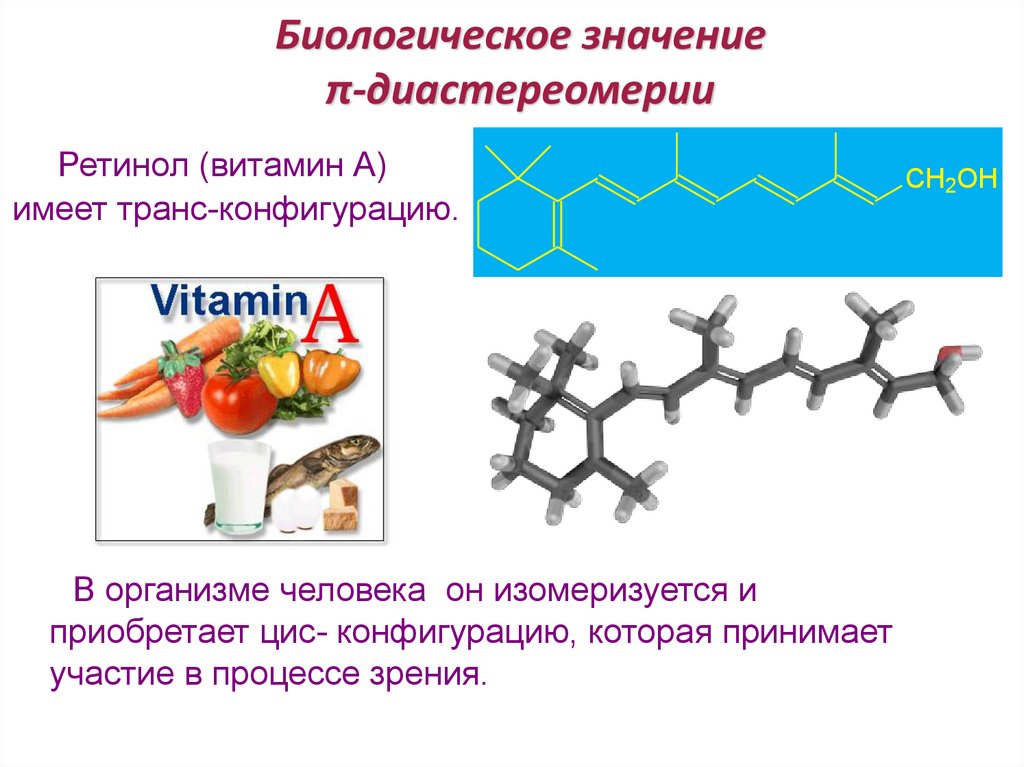
Биологическое значениеπ-диастереомерии
Ретинол (витамин А)
имеет транс-конфигурацию.
В организме человека он изомеризуется и
приобретает цис- конфигурацию, которая принимает
участие в процессе зрения.
CH2OH
77.
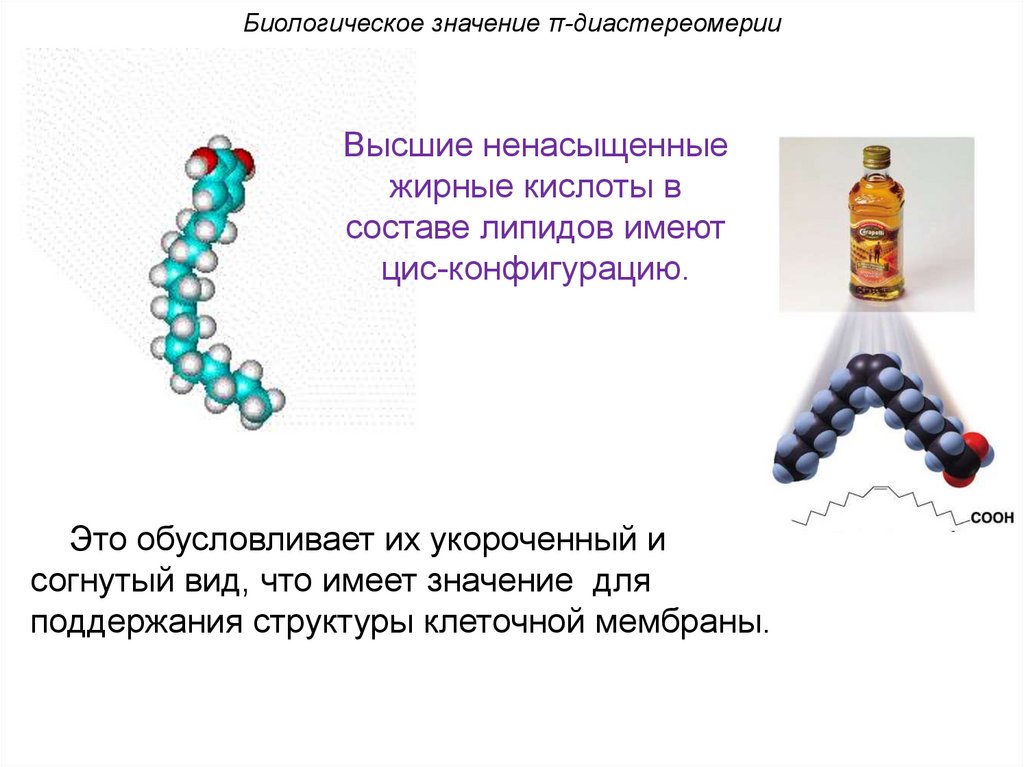
Биологическое значение π-диастереомерииВысшие ненасыщенные
жирные кислоты в
составе липидов имеют
цис-конфигурацию.
Это обусловливает их укороченный и
согнутый вид, что имеет значение для
поддержания структуры клеточной мембраны.
78.
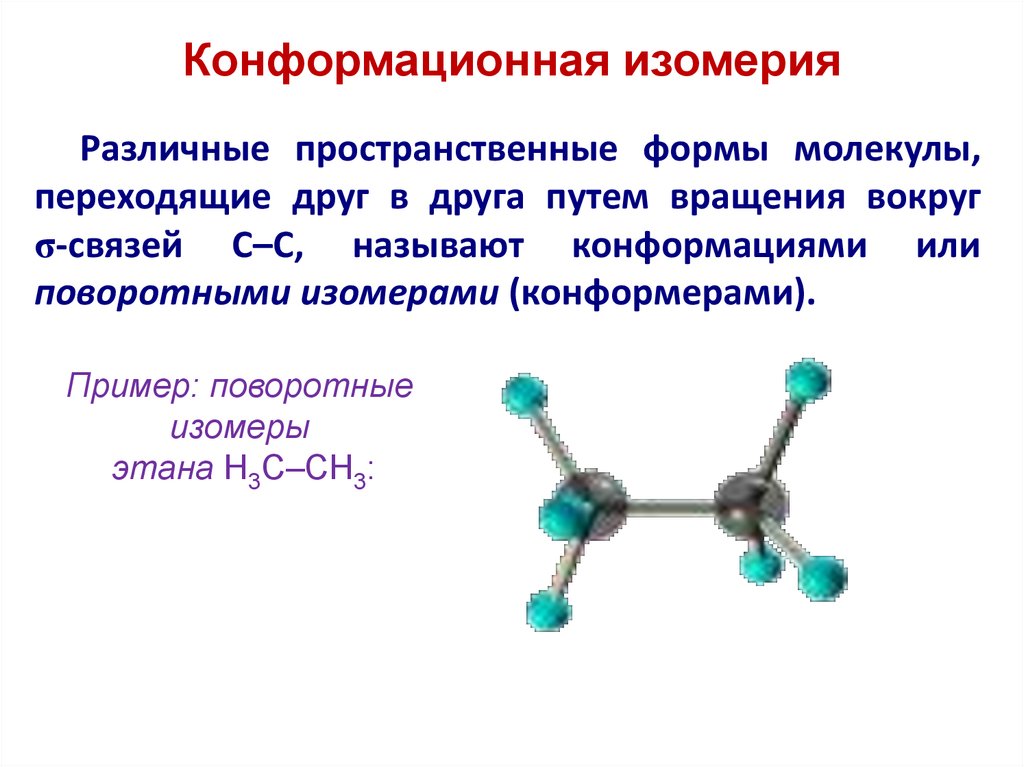
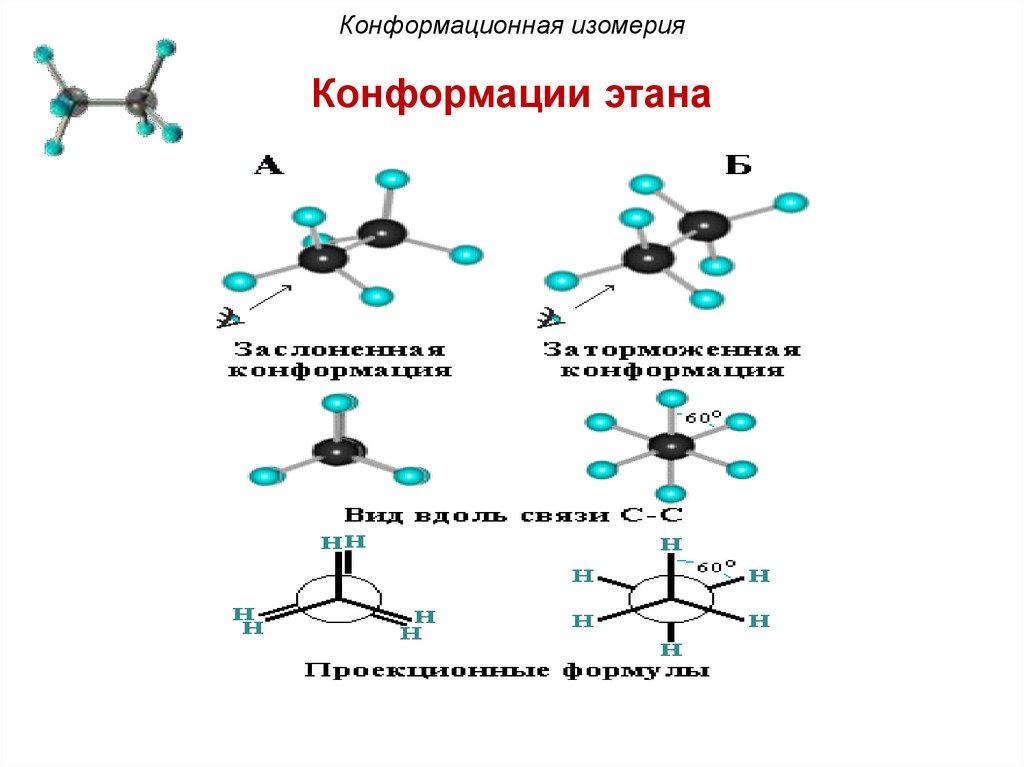
Конформационная изомерияРазличные пространственные формы молекулы,
переходящие друг в друга путем вращения вокруг
σ-связей С–С, называют конформациями или
поворотными изомерами (конформерами).
Пример: поворотные
изомеры
этана Н3С–СН3:
79.
Конформационная изомерияДля представления конформаций на плоскости
используют формулы Ньюмена и стереохимические
формулы. Две крайние конформации называют
заслоненной и заторможенной.
В заслоненной конформации этана атомы водорода
метальных групп, если смотреть вдоль связи углеродуглерод, расположены друг за другом. В заторможенной –
атомы водорода одной метильной группы максимально
удалены от атомов водорода другой. Между заслоненной
и заторможенной конформацией молекула в процессе
вращения принимает множество скошенных (гош-)
конформаций.
80.
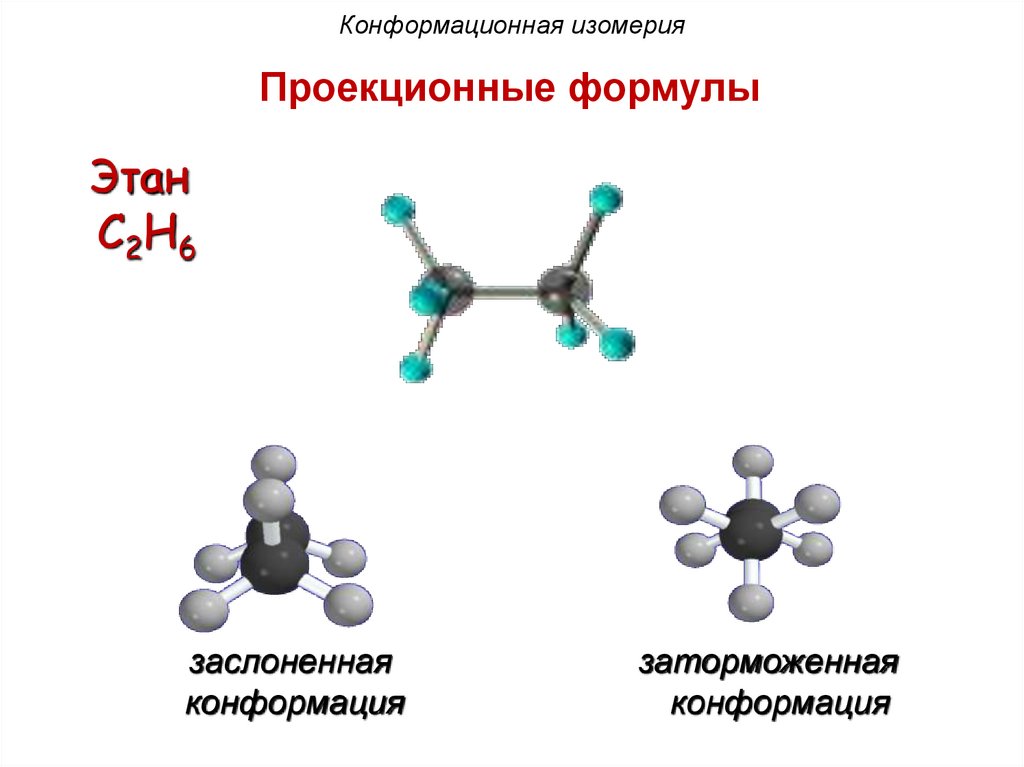
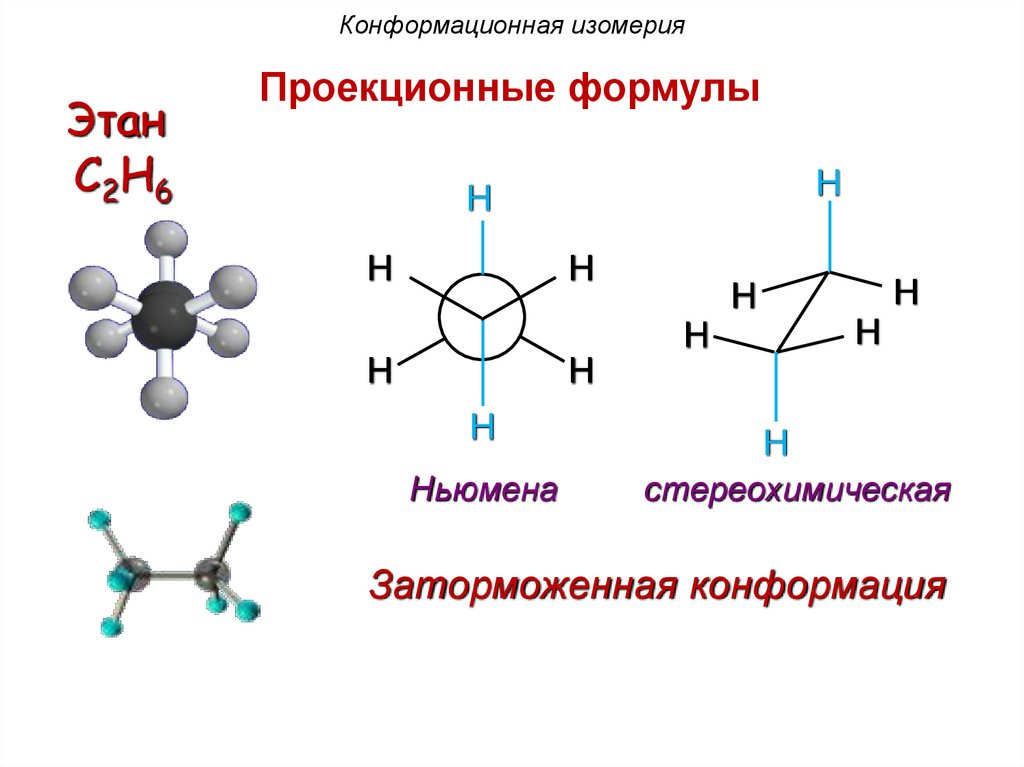
Конформационная изомерияПроекционные формулы
Этан
C2H6
заслоненная
конформация
заторможенная
конформация
81.
Конформационная изомерияЭтан
C2H6
Проекционные формулы
H
H
H
H
H
H
H
H
H
H
H
Ньюмена
H
стереохимическая
Заторможенная конформация
82.
Конформационная изомерияПроекционные формулы
H
H
H
H
180°
H
H
H
H
H
H
H
H
анти-связи
Заторможенная конформация
83.
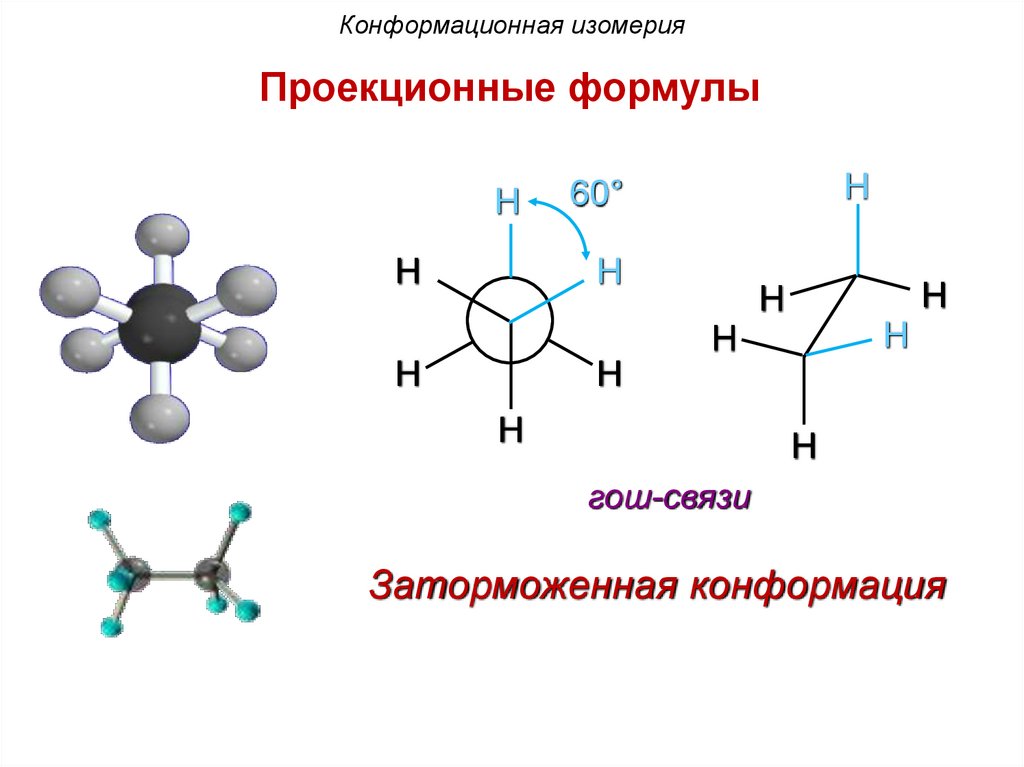
Конформационная изомерияПроекционные формулы
H
H
H
60°
H
H
H
H
H
H
H
H
H
гош-связи
Заторможенная конформация
84.
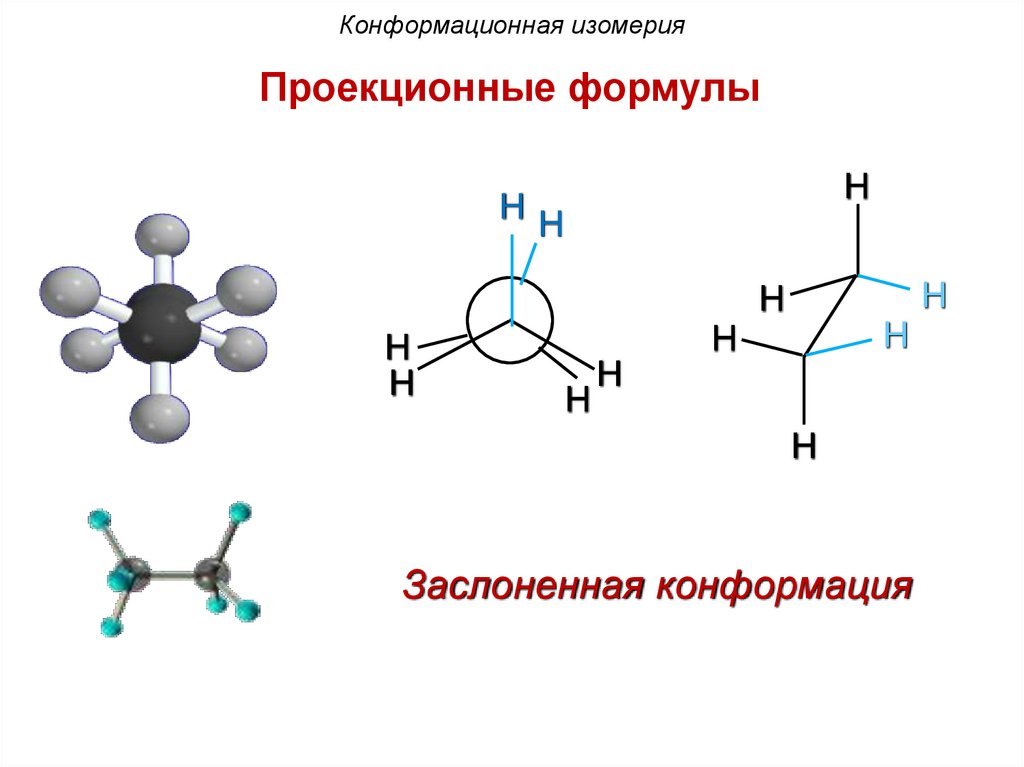
Конформационная изомерияПроекционные формулы
H
HH
H
H
H
H
H
H
H
H
H
Заслоненная конформация
85.
Конформационная изомерияКонформации этана
86.
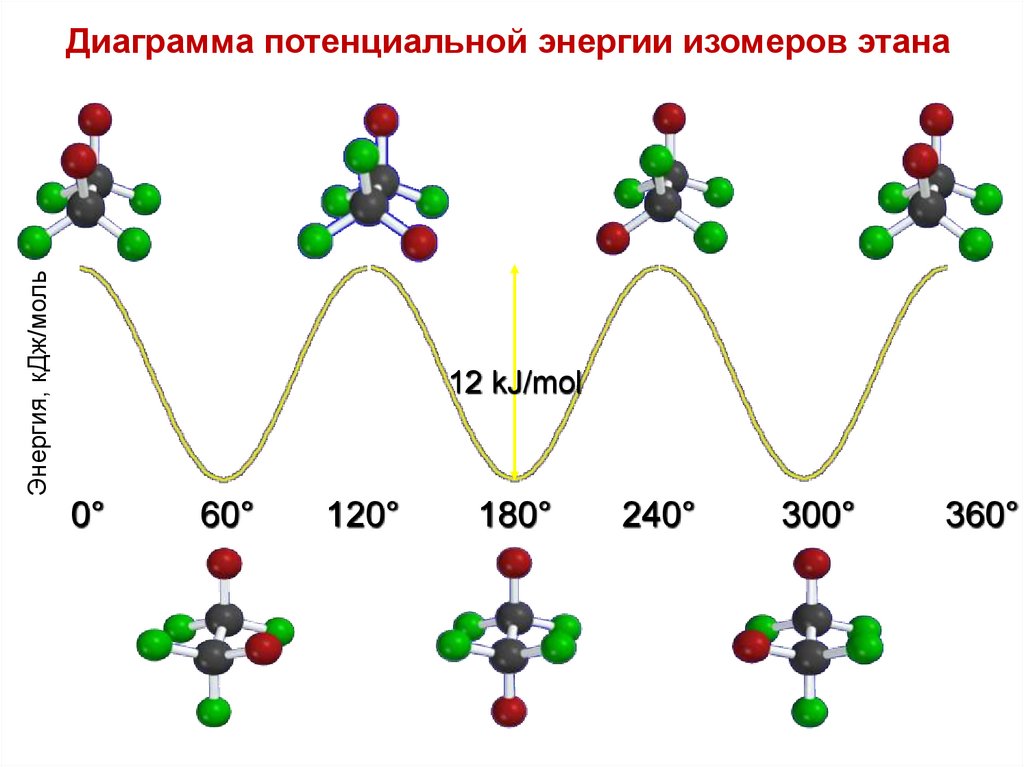
Энергия, кДж/мольДиаграмма потенциальной энергии изомеров этана
12 kJ/mol
0°
60°
120°
180°
240°
300°
360°
87.
Конформационная изомерияКонформации пропана
88.
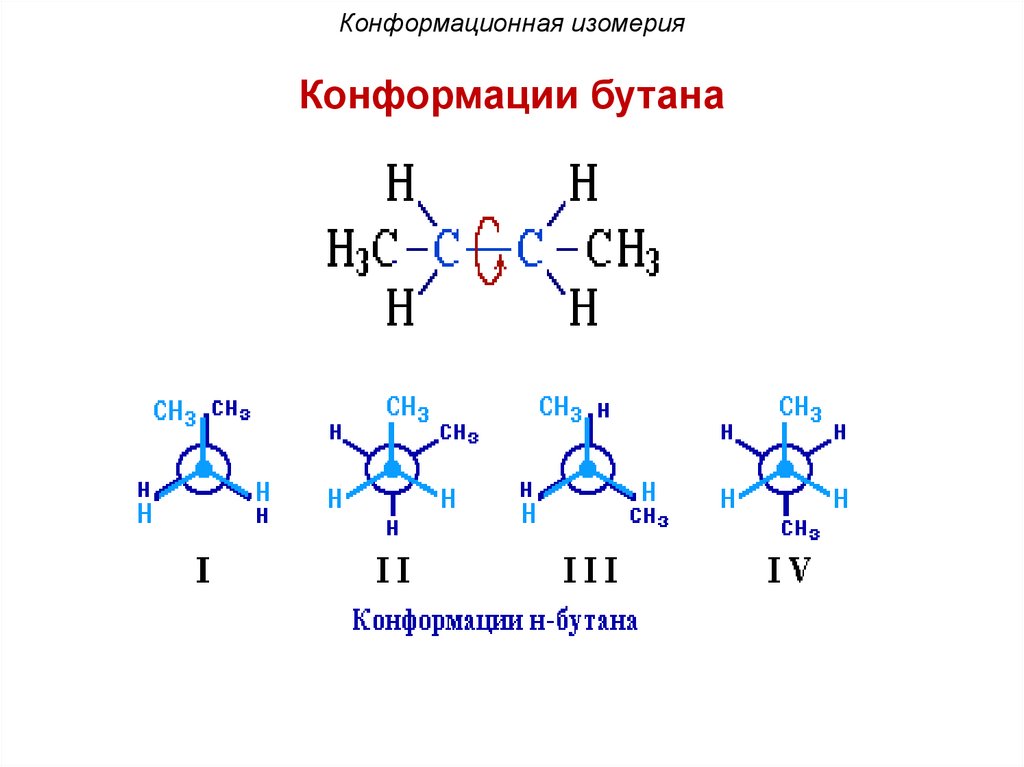
Конформационная изомерияКонформации бутана
89.
Конформационная изомерияКонформации бутана
90.
Энергия, кДж/мольДиаграмма потенциальной энергии изомеров бутана
0°
60°
120°
180°
240°
300°
360°
91.
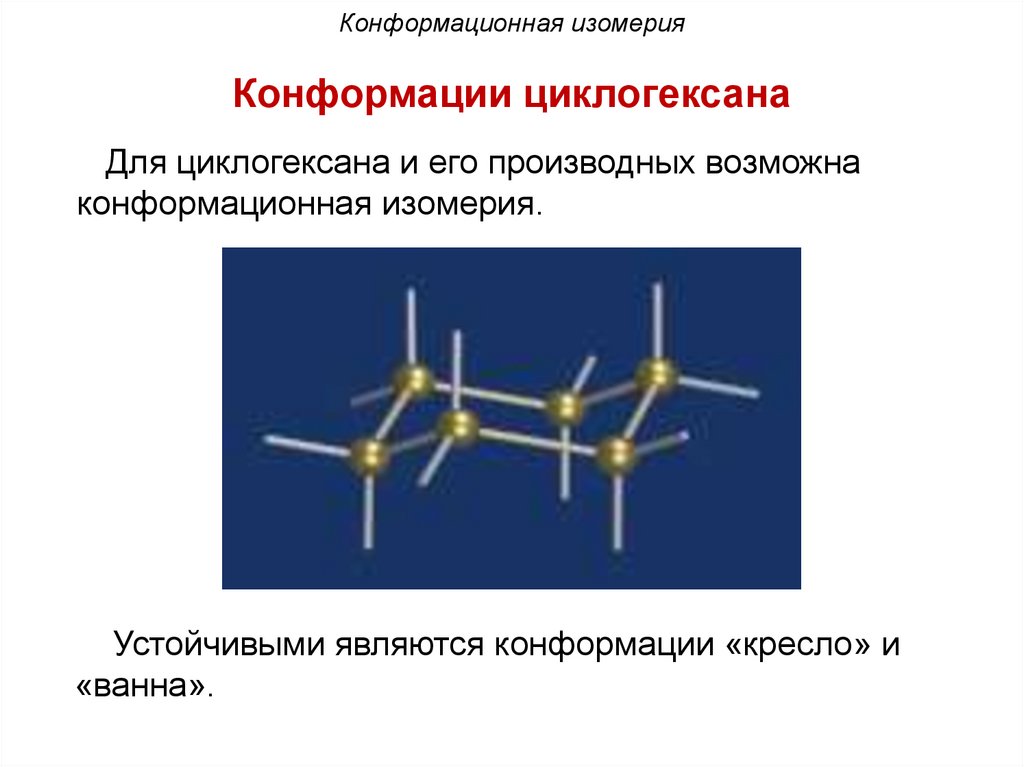
Конформационная изомерияКонформации циклогексана
Для циклогексана и его производных возможна
конформационная изомерия.
Устойчивыми являются конформации «кресло» и
«ванна».
92.
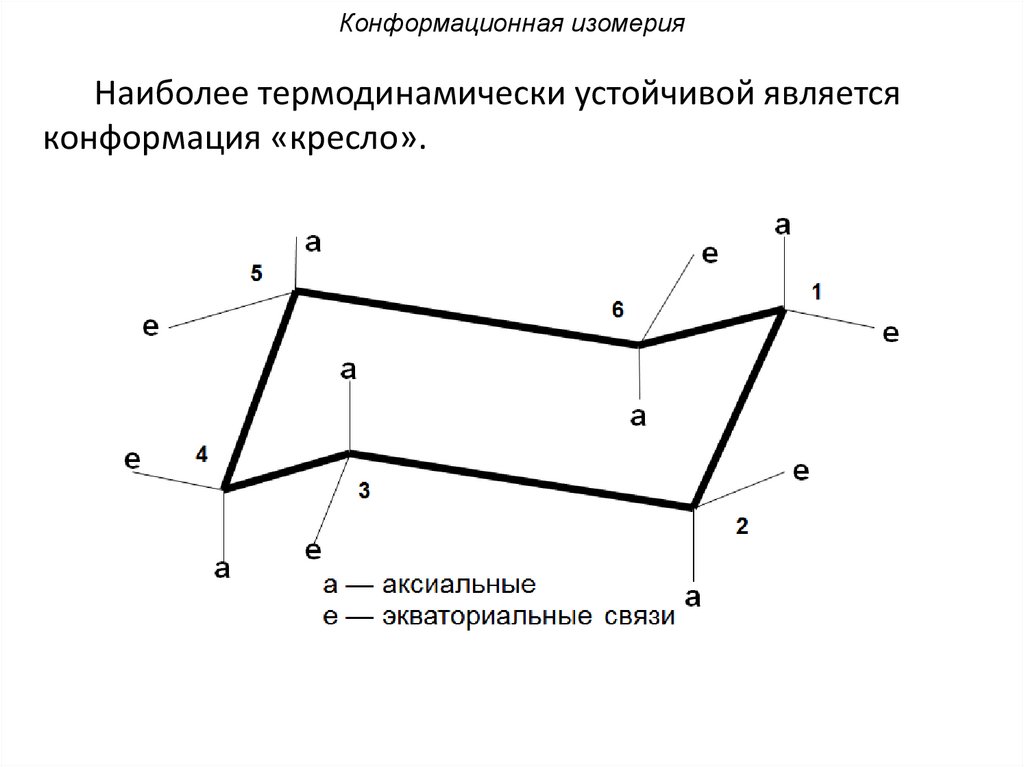
Конформационная изомерияНаиболее термодинамически устойчивой является
конформация «кресло».
93.
Спасибо заВаше
внимание!





































 Химия
Химия








