Похожие презентации:
Качественные реакции на ионы
1.
Качественные реакции на ионы2.
Цель: Научиться определять ионы с помощьюкачественных реакций. Выучить качественные реакции
на некоторые ионы.
Ионы отличаются от атомов строением и свойствами.
Некоторые ионы бесцветны, а другие имеют
определённый цвет.
Например: ионы меди Cu 2+ имеют голубой цвет
ионы железа Fe 3+ имеют жёлтый цвет
ионы никеля Ni 2+ имеют ярко-зелёный цвет
ионы Zn 2+, Al 3+, Ba 2+ бесцветные
3.
Раствор содержащий ионы Cu 2+например: CuSO4, CuCl2
Раствор содержащий ионы Fe 3+
например: FeCl3, Fe2(SO4)3
4.
Для каждого иона характерны специфические химическиесвойства, т.е. нужно провести качественную реакцию.
Качественная реакция – это реакция позволяющая
доказать наличие того или иного вещества (иона) в среде
или присутствие функциональной группы в веществе.
С точки зрения наблюдаемых эффектов все реакции
обнаружения можно разделить на несколько групп:
1). Образование характерных осадков
2). Растворение вещества
3). Появление (изменение) окраски
4). Выделение газов
5). Изменение запаха
6). Окрашивание пламени
5.
Вещество, с помощью которого доказывается наличиедругого вещества, называется реактивом на
определяемое вещество.
Чтобы определить катион в растворе, нужно знать какой
анион способен его осадить и наоборот. Поэтому для
проведения реакций нужно выбрать растворимые соли,
содержащие эти катионы или анионы.
Катион – это положительно заряженный ион.
Анион – это отрицательно заряженный ион.
6.
7.
8.
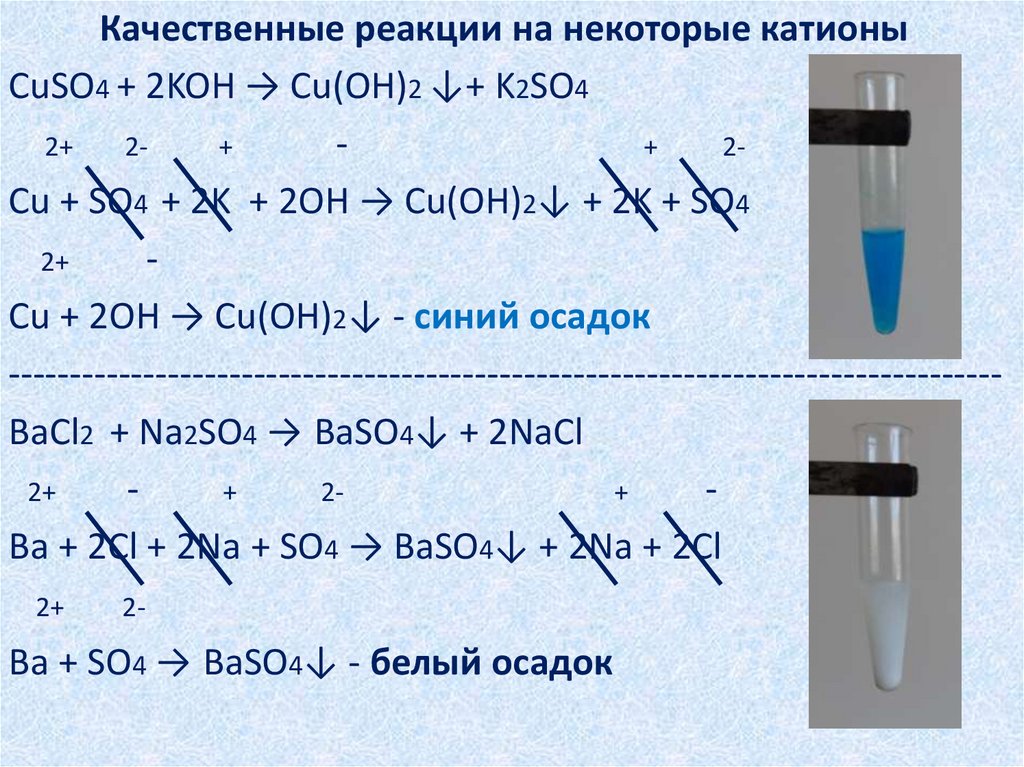
Качественные реакции на некоторые катионыCuSO4 + 2KOH → Cu(OH)2 ↓+ K2SO4
2+
2+
+
2Cu + SO4 + 2K + 2OH → Cu(OH)2↓ + 2K + SO4
2+
Cu + 2OH → Cu(OH)2↓ - синий осадок
--------------------------------------------------------------------------------BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
2+
+
2+
Ba + 2Cl + 2Na + SO4 → BaSO4↓ + 2Na + 2Cl
2+
2-
Ba + SO4 → BaSO4↓ - белый осадок
9.
FeSO4 + 2KOH → Fe(OH)2↓+ K2SO42+
2+
+
2Fe + SO4 + 2K + 2OH → Fe(OH)2↓ + 2K + SO4
2+
Fe + 2OH → Fe(OH)2↓ - зелёный осадок
--------------------------------------------------------------------------------FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
3+
+
+
Fe + 3Cl + 3K + 3OH → Fe(OH)3↓ + 3K + 3Cl
3+
Fe + 3OH → Fe(OH)3↓ - бурый осадок
10.
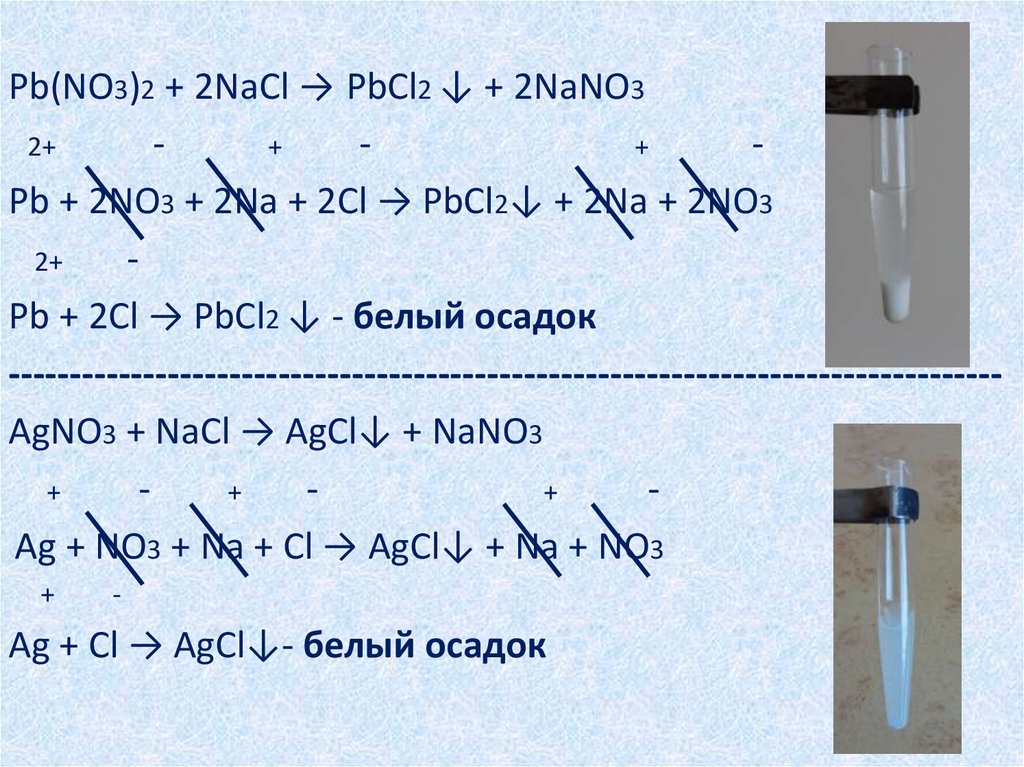
Pb(NO3)2 + 2NaCl → PbCl2 ↓ + 2NaNO32+
+
+
Pb + 2NO3 + 2Na + 2Cl → PbCl2↓ + 2Na + 2NO3
2+
Pb + 2Cl → PbCl2 ↓ - белый осадок
--------------------------------------------------------------------------------AgNO3 + NaCl → AgCl↓ + NaNO3
+
+
+
Ag + NO3 + Na + Cl → AgCl↓ + Na + NO3
+
-
Ag + Cl → AgCl↓- белый осадок
11.
Качественные реакции на некоторые анионыKI + AgNO3 → AgI↓ + KNO3
+ +
+
K + I + Ag + NO3 → AgI↓ + K + NO3
-
+
I + Ag → AgI↓ - жёлтый осадок
--------------------------------------------------------------------------------KCl + AgNO3 → AgCl↓ + KNO3
+
- +
+
K + Cl + Ag +NO3 → AgCl↓ + K + NO3
+
Ag + Cl → AgCl↓ - белый осадок
12.
K2SO4 + BaCl2 → BaSO4↓ + 2KCl+
22+
+
2K + SO4 + Ba + 2Cl → BaSO4↓ + 2K + 2Cl
2-
2+
SO4 + Ba → BaSO4↓ - белый осадок
--------------------------------------------------------------------------------Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl
+
22+
+
2Na + CO3 + Ca + 2Cl → CaCO3↓ + 2Na + 2Cl
2-
2+
CO3 + Ca → CaCO3↓ - белый осадок
13.
Na2SiO3 + 2HNO3 → H2SiO3↓ + 2NaNO3+
2+
+
2Na + SiO3 + 2H + 2NO3 → H2SiO3↓ + 2Na + 2NO3
2-
+
SiO3 + 2H → H2SiO3↓ - белый студенистый осадок
14.
Вопросы для повторения1). Чем отличаются ионы от атомов? –
2). Реакция, позволяющая доказать наличие того или
иного вещества (иона) в среде или присутствие
функциональной группы, называется –
3). Вещество, с помощью которого доказывается наличие
другого вещества, называется –
4). Какой цвет имеют ионы меди? –
5). Какой цвет имеет гидроксид железа (II) ? –
6). Какой цвет имеют ионы железа (III) ? –
7). Положительно заряженные ионы – это
8). Отрицательно заряженные ионы – это









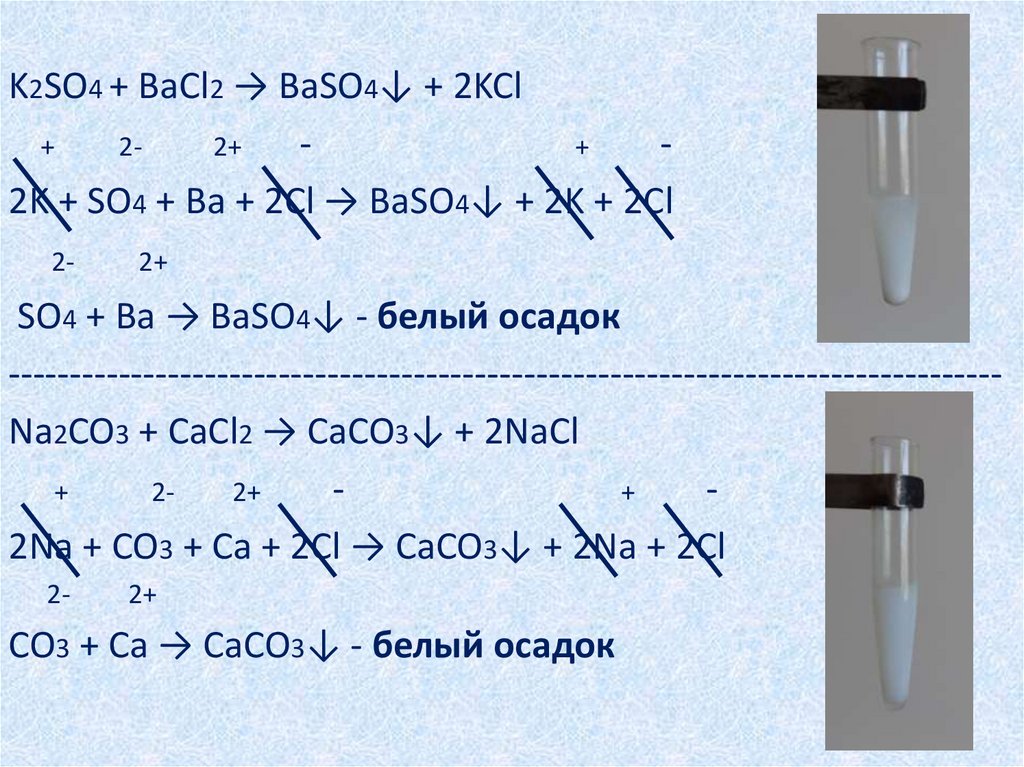


 Химия
Химия








