Похожие презентации:
Соли урана (лекция 5)
1.
Соли уранаЛекция 5
Шагалов Владимир Владимирович
2.
Соли уранаСоль – класс химических соединений
состоящих из анионов и катионов
Исходя из определения – любое бинарное или
тройное соединение можно рассматривать как
соль
Условно будем рассматривать как соли только
соединения урана с минеральными или
органическими кислотами
2
Шагалов Владимир Владимирович
3.
Соли уранаНаиболее устойчивые степени окисления
урана в солях U+4 и U+6
Также возможно образование
неустойчивых трех и пяти валентных
состояний U+3, U+5
3
Шагалов Владимир Владимирович
4.
Соли уранаХимия солей
урана цветная
U+3 - красный
U+4 - зеленый
U+5 - прозрачный
U+6 - желтый
Бывают исключения
4
Шагалов Владимир Владимирович
5.
Соли урана 3+Соли трехвалентного урана неустойчивы соединения
медленно окисляющиеся водой до U+4
Разбавленные растворы имеют розовую окраску,
концентрированные винно-красную.
Могут существовать в растворах только в
присутствии восстановителей
Наиболее устойчивые соли U+3 – фториды, хлориды
и бромиды рассмотрены ранее
5
Шагалов Владимир Владимирович
6.
Получение солей урана 3+Электролиз растворов U+4 в инертной атмосфере
U+4 → U+3 + ē
Восстановление растворов U+4 атомарным водородом
U+4 + Н → U+3 + Н+
6
Шагалов Владимир Владимирович
7.
Соли урана 3+Практического значения в технологии ядерного
топлива не имеют
7
Шагалов Владимир Владимирович
8.
Соли урана 4+Соли четырехвалентного урана стабильные
соединения в инертной атмосфере в присутствии
окислителей переходят в шестивалентные.
Цвет растворов от светло до темно зеленого
Наиболее важные соли: сульфат и оксалат
Выше были рассмотрены фторид, хлорид, бромид
8
Шагалов Владимир Владимирович
9.
Сульфат урана 4+Из всех водорастворимых соединений
четырехвалентного урана наибольшее значение
имеет сульфат урана и его комплексные
производные
Растворимость ≈ 10 % масс.
9
Шагалов Владимир Владимирович
10.
Сульфат урана 4+Взаимодействует с водой с образованием
малорастворимого основного сульфата
U(SO4)2 + H2O ↔ UOSO4↓+ H2SO4
В кислых средах равновесие смещено влево, также
высокая кислотность увеличивает устойчивость к
окислению
10
Шагалов Владимир Владимирович
11.
Получение сульфата урана 4+Окислительные методы (степень окисления < 4)
U + H2SO4(конц) → U(SO4)2 + H2
UH3 + H2SO4 → U(SO4)2 + H2
11
Шагалов Владимир Владимирович
12.
Получение сульфата урана 4+Обменные методы (степень окисления = 4)
200-240
UO2 + H2SO4(конц) → U(SO4)2 + H2O
U(OH)4 + H2SO4 → U(SO4)2 + H2O
UF4 + H2SO4 → U(SO4)2 + HF
UF4 + H2SO4 + SiO2 → U(SO4)2 + SiF4 ↑+ H2O
12
Шагалов Владимир Владимирович
13.
Получение сульфата урана 4+Восстановительные методы (степень окисления > 4)
UO2SO4+ H2SO4 + Zn → U(SO4)2 + ZnSO4 + H2O
•H2SO4 + Zn → ZnSO4 + H2
•UO2SO4+ H2SO4 + H2 → U(SO4)2 + H2O
UO2(SO4) + Тi2(SO4)3 U(SO4)2 + 2ТiOSO4
13
Шагалов Владимир Владимирович
14.
Получение сульфата урана 4+Восстановительные методы (степень окисления > 4)
Электролиз растворов
UO2SO4+ H2SO4 → U(SO4)2 + H2O + O2
на катоде:
UO22- + 2ē + 4Н+ ⇄ U4+ + 2H2O
на аноде:
SО42- – 2ē ⇄ SO3 + 1/2О2↑
SO3 + H2O = Н2SO4
S О42- – 2ē + H2O ⇄ Н2SO4 + 1/2O2↑
14
Шагалов Владимир Владимирович
15.
Получение сульфата урана 4+Из водных растворов сульфат урана выделяется в
виде кристаллогидрата
U(SO4)2∙nH2O
n = 2, 4, 5, 6, 8, 9
15
Шагалов Владимир Владимирович
16.
Получение сульфата урана 4+Дегидратация протекает по схеме:
U(SO4)2‧8H2O
о
U(SO4)2‧4H2O
68 C
о
U(SO4)2‧4H2O
U(SO4)2‧2H2O
200 C
135
U(SO4)2‧2H2O
C
о
U(SO4)2‧0,5H2O
о
300 C
U(SO4)2‧0,5H2O 250
U(SO4)2 (б/в)
U(SO4)2 (б/в)
UO2SO4
о
400 C
900
о
C
окисление до UO2SO4
U3O8
Может быть обезвожен без разложения
16
Шагалов Владимир Владимирович
17.
Получение сульфата урана 4+Соли четырех и шести валентного урана в следствие
малого ионного радиуса и большого заряда
склонены к комплексообразованию
U(SO4)2 + H2SO4 → H2[U(SO4)3]
H2[U(SO4)3] + H2SO4 → H4[U(SO4)4]
17
Комплексные сульфаты урана хорошо растворимы
Шагалов Владимир Владимирович
18.
Оксалат урана 4+Одно из наиболее устойчивых соединений U4+
Кристаллическое вещество темно-зеленого цвета
Плохо растворим в воде и кислотах
Из водных растворов кристаллизуется в виде
кристаллогидрата
U(С2O4)2∙6H2O
18
Шагалов Владимир Владимирович
19.
Оксалат урана 4+Растворимость в воде и разбавленных
кислотах: 25 мг/л
Растворимость в кислотах (0,1 N, H2SO4, HCl, HNO3):
10 мг/л
19
Шагалов Владимир Владимирович
20.
Получение оксалат урана 4+Безводный оксалат урана возможно получить
прокалкой
U(С2O4)2∙6H2O
U(C2O4)2
270 300
о
C
325 350
о
C
U(С2O4)2 + 6H2O
UO2 + CO2 + CO
20
Шагалов Владимир Владимирович
21.
Комплексообразование оксалата урана 4+Образует хорошо растворимые комплексы подобно
сульфату урана
U(С2O4)2 + H2С2O4 → H2[U(С2O4)3]
H2[U(С2O4)3] + H2С2O4 → H4[U(С2O4)4]
21
Шагалов Владимир Владимирович
22.
Соли урана 6++6 наиболее характерная степень окисления урана
В водных растворах шестивалентный уран находится
в виде очень устойчивого иона уранила
Устойчивость связана с образованием
дополнительной связи между ураном и
кислородом
О=Э=О
22
Шагалов Владимир Владимирович
23.
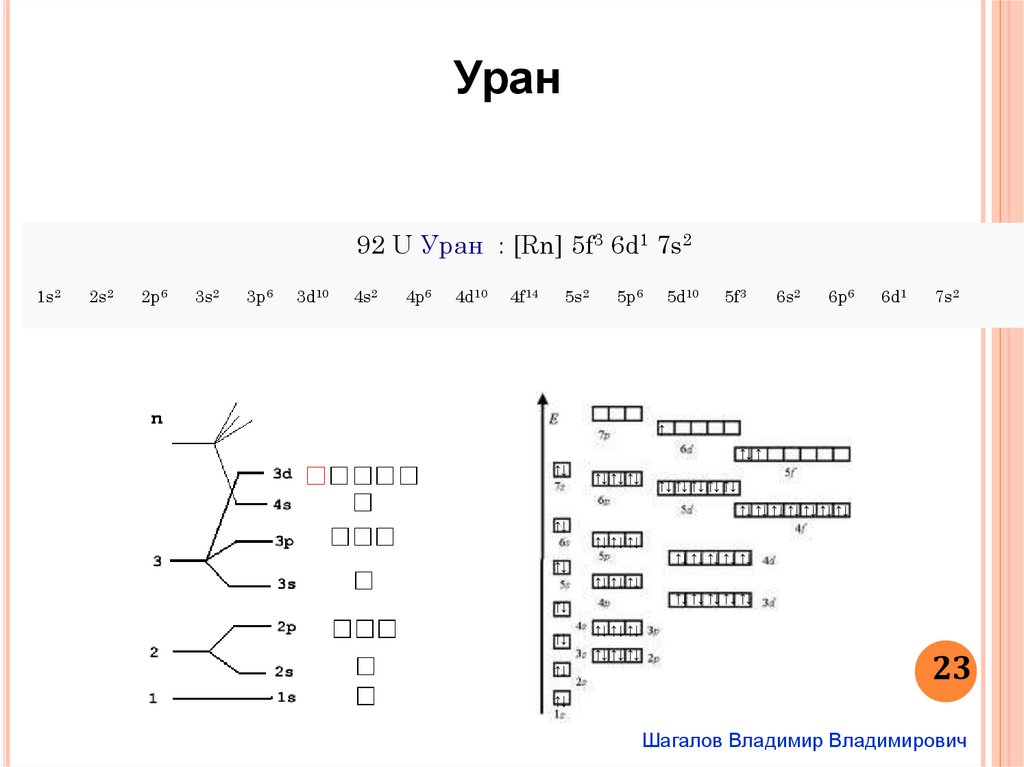
Уран92 U Уран : [Rn] 5f3 6d1 7s2
1s2
2s2
2p6
3s2
3p6
3d10
4s2
4p6
4d10
4f14
5s2
5p6
5d10
5f3
6s2
6p6
6d1
7s2
↑
↑↓ ↑
↑↓
↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
↑↓
↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓
↑↓
23
↑↓
Шагалов Владимир Владимирович
24.
Нитрат уранилаНитрат уранила – желтый кристаллический порошок,
хорошо растворимый в воде, из водных растворов
выделяется в виде кристаллогидратов.
Имеет большое распространение в экстракции
нейтральными экстрагентами
UO2(NO3)2 + 2ТБФ → UO2(NO3)2∙ТБФ
24
Шагалов Владимир Владимирович
25.
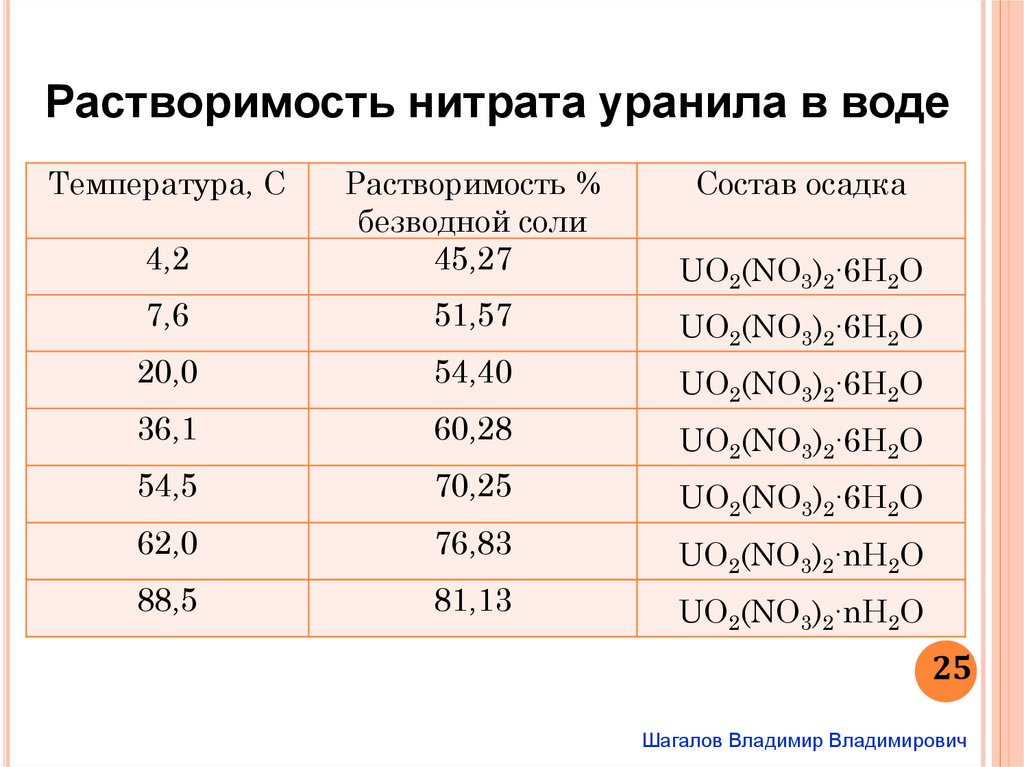
Растворимость нитрата уранила в водеТемпература, С
4,2
Растворимость %
безводной соли
45,27
Состав осадка
7,6
51,57
UO2(NO3)2∙6H2O
20,0
54,40
UO2(NO3)2∙6H2O
36,1
60,28
UO2(NO3)2∙6H2O
54,5
70,25
UO2(NO3)2∙6H2O
62,0
76,83
UO2(NO3)2∙nH2O
88,5
81,13
UO2(NO3)2∙nH2O
UO2(NO3)2∙6H2O
25
Шагалов Владимир Владимирович
26.
Растворимость нитрата уранила ворганических растворителях
Растворитель
Изоамилацетат
Растворимость %
безводной соли
44,0
Трибутилфосфат
43,5
Диэтиловый эфир
42,0
вода
57,2
26
Шагалов Владимир Владимирович
27.
Нитрат уранилаИз водных растворов кристаллизуется в виде
кристаллогидрата
UO2(NO3)2∙nH2O
n = 2, 3, 6, 24
Количество кристаллизационной влаги зависит от
условий получения (температуры и концентрации
азотной кислоты)
27
Шагалов Владимир Владимирович
28.
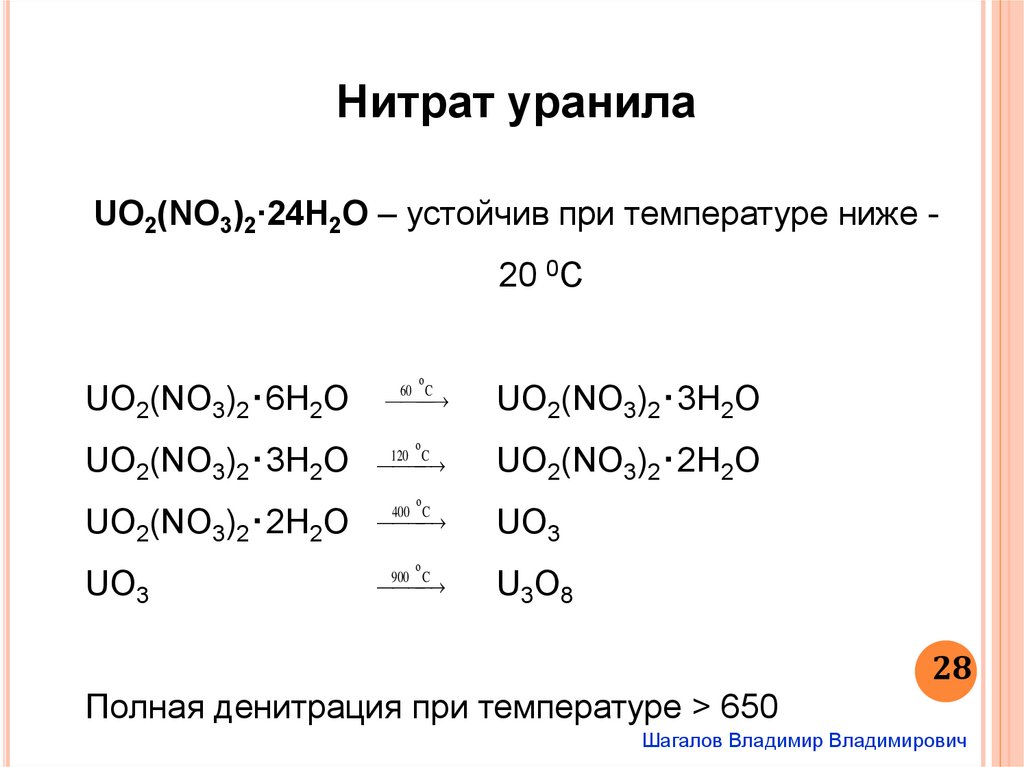
Нитрат уранилаUO2(NO3)2∙24H2O – устойчив при температуре ниже -
20 0С
о
UO2(NO3)2‧6H2O
UO2(NO3)2‧3H2O
UO2(NO3)2‧3H2O
о
UO2(NO3)2‧2H2О
UO2(NO3)2‧2H2О
UО3
60 C
120 C
о
400 C
о
900 C
UО3
U3O8
28
Полная денитрация при температуре > 650
Шагалов Владимир Владимирович
29.
Нитрат уранилаПлотность нитрата уранила
UO2(NO3)2‧6H2O – 2,742 г/см3
UO2(NO3)2‧3H2O – 2,93 г/см3
UO2(NO3)2‧2H2О – 3,35 г/см3
29
Шагалов Владимир Владимирович
30.
Сульфат уранилаКроме безводного сульфата уранила существует 9
кристаллогидратов. Наиболее устойчивыми
являются моно и тригидрат уранила. Хорошо
растворимые в воде
Тригидрат сульфата уранила – осаждается из
слабокислых растворов при низких температурах
Моногидрат сульфата уранила – осаждается в
сильнокислых растворох при высоких
30
температурах
Шагалов Владимир Владимирович
31.
Растворимо стьUO 2SO 4, % масс.
75
Сульфат уранила
50
1
25
2
3
0
25
4
5
50
100
75
[H2SO4], % масс.
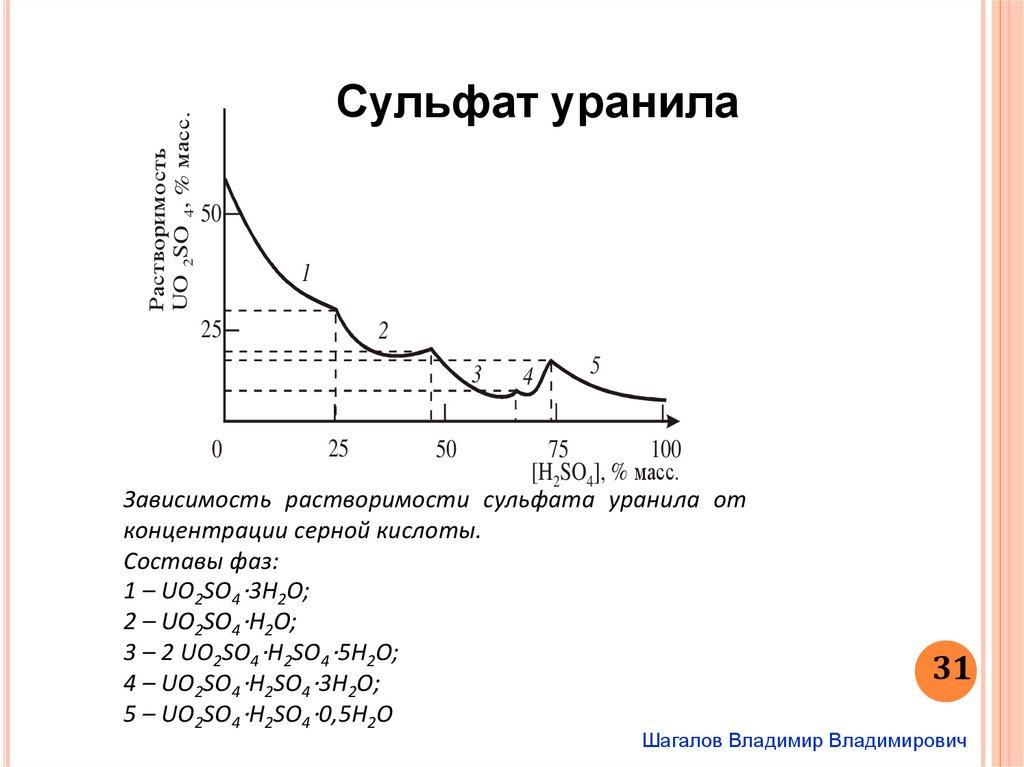
Зависимость растворимости сульфата уранила от
концентрации серной кислоты.
Составы фаз:
1 – UO2SO4‧3Н2О;
2 – UO2SO4‧Н2О;
3 – 2 UO2SO4‧Н2SО4‧5Н2О;
4 – UO2SO4‧Н2SО4‧3Н2О;
5 – UO2SO4‧Н2SО4‧0,5Н2О
31
Шагалов Владимир Владимирович
32.
Сульфата уранилаВ слабокислых сульфатных средах сульфат урана
склонен к комплексообразованию
UO2SO4 + H2SO4 → H2[UO2(SO4)2]
H2[UO2(SO4)2] + H2SO4 → H4[UO2(SO4)3]
32
Шагалов Владимир Владимирович
33.
Сульфат уранилаВ растворе существует подвижное равновесие
33
Шагалов Владимир Владимирович
34.
Карбонат уранилаБезводный карбонат уранила – твердое вещество,
кристаллизующееся в виде пластинок желтого
цвета
Плотность – 5,24 г/см3
Получают
UO3 + СО2
PCO 15 20 атм
2
UO2CO3
Практического применения не имеет
34
Шагалов Владимир Владимирович
35.
Карбонат уранила (УТК)В водных растворах карбонатов уранил существует
только в виде комплексных соединений
M4[UO2(CO3)3]; К = 2∙1018
М2[UO2(CO3)2(H2O)2];
М6[(UO2)2(CO3)5(H2O)2]·H2O;
М3[(UO2)2(CO3)3(OH)(H2O)5];
М[UO2CO3(ОН)(H2O)3] и др.
35
Шагалов Владимир Владимирович
36.
Уранил трикарбонатM4[UO2(CO3)3] – устойчивое, хорошо растворимое
соединение (~100 г/л); в технологии наиболее
распространен АУТК – аммоний уранил
трикарбонат и натрий уранил трикарбонат
Na4[UO2(CO3)3]
(NH4)4[UO2(CO3)3]
36
Шагалов Владимир Владимирович
37.
Растворимость уранил трикарбонатанатрия
Температура, С
Растворимость
Na4[UO2(CO3)3] , гU/л
18
66
30
50
60
40
90
33
37
Шагалов Владимир Владимирович
38.
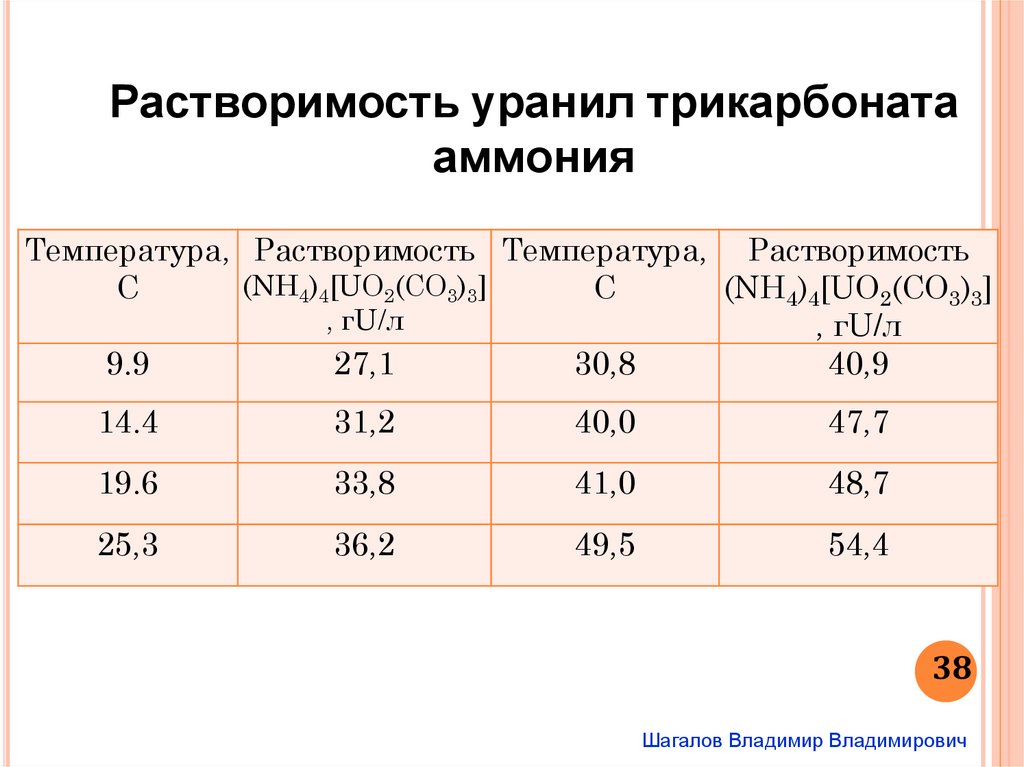
Растворимость уранил трикарбонатааммония
Температура, Растворимость Температура, Растворимость
(NH4)4[UO2(CO3)3]
С
С
(NH4)4[UO2(CO3)3]
, гU/л
, гU/л
9.9
27,1
30,8
40,9
14.4
31,2
40,0
47,7
19.6
33,8
41,0
48,7
25,3
36,2
49,5
54,4
38
Шагалов Владимир Владимирович
39.
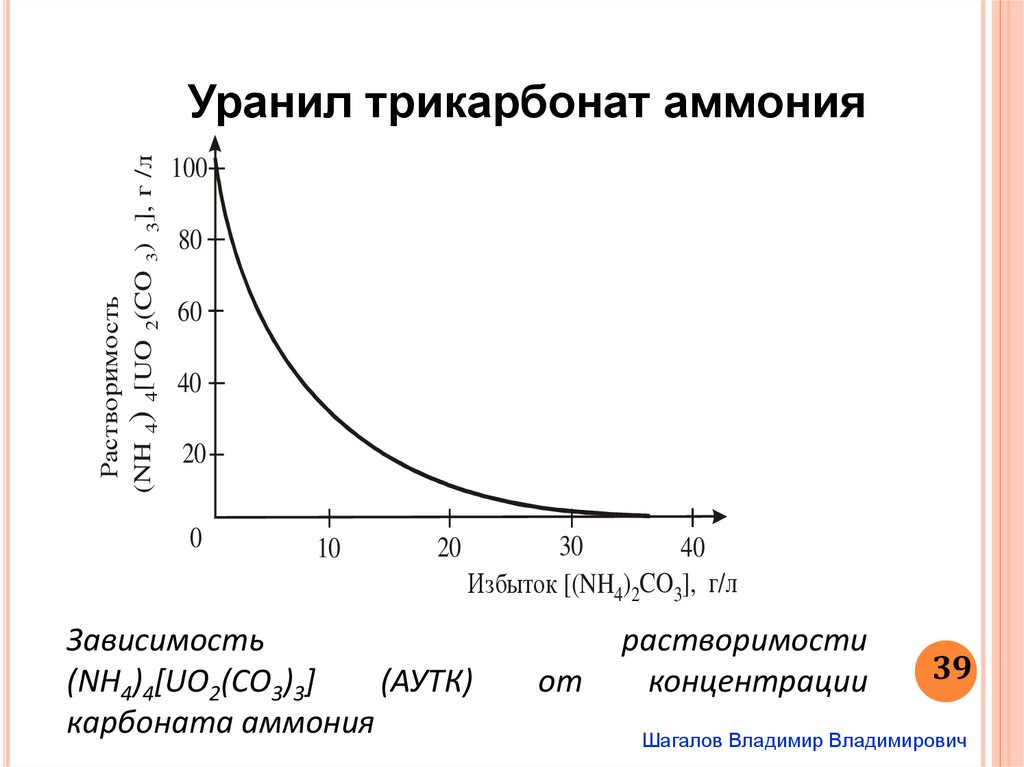
Растворимо сть(NH 4) 4[UO 2(CO 3) 3], г /л
Уранил трикарбонат аммония
100
80
60
40
20
0
10
20
30
40
Избыток [(NH4)2CO3], г/л
Зависимость
(NH4)4[UO2(СO3)3]
(АУТК)
карбоната аммония
от
растворимости
концентрации
39
Шагалов Владимир Владимирович
40.
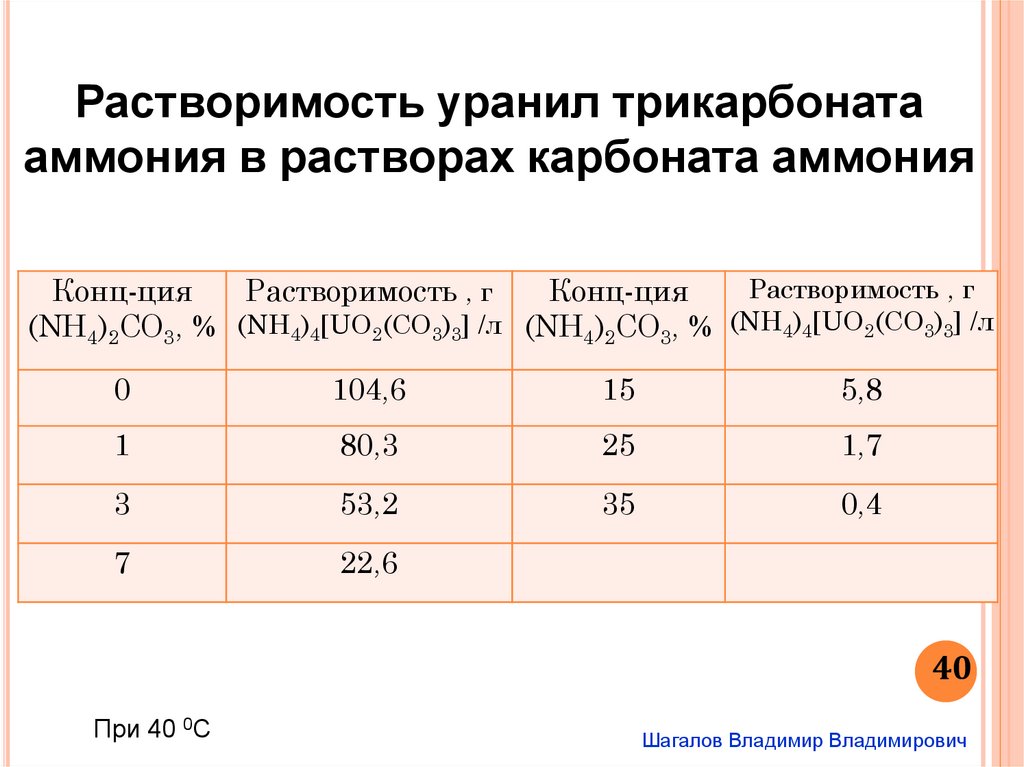
Растворимость уранил трикарбонатааммония в растворах карбоната аммония
Растворимость , г
Конц-ция
Растворимость , г
Конц-ция
(NH4)2CO3, % (NH4)4[UO2(CO3)3] /л (NH4)2CO3, % (NH4)4[UO2(CO3)3] /л
0
104,6
15
5,8
1
80,3
25
1,7
3
53,2
35
0,4
7
22,6
40
При 40 0С
Шагалов Владимир Владимирович
41.
Уранил трикарбонатПолучение
Разложение
41
Шагалов Владимир Владимирович
42.
Оксалат уранилаОксалат уранила образуется при действии щавелевой
кислоты или оксалатов щелочных металлов на
растворы уранила. При осаждении из растворов
образуются моно, ди и три гидраты.
42
Шагалов Владимир Владимирович
43.
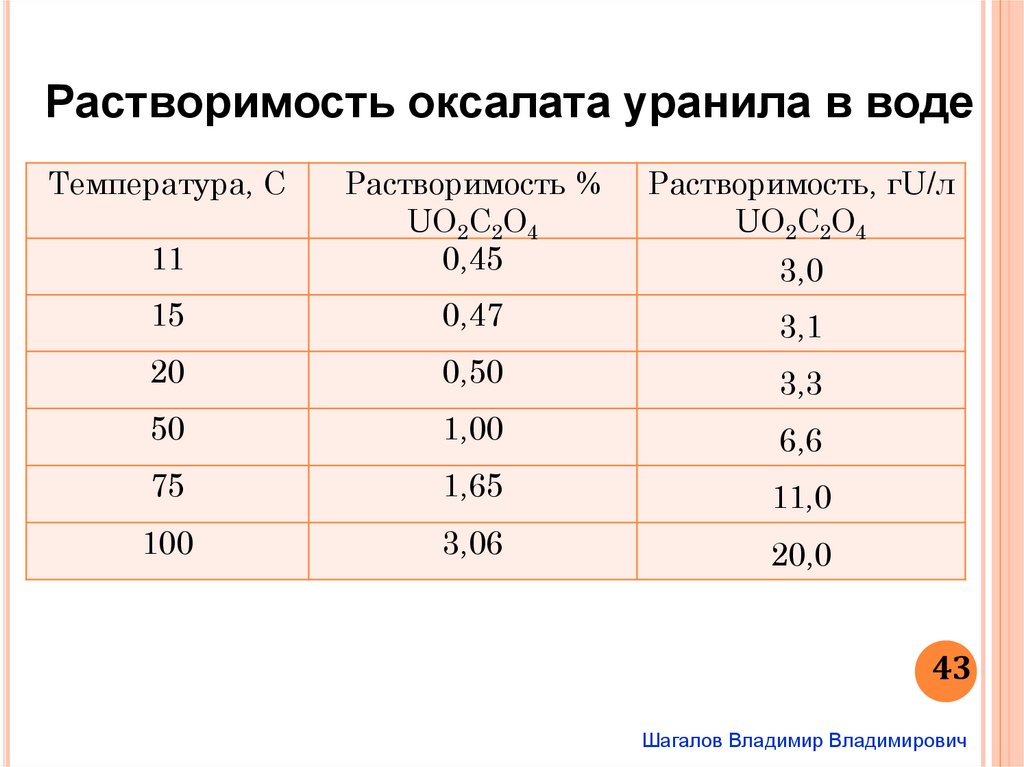
Растворимость оксалата уранила в водеТемпература, С
11
Растворимость %
UO2C2O4
0,45
Растворимость, гU/л
UO2C2O4
15
0,47
3,1
20
0,50
3,3
50
1,00
6,6
75
1,65
11,0
100
3,06
20,0
3,0
43
Шагалов Владимир Владимирович
44.
Оксалат уранилаВ присутствии избытка оксалат ионов образует
растворимые комплексные соединения типа
карбонатных
UO2C2O4 → UO3 (U3O8, UO2) + CO2 + CO
44
Шагалов Владимир Владимирович
45.
Растворимость оксалата уранила вщавелевой кислоте 15 0С
Концентрация
Н2C2O4, г/л
0,1
Растворимость, гU/л
UO2C2O4
3,1
14,0
10,4
26,6
12,4
41,2
13,4
51,8
13,9
73,9
14,6
45
Шагалов Владимир Владимирович
46.
Ацетаты уранилаАцетат уранила образуется при действии уксусной
кислоты на растворы уранила. При осаждении из
растворов образуется дигидрат. Дегидратация
протекает при 110 0С
UO2(CH3СОО)2 ‧2H2O → UO2(CH3СОО)2 + H2O
Растворимость 7,69 г/100 г воды
46
Шагалов Владимир Владимирович
47.
Ацетат уранилаОбразует большое разнообразие комплексных солей
М+UO2(CH3СОО)3‧ nН2О,
М = Na+, K+, NH , Ag+;
М2+UO2 (CH3COO)4‧ nН2О,
М = Ве2+, Мg2+, Zn2+, Сd2+, Рb2+;
М2+(UO2)2(CН3COO)6‧ nН2О, М = Мg2+, Са2+, Ва2+, Zn2+, Сd2+;
NaM(UO2)3(CH3COO)9‧ nН2О М=Ве, Мg, Zn, Ni, Со,Fe, Мn,
,
Cu, Cd.
UO2SO4+ NaCH3COO NaUO2(CH3COO)3 + Na2SO4
47
Шагалов Владимир Владимирович
48.
Уранил фторидUО2F2
-
вещество
светло-желтого
цвета,
кристаллизующееся из водных растворов с двумя
молекулами воды. При прокаливании при 200 °С
переходит в безводный
Плотность – 6,37 г/см3
Тпл= неизвестна, разлагается до закиси-окиси
48
Шагалов Владимир Владимирович
49.
Физические свойства UО2F2Растворим в воде и спирте
Температура, ºС
Растворитель
Растворимость,
% масс.
25
H2O
65,6
100
H2O
74,1
49
Шагалов Владимир Владимирович
50.
Химические свойства UО2F2о
C
UO2+2HF
UO2F2 + H2 600
UO2F2 +2F2
250 C
о
UF6 + О2↑ + (OF2; O2F2)↑
UO2F2 + SnCl2 + 4НF UF4↓ + SnCl2F2 + 2H2O
50
Шагалов Владимир Владимирович
51.
Химические свойства UО2F2С фторидами щелочных металлов образует
двойные соли
NaUO2F3; K3(UO2)2F7; K5(UO2)2F9; Me3UO2F5
(Ме = Li, Na, K, Rb, Cs, NH4+ )
51
Шагалов Владимир Владимирович











































 Химия
Химия








