Похожие презентации:
Химическая связь
1. Понятие химической связи
16.10.20191
Понятие химической связи
• Что такое химическая связь?
— взаимодействие между атомами, приводящее к
образованию устойчивой многоатомной системы:
молекулы, иона, кристалла.
• Каковы причины образования химической
связи?
— стремление системы к минимуму энергии; при
этом всегда выделяется энергия;
— стремление атомов к завершению внешнего
энергетического уровня.
• Какова природа химической связи?
— имеет электрический характер, т.к. образуется
валентными ē;
2. Типы химической связи
16.10.20192
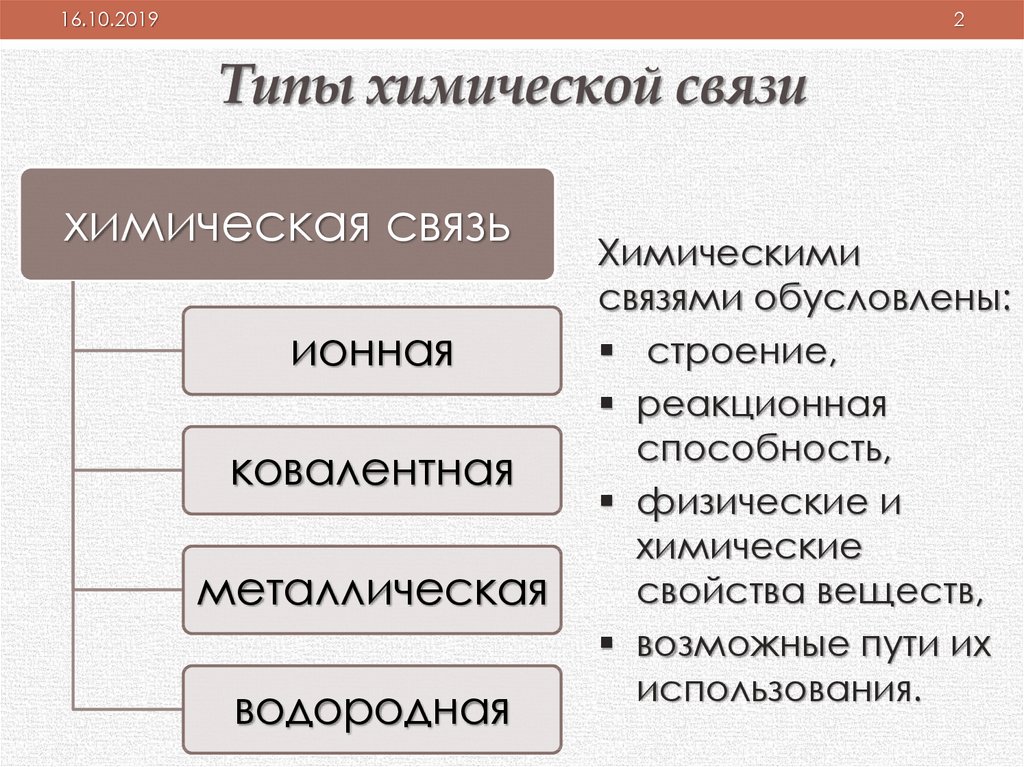
Типы химической связи
химическая связь
ионная
ковалентная
металлическая
водородная
Химическими
связями обусловлены:
строение,
реакционная
способность,
физические и
химические
свойства веществ,
возможные пути их
использования.
3. Электроотрицательность
16.10.20193
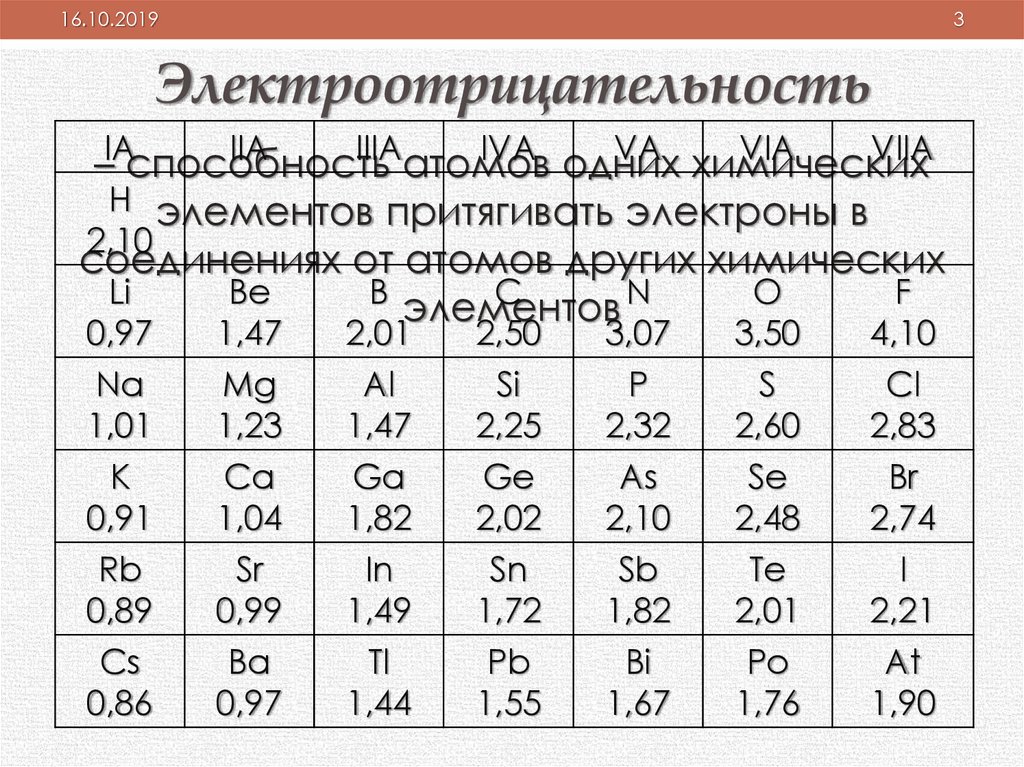
Электроотрицательность
IIA
IIIA
IVA
VA
VIA
VIIA
–IAспособность
атомов
одних
химических
H элементов притягивать электроны в
2,10
соединениях от атомов других химических
Li
Be
B
C
N
O
F
элементов
0,97
Na
1,01
1,47
Mg
1,23
2,01
Al
1,47
2,50
Si
2,25
3,07
P
2,32
3,50
S
2,60
4,10
Cl
2,83
K
0,91
Rb
0,89
Ca
1,04
Sr
0,99
Ga
1,82
In
1,49
Ge
2,02
Sn
1,72
As
2,10
Sb
1,82
Se
2,48
Te
2,01
Br
2,74
I
2,21
Cs
0,86
Ba
0,97
Tl
1,44
Pb
1,55
Bi
1,67
Po
1,76
At
1,90
4.
416.10.2019
основные виды химических
связей
ковалентная
ионная
0 < Δ < א1,7
Δ > א1,7
неполярная
полярная
0 = Δ < א0,5
0,5 < Δ < א1,7
Δ – אразница э/о
ИХС можно рассматривать как
крайний случай КХС
5. Ионная химическая связь
6. Механизм образования ИХС
16.10.20196
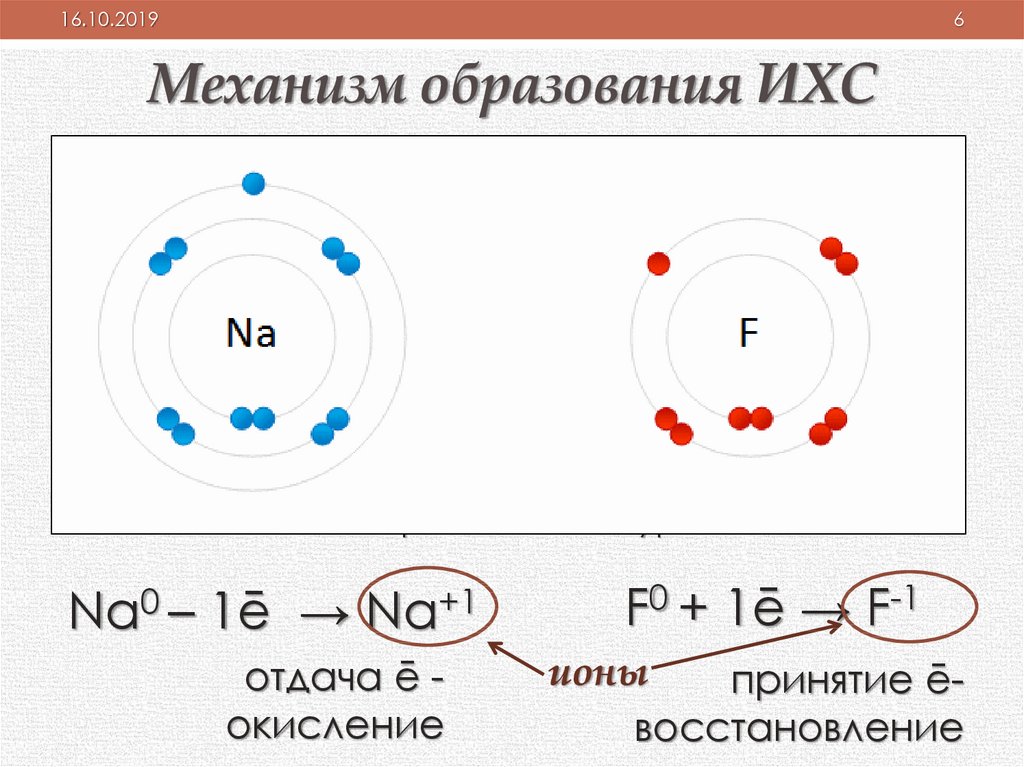
Механизм образования ИХС
устойчивая конфигурация внешнего
энергетического уровня
Na0 – 1ē → Na+1
отдача ē окисление
F0 + 1ē → F-1
ионы
принятие ēвосстановление
7. Ионная химическая связь (ИХС)
16.10.20197
Ионная химическая связь
(ИХС)
• это связь между ионами;
• ионы- заряженные частицы, имеющие
устойчивую конфигурацию внешнего
+
+
уровня, которые образуются в
результате отдачи или принятия
- ē.
-
ион-катион
Ме0 – nē→Меn+
ион-анион
неМе0 + nē→неМеn-
8. Ионная связь возникает
16.10.20198
Ионная связь возникает
• только между некоторыми Ме и неМе;
характерна для:
1. оксидов
AlCl3
MgS
2. гидроксидов
и 1,23
э/о(Al)= 1,47 щелочных
э/о(Mg)=
Ме
3. гидридов
э/о(Cl)= 2,83 щелочно-земельных
э/о(S)= 2,60
4. солей
Δ=א
Δ=א
• твердые, кристаллические вещества с
высокими Ткип. и Тпл., хорошо растворимые в
воде
• для в-в с ИХС характерна ионная
кристаллическая решетка
9. Физические свойства веществ с ИХС
916.10.2019
Физические свойства веществ с ИХС
твёрдые, кристаллические в-ва, очень
прочные [н-р: Тпл (NaCl)=801°С]
хрупкие;
• хорошо
растворимые в воде
в твердом состоянии ионы прочно связаны в
решетке и не могут двигаться и переносить
заряд, т. е. являются изоляторами;
в расплаве или растворе диссоциируют на
ионы и становятся на 100% ионными:
NaCl
Na+ + Cl‾
проводники эл/тока 2 рода (электролиты)
10. Классификация ионов
16.10.201910
Классификация ионов
по заряду:
катионы Na+,NH4+
анионы OH-, Cl-
по составу:
простые Na+,Cl-
сложные NH4+, SO42-
по наличию гидратной оболочки:
гидратированные
негидратированные
11. Относительность понятия
1116.10.2019
Относительность понятия
“ИХС – это связь между Ме и неМе”
1. соли аммония имеют ионную
кристаллическую решетку и ИХС:
NH–4Cl,
NH4NO3,случай
(CH3NH3КХС,
)2SO4
ИХС
крайний
2. AlCl3 Δ =א1,36 ⟹ КПС
и перехода
характеризуется
3. полного
электронов при
образовании ИХС не происходит:
степенью
ионности.
величины эффективных
зарядов
Na+0,8 Cl-0,8
Li+0,87 F-0,87
Cs+0,94 F-0,94
Rb+0,82 I-0,82
12. Домашнее задание:
1216.10.2019
Домашнее задание:
§3; записи;
ТПО









 Химия
Химия








