Похожие презентации:
Сванте Аррениус. Теория электролитической диссоциации
1.
Теорияэлектролитической
диссоциации
1877 г.
Сванте Аррениус
2.
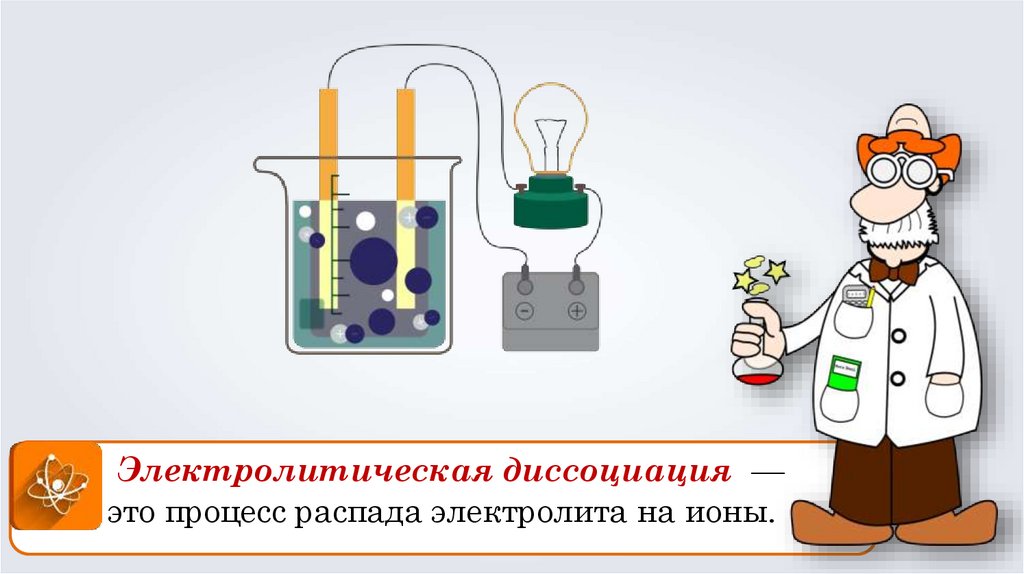
Электролитическая диссоциация —это процесс распада электролита на ионы.
3.
4.
Теория электролитической диссоциации+
-
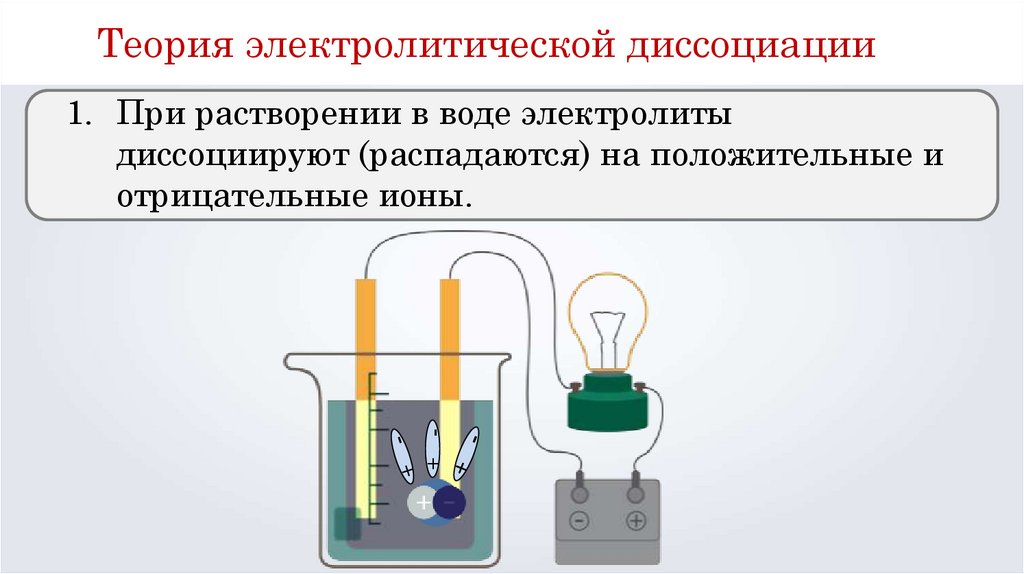
1. При растворении в воде электролиты
диссоциируют (распадаются) на положительные и
отрицательные ионы.
5.
Ионы+
H
+
Na
—
Cl
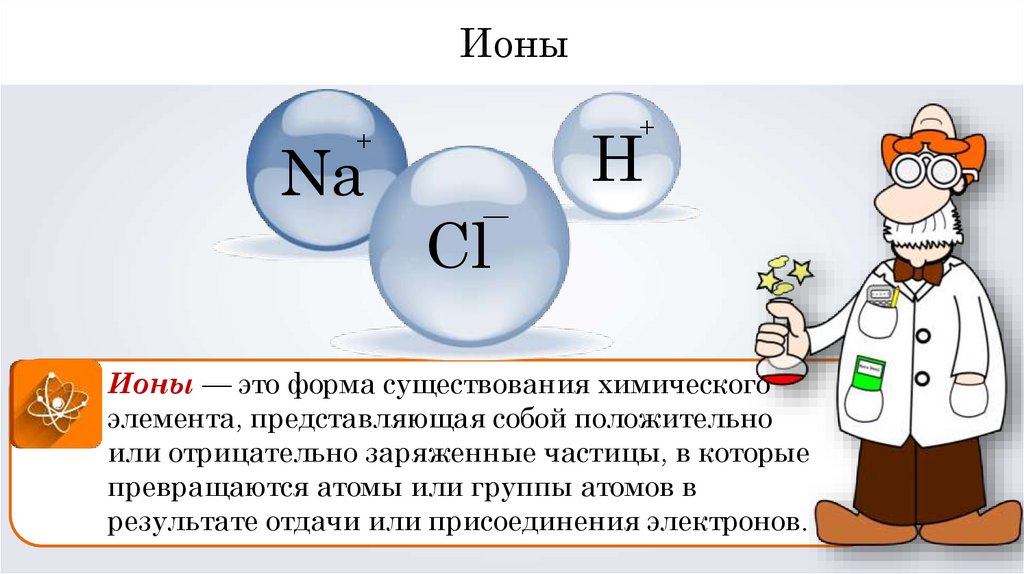
Ионы — это форма существования химического
элемента, представляющая собой положительно
или отрицательно заряженные частицы, в которые
превращаются атомы или группы атомов в
результате отдачи или присоединения электронов.
6.
7.
Ионыпростые
сложные
состоят из одного
атома:
состоят из
нескольких атомов:
+
Na
Мg
2+
3+
Al
–
NO3
2–
SO4
3–
PO4
8.
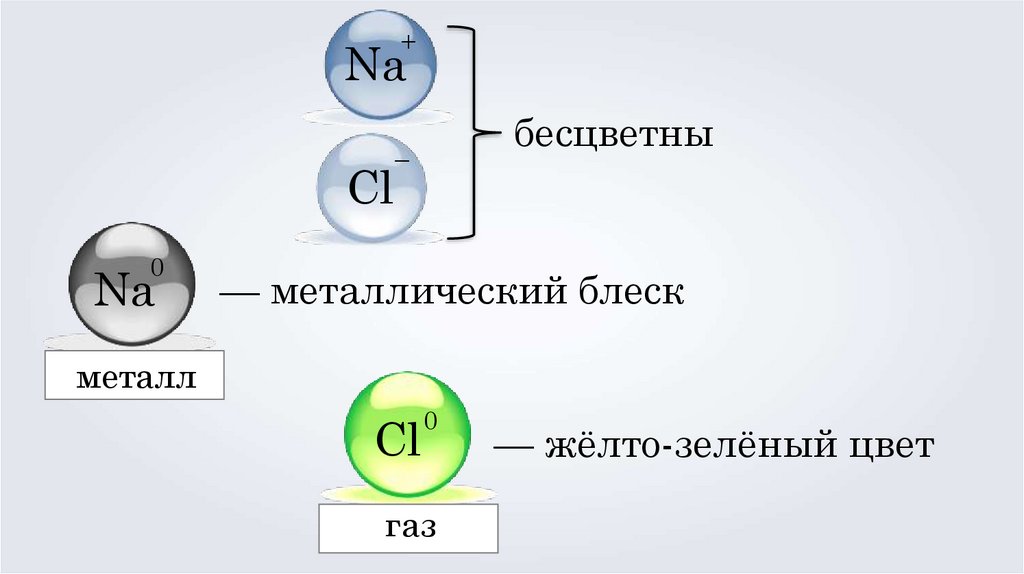
+Na
Cl
0
Na
бесцветны
–
— металлический блеск
металл
Cl
0
газ
— жёлто-зелёный цвет
9.
Теория электролитической диссоциации2. Причиной диссоциации электролита в одном
растворе является его гидратация, т. е.
взаимодействие электролита с молекулами воды и
разрыв химической связи в нём.
+
-
+
+
-
+
-
10.
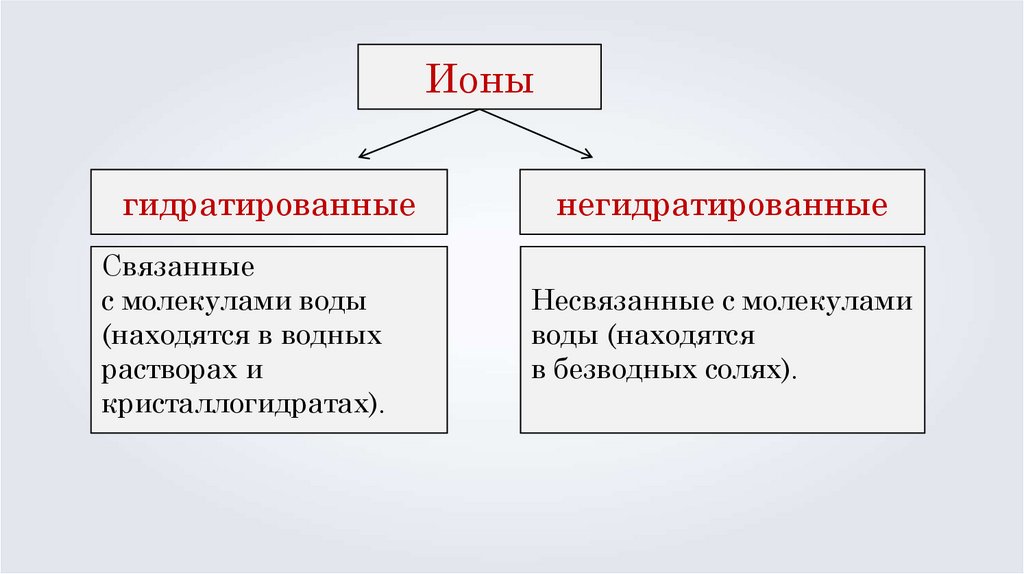
Ионыгидратированные
Связанные
с молекулами воды
(находятся в водных
растворах и
кристаллогидратах).
негидратированные
Несвязанные с молекулами
воды (находятся
в безводных солях).
11.
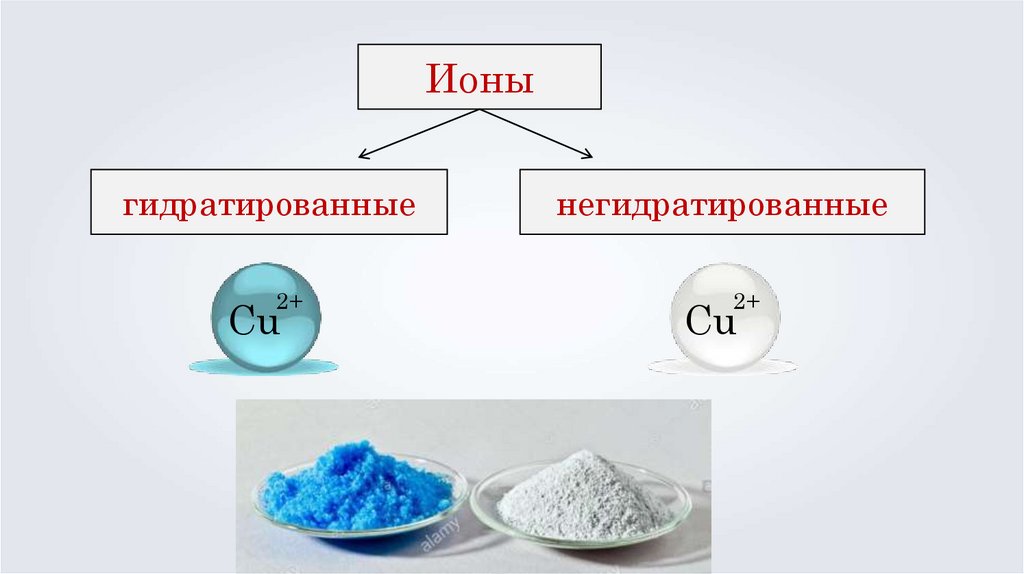
Ионыгидратированные
2+
Сu
негидратированные
2+
Сu
12.
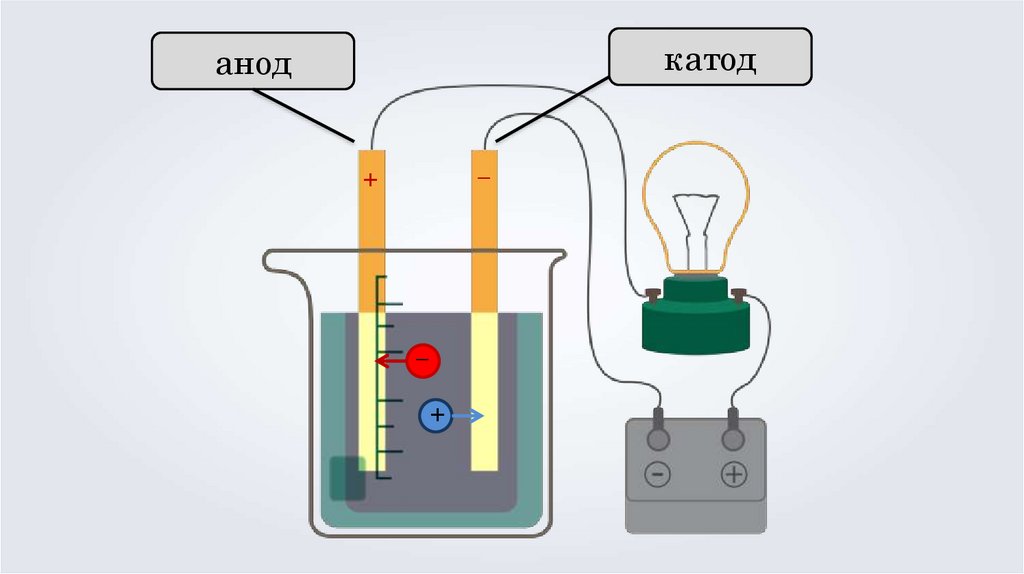
Теория электролитической диссоциации3. Под действием электрического тока, положительно
заряженные ионы движутся к отрицательно
заряженному полюсу источника тока — катоду,
поэтому их называют катионами, а отрицательно
заряженные ионы движутся к положительному
полюсу источника тока — аноду, поэтому их
называют анионами.
13.
катоданод
–
+
–
+
14.
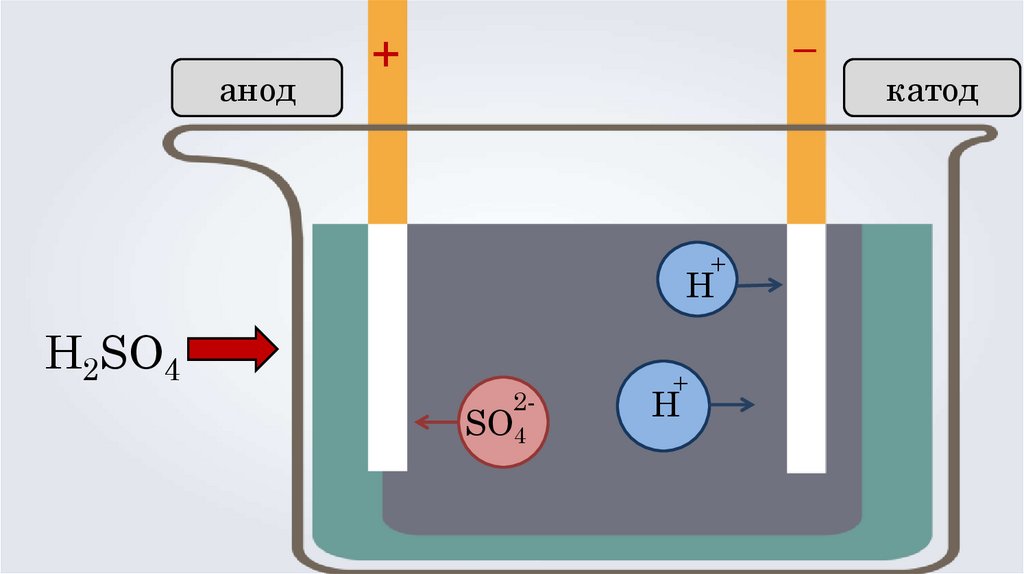
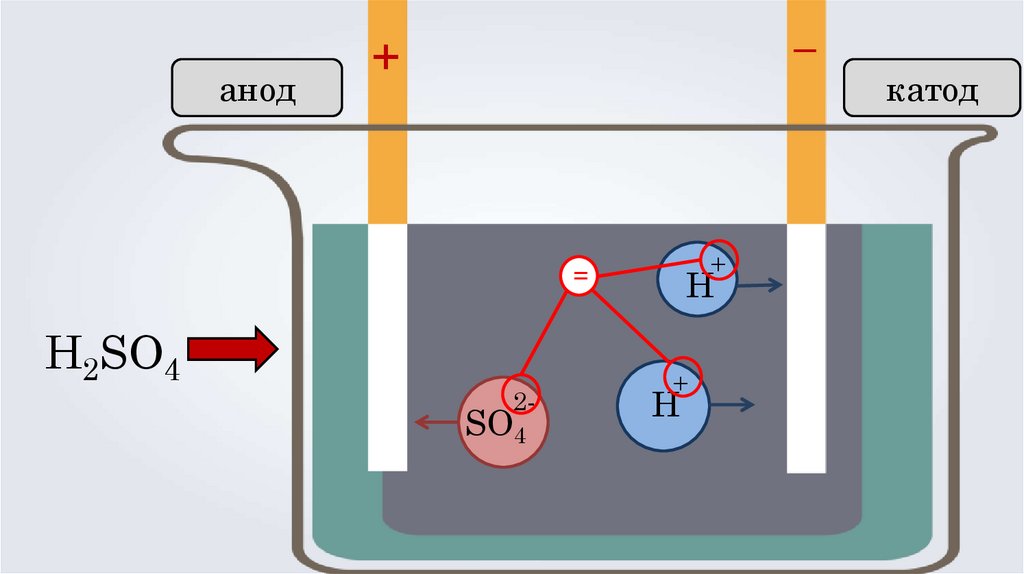
анод–
+
+
Н
H2SO4
2-
SO4
+
Н
катод
15.
Ионыкатионы
+
Н
+
К
анионы
3+
Al
–
NO3
2–
SO4
3–
PO4
16.
анод–
+
+
=
H2SO4
2-
SO4
Н
+
Н
катод
17.
Теория электролитической диссоциации4. Электролитическая диссоциация — процесс
обратимый для слабых электролитов.
Н2СО3
+
22Н + СО3
18.
Теория электролитической диссоциации5. Не все электролиты в одинаковой мере
диссоциируют на ионы.
электролиты
сильные
+
NaCl → Na + Cl
слабые
–
HNO2
+
–
H + NO2
19.
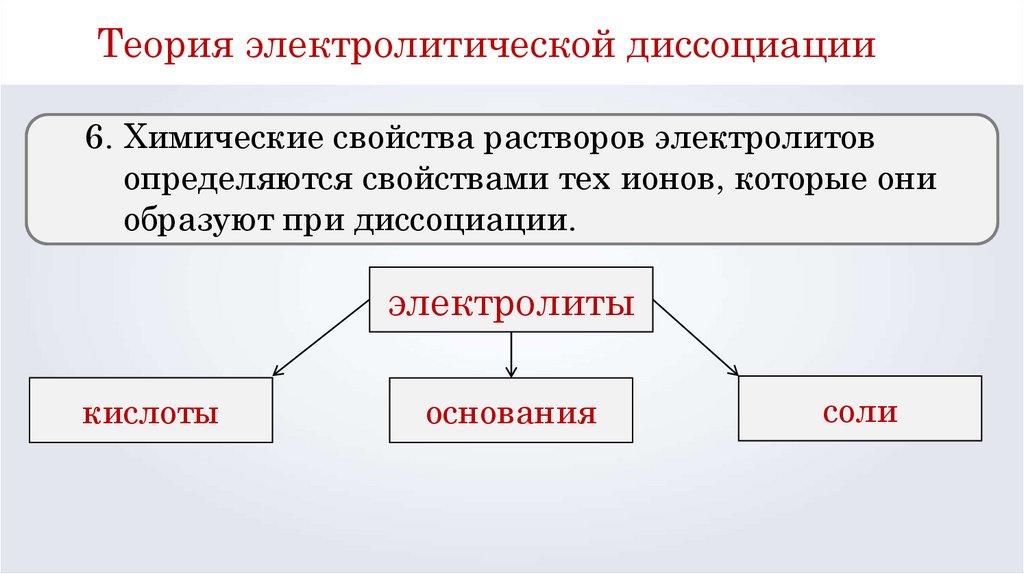
Теория электролитической диссоциации6. Химические свойства растворов электролитов
определяются свойствами тех ионов, которые они
образуют при диссоциации.
электролиты
кислоты
основания
соли
20.
+катион водорода
HNO3
–
анион кислотного
остатка
Кислотами называют электролиты,
которые при диссоциации образуют
катионы водорода и анионы кислотного
остатка.
21.
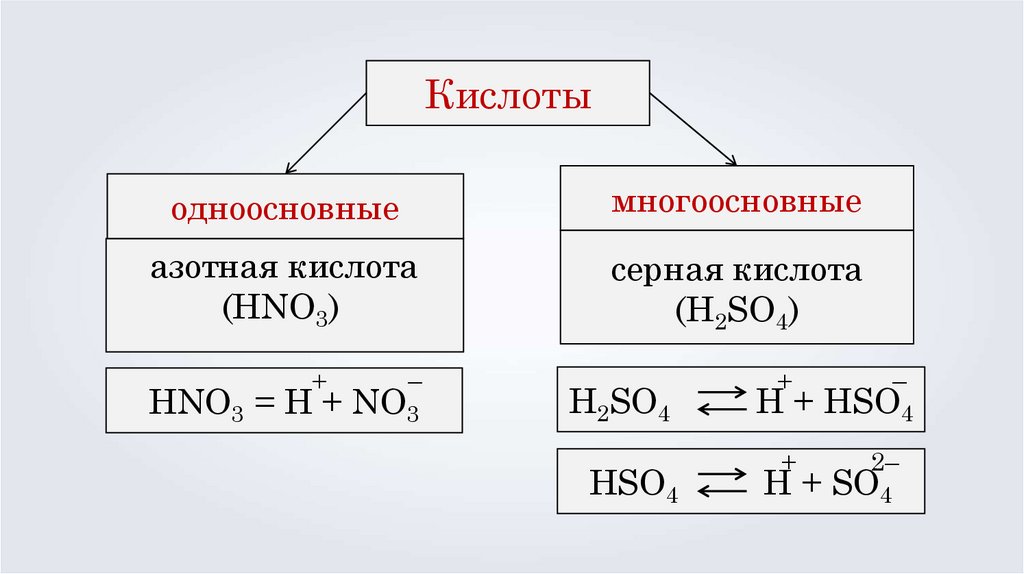
Кислотыодноосновные
многоосновные
азотная кислота
(HNO3)
серная кислота
(H2SO4)
+
–
HNO3 = H + NO3
H2SO4
HSO4
+
–
+
2–
H + HSO4
H + SO4
22.
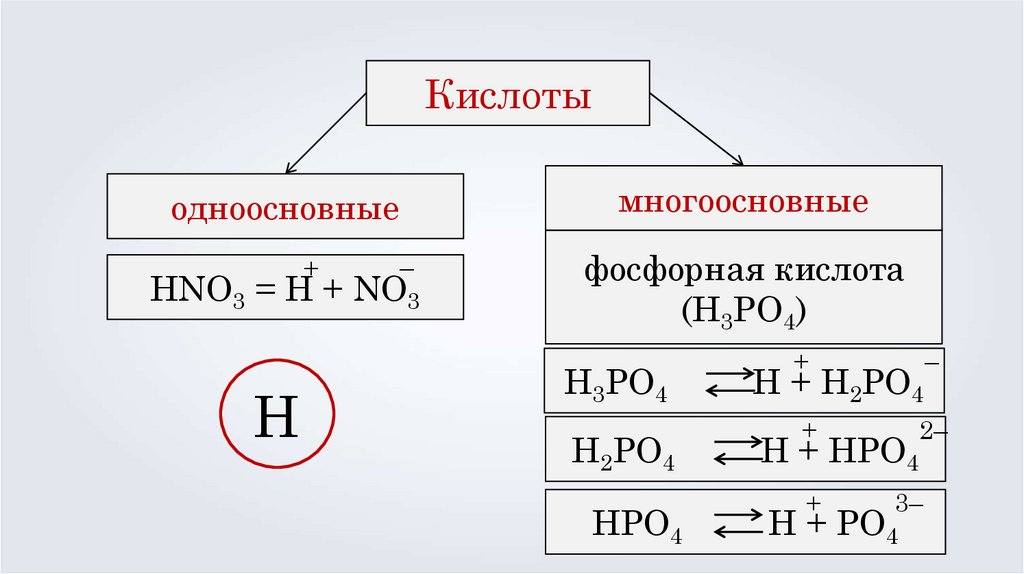
Кислотыодноосновные
+
–
HNO3 = H + NO3
H
многоосновные
фосфорная кислота
(H3PO4)
H3PO4
H2PO4
HPO4
+
–
+
2–
H + H2PO4
H + HPO4
+
3–
H + PO4
23.
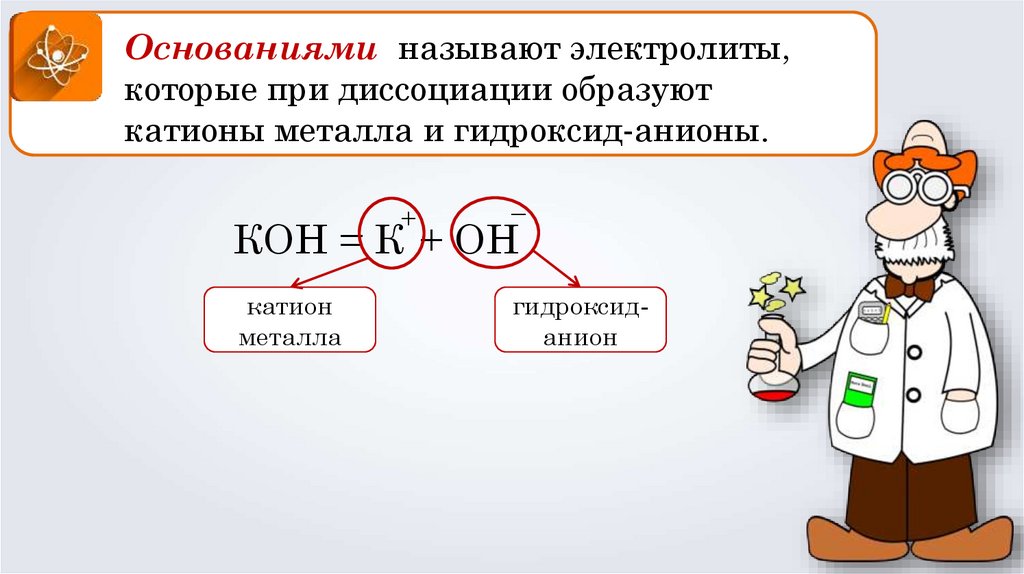
Основаниями называют электролиты,которые при диссоциации образуют
катионы металла и гидроксид-анионы.
+
–
КОН = К + ОН
катион
металла
гидроксиданион
24.
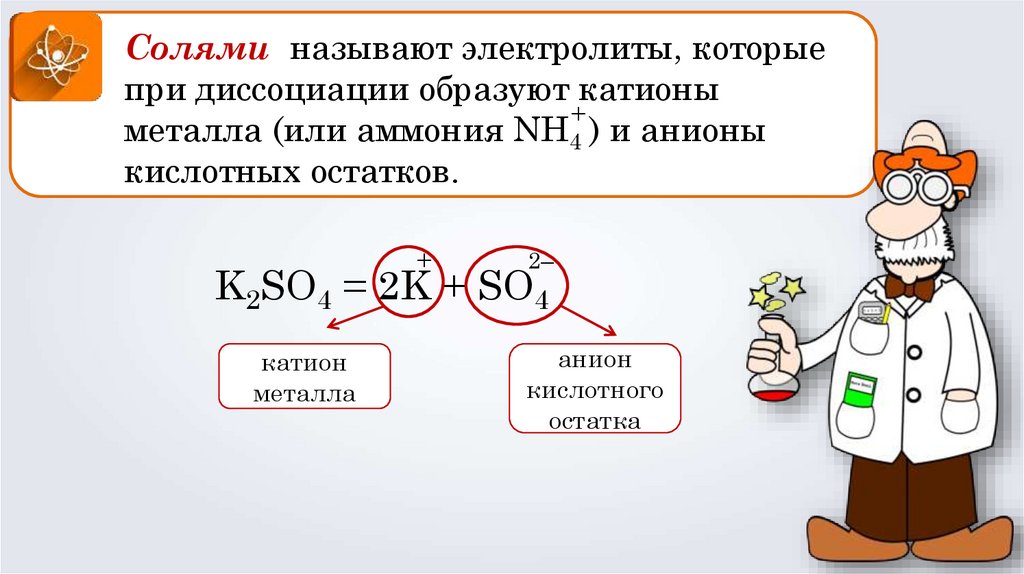
Солями называют электролиты, которыепри диссоциации образуют катионы
+
металла (или аммония NH4 ) и анионы
кислотных остатков.
+
2–
K2SO4 = 2K + SO4
катион
металла
анион
кислотного
остатка
25.
Основные положения теорииэлектролитической диссоциации отражают все
процессы, происходящие при растворении
веществ.












 Химия
Химия








