Похожие презентации:
Электролитическая диссоциация (9 класс)
1. Электролитическая диссоциация
9 класс2. Вопросы урока?
1. Электролитическая диссоциация2. Заряженные частицы
3. Электролиты
4. Неэлектролиты
5. Молекулы воды
6. Диссоциация солей
7. Диссоциация щелочей
8. Диссоциация кислот
3. Степень диссоциации
ά=N диссоц
N общее число молекул
Измеряется в % или в долях от 1
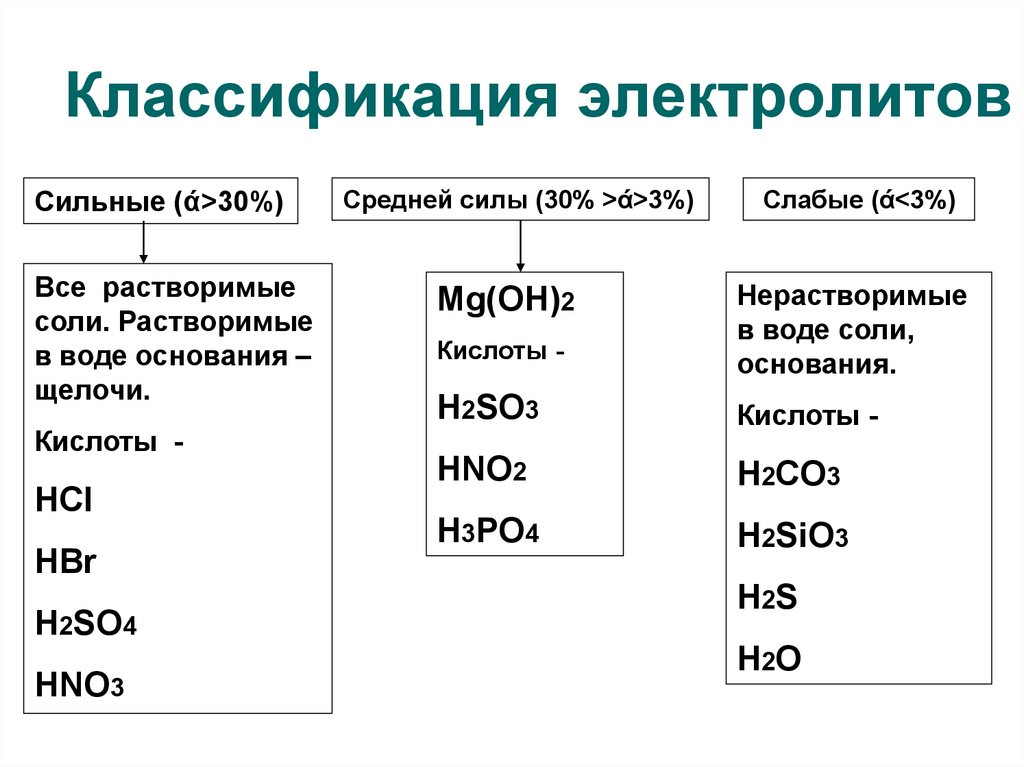
4. Классификация электролитов
Сильные (ά>30%)Все растворимые
соли. Растворимые
в воде основания –
щелочи.
Кислоты -
HCl
HBr
H2SO4
HNO3
Средней силы (30% >ά>3%)
Слабые (ά<3%)
Mg(OH)2
Нерастворимые
в воде соли,
основания.
Кислоты -
H2SO3
Кислоты -
HNO2
H2CO3
H3PO4
H2SiO3
H2S
H2O
5. Основные положения теории электролитической диссоциации
1. Электролиты в воде распадаются наионы;
2. Причина диссоциации –
взаимодействие электролита с
молекулами воды;
3. +
катионы движутся к КАТОДУ (-),
-
анионы движутся к АНОДУ(+)
6. Основные положения теории электролитической диссоциации
4. Диссоциация – обратимый процесс;5. По степени диссоциации электролиты
разделяют на сильные, средние и
слабые;
6. Химические свойства растворов
электролитов определяются
свойствами ионов.
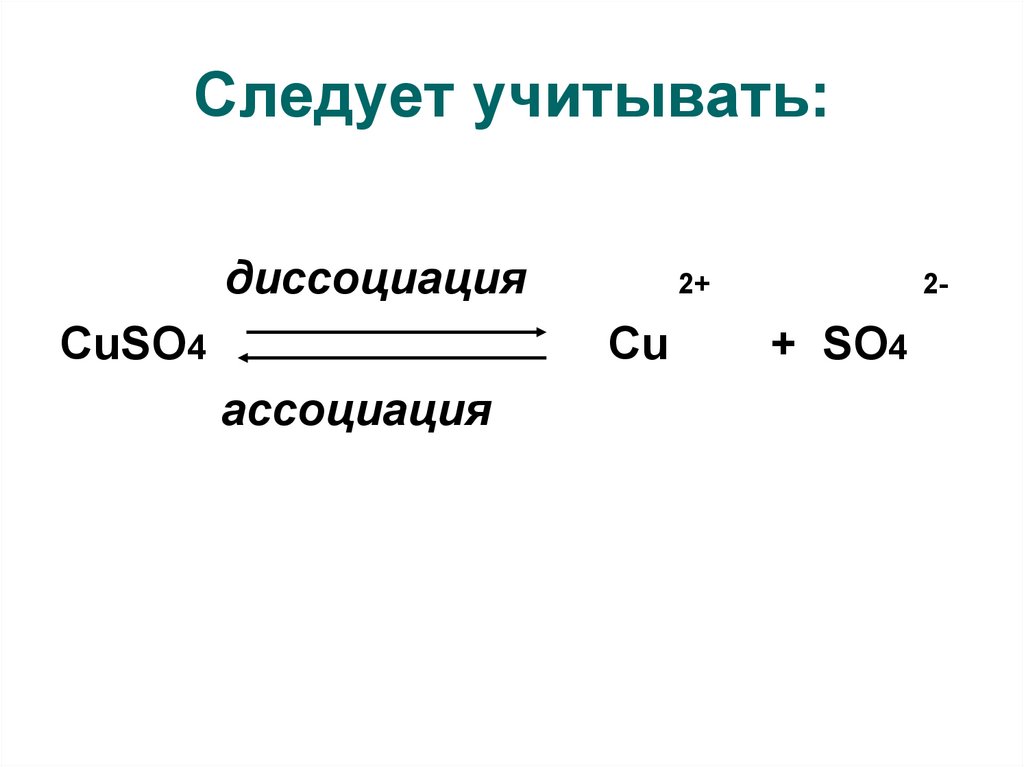
7. Следует учитывать:
диссоциацияCuSO4
2+
Cu
ассоциация
2-
+ SO4
8. Электролиты
ОснованияСоли
Кислоты
Правила выучить!!!
9. Решить задачу:
Сколько литровсероводорода надо взять
для реакции с 40 граммами
гидроксида калия?






 Химия
Химия








