Похожие презентации:
Гетерогенные равновесия
1.
Гетерогенные равновесияИзолированные
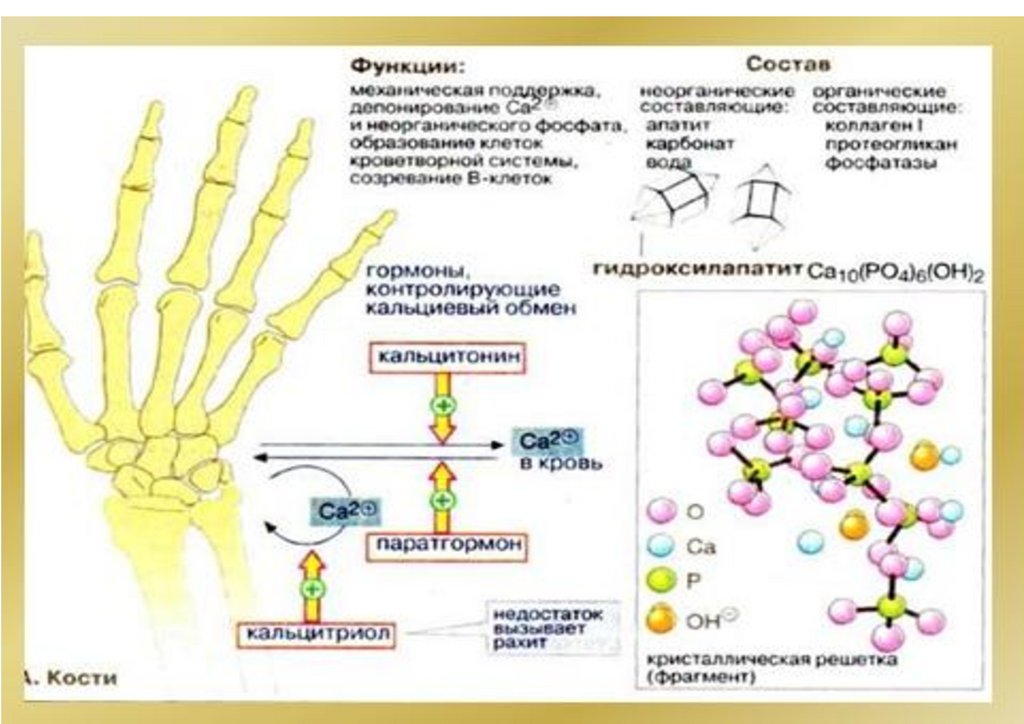
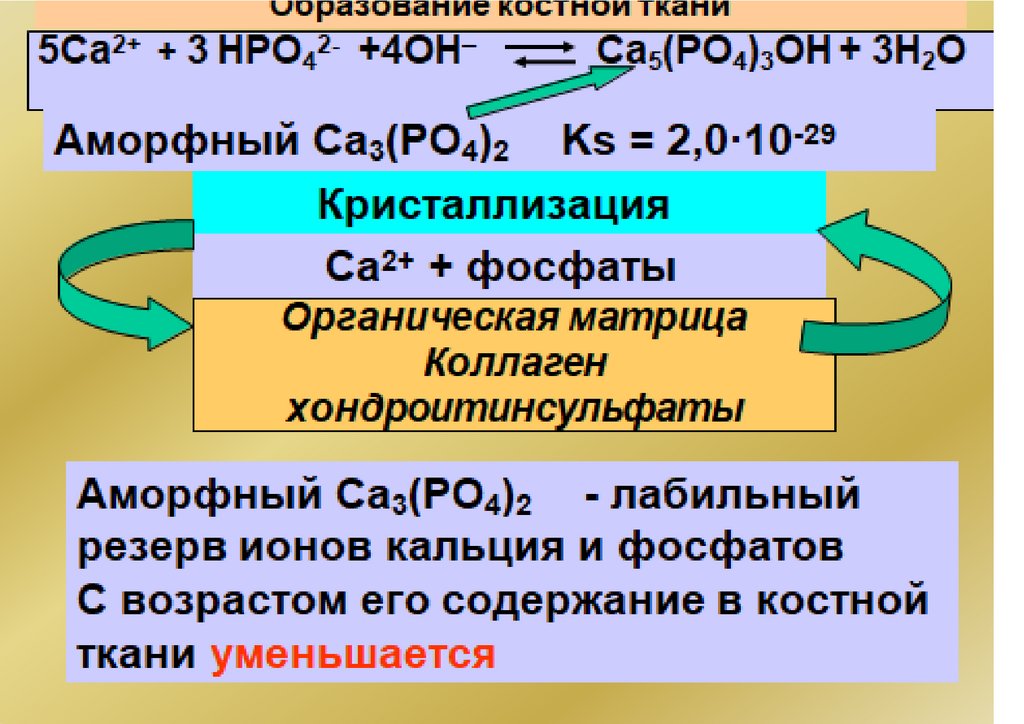
Са5(РO4)3ОН(тв)
5Са2+
(р-р)
+3РО 3–
4
(р-р)
+ ОН–
(р-р)
Совмещенные(конкурирующие)
n m Ks(Ktn Anm )
Са
n m 2–
СО
3
n
2+
+
Ks 9
CaCO 3
m
Ks
84375
?
SO4
2-
CaSO4
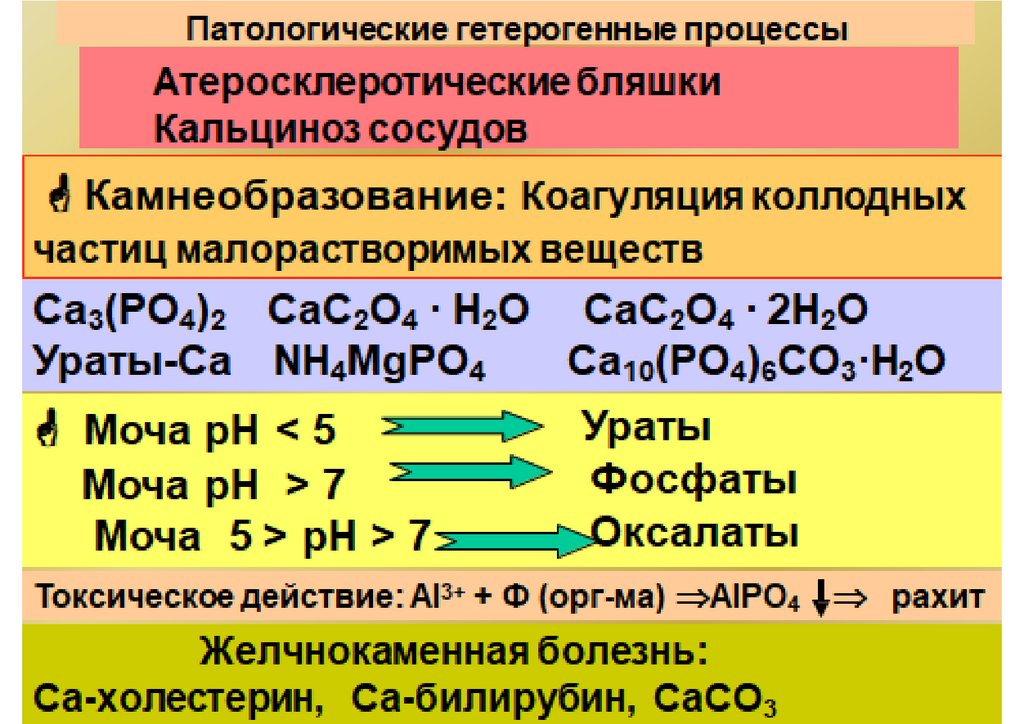
Ks(CaCO3) = 3,8·10-9 < Ks(CaSO4) = 2,5·10-5
CaCO3
2.
Гетерогенные равновесияСовмещенные(конкурирующие)
Са2+
CaSO4
SO42-
+
Sr
2+
n m Ks(Ktn Anm )
nn mm
?
SrSO4
Ks 9
Ks
84375
Ks(SrSO4) = 3,2·10-7 < Ks(CaSO4) = 2,5·10-5
SrSO4
Sr-90!
Стронциевый
рахит
Саркома
3.
Гетерогенные процессы и равновесияОсадок (тв)
BaSO4
раствор (ионы)
Раствор
Ba2+ + SO42–
[Ba ] [SO ]
Kравн
[BaSO 4 ]
2
24
Kравн·[BaSO4]=Ks(ПР)= [Ba2+]·[SO4 2-]=
1,1·10-10
4.
Константа расторимости, Ks (ПР)Кs – произведение равновесных
концентраций ионов
малорастворимого электролита
в его насыщенном растворе при
данных условиях
Са3(РО4)2
3Сa2
р-р
+ +
2РO 3–
Ks = [Ca2+]3·[PO43–]2
Ks(ПР) = [Ktm+]n·[Ann-]m
Чем меньше Ks(ПР) , тем хуже растворимо
вещество!
4
р-р
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
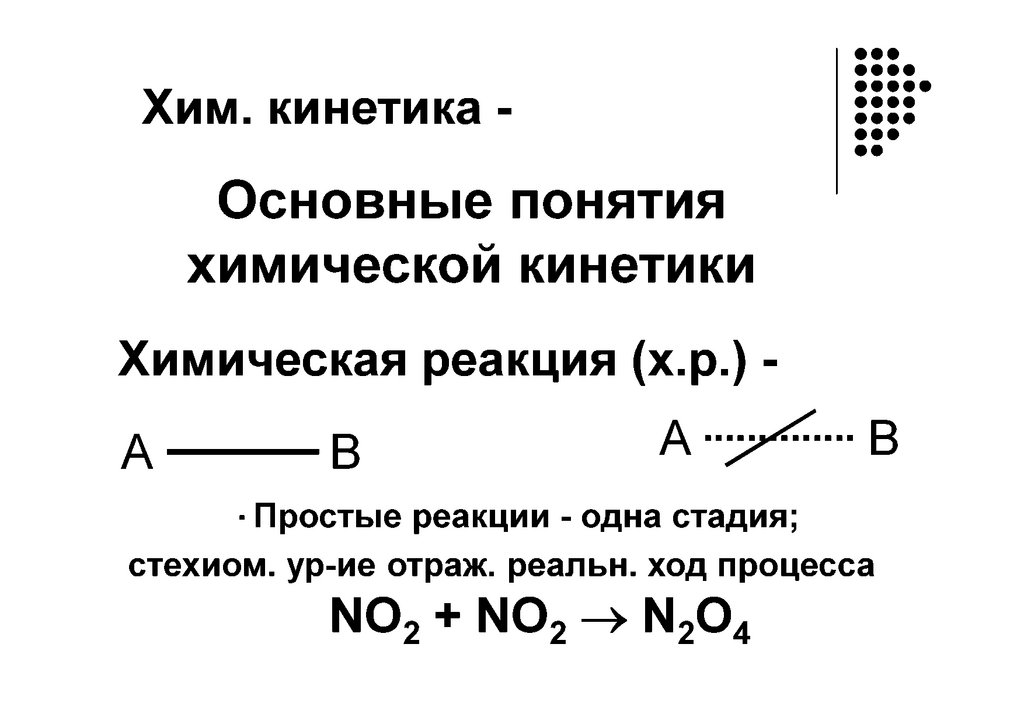
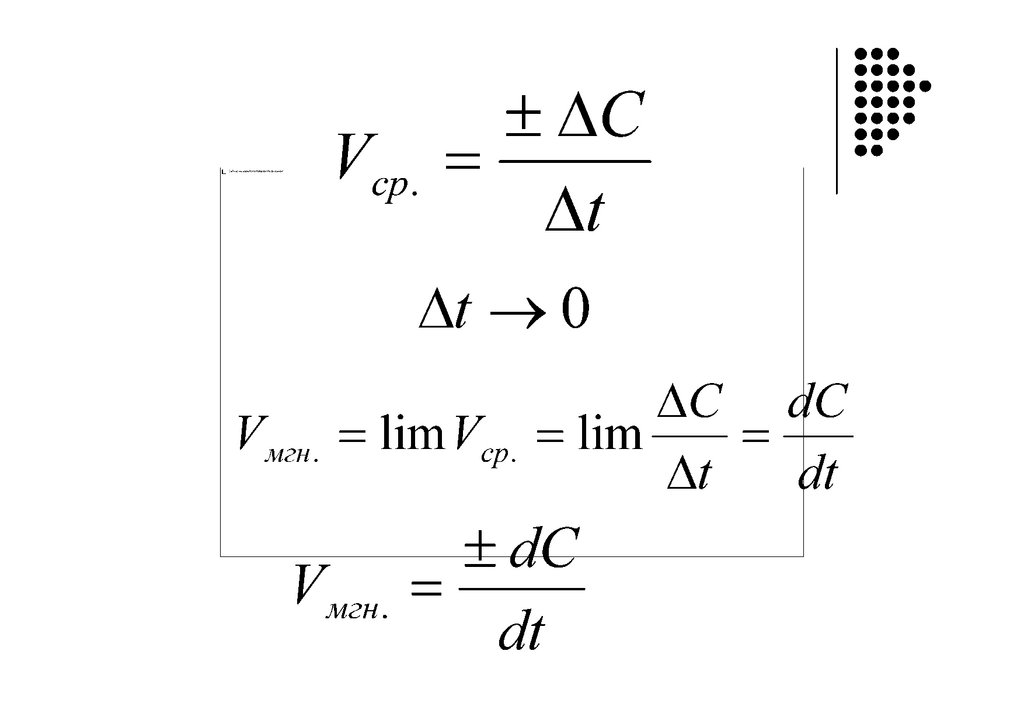
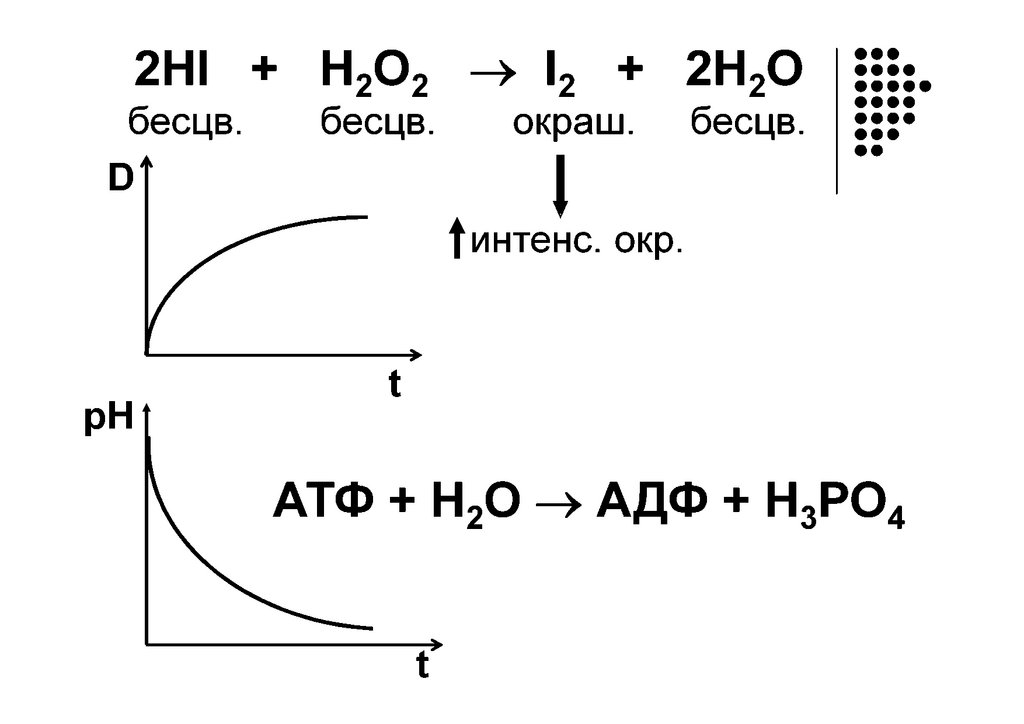
Время протекания реакциискорость реакции
кинетика
«kinẽtikos”, что означает “движущийся”.
Кинетика – раздел физической химии, изучающий
механизм и скорость протекания реакций
19.
Химическая кинетика - разделхимии, изучающий скорость и
механизмы химических реакций
Термодинамика - наука о
макросистемах
Химическая кинетика
рассматривает их механизм
реакций на уровне отдельных
частиц
Кинетика и термодинамика дают
целостное представление о
закономерностях протекания
20.
21.
22.
Классификация по механизмуреакции
Механизм реакций - совокупность
элементарных стадий слагающих
процесс
Простой процесс - протекает в одну
стадию (реагент продукт)
Сложный процесс –
многостадийный (реагент
промежуточные продукты
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
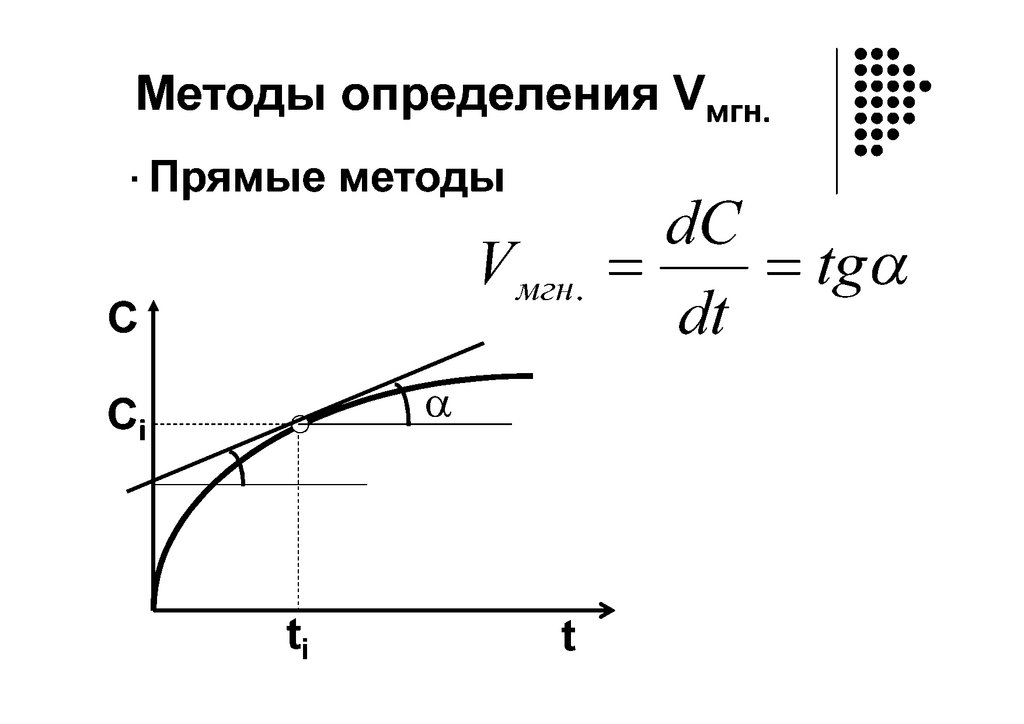
Графическое определение ndc
V = dt = f(С)
v а) n=0
v б) n=1
v в)
n>1
0
c
0
c
0
38.
39.
Период полупревращенияВремя полупревращения (
t1/2) для
реакций называют периодом
полураспада (не зависит от
начальной концентрации
вещества)
n = 0; t1/2 = C0/2k
n = 1; t1/2 = 0,69/k
n = 2; t = 1/C k
40.
41.
42.
43.
44.
45.
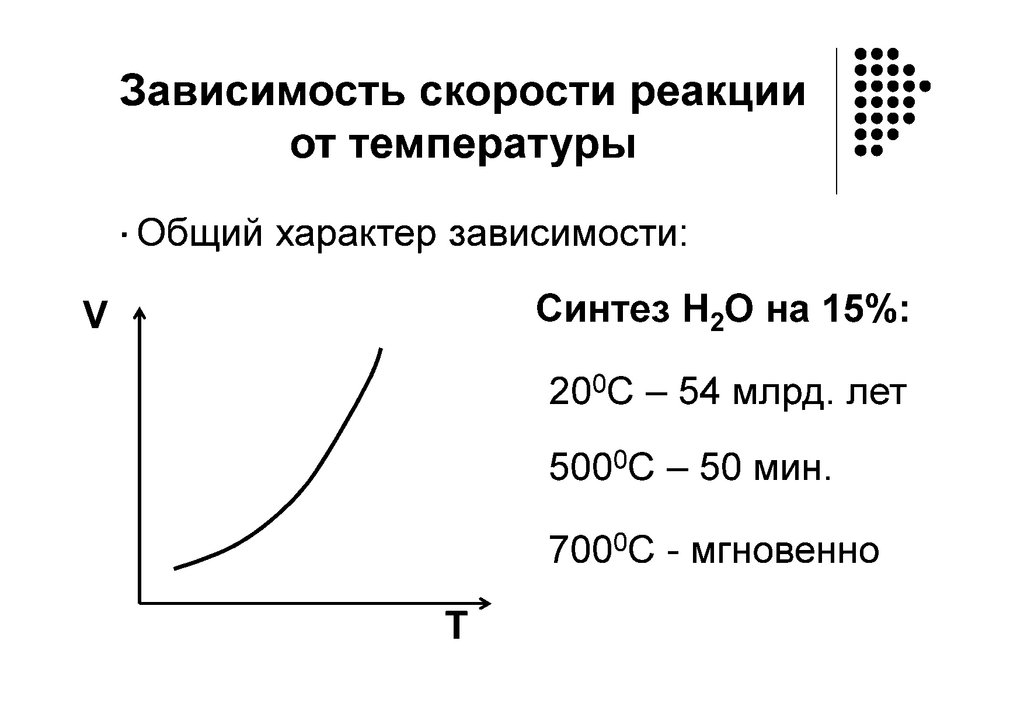
ЗАВИСИМОСТЬ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ:ЭМПИРИЧЕСКОЕ ПРАВИЛО ВАНТ-ГОФФА
Данное правило применимо
только для областей низких
температур!!!
46.
47.
48.
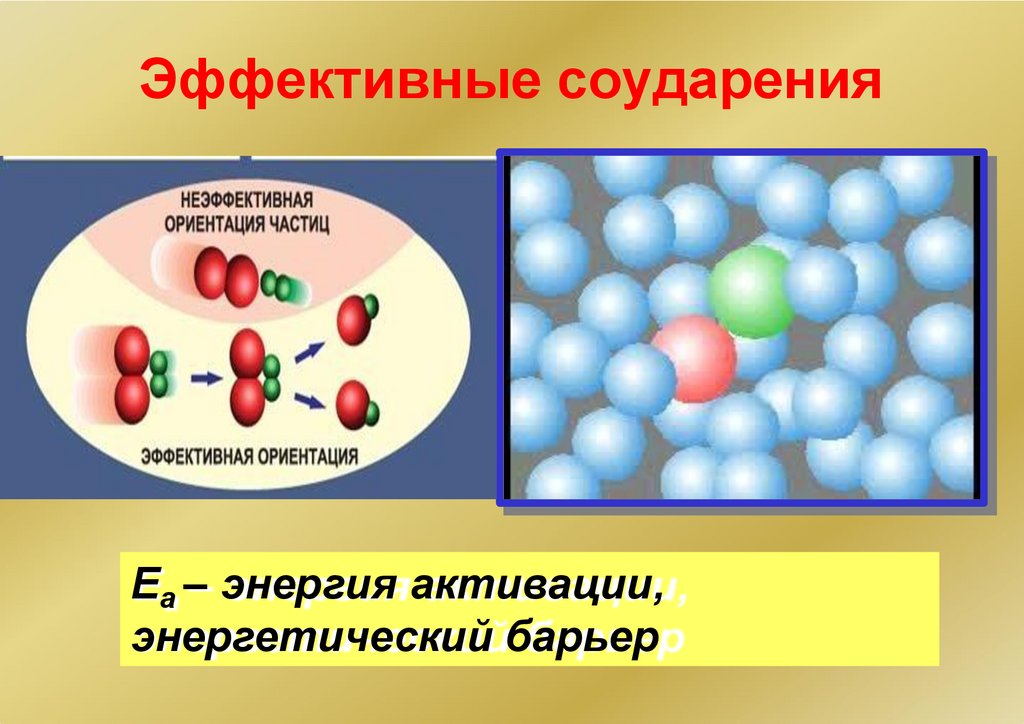
Эффективные соударенияЕа – энергия активации,
энергетический барьер
49.
Энергетический профильэкзотермической реакции
Е
Е3
А...
В
Е1 А+В
Е2
Е
а
H
ЕI
а
С...D
Ход реакции
А…В – активир.
комплекс
Е1, Е2,,,, Е3 - средняя
энергия молекул
реагентов, продуктов,
переходного
состояния
Еа = Е3 - Е1 - энергия
активации.
Еа` - энергия
активации
обратной р-ции
50.
51.
52.
53.
Физический смыслпредэкспоненциального
множителя: Величина А соответствует такой
(максимальной) скорости реакции, когда Еа
равна нулю, то есть в каждом столкновении
энергия сталкивающихся молекул достаточна,
чтобы прошла реакция.
А=P*Z
Z–число столкновений частиц,
Р – стерический фактор реакции, связанный с
энтропией активации.
54.
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ: СВАНТЕАРРЕНИУС
А – частотный фактор (связывает
частоту
столкновений
частиц
с
вероятностью того, что столкновения
будут эффективные), е – основание
натурального логарифма,
Е* - энергия активации, Дж\моль, R
– универсальная газовая постоянная,
T – температура, при которой идет
реакция, К.
Чем выше температура, тем выше
кинетическая энергия частиц, тем
быстрее они движутся и чаще
сталкиваются друг с другом
тем больше эффективных
столкновений, т.е. величина
k
55.
56.
Графическое определение ЕаЕа и А находят из графика в
аррениусовских координатах (ln
k 1/Т)
ln k
lnА
Ea
tg
R
1/T
57.
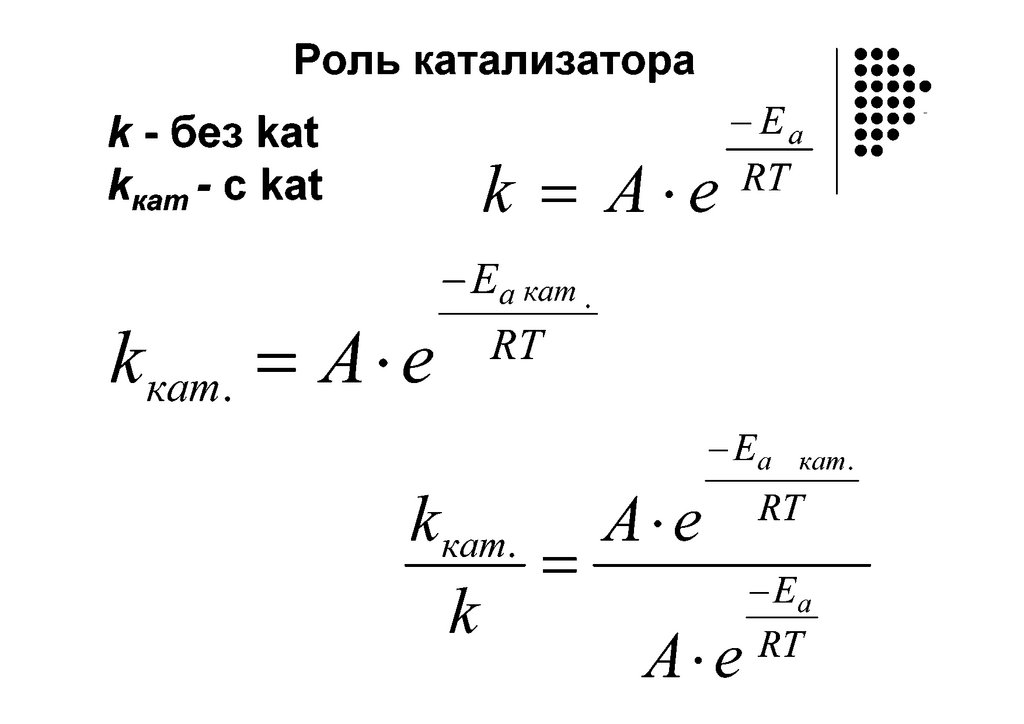
Определение энергииактивации
E
k A exp(
a
RT
)
Ea
ln k ln A
RT
RT1 T2
k1 2,3 RT1 T2 k2
Ea
ln
lg .
T1 T2
k2
T2 T1
k1
58.
59.
ЕПереходное
состояние
Исходные
вещества
+
Eакт
E’акт Продукты
Ho
+
Координата реакции
60.
61.
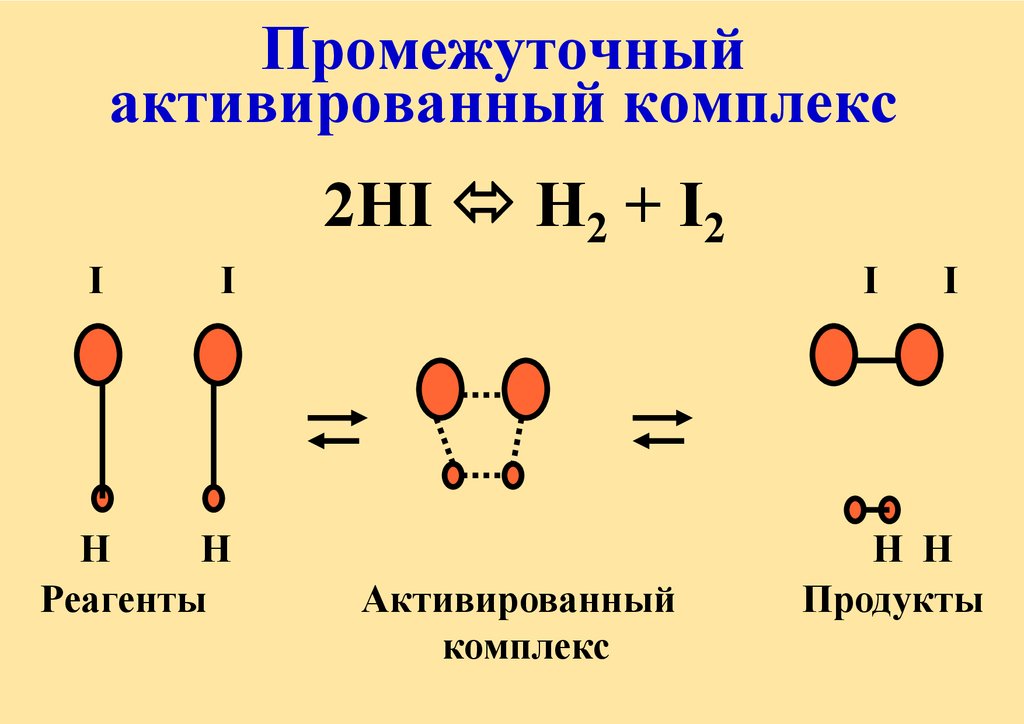
Промежуточныйактивированный комплекс
2HI H2 + I2
I
I
H
H
Реагенты
I
Активированный
комплекс
I
H H
Продукты
62.
63.
Способы активации молекултермический
светом
ионизирующее излучение
, e , p t , n o - излучение
корпускулярные и др.
механохимическая
звуковая активация
64.
65.
66.
67.
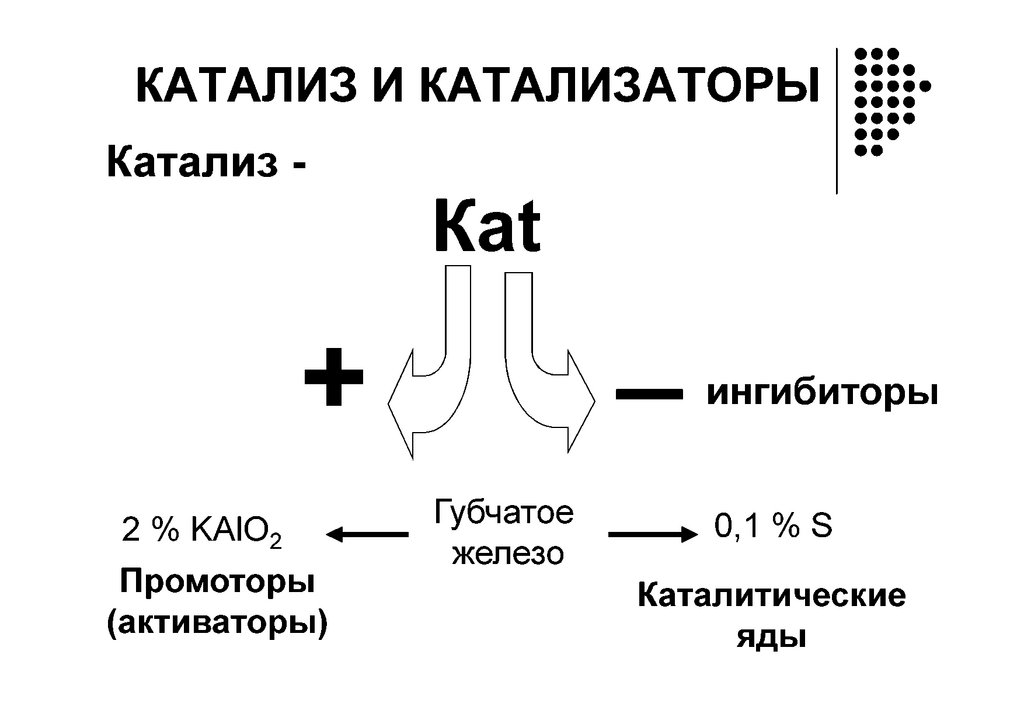
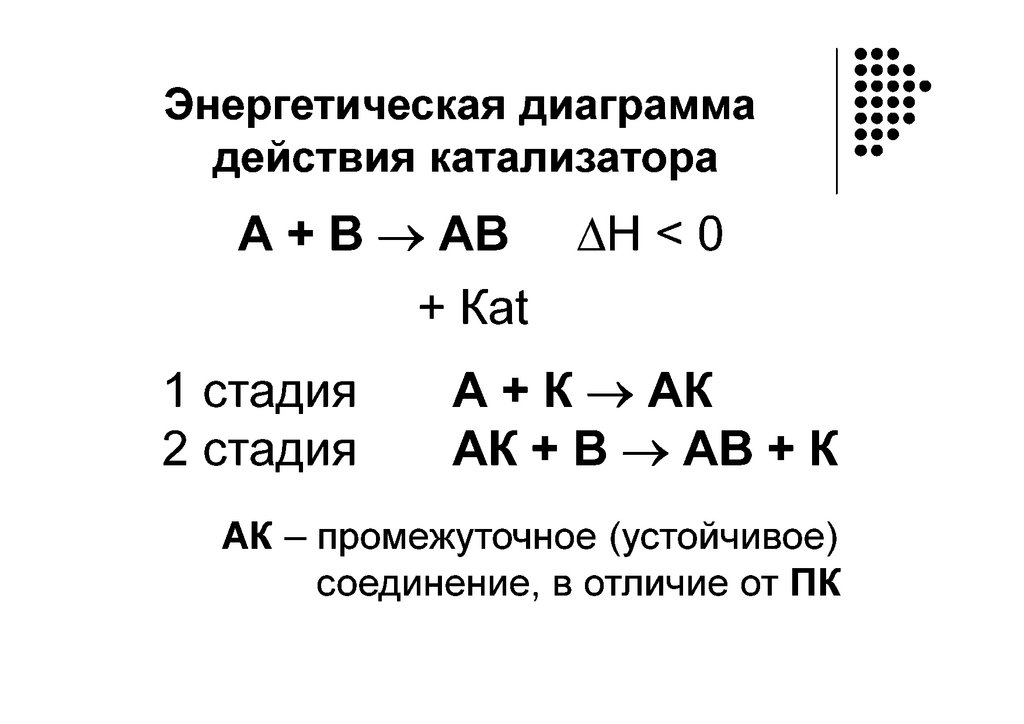
КатализГомогенный Гетерогенный
А + В АВ
А + К АК
АК + В АВК АВК*
АВК* АВ + К
Кислотно-основный катализ
Пепсиноген Н пепсин
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
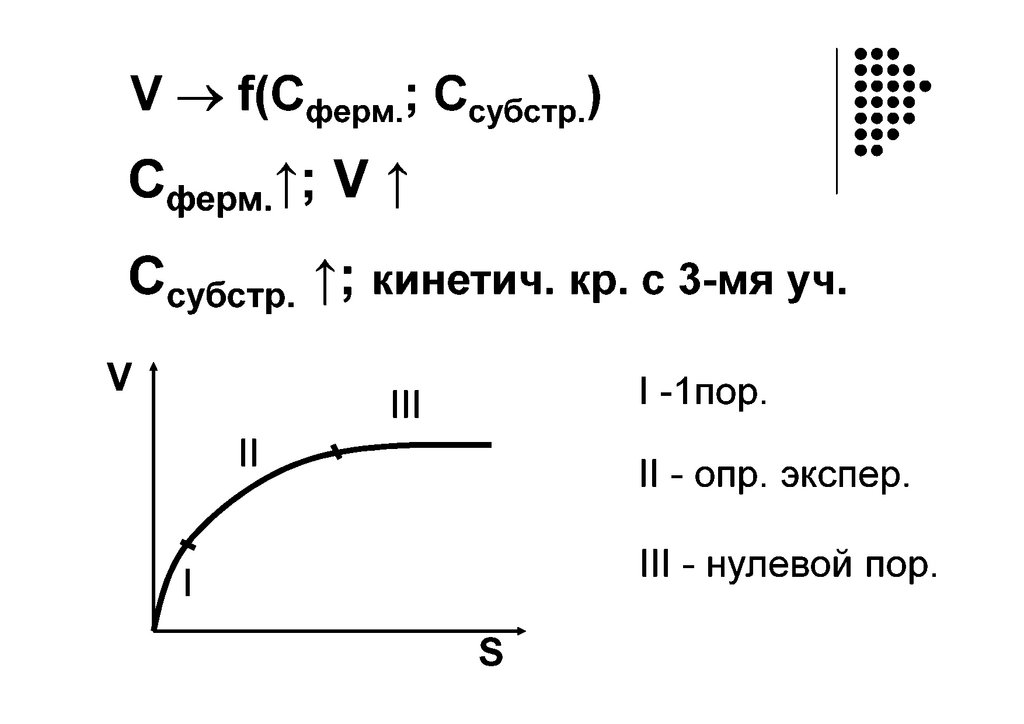
ЕES-комплекс
Фермент
Энзим (Е)
+
фермент
E1акт
Субстрат (S)
Координата реакции
+
83.
84.
Основное уравнение кинетики ферментативных процессов –уравнение Михаэлиса-Ментен
85.
86.
87.
88.
89.
90.
91.
92.
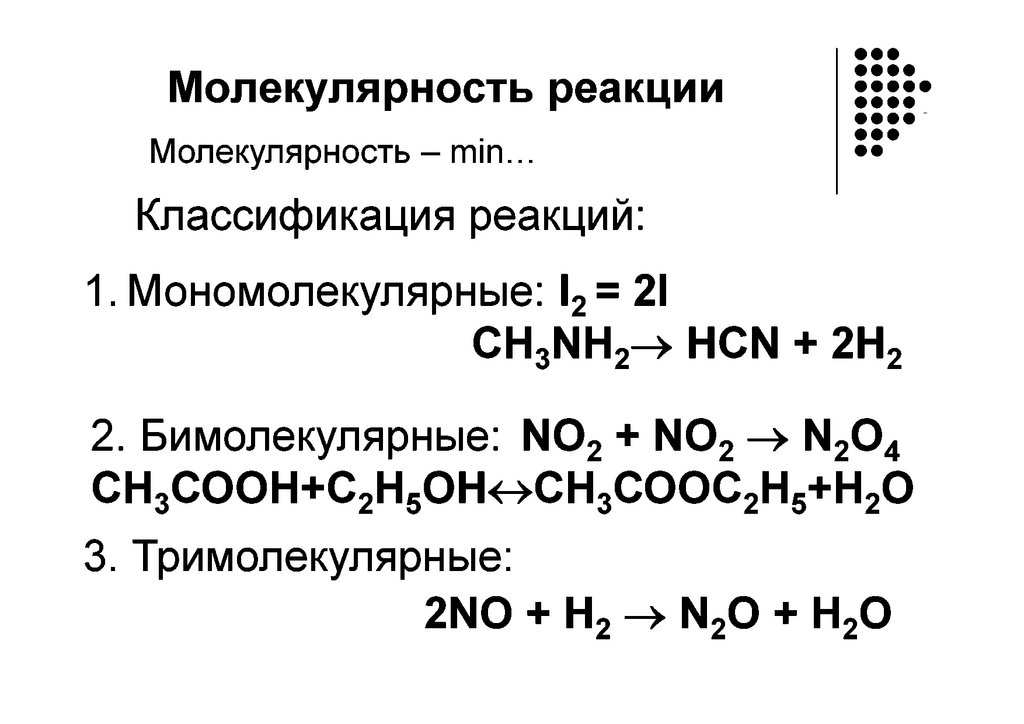
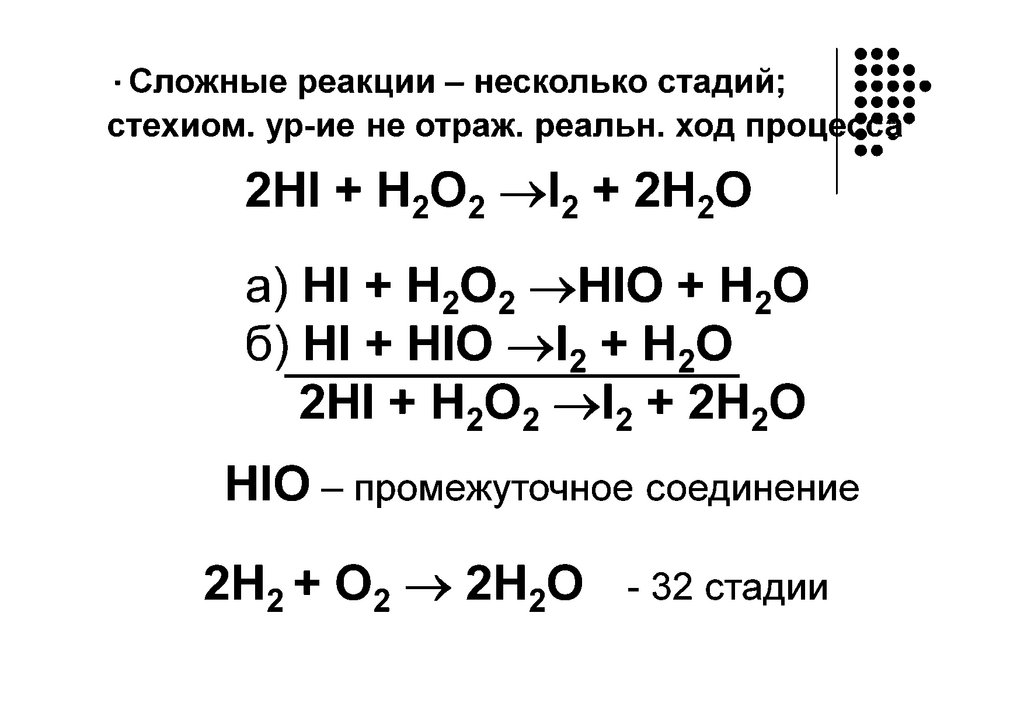
Классификация химических реакцийПростые
- протекают в одну стадию и
называются одностадийными.
Порядок реакции совпадает с молекулярностью, а
кинетическое уравнение с законом действующих
масс.
Сложные – идут либо последовательно
(многостадийные),
либо
параллельно,
либо
последовательно параллельно.
Состоят из ряда простых элементарных стадий,
которые протекают по одно-, двух-, или трех
молекулярному механизму. Поэтому реакции могут
иметь разную молекулярность.
93.
Скорость химической реакции определяется наиболеемедленной стадией, эта стадия лимитирующая.
2 N2О5 = 4 NО2 + О2 протекает через стадии:
N2О5↔NО2+NО3 ( быстрая) мономолекулярная
NО2+NО3→NО2+NО+О2 (медленная ) бимолекулярная
NО2 + NО3 ↔ 2 NО2 (быстрая) бимолекулярная
NО2 и NО3 –интермедиаты, скорость их образования
равна скорости их расходования.
Скорость лимитирующей стадии равна скорости всего
процесса, следовательно, V = k*СN2О5.
Порядок реакции равен 1 и меньше суммы
стехиометрических коэффициентов (2).





























































































 Химия
Химия








