Похожие презентации:
Сущность процесса электролитической диссоциации
1. Тема: «Сущность процесса электролитической диссоциации»
2.
• Учащиесячто
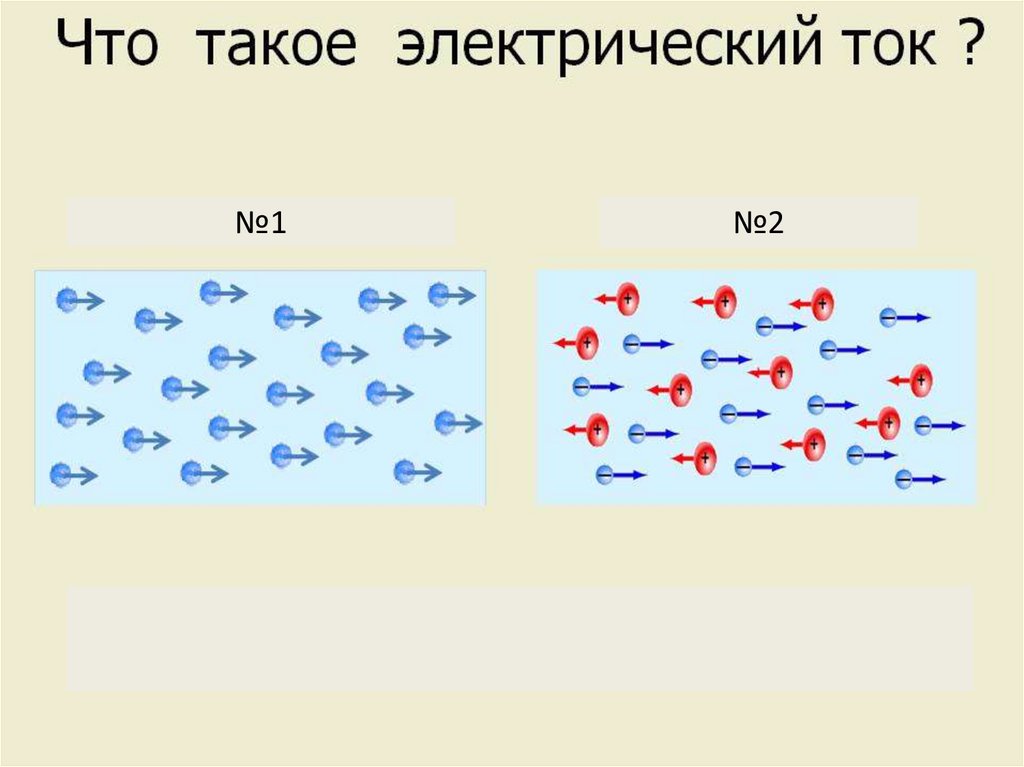
№1 вспоминают из курса физики,
№2
такое электрический ток (упорядоченное
движение носителей электрических
• зарядов).
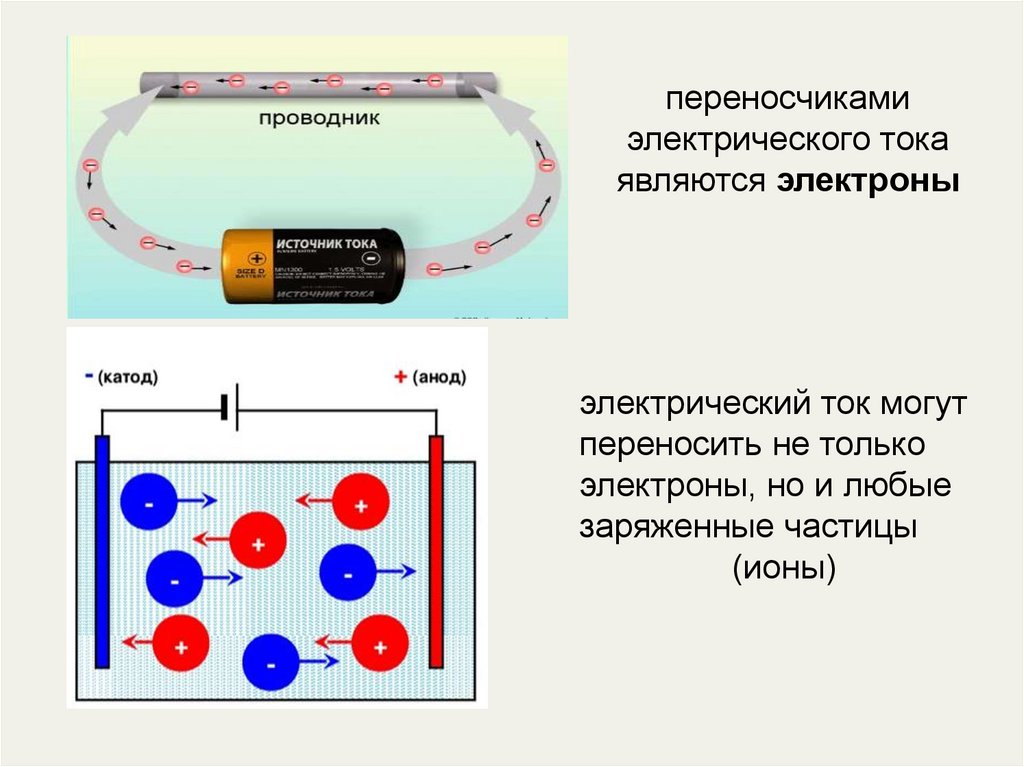
3. Какие частицы являются переносчиками тока в металлах?
• Металлы — это проводники первого рода.4. переносчиками электрического тока являются электроны
электрический ток могутпереносить не только
электроны, но и любые
заряженные частицы
(ионы)
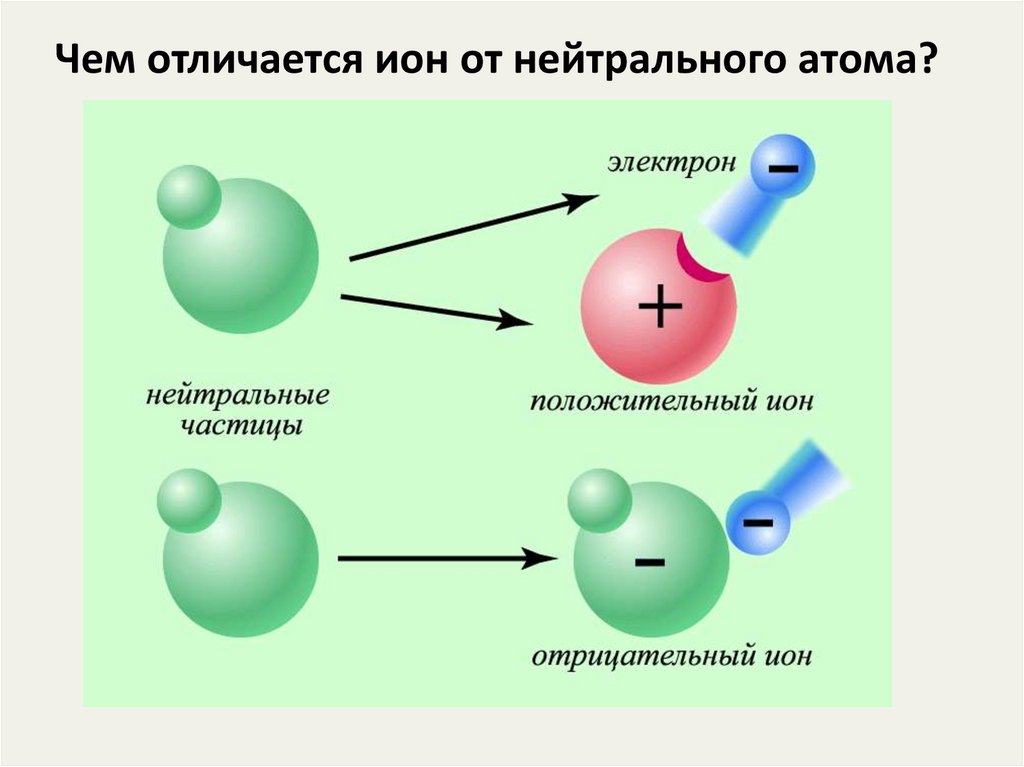
5. Чем отличается ион от нейтрального атома?
6.
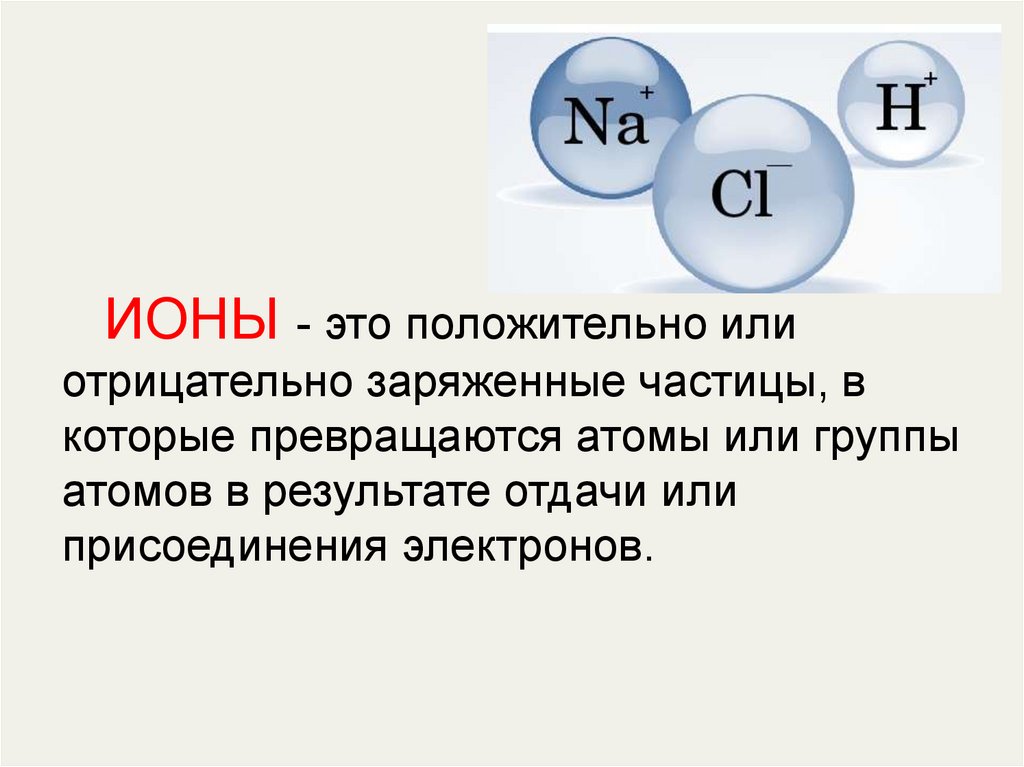
ИОНЫ - это положительно илиотрицательно заряженные частицы, в
которые превращаются атомы или группы
атомов в результате отдачи или
присоединения электронов.
7. Чем отличается металлический натрий от иона натрия?
Атом натрия Na0Ион натрия Na+
11 p+ , 12n0 , 11 e
11 p+ , 12n0 , 10 e
8.
опыты по проверке электропроводности веществхлорид натрия
(кристаллический)
дистиллированная
вода
водный раствор
хлорида натрия
выводы:
1) кристаллический
хлорид натрия
не проводит
электрический ток;
2) дистиллированная
вода не проводит
электрический ток;
https://youtu.be/0XO0GVZVHKY
3) водный раствор
хлорида натрия
проводит
электрический ток.
9.
Фарадей Майкл22. IX.1791 – 25.VIII. 1867
Английский физик и химик.
В первой половине 19 в. ввел понятие
об электролитах и неэлектролитах.
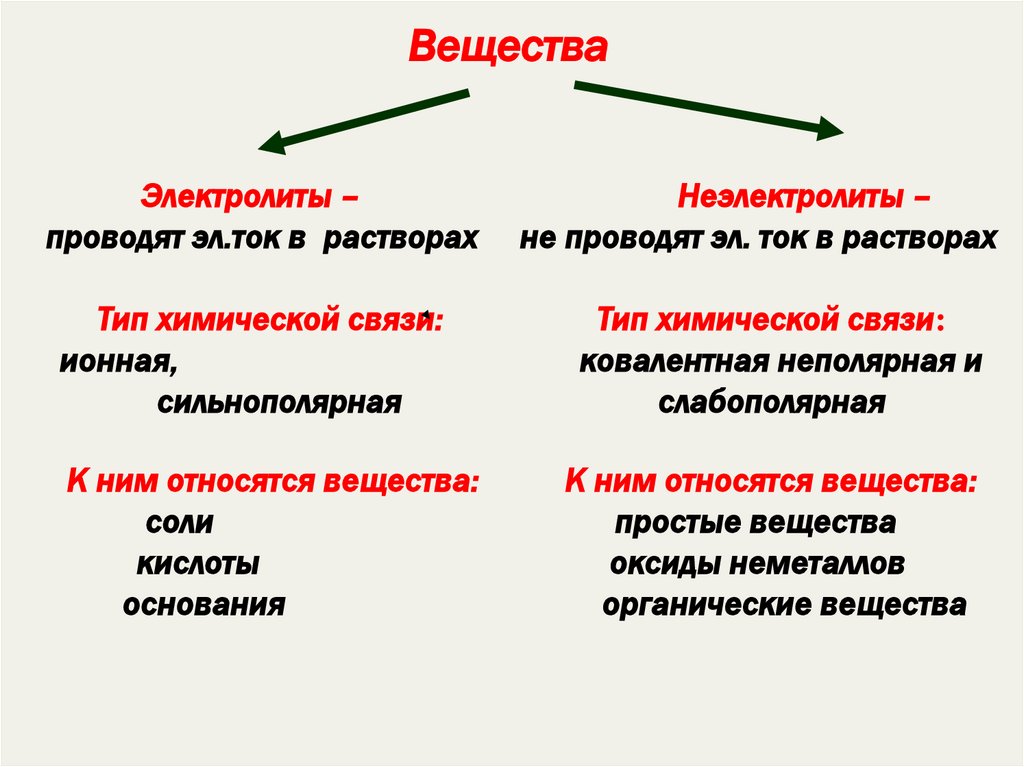
Вещества
Электролиты
Вещества, водные растворы
или расплавы которых
проводят электрических ток
Неэлектролиты
Вещества, водные растворы
или расплавы которых не
проводят электрический ток
10. Теория электролитической диссоциации (ТЭД)
В 1877 году шведский учёныйС. Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными.
Сванте Аррениус
11.
ВеществаЭлектролиты –
проводят эл.ток в растворах
Неэлектролиты –
не проводят эл. ток в растворах
Тип химической связи:
ионная,
сильнополярная
Тип химической связи:
ковалентная неполярная и
слабополярная
К ним относятся вещества:
соли
кислоты
основания
К ним относятся вещества:
простые вещества
оксиды неметаллов
органические вещества
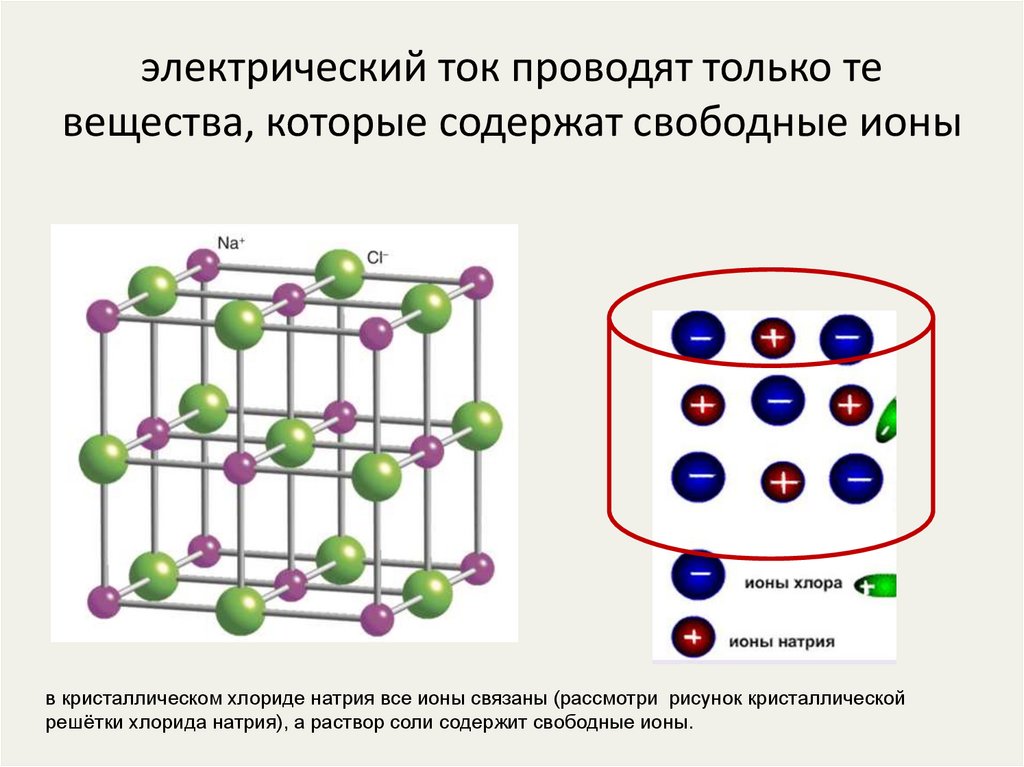
12. электрический ток проводят только те вещества, которые содержат свободные ионы
в кристаллическом хлориде натрия все ионы связаны (рассмотри рисунок кристаллическойрешётки хлорида натрия), а раствор соли содержит свободные ионы.
13.
Процесс распада электролита наионы при растворении его в воде
или расплавлении называется
электролитической
диссоциацией.
14.
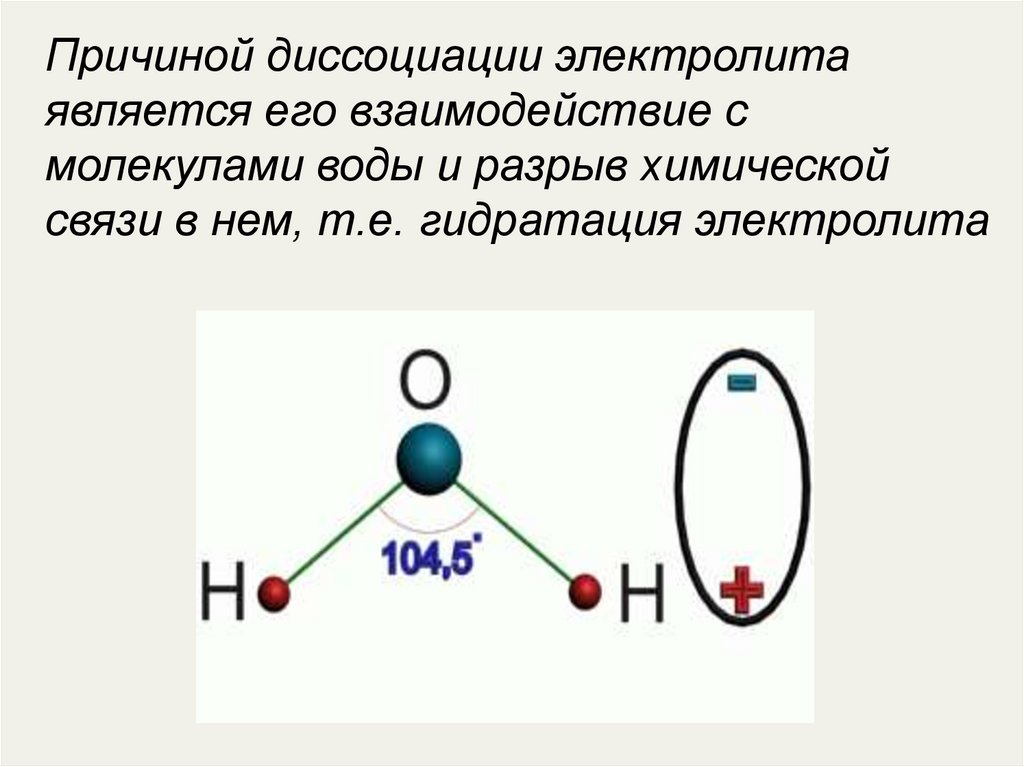
Причиной диссоциации электролитаявляется его взаимодействие с
молекулами воды и разрыв химической
связи в нем, т.е. гидратация электролита
15.
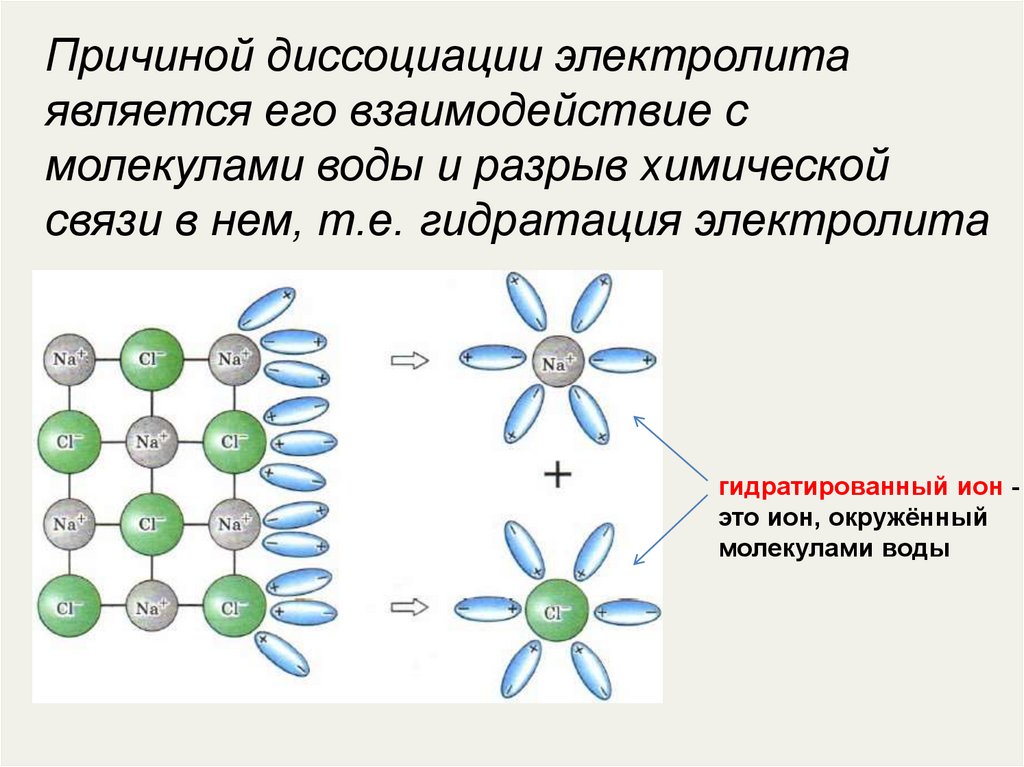
Причиной диссоциации электролитаявляется его взаимодействие с
молекулами воды и разрыв химической
связи в нем, т.е. гидратация электролита
гидратированный ион это ион, окружённый
молекулами воды
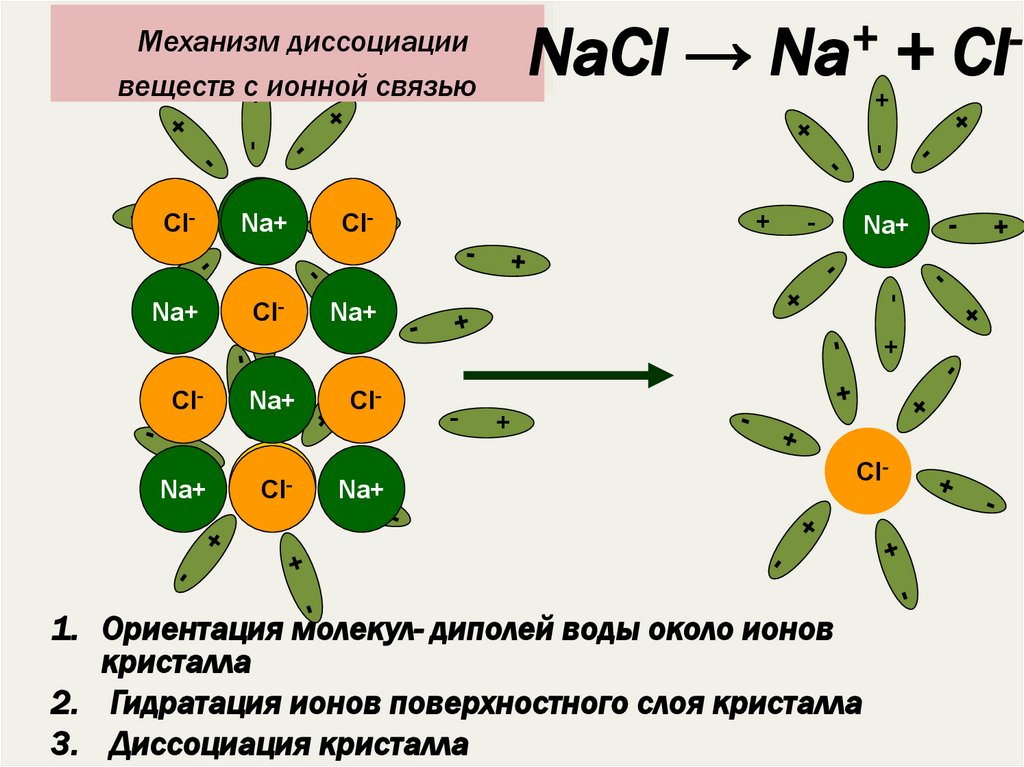
16. Механизм диссоциации веществ с ионной связью
+NaCl → Na + Cl
+
+
Механизм диссоциации
веществ с ионной связью
Na+
Cl-
Cl-
Na+
Na+
Cl--
Cl-
+
-
Na+
-
-
Na+
Na+
-
+ Cl--
+
+
Na+
-
Na+
+
Cl-
Cl-
1. Ориентация молекул- диполей воды около ионов
кристалла
2. Гидратация ионов поверхностного слоя кристалла
3. Диссоциация кристалла
17. Сущность процесса электролитической диссоциации веществ с ионной связью
1. ориентация молекул воды около ионов,образующих кристалл;
2. взаимодействие молекул воды с ионами
поверхностного слоя кристалла (гидратация);
3. распад кристалла на гидратированные ионы
(диссоциация).
NaCl = Na + Cl
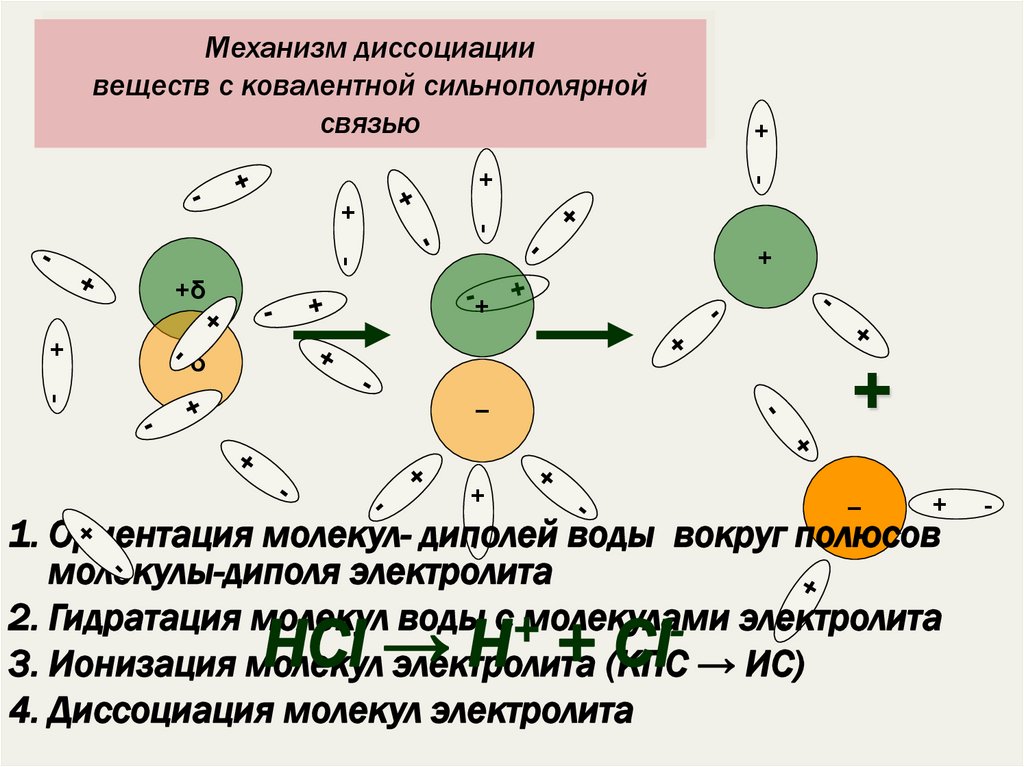
18. Механизм диссоциации веществ с ковалентной сильнополярной связью
+Механизм диссоциации
веществ с ковалентной сильнополярной
связью
-
+
+
-
-
+
+δ
+
+
−δ
-
−
+
+
−
+
-
1. Ориентация молекул- диполей воды вокруг полюсов
молекулы-диполя электролита
2. Гидратация молекул воды с+молекулами
- электролита
3. Ионизация молекул электролита (КПС → ИС)
4. Диссоциация молекул электролита
HCl → H + Cl
-
19. Сущность процесса электролитической диссоциации веществ с ковалентной полярной связью
1. ориентация молекул воды вокруг полюсовмолекулы электролита;
2. взаимодействие молекул воды с молекулами
электролита;
3. ионизация электролита (превращение
ковалентной полярной связи в ионную);
4. диссоциация (распад) молекул электролита на
гидратированные ионы.
НCl = Н + Cl
20.
Кристаллогидраты — кристаллы, содержащие молекулы воды иобразующиеся, если в кристаллической решётке катионы образуют более прочную
связь с молекулами воды, чем связь между катионами и анионами в кристалле
безводного вещества.
Кристаллизационная вода – это вода, входящая в структуру кристаллов
некоторых веществ, называемых кристаллогидратами.
21. Рефлексия
• Я умею определять ….. и …..• Я умею записывать … и ….
• Я знаю, что ……..
22. Домашнее задание
• §6 прочитать, выучить основныеопределения.
• Выполнить задания 1- 4












 Химия
Химия








