Похожие презентации:
Карбоновые кислоты и их функциональные производные
1.
ЛЕКЦИЯ №9для студентов 1 курса,
обучающихся по специальности
медицинская кибернетика
лектор: ст. преподаватель
кафедры биохимии
Шадрина Людмила Борисовна
Красноярск 2017
2.
Карбоновые кислоты и их функциональные производные (сложныеэфиры и тиоэфиры, амиды, гидразиды, галогенангидриды и
ангидриды) широко распространены в природе.
Работа функциональных групп этих классов лежит в основе различных
процессов жизнедеятельности.
Их взаимопревращаемость используется в органическом синтезе.
Функциональные группы карбоновых кислот и их производных входят
в состав биомолекул и лекарственных веществ.
Знание электронного строения функциональных групп данных классов
и прогнозирование реакционной способности важно для понимания
процессов, протекающих в организме и возможностей проведения
синтезов.
2
3.
34.
1. Карбоновые кислоты: классификация, природные источники.2. Предельные одноосновные карбоновые кислоты: общая
формула, гомологический ряд.
3. Реакционные центры карбоновых кислот и их
функциональных производных.
4. Сравнение кислотности карбоновых кислот.
5. Реакции нуклеофильного замещения SN у тригонального
атома углерода. Механизм и схема в общем виде.
6. Реакции этерификации и гидролиза. Условия протекания.
4
5.
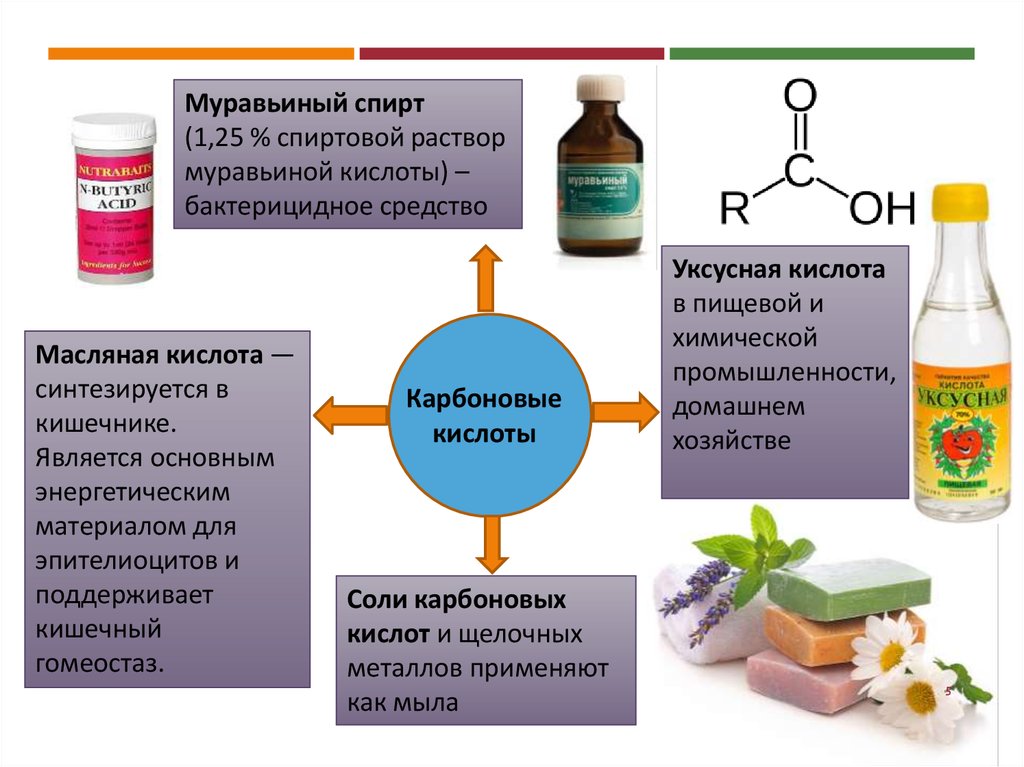
Муравьиный спирт(1,25 % спиртовой раствор
муравьиной кислоты) –
бактерицидное средство
Масляная кислота —
синтезируется в
кишечнике.
Является основным
энергетическим
материалом для
эпителиоцитов и
поддерживает
кишечный
гомеостаз.
Карбоновые
кислоты
Соли карбоновых
кислот и щелочных
металлов применяют
как мыла
Уксусная кислота
в пищевой и
химической
промышленности,
домашнем
хозяйстве
5
6.
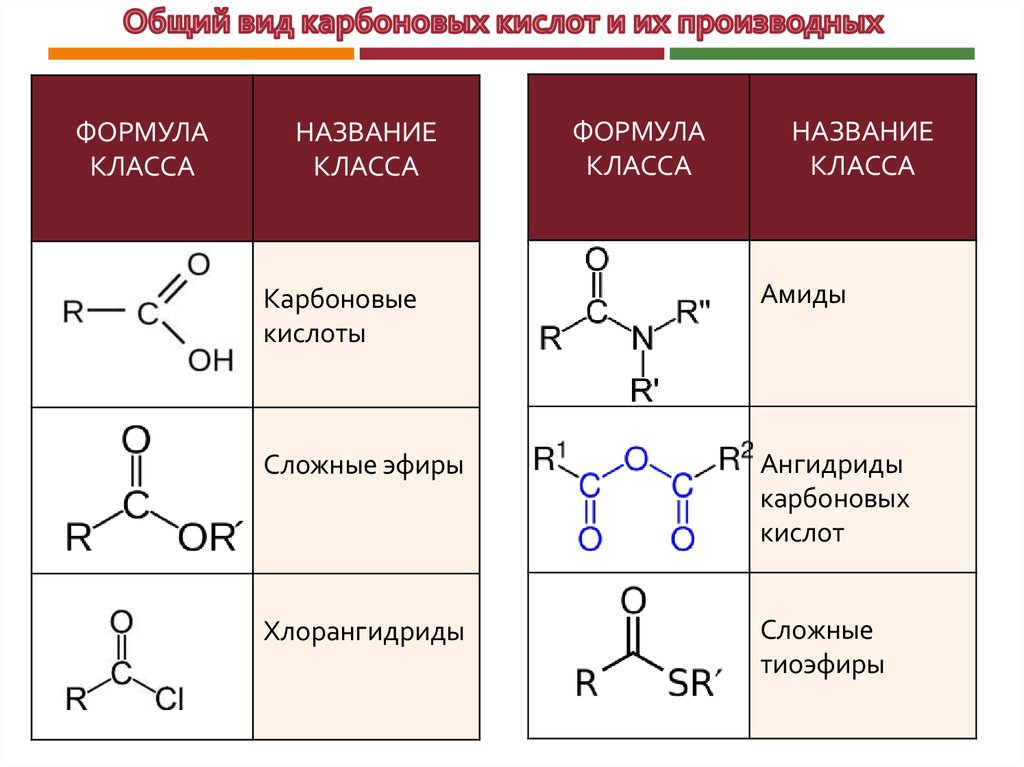
ФОРМУЛАКЛАССА
НАЗВАНИЕ
КЛАССА
ФОРМУЛА
КЛАССА
НАЗВАНИЕ
КЛАССА
Карбоновые
кислоты
Амиды
Сложные эфиры
Ангидриды
карбоновых
кислот
Хлорангидриды
Сложные
тиоэфиры
6
7.
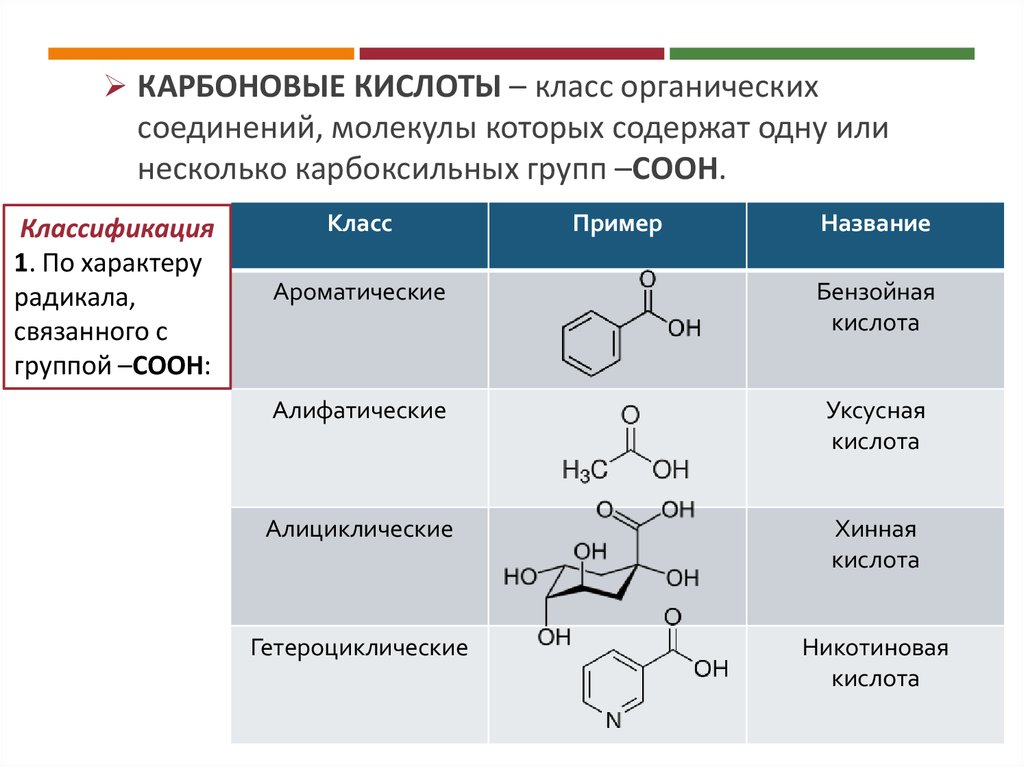
КАРБОНОВЫЕ КИСЛОТЫ – класс органическихсоединений, молекулы которых содержат одну или
несколько карбоксильных групп –СООН.
Классификация
1. По характеру
радикала,
связанного с
группой –СООН:
Класс
Пример
Название
Ароматические
Бензойная
кислота
Алифатические
Уксусная
кислота
Алициклические
Хинная
кислота
Гетероциклические
Никотиновая
кислота 7
8.
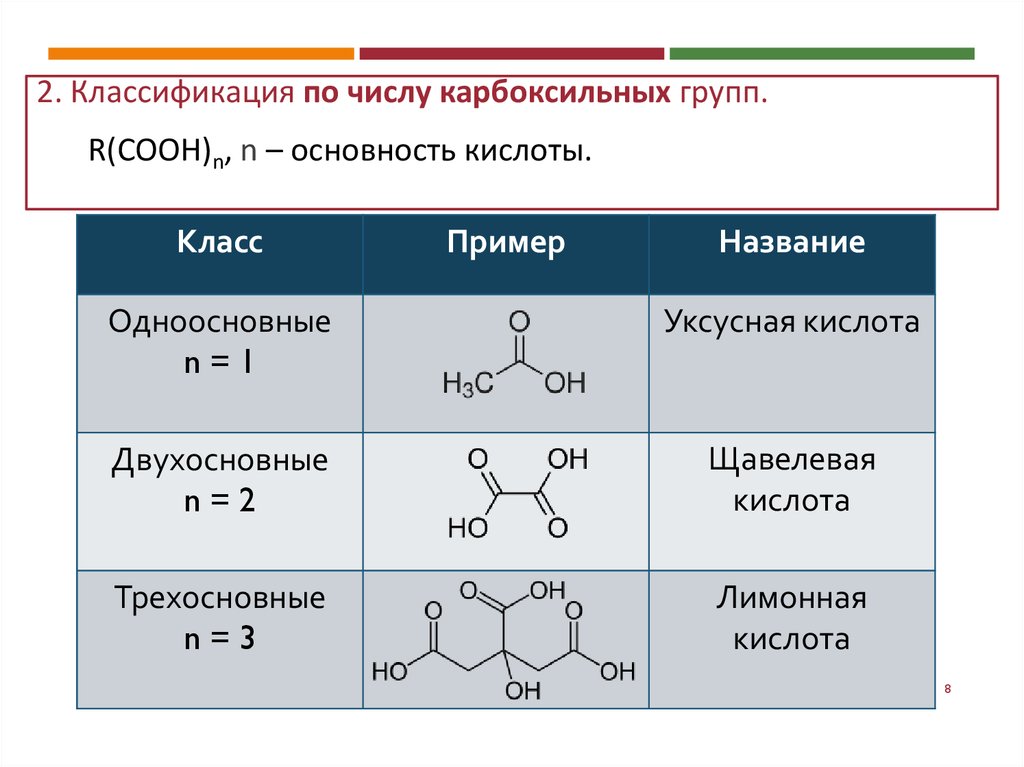
2. Классификация по числу карбоксильных групп.R(COOH)n, n – основность кислоты.
Класс
Пример
Название
Одноосновные
n=1
Уксусная кислота
Двухосновные
n=2
Щавелевая
кислота
Трехосновные
n=3
Лимонная
кислота
8
9.
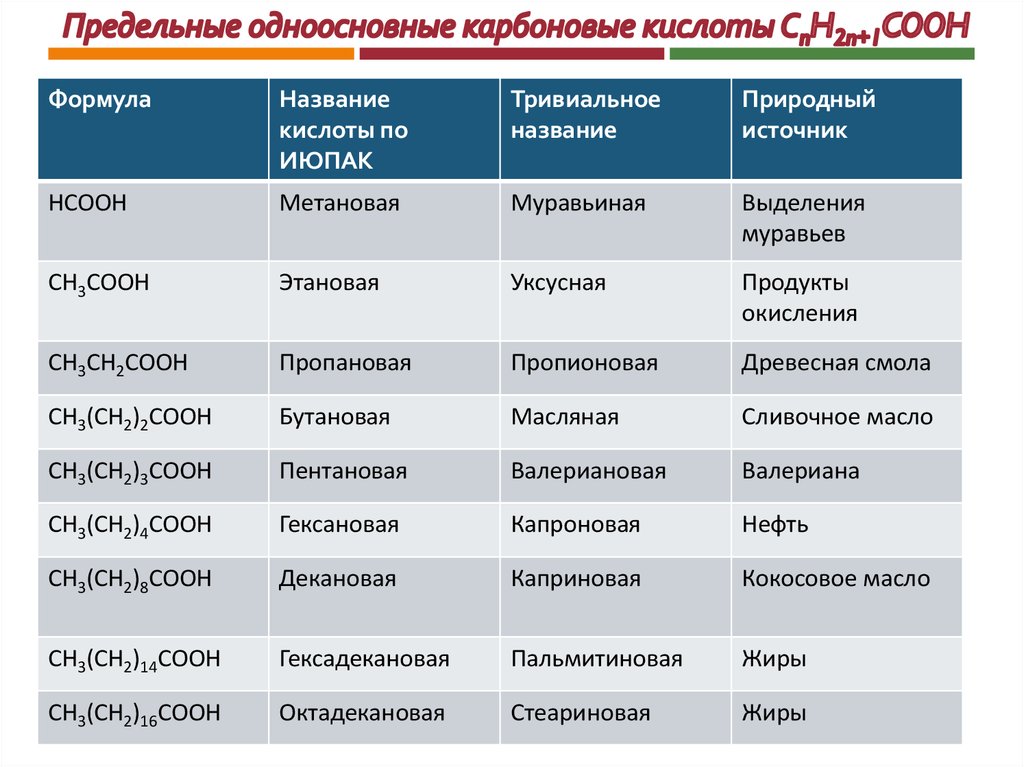
ФормулаНазвание
кислоты по
ИЮПАК
Тривиальное
название
Природный
источник
НСООН
Метановая
Муравьиная
Выделения
муравьев
СН3СООН
Этановая
Уксусная
Продукты
окисления
СН3СН2СООН
Пропановая
Пропионовая
Древесная смола
СН3(СН2)2СООН
Бутановая
Масляная
Сливочное масло
СН3(СН2)3СООН
Пентановая
Валериановая
Валериана
СН3(СН2)4СООН
Гексановая
Капроновая
Нефть
СН3(СН2)8СООН
Декановая
Каприновая
Кокосовое масло
СН3(СН2)14СООН
Гексадекановая
Пальмитиновая
Жиры
9
СН3(СН2)16СООН
Октадекановая
Стеариновая
Жиры
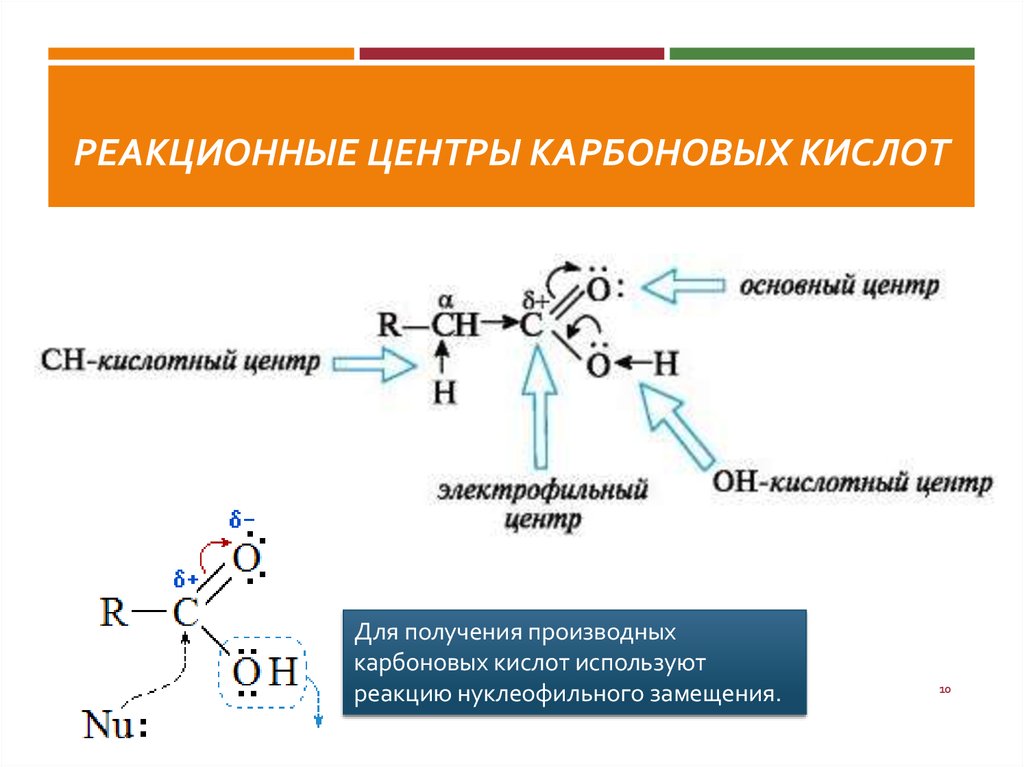
10. Реакционные центры карбоновых кислот
РЕАКЦИОННЫЕ ЦЕНТРЫ КАРБОНОВЫХ КИСЛОТДля получения производных
карбоновых кислот используют
реакцию нуклеофильного замещения.
10
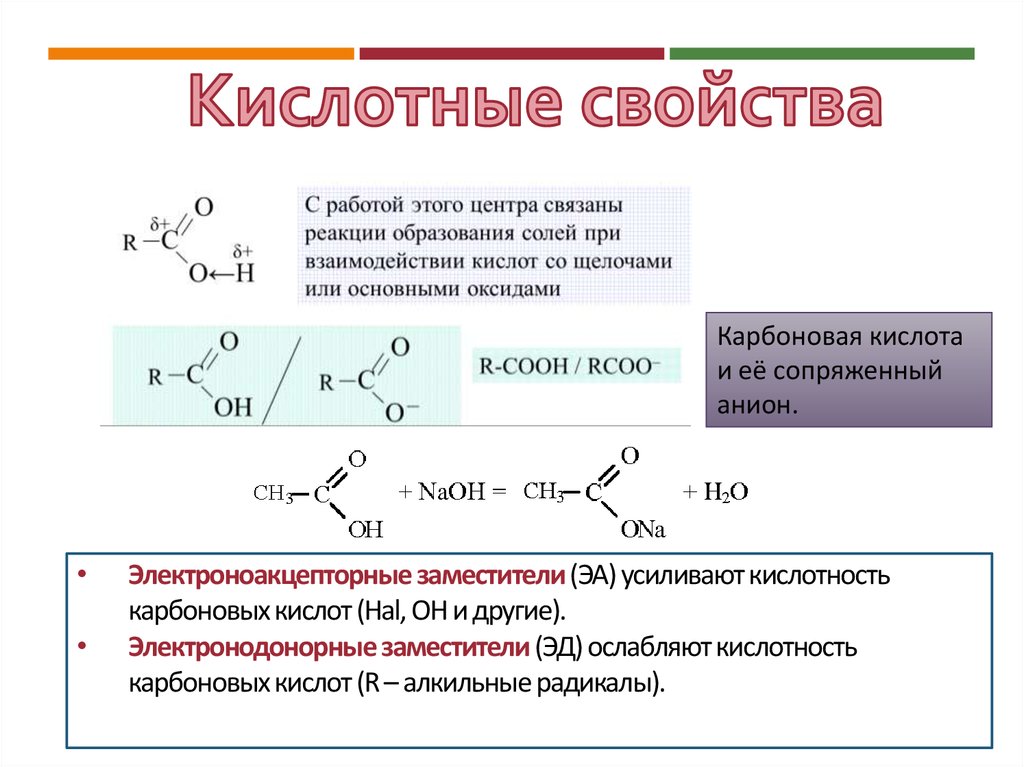
11. Кислотность карбоновых кислот
КИСЛОТНОСТЬ КАРБОНОВЫХ КИСЛОТКарбоновая кислота
и её сопряженный
анион.
Электроноакцепторные заместители (ЭА) усиливают кислотность
карбоновых кислот (Hal, OH и другие).
Электронодонорные заместители (ЭД) ослабляют кислотность
карбоновых кислот (R – алкильные радикалы).
11
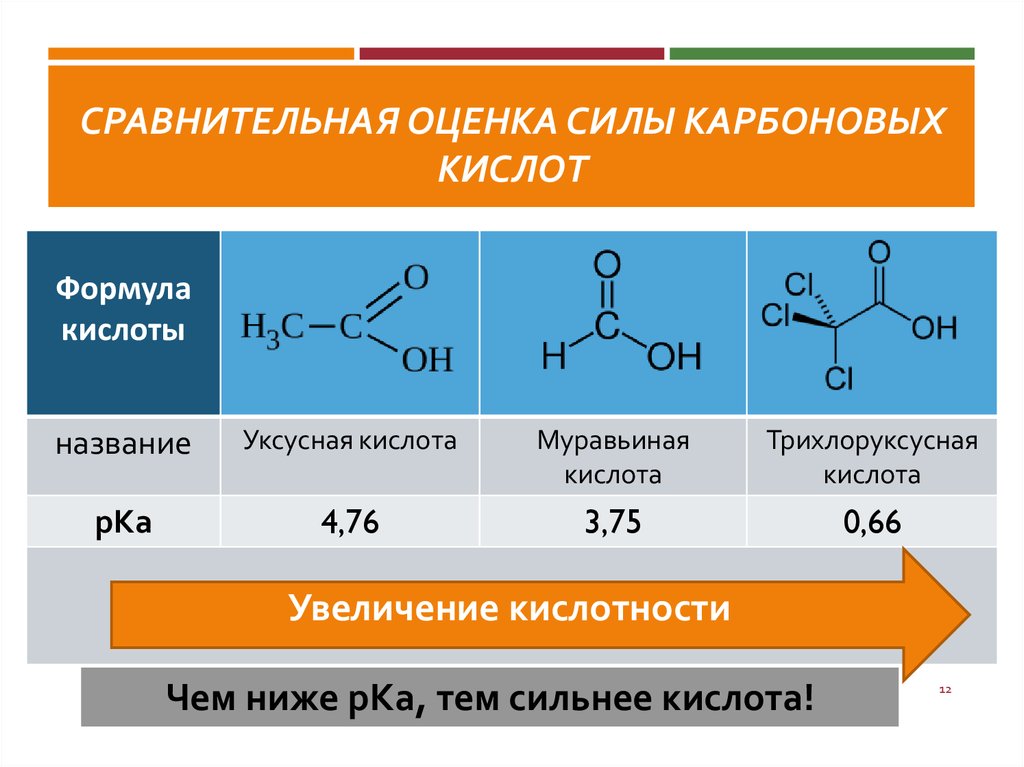
12. Сравнительная оценка силы карбоновых кислот
СРАВНИТЕЛЬНАЯ ОЦЕНКА СИЛЫ КАРБОНОВЫХКИСЛОТ
Формула
кислоты
название
Уксусная кислота
Муравьиная
кислота
Трихлоруксусная
кислота
рКа
4,76
3,75
0,66
Увеличение кислотности
Чем ниже рКа, тем сильнее кислота!
12
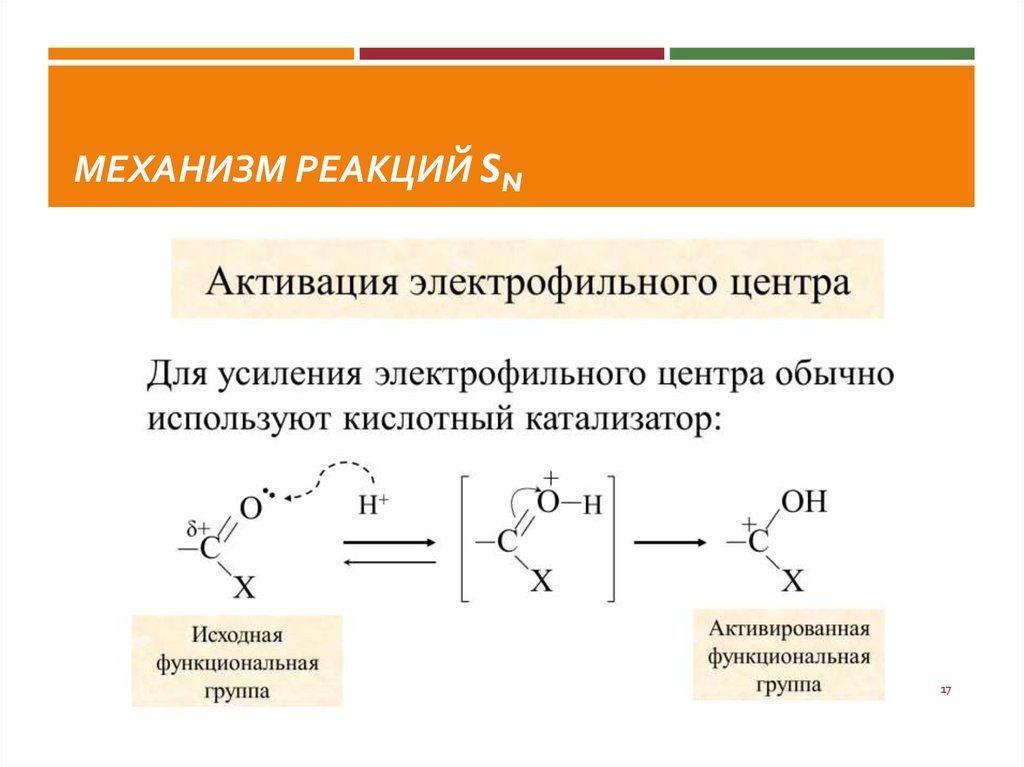
13. Механизм реакций SN (нуклеофильного замещения)
МЕХАНИЗМ РЕАКЦИЙ SN(НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ)
13
14. УСЛОВИЯ ПРОТЕКАНИЯ РЕАКЦИЙ SN
1. Наличие хорошей уходящей группы.2. Наличие сильного нуклеофильного реагента или сильного
электрофильного центра.
!!! Если нуклеофильный
реагент и электрофильный
центр являются слабыми, то
необходим катализатор (Н+).
14
15. Сравнение силы реакционных центров в карбоновых кислотах и их функциональных производных
СРАВНЕНИЕ СИЛЫ РЕАКЦИОННЫХ ЦЕНТРОВ ВКАРБОНОВЫХ КИСЛОТАХ И ИХ ФУНКЦИОНАЛЬНЫХ
ПРОИЗВОДНЫХ
15
16. Сравнение силы реакционных центров в карбоновых кислотах и их функциональных производных
СРАВНЕНИЕ СИЛЫ РЕАКЦИОННЫХ ЦЕНТРОВ ВКАРБОНОВЫХ КИСЛОТАХ И ИХ ФУНКЦИОНАЛЬНЫХ
ПРОИЗВОДНЫХ
16
17. Механизм реакций SN
МЕХАНИЗМ РЕАКЦИЙ SN17
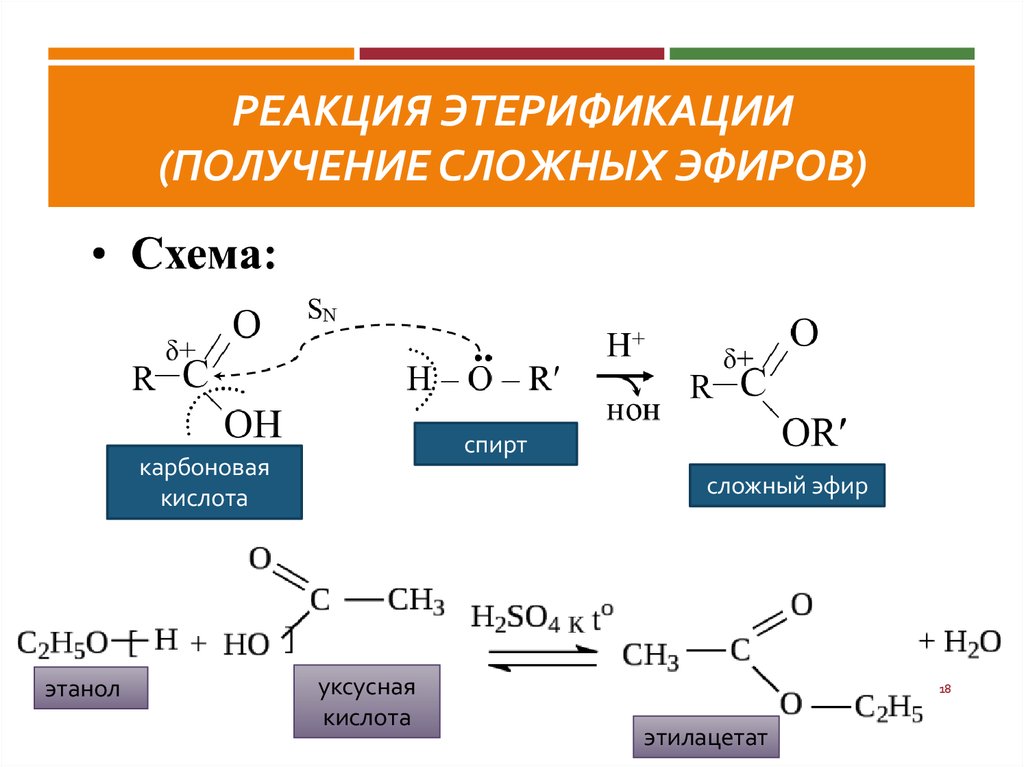
18. Реакция этерификации (получение сложных эфиров)
РЕАКЦИЯ ЭТЕРИФИКАЦИИ(ПОЛУЧЕНИЕ СЛОЖНЫХ ЭФИРОВ)
спирт
карбоновая
кислота
этанол
сложный эфир
уксусная
кислота
18
этилацетат
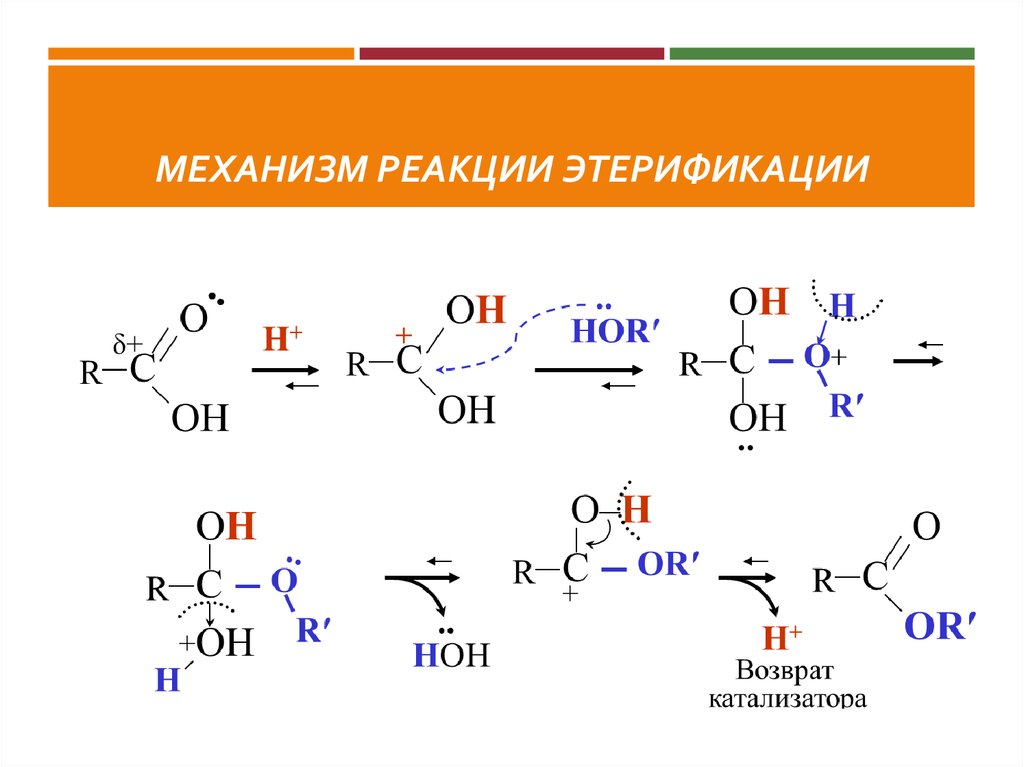
19. Механизм Реакции этерификации
МЕХАНИЗМ РЕАКЦИИ ЭТЕРИФИКАЦИИ19
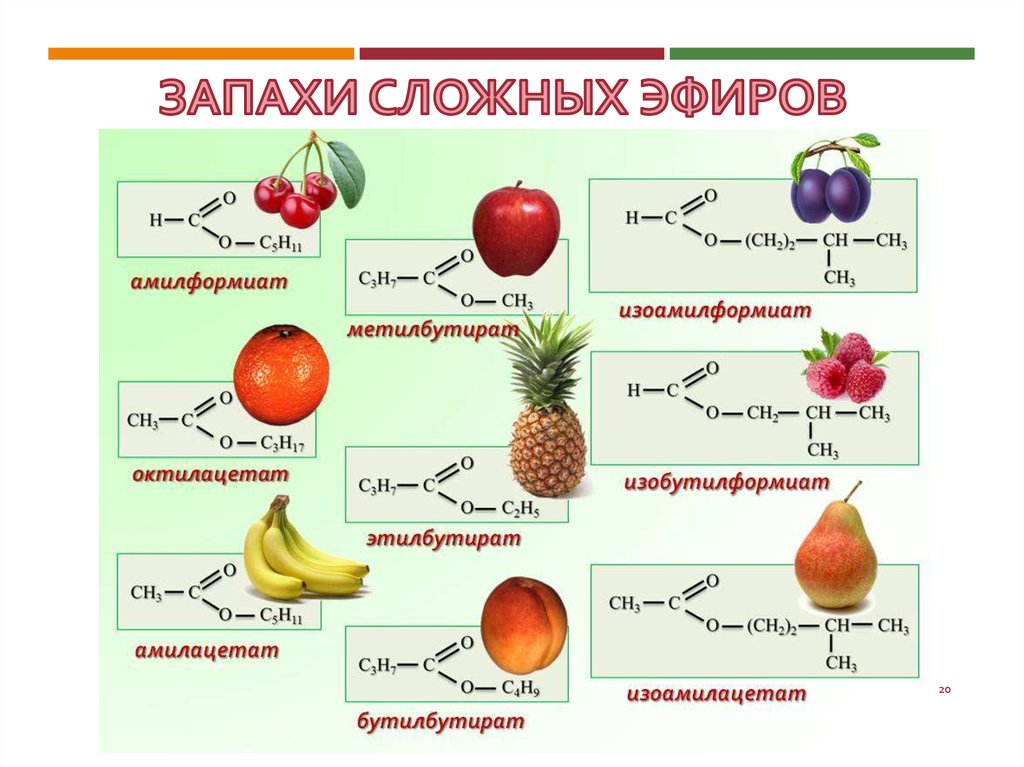
20. ЗАПАХИ СЛОЖНЫХ ЭФИРОВ
2021. Гидролиз сложных эфиров
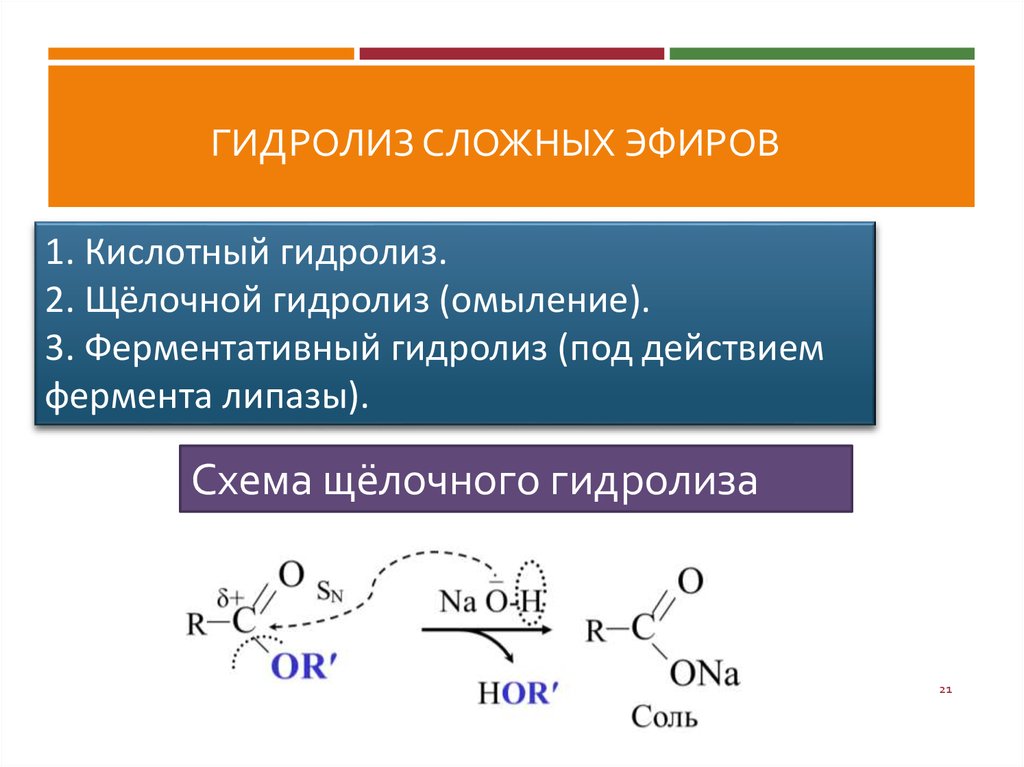
ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ1. Кислотный гидролиз.
2. Щёлочной гидролиз (омыление).
3. Ферментативный гидролиз (под действием
фермента липазы).
Схема щёлочного гидролиза
21
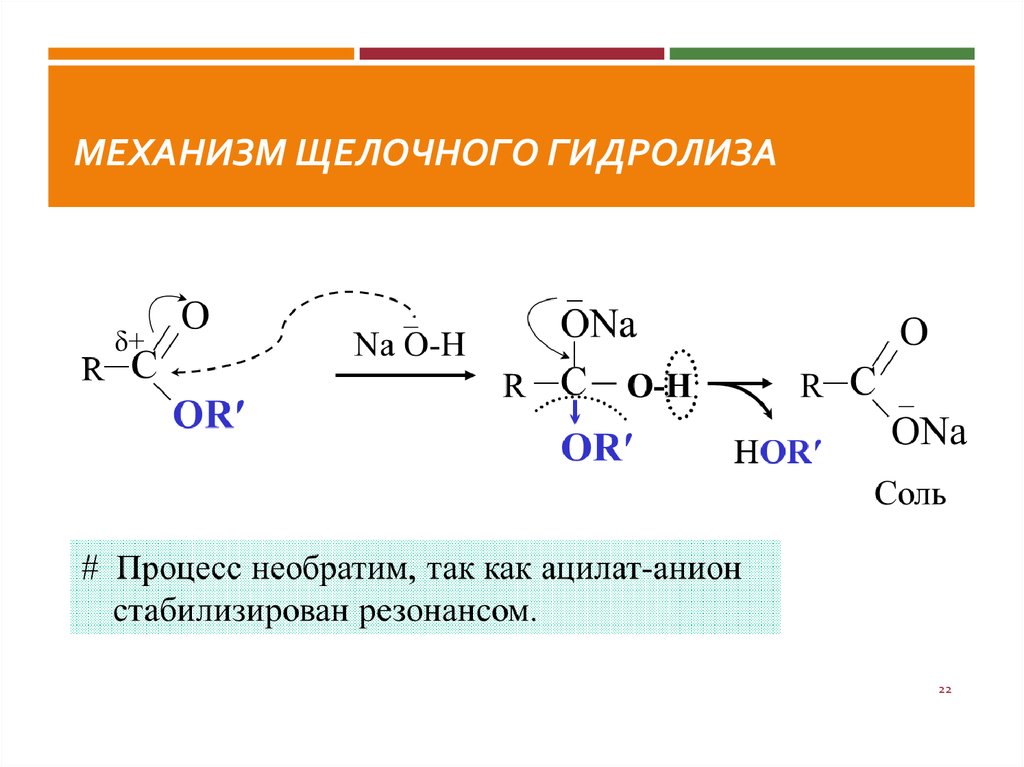
22. Механизм щелочного гидролиза
МЕХАНИЗМ ЩЕЛОЧНОГО ГИДРОЛИЗА22
23.
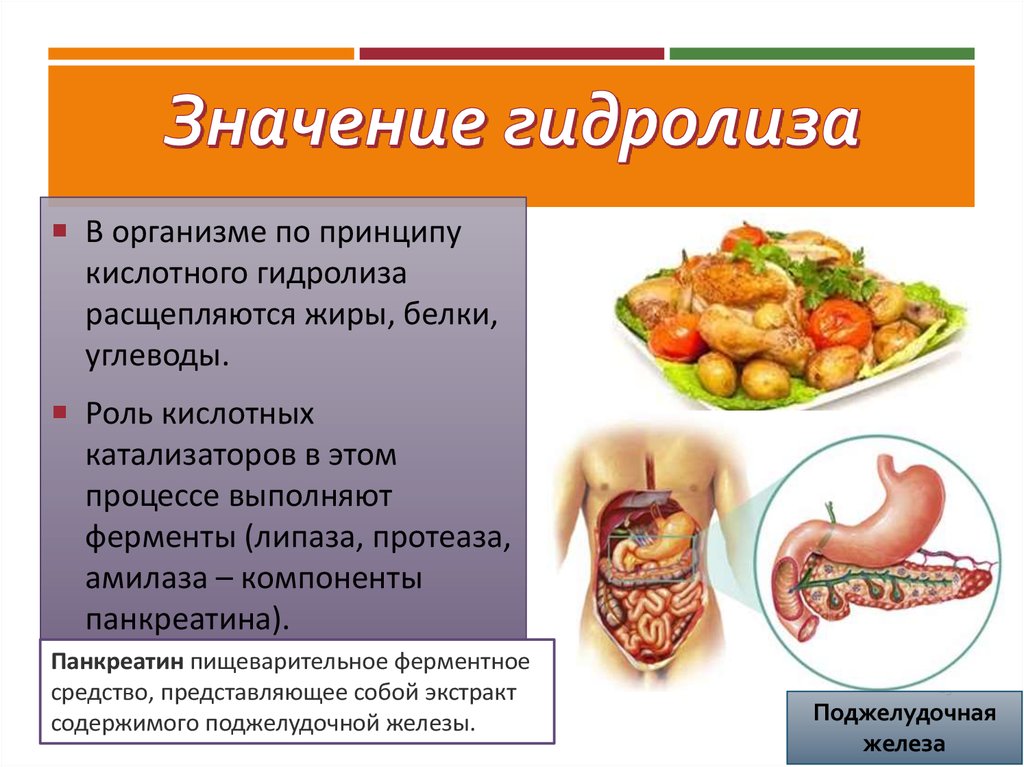
В организме по принципукислотного гидролиза
расщепляются жиры, белки,
углеводы.
Роль кислотных
катализаторов в этом
процессе выполняют
ферменты (липаза, протеаза,
амилаза – компоненты
панкреатина).
Панкреатин пищеварительное ферментное
средство, представляющее собой экстракт
содержимого поджелудочной железы.
23
Поджелудочная
железа
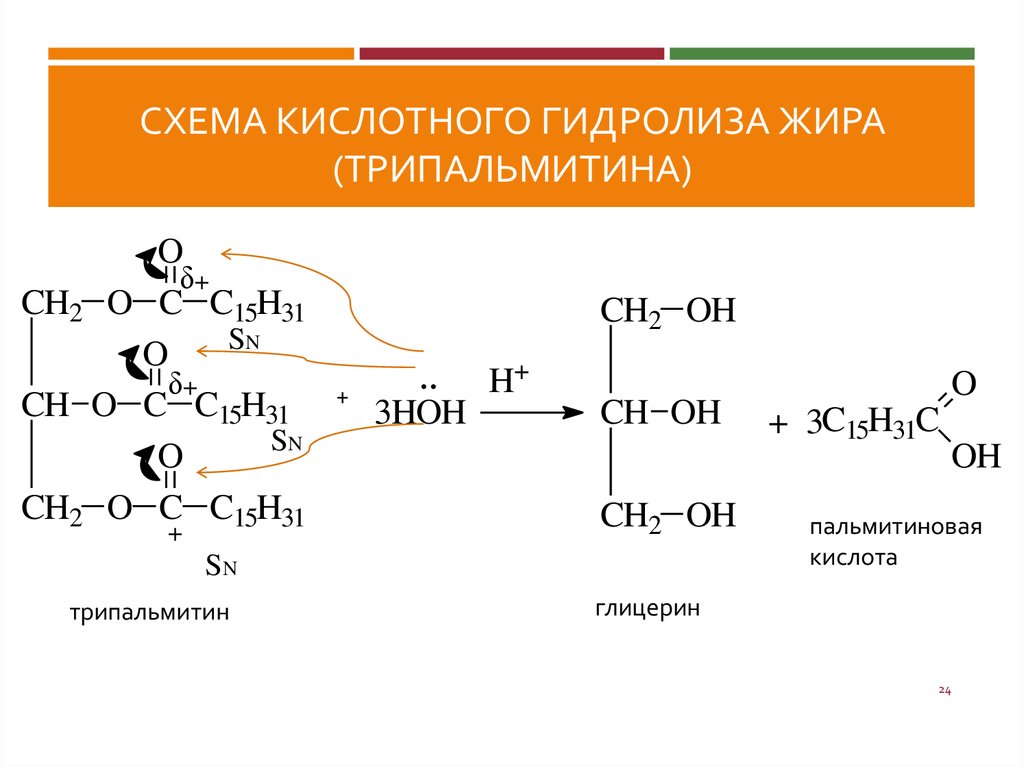
24. Схема кислотного гидролиза жира (трипальмитина)
СХЕМА КИСЛОТНОГО ГИДРОЛИЗА ЖИРА(ТРИПАЛЬМИТИНА)
O
δ+
CH2 O C C15H31
SN
O
δ+
CH O C C15H31
SN
O
CH2 O C C15H31
+
CH2 OH
+
3HOH
H+
CH OH
CH2 OH
SN
трипальмитин
O
+ 3C15H31C
OH
пальмитиновая
кислота
глицерин
24
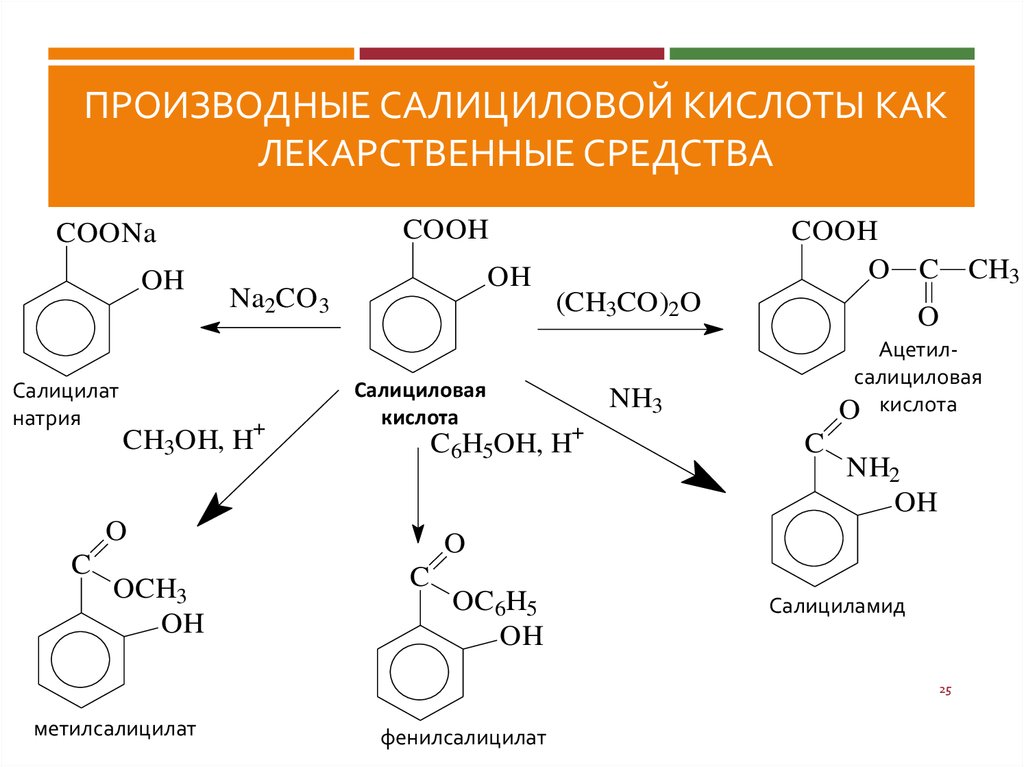
25. Производные салициловой кислоты как лекарственные средства
ПРОИЗВОДНЫЕ САЛИЦИЛОВОЙ КИСЛОТЫ КАКЛЕКАРСТВЕННЫЕ СРЕДСТВА
COOH
COONa
OH
Салицилат
натрия
OH
Na2CO 3
+
CH3OH, H
Салициловая
кислота
OCH3
OH
(CH3CO)2O
C6H5OH, H+
O
C
COOH
O
C
CH3
O
Ацетилсалициловая
O кислота
NH3
C
NH2
OH
O
C
OC6H5
OH
Салициламид
25
метилсалицилат
фенилсалицилат
26. СПАСИБО ЗА ВНИМАНИЕ!
2627. Литература
ЛИТЕРАТУРАСлесарев В.И. – Химия: Основы химии живого:
Учебник для вузов. – 3-е изд., испр. – СПб:
Химиздат. – 2007. – 784с.
Тюкавкина Н. А., Бауков Ю.И. –
Биоорганическая химия : Учебник. – М.:
ДРОФА. – 2006. – С. 36 – 46
27










 Химия
Химия








