Похожие презентации:
Спирты
1.
Название дисциплины, МДКТема лекции «СПИРТЫ»
Специальность: 18.02.12
Технология аналитического контроля
химических соединений
Курс 2
Автор:
Менькова Наталья Сергеевна
2. План:
ПЛАН:1. Классификация, номенклатура, изомерия.
2. Методы получения спиртов.
3. Химические свойства.
4. Особенности многоатомных спиртов.
5. Применение.
3. Спирты –
СПИРТЫ –это органические соединения, в
молекулах которых одна или
несколько групп —ОН соединены с
углеводородным радикалом.
R(OH)n≥1
4. 1.Классификация, номенклатура, изомерия
1.КЛАССИФИКАЦИЯ,НОМЕНКЛАТУРА,
ИЗОМЕРИЯ
5. 1. Классификация спиртов по количеству гидроксильных групп
1. КЛАССИФИКАЦИЯ СПИРТОВПО КОЛИЧЕСТВУ
ГИДРОКСИЛЬНЫХ ГРУПП
1) Одноатомные спирты (моноолы)
CH3 CH2 OH
2) Двухатомные спирты (диолы)
CH2 OH
CH2 CH2
CH3 CH CH2
OH
OH
OH OH
OH OH
этандиол-1,1
метандиол
этандиол-1,2
(этиленгликоль)
пропандиол-1,2
(пропиленгликоль)
CH3 CH OH
6.
3) Многоатомные спиртыCH2 CH CH2
CH2 CH CH CH2
OH OH OH
OH OH OH OH
пропантриол-1,2,3
(глицерин)
бутантетраол-1,2,3,4
(эритрит)
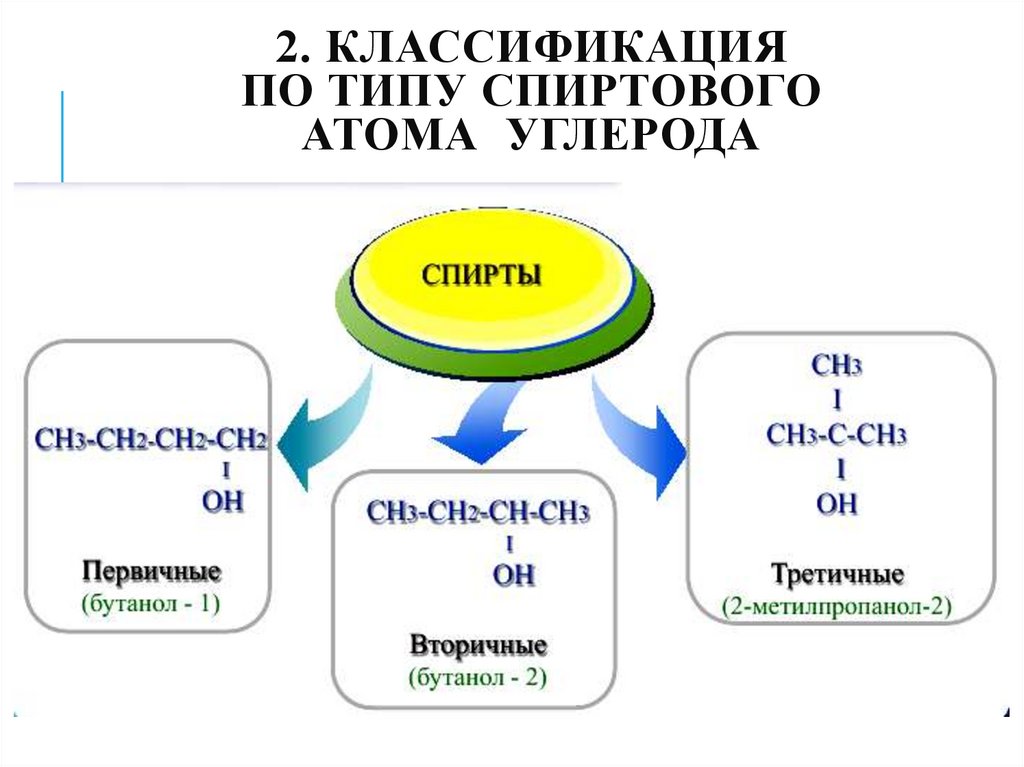
7. 2. Классификация по типу спиртового атома углерода
2. КЛАССИФИКАЦИЯПО ТИПУ СПИРТОВОГО
АТОМА УГЛЕРОДА
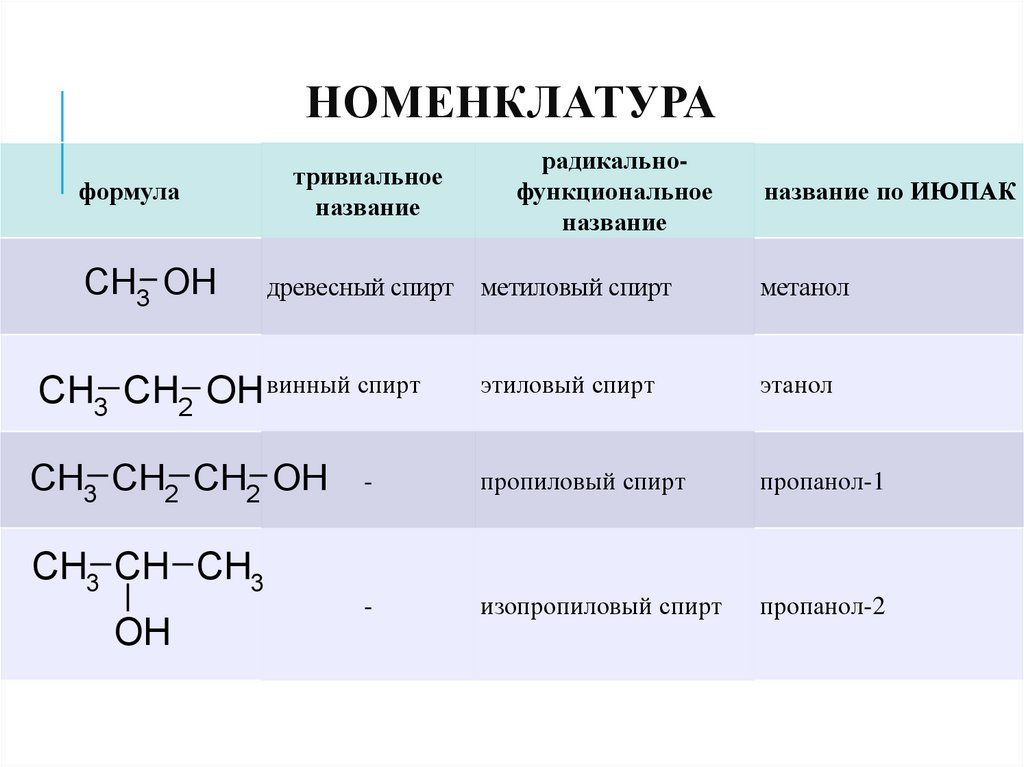
8. Номенклатура
НОМЕНКЛАТУРАформула
CH3 OH
тривиальное
название
название по ИЮПАК
метиловый спирт
метанол
CH3 CH2 OH винный спирт
этиловый спирт
этанол
CH3 CH2 CH2 OH
-
пропиловый спирт
пропанол-1
-
изопропиловый спирт
пропанол-2
CH3 CH CH3
OH
древесный спирт
радикальнофункциональное
название
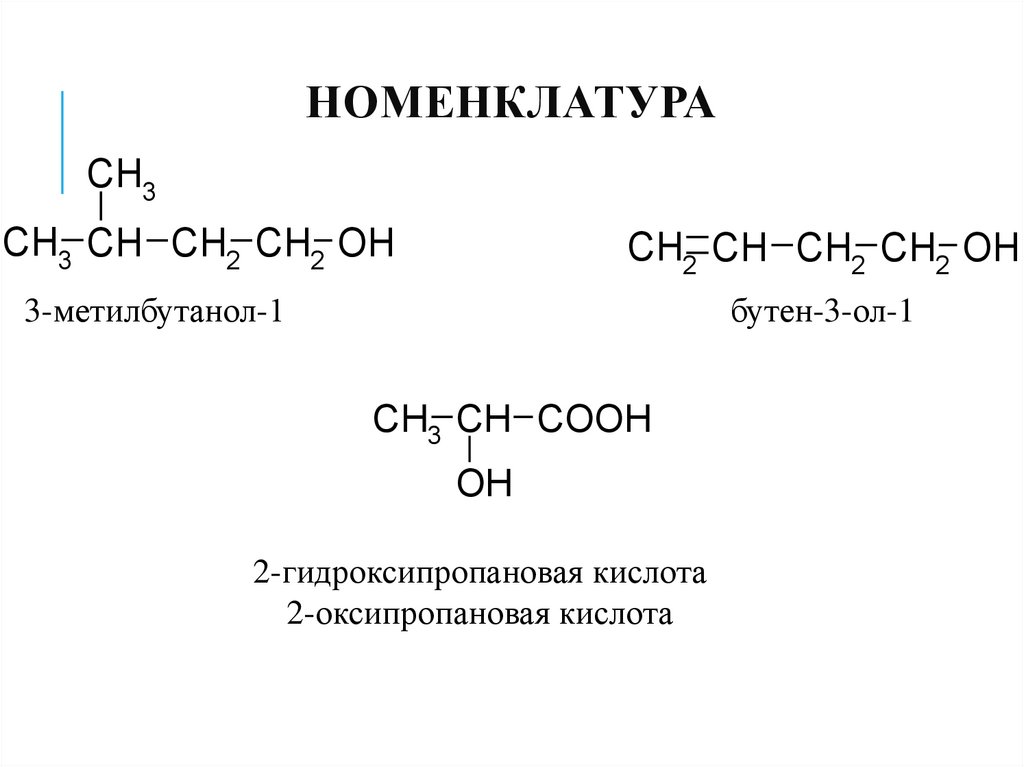
9. Номенклатура
НОМЕНКЛАТУРАCH3
CH3 CH CH2 CH2 OH
CH2 CH CH2 CH2 OH
бутен-3-ол-1
3-метилбутанол-1
CH3 CH COOH
OH
2-гидроксипропановая кислота
2-оксипропановая кислота
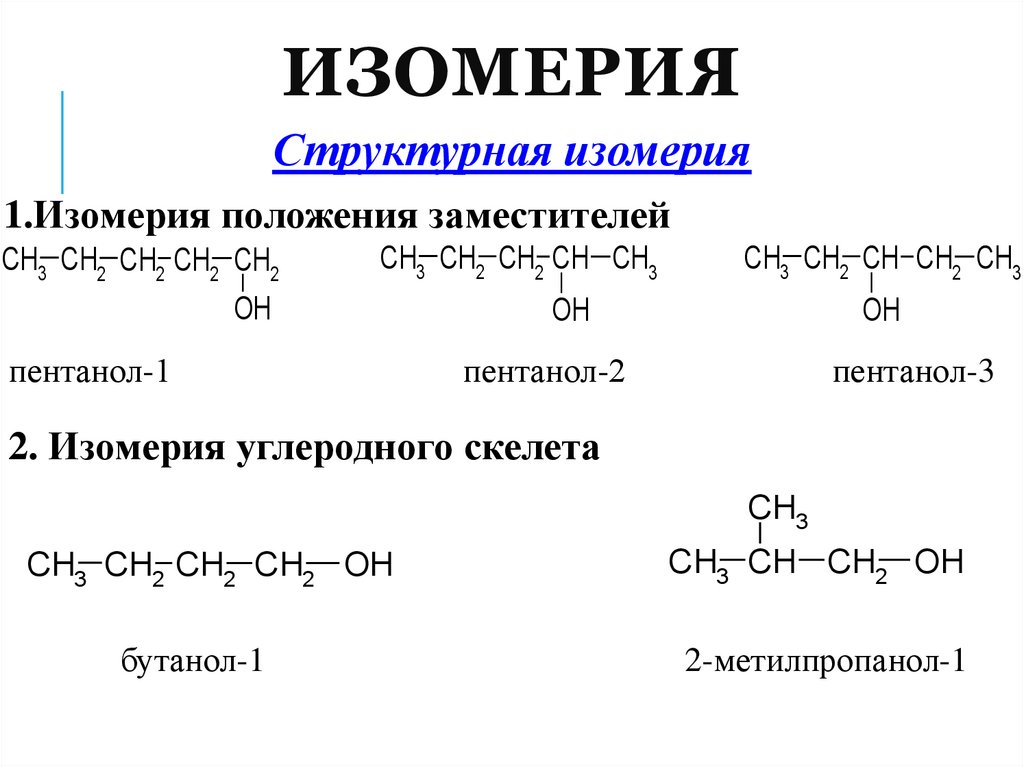
10. Изомерия
ИЗОМЕРИЯСтруктурная изомерия
1.Изомерия положения заместителей
CH3 CH2 CH2 CH2 CH2
CH3 CH2 CH2 CH CH3
OH
пентанол-1
CH3 CH2 CH CH2 CH3
OH
OH
пентанол-2
пентанол-3
2. Изомерия углеродного скелета
CH3
CH3 CH2 CH2 CH2 OH
CH3 CH CH2 OH
бутанол-1
2-метилпропанол-1
11. Изомерия
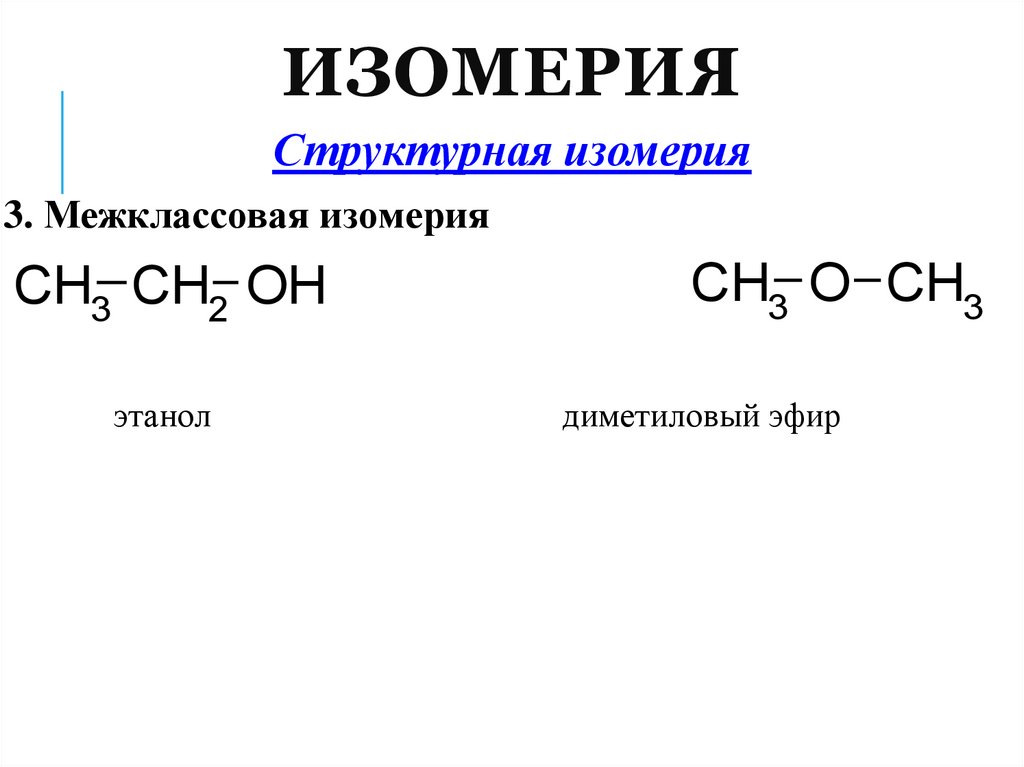
ИЗОМЕРИЯСтруктурная изомерия
3. Межклассовая изомерия
CH3 CH2 OH
этанол
CH3 O CH3
диметиловый эфир
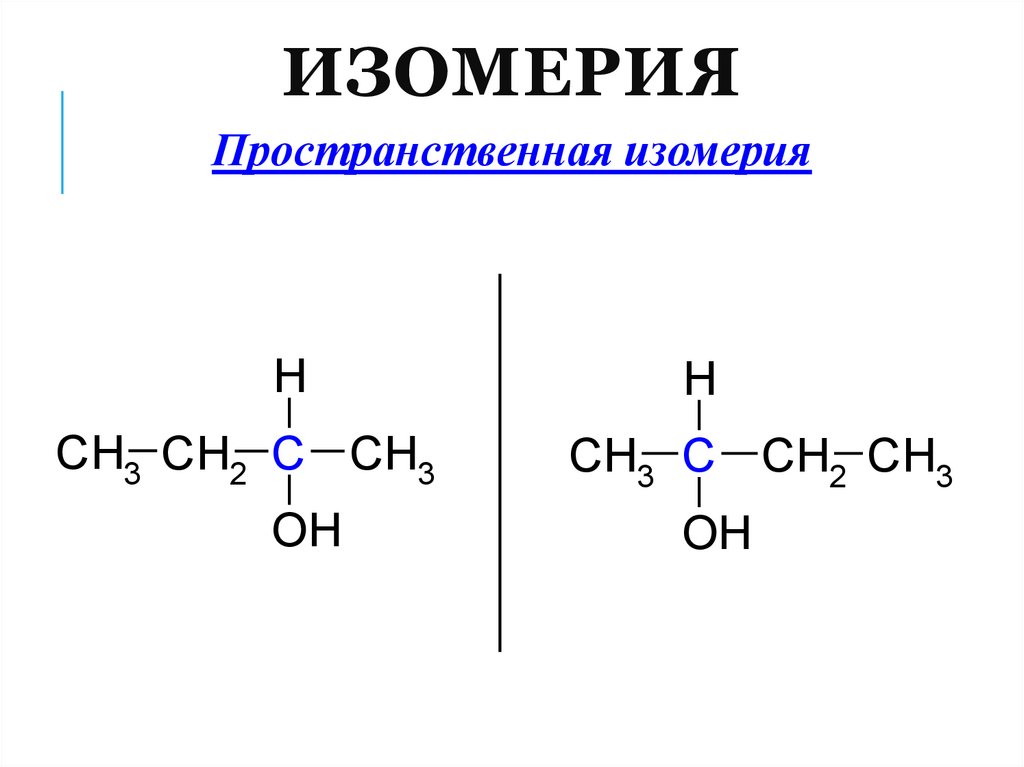
12. Изомерия
ИЗОМЕРИЯПространственная изомерия
H
CH3 CH2 C CH3
OH
H
CH3 C CH2 CH3
OH
13. Физические и биологические свойства
ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕСВОЙСТВА
•Гидроксигруппа является сильно полярной группой, поэтому
низшие спирты растворяются в воде неограниченно: метанол,
этанол, пропанол смешиваются с водой во всех отношениях.
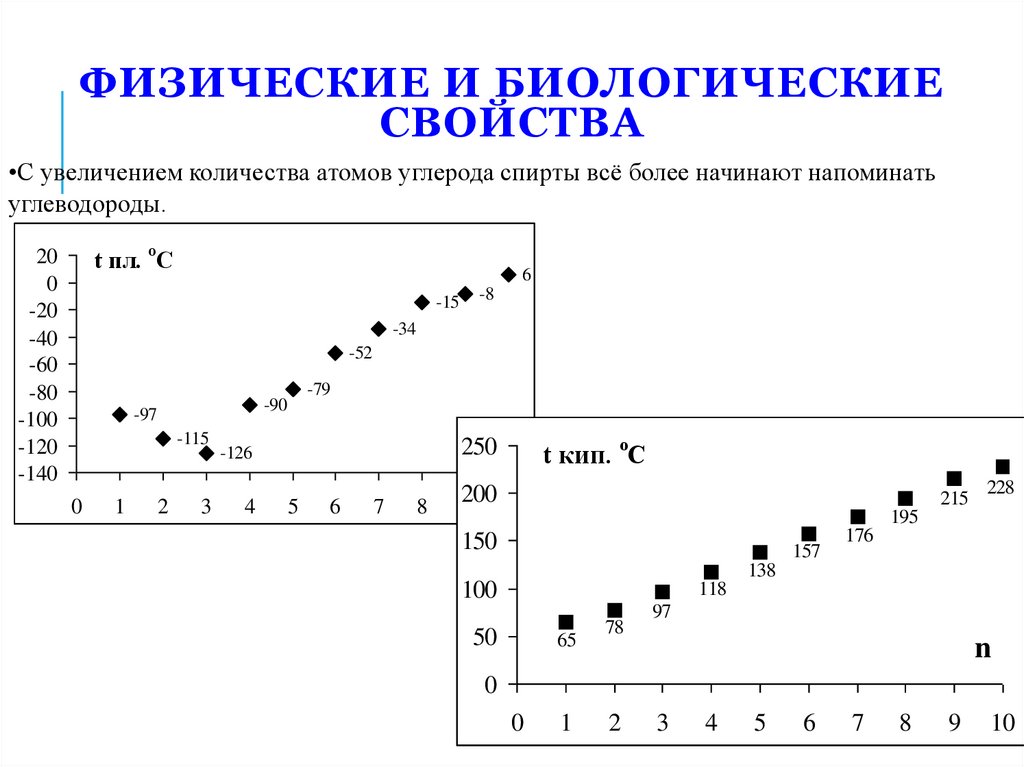
14. Физические и биологические свойства
ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕСВОЙСТВА
•С увеличением количества атомов углерода спирты всё более начинают напоминать
углеводороды.
t пл. оС
20
0
-20
-40
-60
-80
-100
-120
-140
6
-15
-8
-34
-52
-97
-115
0
1
-79
-90
2
3
4
t кип. оС
250
n
-126
5
6
7
8
200
9 10
215
228
195
150
157
176
138
100
118
50
65
78
97
n
0
0
1
2
3
4
5
6
7
8
9
10
15. 2. Методы получения спиртов
2. МЕТОДЫ ПОЛУЧЕНИЯСПИРТОВ
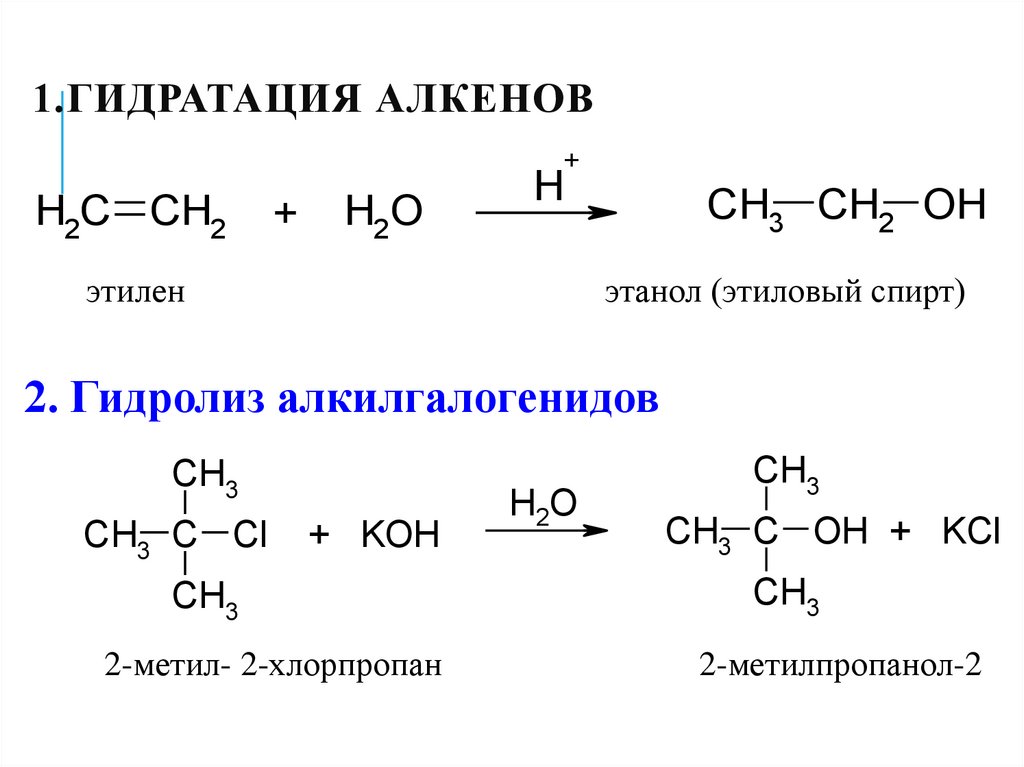
16. 1.Гидратация алкенов
1.ГИДРАТАЦИЯ АЛКЕНОВ+
H2C CH2
+
H2O
H
этилен
CH3 CH2 OH
этанол (этиловый спирт)
2. Гидролиз алкилгалогенидов
CH3
CH3 C Cl
+ KOH
CH3
2-метил- 2-хлорпропан
H2O
CH3
CH3 C OH + KCl
CH3
2-метилпропанол-2
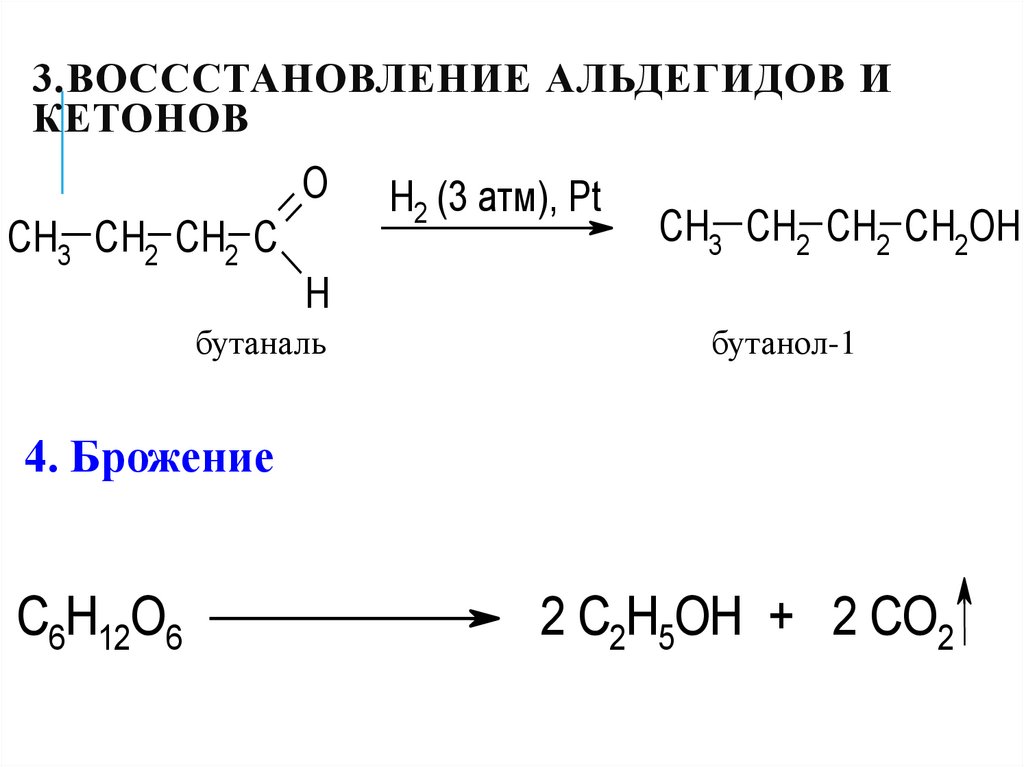
17. 3.Воссстановление альдегидов и кетонов
3.ВОСССТАНОВЛЕНИЕ АЛЬДЕГИДОВ ИКЕТОНОВ
O
CH3 CH2 CH2 C
H2 (3 атм), Pt
CH3 CH2 CH2 CH2OH
H
бутаналь
бутанол-1
4. Брожение
C6H12O6
2 C2H5OH + 2 CO2
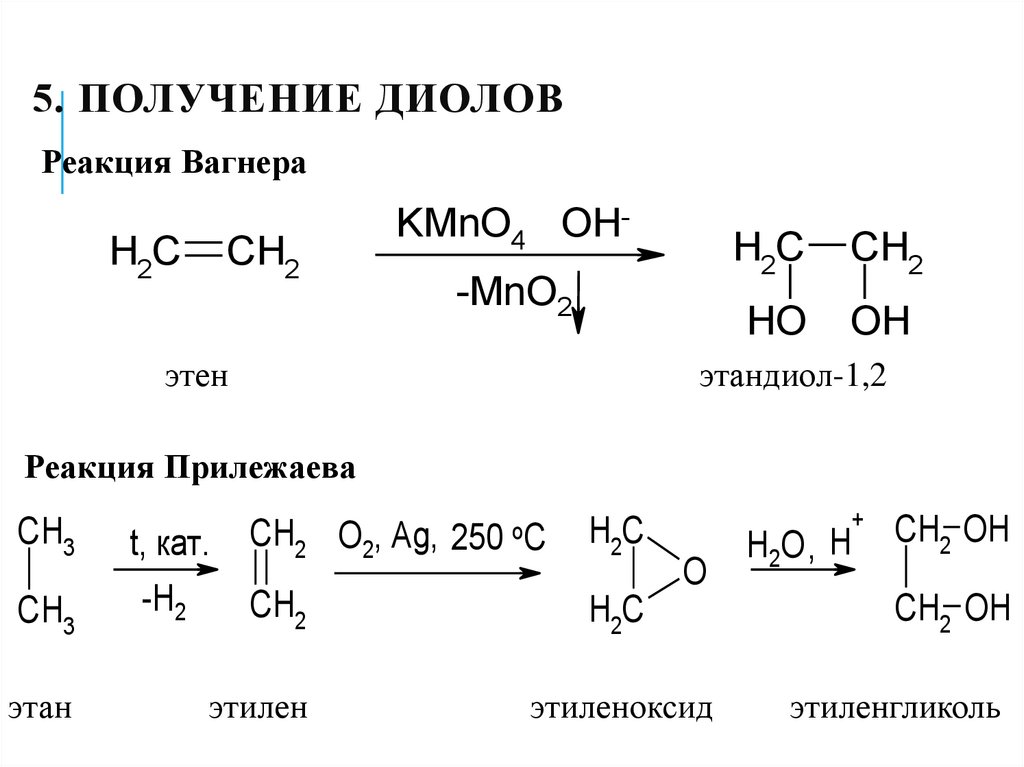
18. 5. Получение диолов
5. ПОЛУЧЕНИЕ ДИОЛОВРеакция Вагнера
H2C
CH2
KMnO4 OH-MnO2
этен
H2C
CH2
HO
OH
этандиол-1,2
Реакция Прилежаева
CH3
CH3
этан
+
CH2 O2, Ag, 250 oC
H2C
CH2
H2C
этилен
этиленоксид
t, кат.
-H2
O
H2O , H
CH2 OH
CH2 OH
этиленгликоль
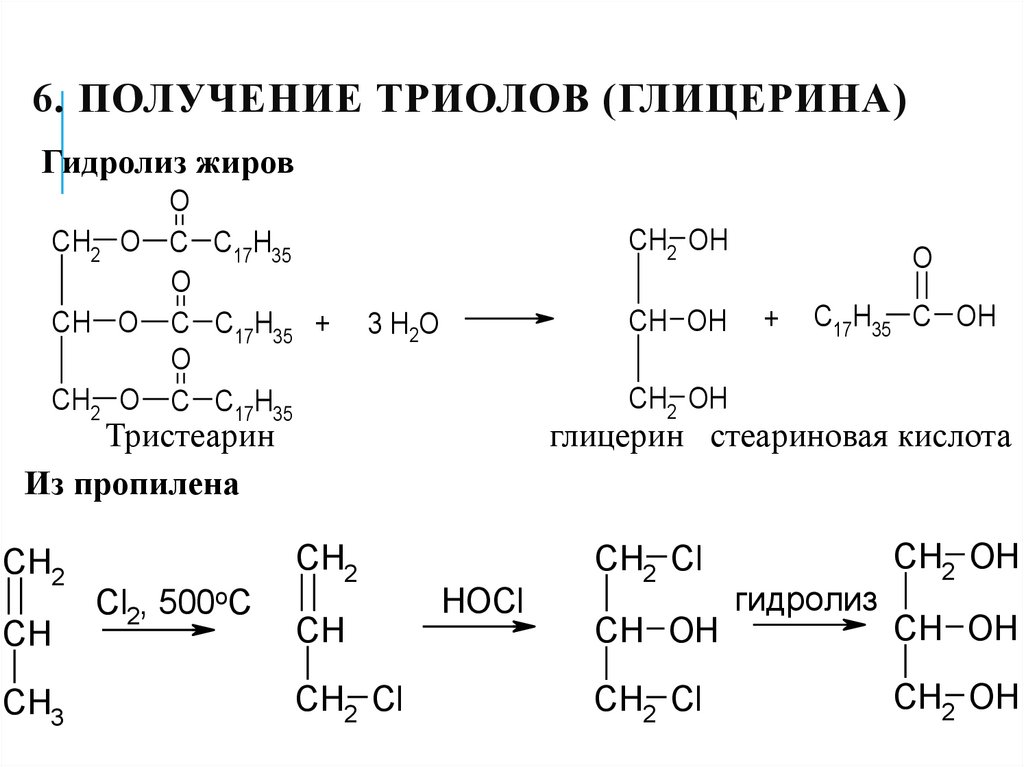
19. 6. Получение триолов (глицерина)
6. ПОЛУЧЕНИЕ ТРИОЛОВ (ГЛИЦЕРИНА)Гидролиз жиров
O
CH2 O C C17H35
O
CH O C C17H35 +
O
CH2 O C C17H35
CH2 OH
CH OH
3 H2O
CH
CH3
CH
CH2 Cl
C17H35 C OH
глицерин стеариновая кислота
CH2
Cl2, 500oC
+
CH2 OH
Тристеарин
Из пропилена
CH2
O
CH2 Cl
HOCl
CH OH
CH2 Cl
гидролиз
CH2 OH
CH OH
CH2 OH
20. 3.Химические свойства
3.ХИМИЧЕСКИЕСВОЙСТВА
21. Для алканолов характерно 3 типа реакций:
ДЛЯ АЛКАНОЛОВ ХАРАКТЕРНО 3ТИПА РЕАКЦИЙ:
1. Реакция замещения атома
водорода группы -ОН
2.Реакция замещения
группы -ОН
3. Реакции
окисления
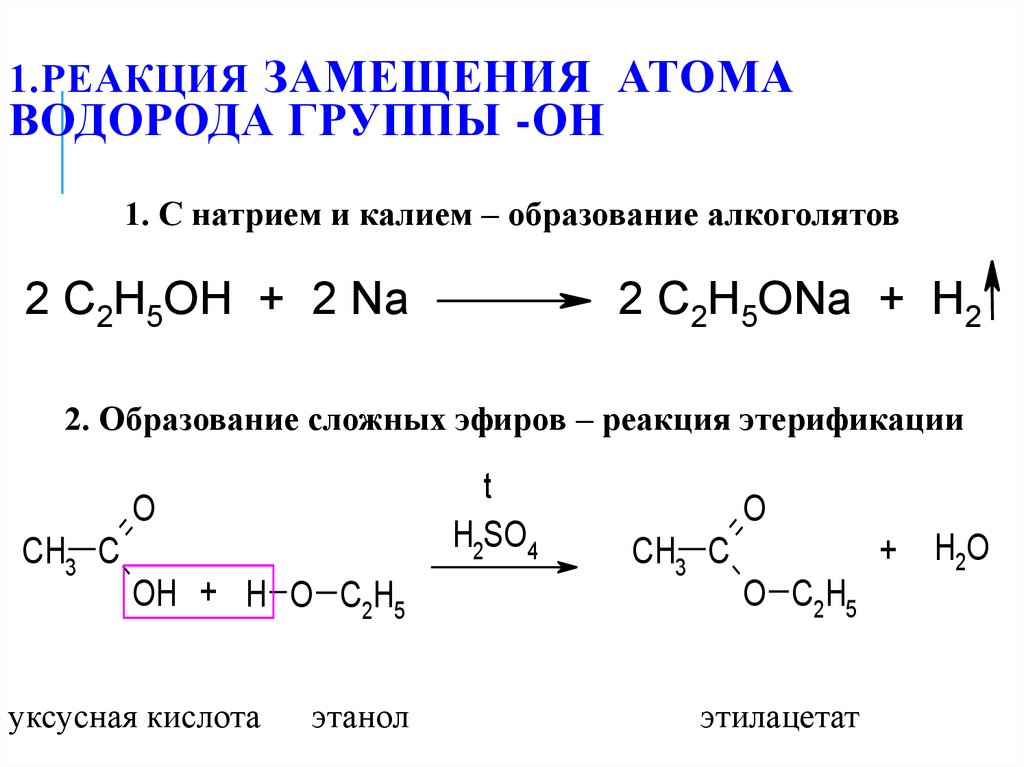
22. 1.Реакция замещения атома водорода группы -ОН
1.РЕАКЦИЯ ЗАМЕЩЕНИЯ АТОМАВОДОРОДА ГРУППЫ -ОН
1. С натрием и калием – образование алкоголятов
2 C2H5OH + 2 Na
2 C2H5ONa + H2
2. Образование сложных эфиров – реакция этерификации
t
H2SO4
O
CH3 C
OH + H O C2H5
уксусная кислота
этанол
O
CH3 C
+
O C2H5
этилацетат
H2O
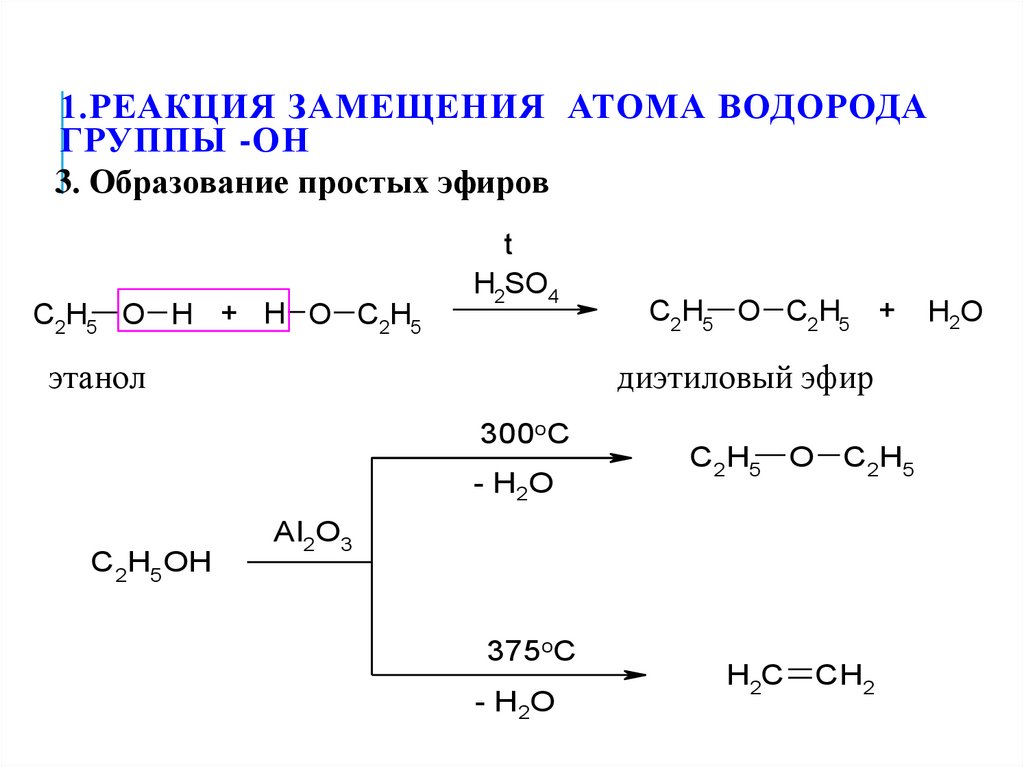
23. 1.Реакция замещения атома водорода группы -ОН
1.РЕАКЦИЯ ЗАМЕЩЕНИЯ АТОМА ВОДОРОДАГРУППЫ -ОН
3. Образование простых эфиров
C2H5 O H + H O C2H5
t
H2SO4
этанол
диэтиловый эфир
300oC
- H2O
C2H5OH
C2H5 O C2H5 +
C2H5 O C2H5
Al2O3
375oC
- H2O
H2C
CH2
H2O
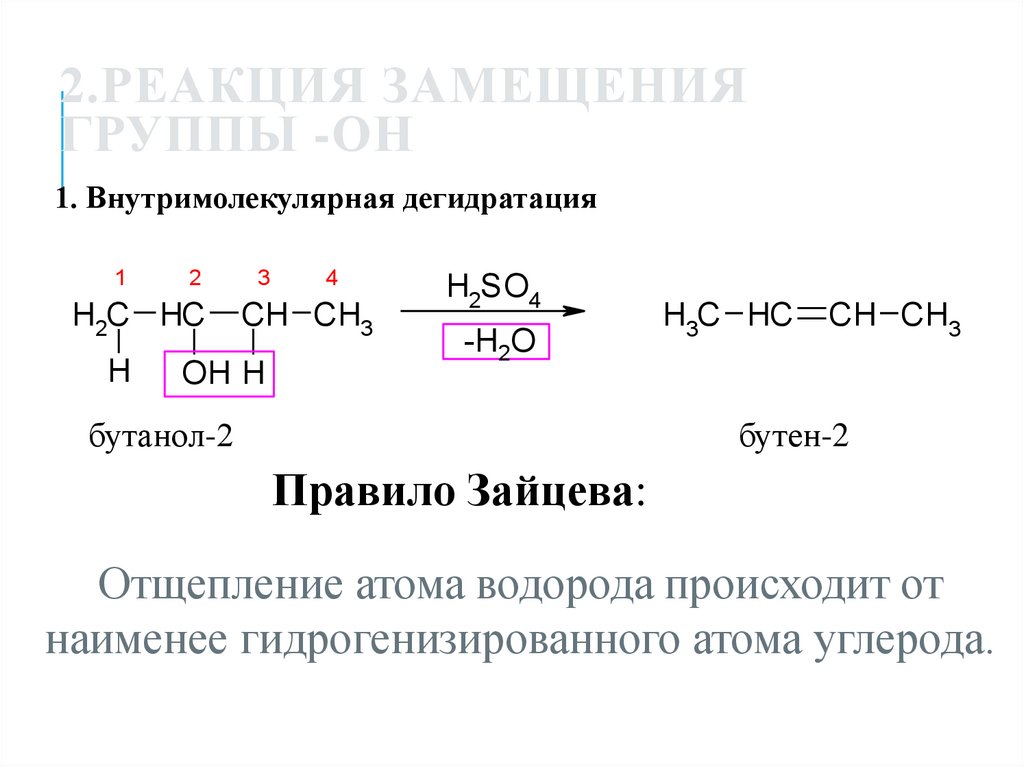
24. 2.Реакция замещения группы -ОН
2.РЕАКЦИЯ ЗАМЕЩЕНИЯГРУППЫ -ОН
1. Внутримолекулярная дегидратация
1
2
H2C HC
H
3
4
CH CH3
OH H
H2SO4
-H2O
бутанол-2
H3C HC
CH CH3
бутен-2
Правило Зайцева:
Отщепление атома водорода происходит от
наименее гидрогенизированного атома углерода.
25. 2.Реакция замещения группы -ОН
C2H5OH + HCl2
4
C2H5Cl +
H2O
2.РЕАКЦИЯ
ЗАМЕЩЕНИЯ
C2H5OH + HBr
C2H5Br + H2O
ГРУППЫ -ОН
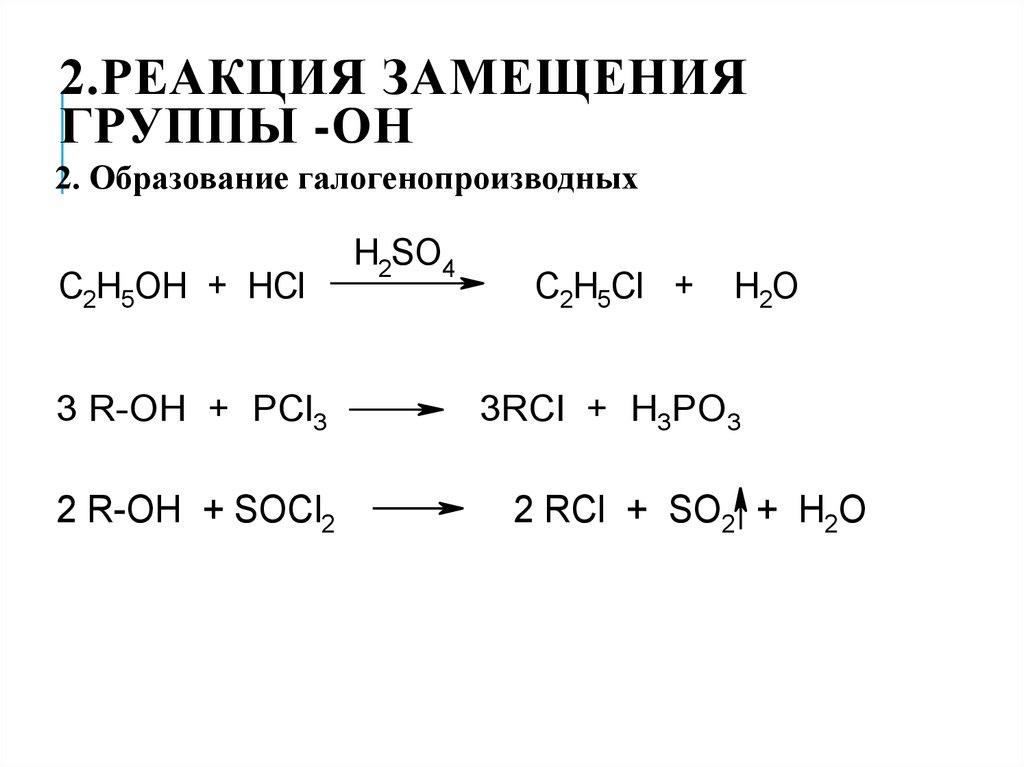
2. Образование галогенопроизводных
H SO
3C2R-OH
H5OH ++ PCl
HCl
3
C2H5OH + HCl
CR-OH
HBr
2H5OH+ +PCl
5
2
H2SO4
4
3RCl
+C2HH35PO
Cl 3 +
H2O
C2H5Cl + H2O
+ HO
RCl + C
POCl
2H5Br
3 + HCl 2
C2H5OH + HBr
3 R-OH
R-OH ++ PI
PCl
3 3
C2H5Br + H2O
33RCl
RI + +H3H
PO
3PO
3 3
3 R-OH + PCl3
R-OH ++ SOCl
PCl52
2 R-OH
3RCl + H3PO3
RCl
+ POCl
2 RCl
+ SO
H2O
3 2 ++ HCl
R-OH + PCl5
3 R-OH + PI3
RCl + POCl3 + HCl
3 RI + H3PO3
3 R-OH + PI3
2 R-OH + SOCl2
3 RI + H3PO3
2 RCl + SO2 + H2O
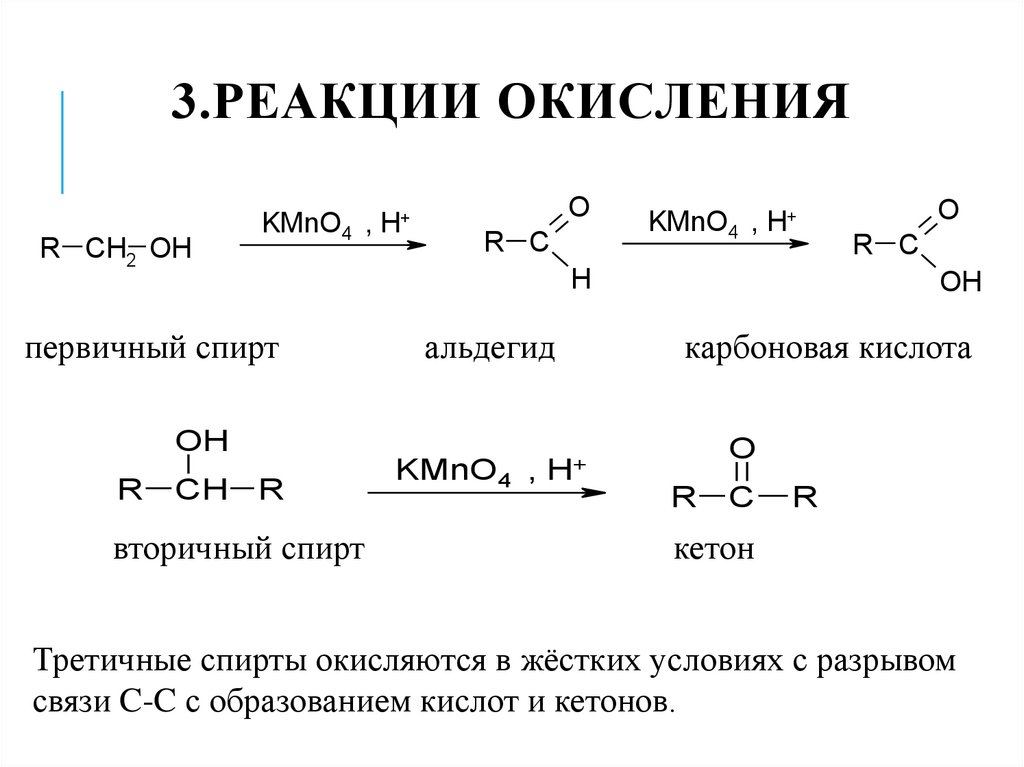
26. 3.Реакции окисления
3.РЕАКЦИИ ОКИСЛЕНИЯR CH2 OH
KMnO4 , H+
O
R C
H
первичный спирт
альдегид
OH
R
CH
KMnO4 , H+
R
вторичный спирт
KMnO4
O
R C
OH
карбоновая кислота
O
, H+
R
C
R
кетон
Третичные спирты окисляются в жёстких условиях с разрывом
связи C-C с образованием кислот и кетонов.
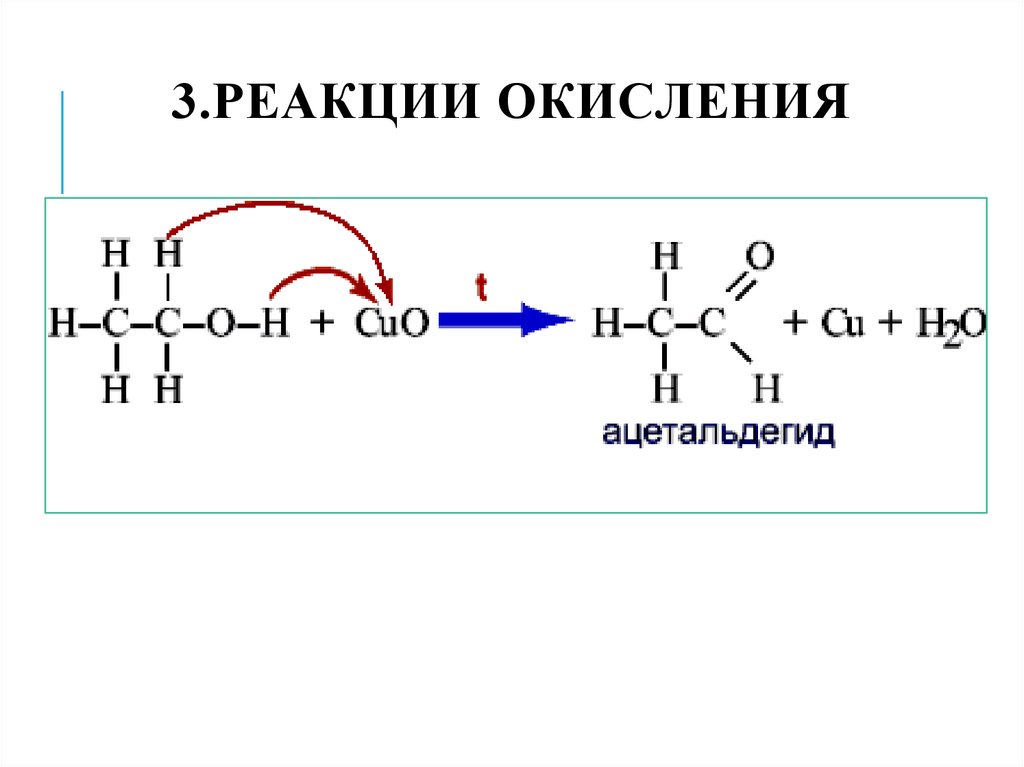
27. 3.Реакции окисления
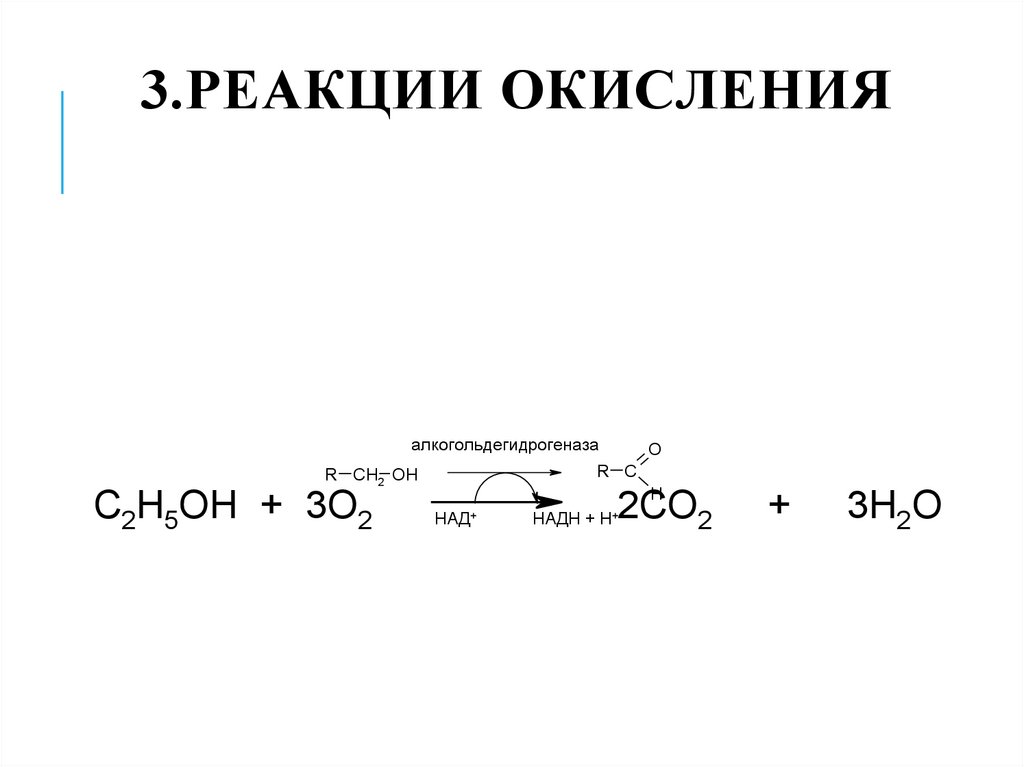
3.РЕАКЦИИ ОКИСЛЕНИЯ28. 3.Реакции окисления
3.РЕАКЦИИ ОКИСЛЕНИЯалкогольдeгидрогeназа
R CH2 OH
C2H5OH + 3O2
O
R C
H
НАД+
2CO2
НАДН + H+
+
3H2O
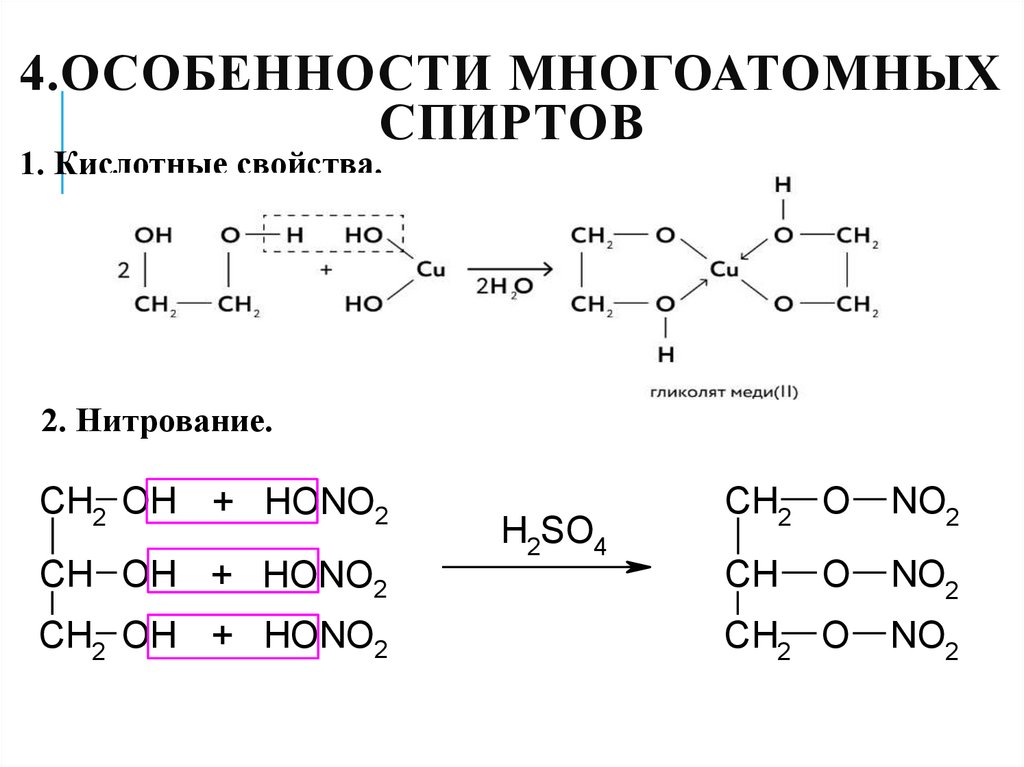
29. 4.Особенности многоатомных спиртов
4.ОСОБЕННОСТИ МНОГОАТОМНЫХСПИРТОВ
1. Кислотные свойства.
2. Нитрование.
CH2 OH + HONO2
CH2 O
NO2
CH OH + HONO2
CH
O
NO2
CH2 OH + HONO2
CH2 O
NO2
H2SO4
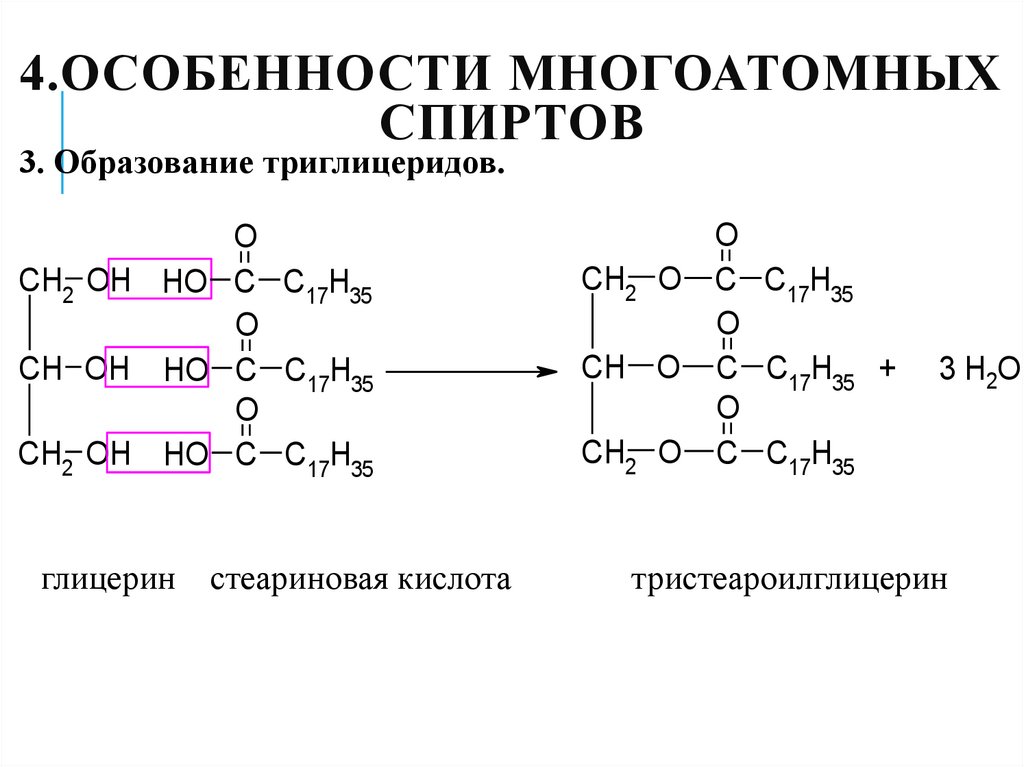
30. 4.Особенности многоатомных спиртов
4.ОСОБЕННОСТИ МНОГОАТОМНЫХСПИРТОВ
3. Образование триглицеридов.
O
CH2 OH HO C C17H35
O
CH OH HO C C17H35
O
CH2 OH HO C C17H35
глицерин
стеариновая кислота
O
CH2 O C C17H35
O
CH O C C17H35 +
O
CH2 O C C17H35
3 H2O
тристеароилглицерин
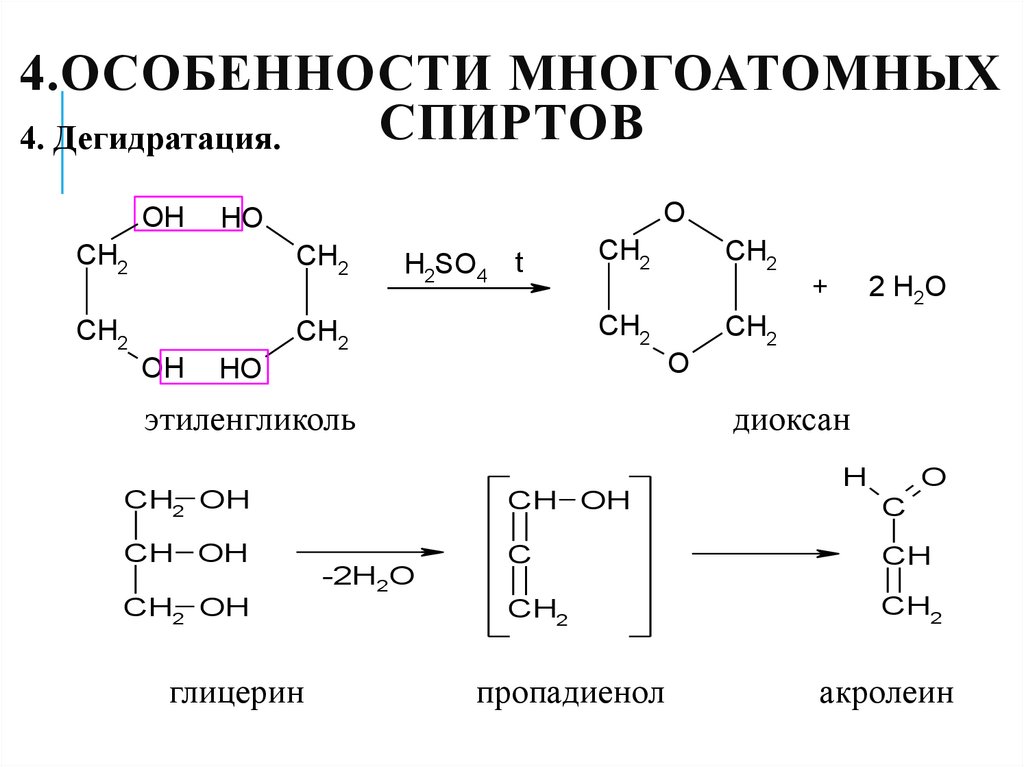
31. 4.Особенности многоатомных спиртов
4.ОСОБЕННОСТИ МНОГОАТОМНЫХСПИРТОВ
4. Дегидратация.
OH
O
HO
CH2
CH2
CH2
CH2
OH
H2SO4
t
CH2
+
CH2
этиленгликоль
CH OH
CH2 OH
глицерин
CH2
диоксан
CH OH
-2H2O
2 H2O
O
HO
CH2 OH
CH2
H
O
C
C
CH
CH2
CH2
пропадиенол
акролеин
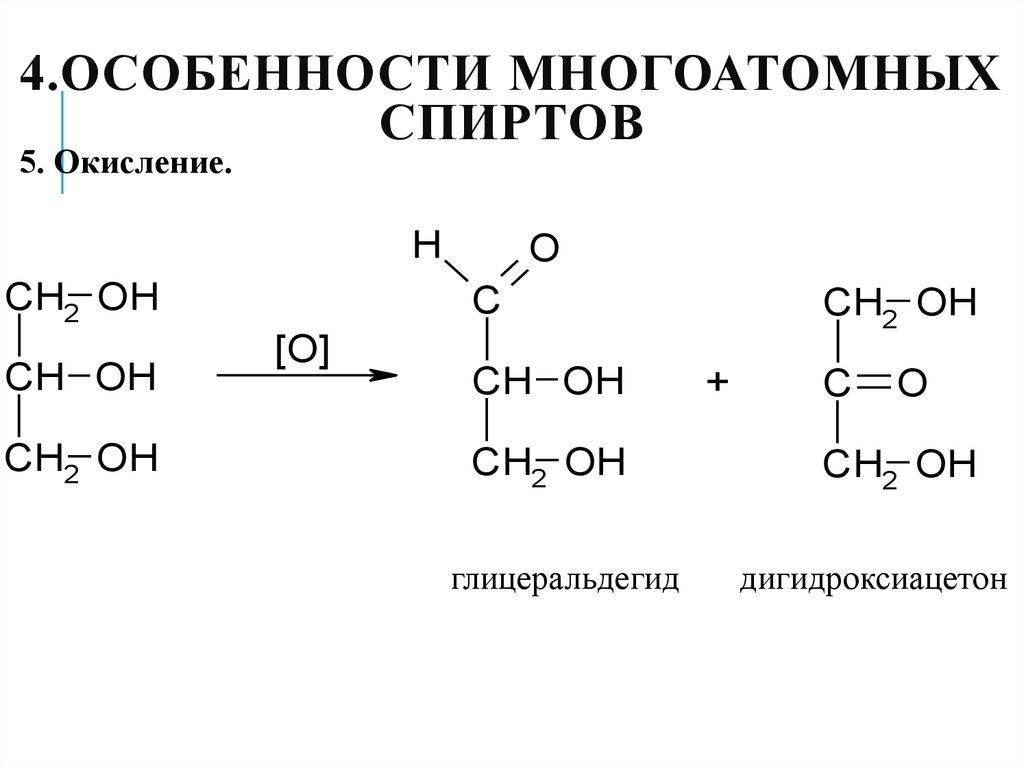
32. 4.Особенности многоатомных спиртов
4.ОСОБЕННОСТИ МНОГОАТОМНЫХСПИРТОВ
5. Окисление.
H
CH2 OH
CH OH
CH2 OH
O
C
[O]
CH OH
CH2 OH
глицеральдегид
CH2 OH
+
C
O
CH2 OH
дигидроксиацетон
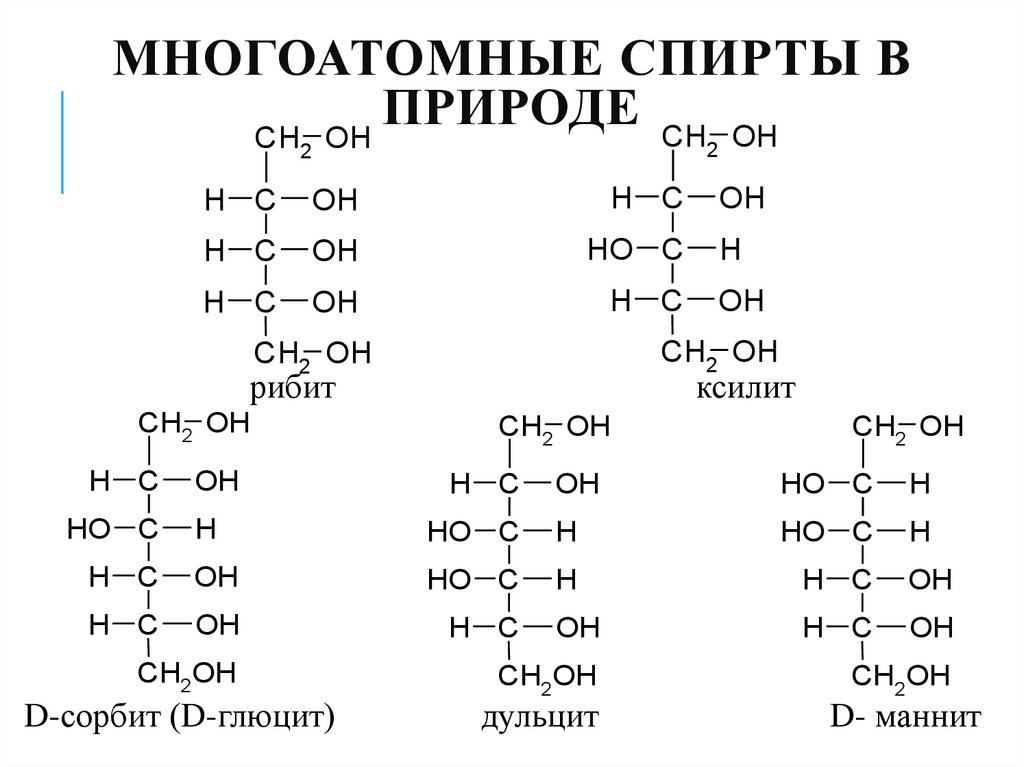
33. Многоатомные спирты в природе
МНОГОАТОМНЫЕ СПИРТЫ ВПРИРОДЕ
CH OH
CH OH
2
2
H C
OH
H C
OH
H C
OH
HO C
H
H C
OH
H C
OH
CH2 OH
CH2 OH
рибит
CH2 OH
ксилит
CH2 OH
CH2 OH
H C
OH
H C
OH
HO C
H
HO C
H
HO C
H
HO C
H
H C
OH
HO C
H
H C
OH
H C
OH
H C
OH
H C
OH
CH2OH
D-сорбит (D-глюцит)
CH2OH
дульцит
CH2OH
D- маннит
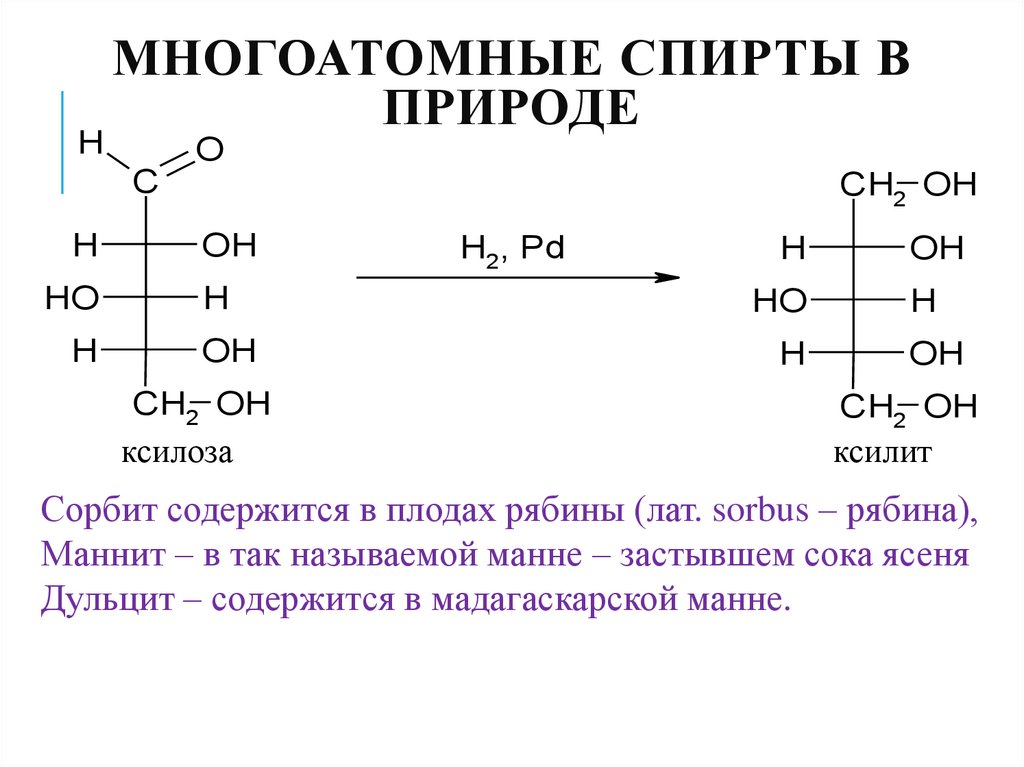
34. Многоатомные спирты в природе
HМНОГОАТОМНЫЕ СПИРТЫ В
ПРИРОДЕ
O
C
CH2 OH
H
OH
HO
H
H2, Pd
H
OH
H
HO
H
OH
H
OH
CH2 OH
ксилоза
CH2 OH
ксилит
Сорбит содержится в плодах рябины (лат. sorbus – рябина),
Маннит – в так называемой манне – застывшем сока ясеня
Дульцит – содержится в мадагаскарской манне.









 Химия
Химия








