Похожие презентации:
Электронные эффекты заместителей. Типы химических реакций
1. 2. Электронные эффекты заместителей.
Типы химических реакций2. Электронные эффекты
заместителей.
Лектор: кандидат биологических наук,
доцент Мицуля Татьяна Петровна
2.
2. Электронные эффектызаместителей
Взаимное влияние атомов в молекуле
может осуществляться по системе σсвязей (индуктивный эффект), по
системе -связей (мезомерный эффект).
3.
Индуктивный эффект (I-эффект) –смещение электронной плотности по
цепи σ -связей, которое обусловлено
различиями в
электроотрицательностях атомов:
H3C
CH2
CH2 CH2
CH2
F
4.
Индуктивный эффект обозначаютбуквой I и графически изображают
стрелкой, остриё которой направлено в
сторону более ЭО элемента.
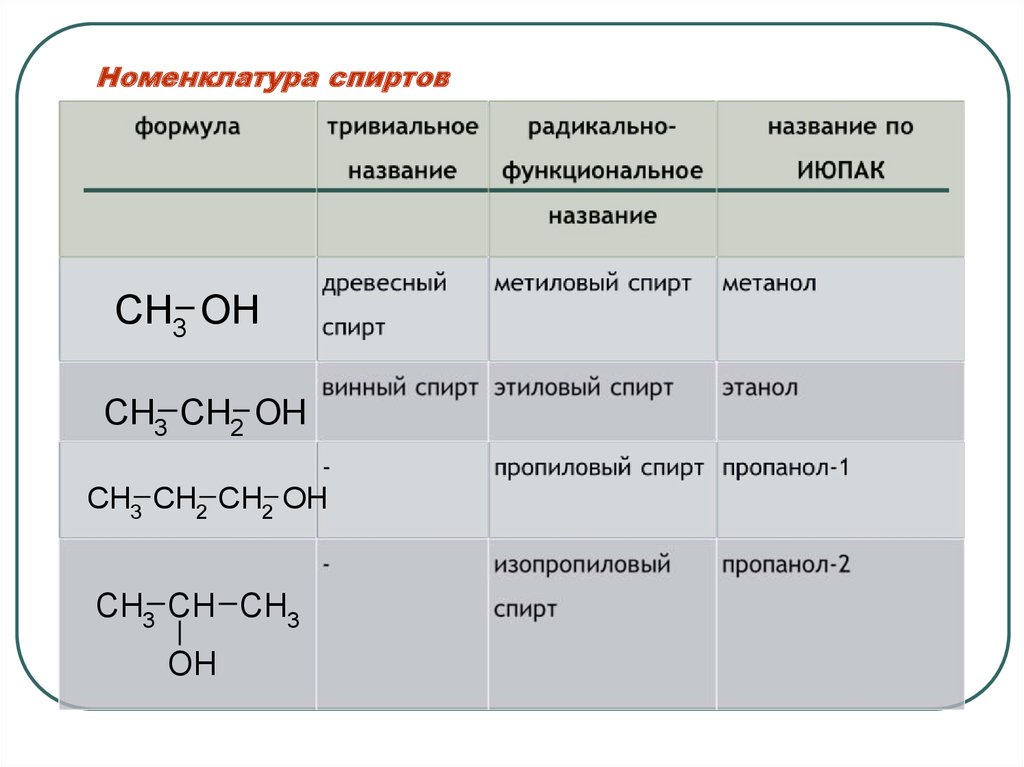
Действие индуктивного эффекта
наиболее сильно проявляется на двух
ближайших атомах углерода, а через 3-4
связи он затухает.
5.
–I эффект проявляют заместители,которые содержат атомы с большей ЭО,
чем у углерода: -F, -Cl, -Br, -OH, -NH2, NO2, >C=O, -COOH и др.
Это электроноакцепторные
заместители (ЭА). Они снижают
электронную плотность в углеродной
цепи.
6.
+I эффект проявляют заместители,содержащие атомы с низкой
электроотрицательностью: металлы
(-Mg, -Li); насыщенные углеводородные
радикалы (-CH3, -C2H5) и т.п.
Это электронодонорные (ЭД)
заместители. Они повышают
электронную плотность в углеродной
цепи.
7.
Мезомерный эффект – смещениеэлектронной
плотности
по
цепи
сопряженных -связей. Возникает только
при наличии сопряжения связей.
Действие мезомерного эффекта
заместителей проявляется как в
открытых, так и замкнутых системах.
8.
- М-эффект проявляют заместители,понижающие электронную плотность в
сопряженной системе. Заместители
содержат кратные связи: -CHO, -COOH, NO2, -SO3H, -CN).
Это электроноакцепторные (ЭА)
заместители.
COOH
H
H
.
O
H
OH
H
H
9.
+М-эффектомобладают
заместители, повышающие электронную
плотность в сопряженной системе. К ним
относятся -OH, -NH2, -OCH3, -O-, -F, -Cl, -Br,
-I и др.
Это электронодонорные заместители
(ЭД).
OH
H
H
.
O
H
H
H
H
10.
В молекулах органических соединенийиндуктивный и мезомерный эффекты
заместителей, действуют
одновременно.
11.
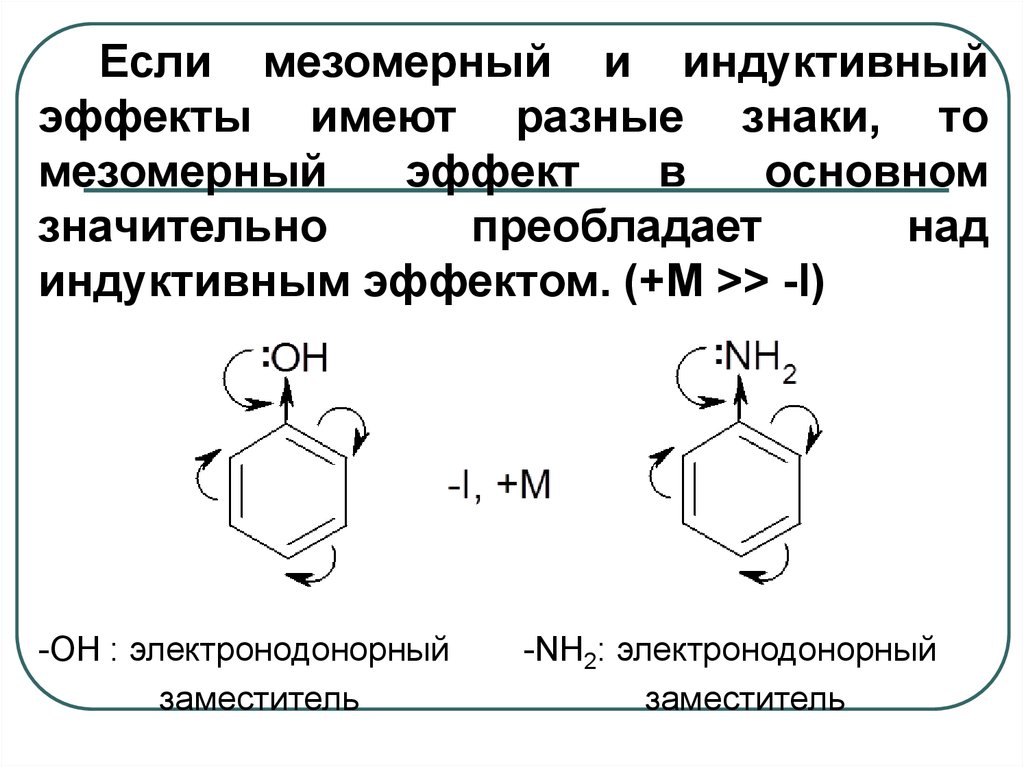
Если мезомерный и индуктивныйэффекты имеют разные знаки, то
мезомерный
эффект
в
основном
значительно
преобладает
над
индуктивным эффектом. (+M >> -I)
-ОН : электронодонорный
заместитель
-NH2: электронодонорный
заместитель
12.
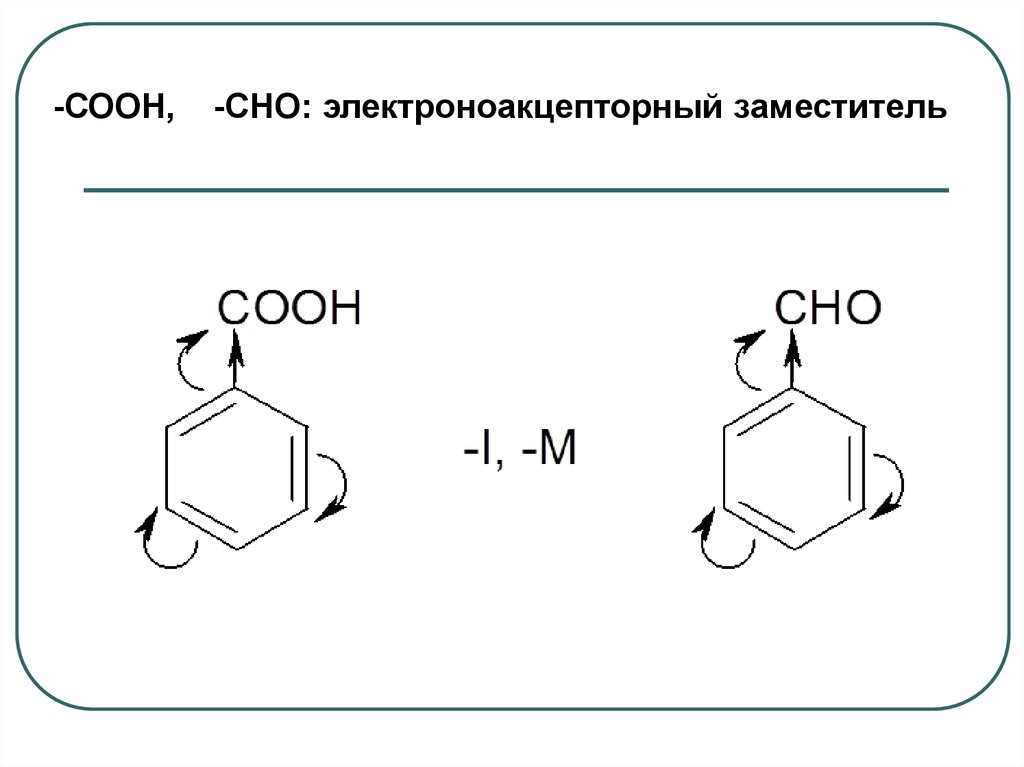
-СООН,-СНО: электроноакцепторный заместитель
13.
Таким образом, учитываяперераспределение электронной
плотности в молекулах органических
соединений можно прогнозировать их
свойства.
14.
Повышение реактивностиКлассификация заместителей
-NH2, -NHR, -NR2
-OH
-OR
-NHCOCH3
-C6H5
-R
-H
-X
-CHO, -COR
-SO3H
-COOH, -COOR
-CN
-NR3+
-NO2
орто/пара
ориентанты
Мета
ориентанты
15.
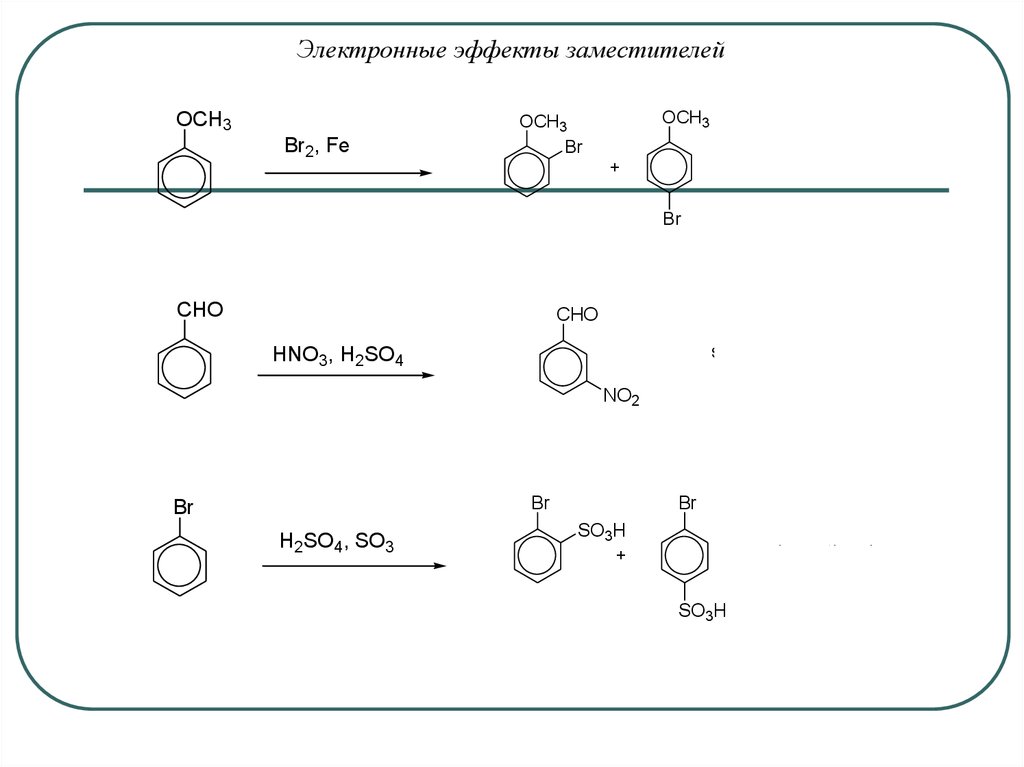
Электронные эффекты заместителейOCH3
Br2, Fe
OCH3
OCH3
Br
faster than benzene
+
Br
CHO
CHO
slower than benzene
HNO3, H2SO4
NO2
Br
Br
H2SO4, SO3
Br
SO3H
+
slower than benzene
SO3H
16. 1. Общая характеристика спиртов. 2. Одноатомные спирты: физические и химические свойства, способы получения. 3. Многоатомные
Гидроксисоединения1. Общая характеристика спиртов.
2. Одноатомные спирты: физические и
химические свойства, способы получения.
3. Многоатомные спирты.
4. Фенолы: характеристика, способы получения,
свойства, применение.
5. Простые эфиры (самостоятельное изучение)
Лектор: кандидат биологических наук,
доцент Мицуля Татьяна Петровна
17. 1.
Общаяхарактеристика
спиртов.
Номенклатура,
классификация,
изомерия.
18.
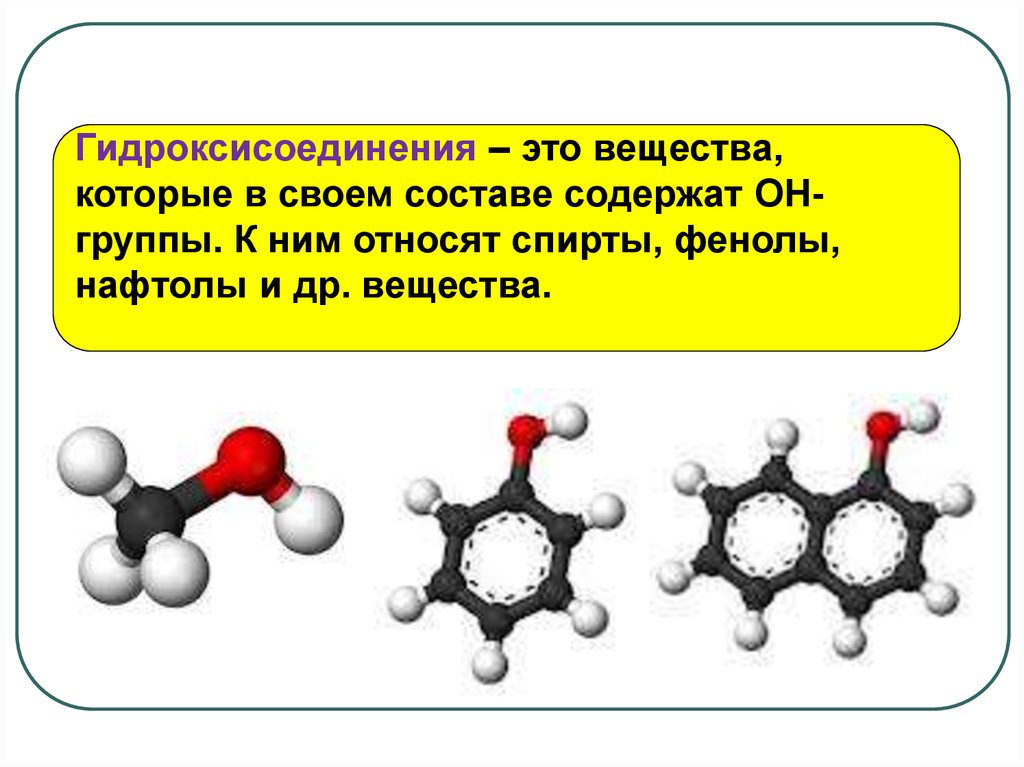
Гидроксисоединения – это вещества,которые в своем составе содержат OHгруппы. К ним относят спирты, фенолы,
нафтолы и др. вещества.
19.
Спирты – это гидроксисоединения, вмолекулах которых OH-группы связаны с
насыщенным атомом углерода,
3
находящимся в состоянии sp-гибридизации.
Общая формула R-OH.
Общая формула гомологического ряда
предельных одноатомных спиртов —
CnH2n+1OH.
20.
109oCH3
H
O
sp3
..
..
21. Классификация спиртов
I. По строению углеводородногорадикала:
- алифатические предельные и
непредельные: пропанол-1, бутен-2-ол-1
- алициклические: циклогексанол
- ароматические: бензиловый спирт
(фенилметанол)
22.
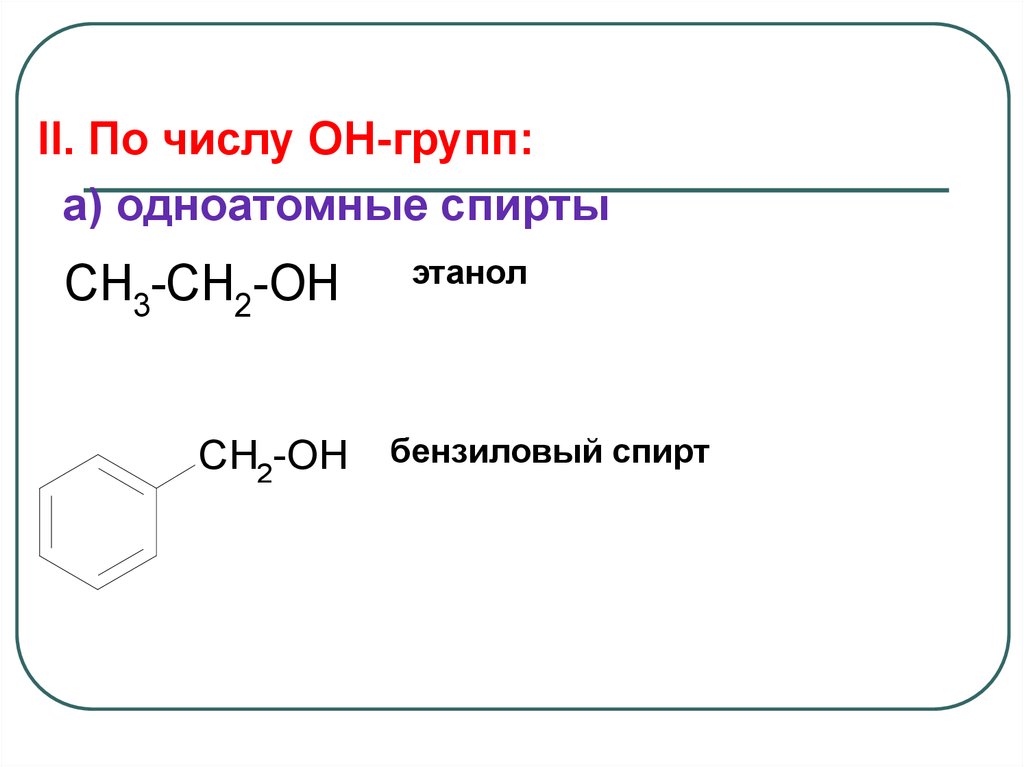
II. По числу OH-групп:a) одноатомные спирты
CH3-CH2-OH
CH2-OH
этанол
бензиловый спирт
23.
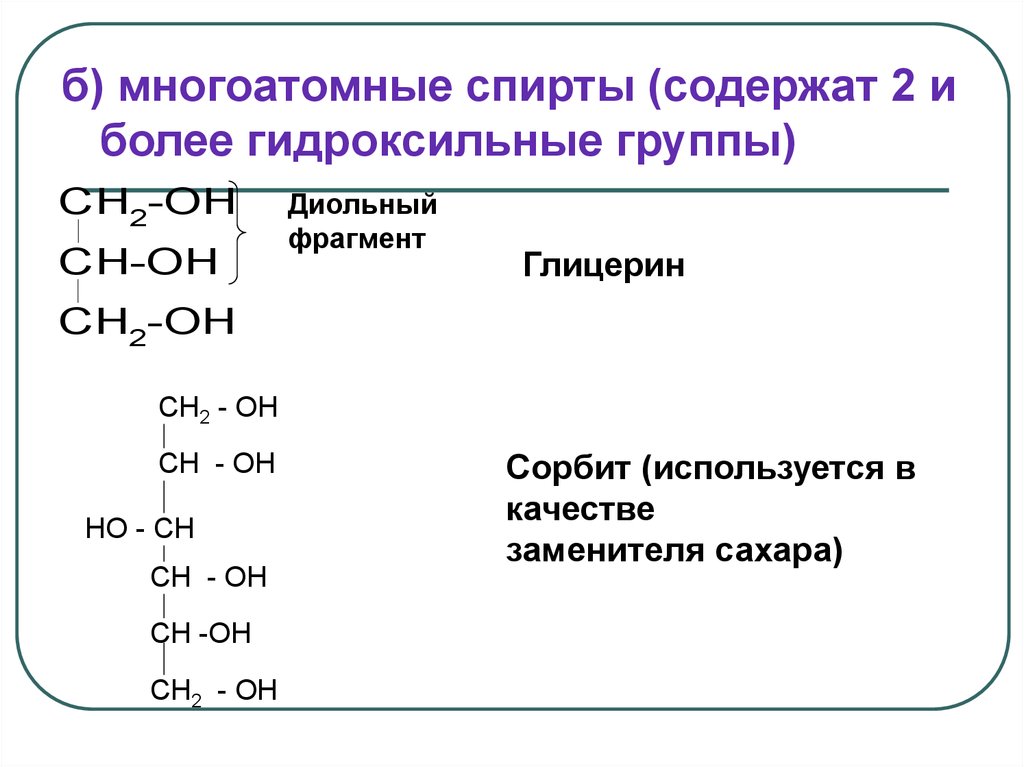
б) многоатомные спирты (содержат 2 иболее гидроксильные группы)
CH2-OH
CH-OH
Диольный
фрагмент
Глицерин
CH2-OH
CH2 - OH
CH - OH
HO - CH
CH - OH
CH -OH
CH2 - OH
Сорбит (используется в
качестве
заменителя сахара)
24.
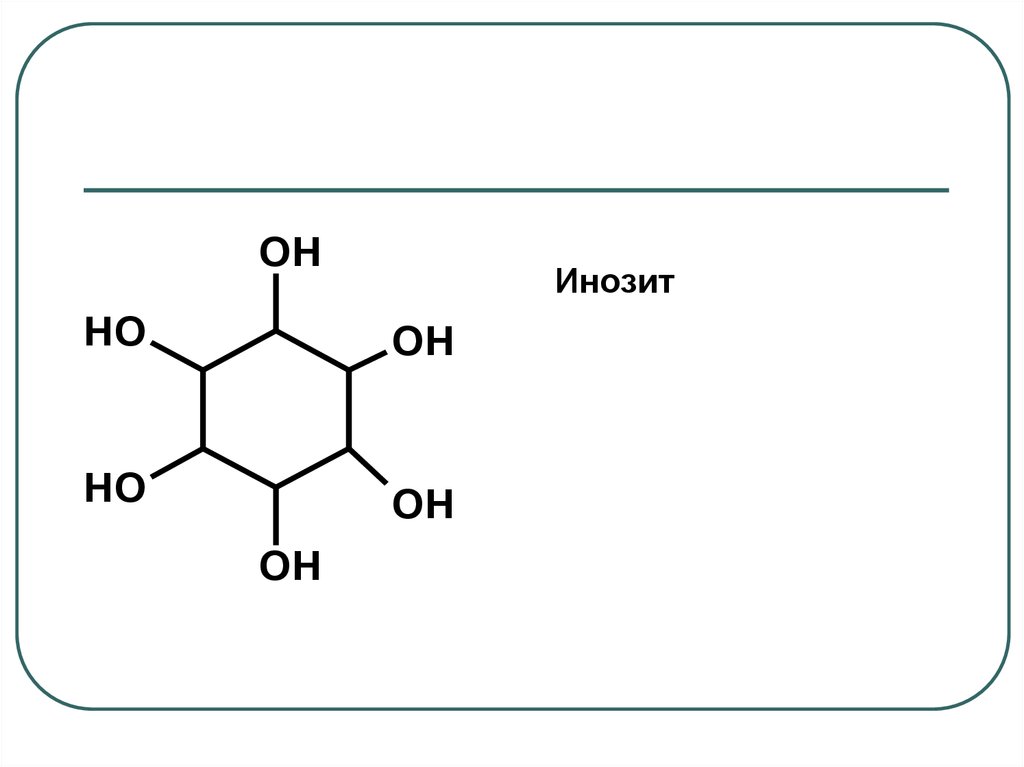
OHИнозит
HO
OH
HO
OH
OH
25.
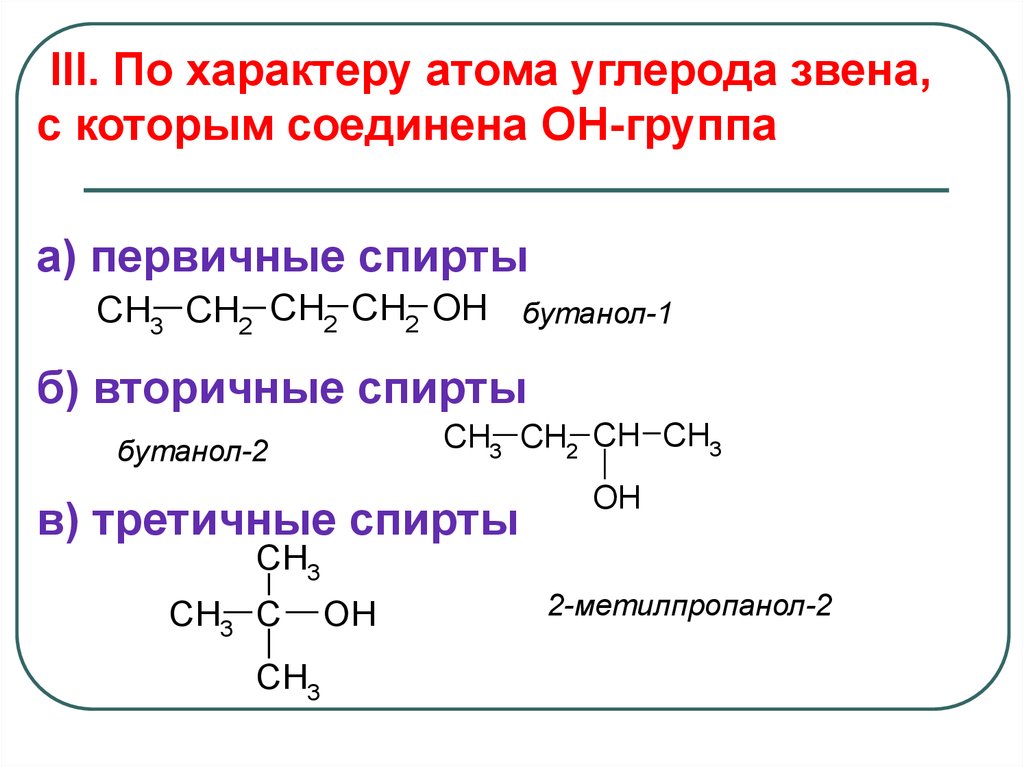
III. По характеру атома углерода звена,с которым соединена OH-группа
a) первичные спирты
CH3 CH2 CH2 CH2 OH бутанол-1
б) вторичные спирты
CH3 CH2 CH CH3
бутанол-2
в) третичные спирты
OH
CH3
CH3 C
CH3
OH
2-метилпропанол-2
26. Номенклатура спиртов
CH3 OHCH3 CH2 OH
CH3 CH2 CH2 OH
CH3 CH CH3
OH
27. 2.
Одноатомные спирты: физические ихимические
свойства,
способы
получения.
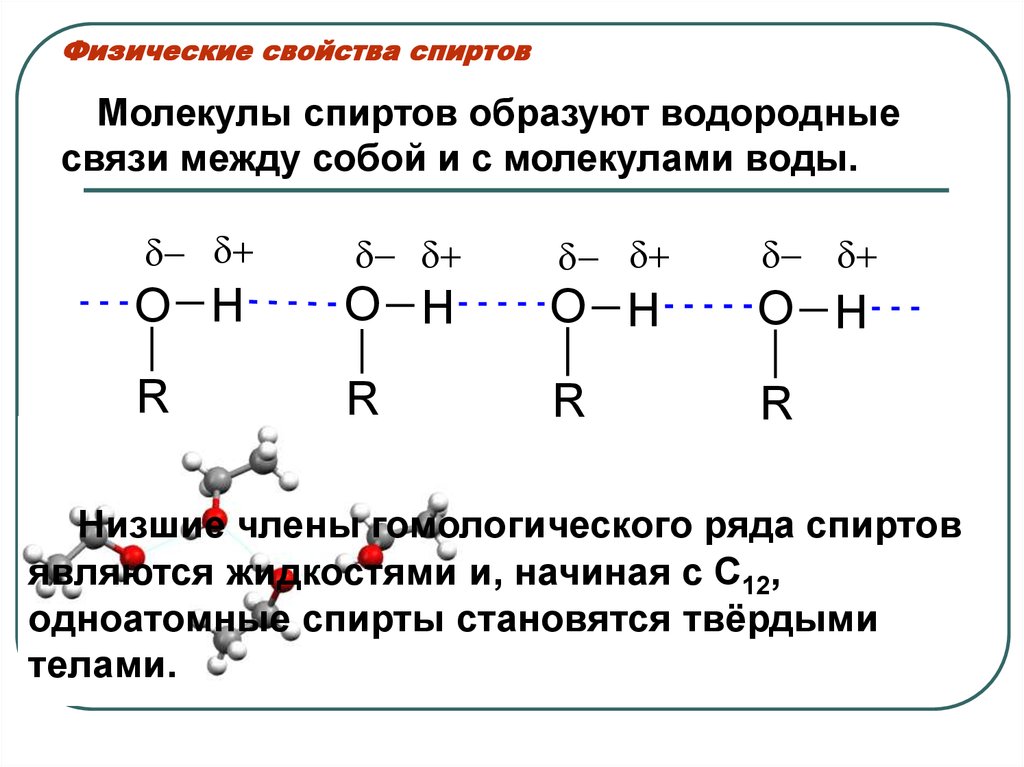
28. Физические свойства спиртов
Молекулы спиртов образуют водородныесвязи между собой и с молекулами воды.
O H
O H
O H
O H
R
R
R
R
Низшие члены гомологического ряда спиртов
являются жидкостями и, начиная с C12,
одноатомные спирты становятся твёрдыми
телами.
29.
Гидроксигруппа является сильно полярнойгруппой, поэтому низшие спирты
растворяются в воде неограниченно: метанол,
этанол, пропанол смешиваются с водой во
всех отношениях.
С увеличением количества атомов углерода
растворимость уменьшается.
Растворимость амилового спирта
(пентанола-1) – 2,7 г/ 100 мл, растворимость
октанола-1 – 0,059 г/ 100 мл.
30.
НЕ ПЕЙМЕТИЛОВЫЙ
СПИРТ
Метиловый
спирт
считается самым ядовитым
спиртом. Прием внутрь
вызывает
слепоту
или
смерть.
31.
В молекуле спиртов можновыделить несколько реакционных
центров:
О-Н кислотный центр, за счет
полярности связи способный к
отщеплению протона.
Нуклеофильный и
n-основный центр - атом
кислорода, имеющий
неподеленную пару
электронов:
32.
Электрофильный центр – α-атом углерода, накотором дефицит электронов вызван –I-эффектом
соседней гидроксильной группы.
β-CH-кислотный центр, в котором поляризация связи
C – H обусловлена электроноакцепторным влиянием
гидроксильной группы.
2
1
R
α δ+
β
CH
CH2
.. δ-
O
H
4
3
1
1. OH-кислотный центр
2. Нуклеофильный и n
H основный центр
3. – электрофильный центр
4. – β-CH-кислотный центр
33. Химические свойства
Спирты проявляют слабые кислотные и слабыеосновные свойства, то есть являются
амфолитами.
I. Реакции замещения
1. замещение атомов водорода в группе –ОН
атомами металлов (образование алкоголятов):
2С2Н5-ОН + 2Na →
2С2Н5-ОNa + Н2↑
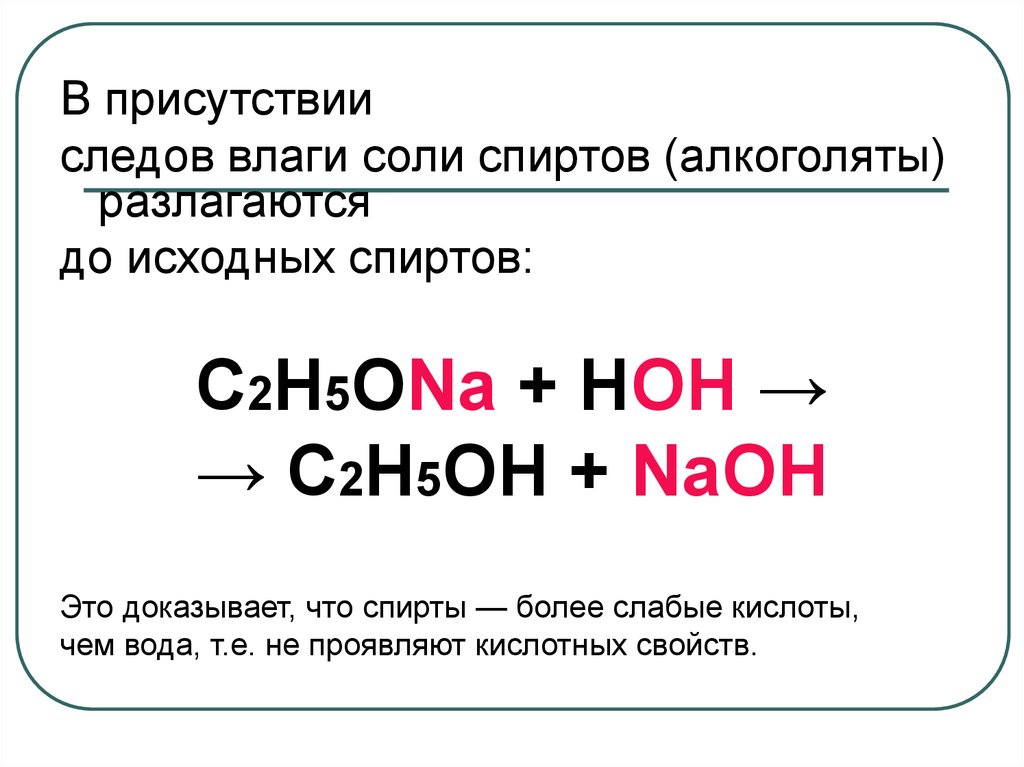
34.
В присутствииследов влаги соли спиртов (алкоголяты)
разлагаются
до исходных спиртов:
С2Н5ОNa + НОН →
→ С2Н5ОН + NaОН
Это доказывает, что спирты — более слабые кислоты,
чем вода, т.е. не проявляют кислотных свойств.
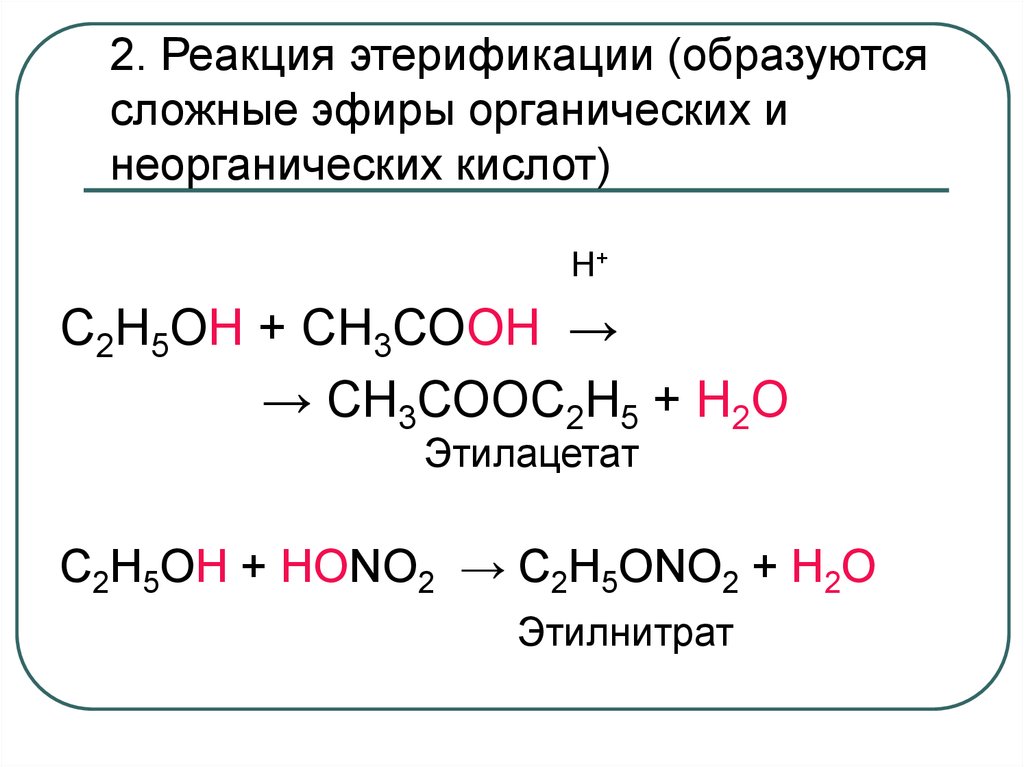
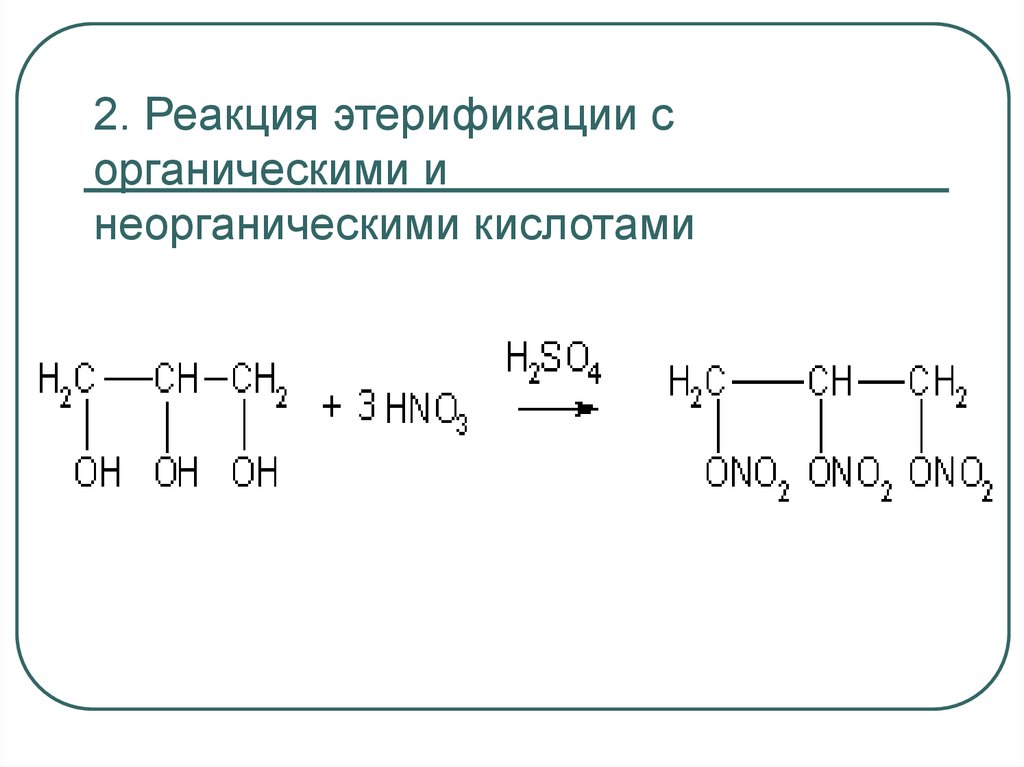
35. 2. Реакция этерификации (образуются сложные эфиры органических и неорганических кислот)
Н+С2Н5ОН + СН3СООН →
→ СН3СООС2Н5 + Н2О
Этилацетат
C2H5OH + HONO2 → C2H5ONO2 + Н2O
Этилнитрат
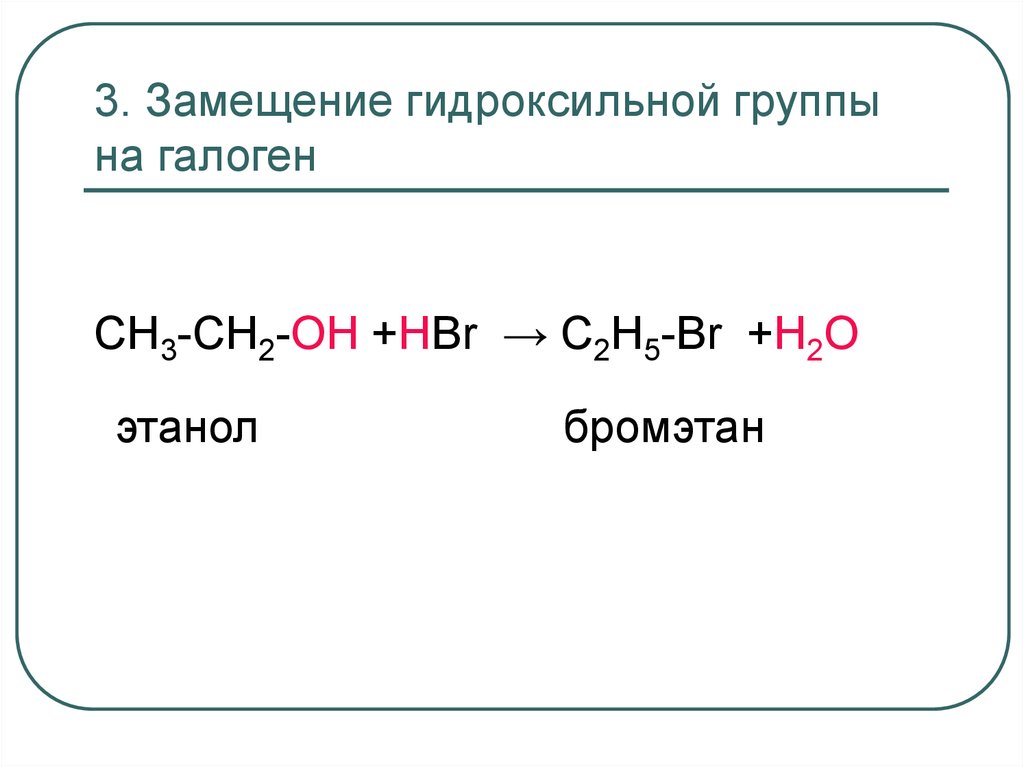
36. 3. Замещение гидроксильной группы на галоген
CH3-CH2-OH +НBr → C2H5-Br +H2Oэтанол
бромэтан
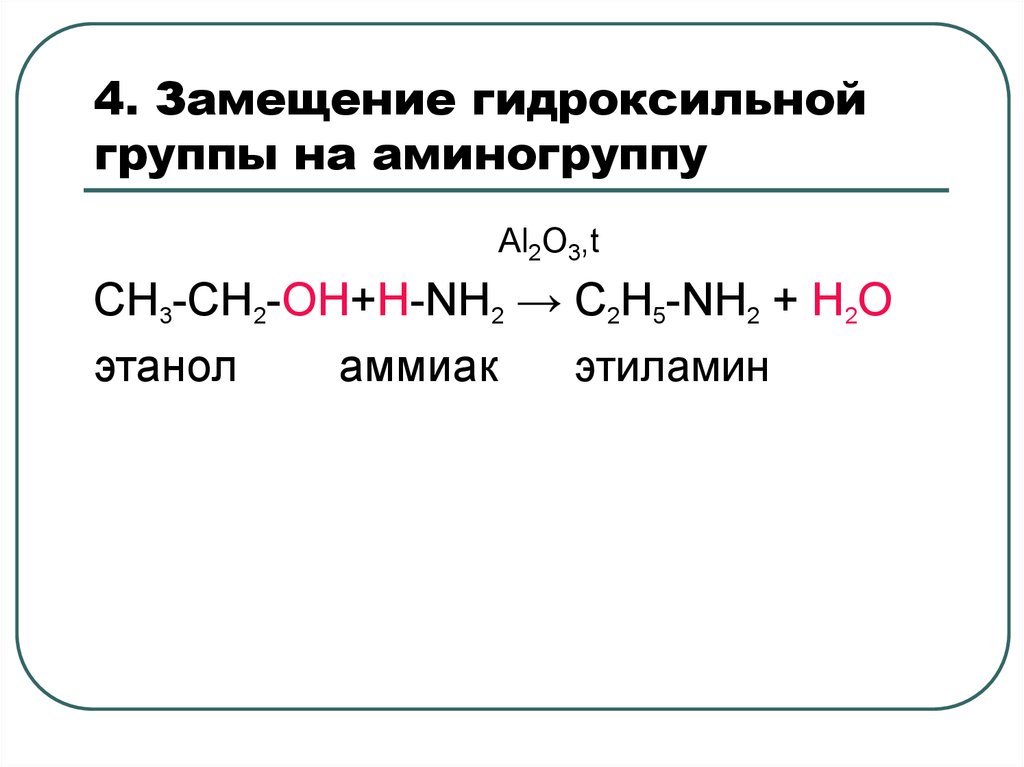
37. 4. Замещение гидроксильной группы на аминогруппу
Al2O3,tCH3-CH2-OH+Н-NН2 → C2H5-NН2 + H2O
этанол
аммиак
этиламин
38. II. Реакции отщепления (элиминирования)
Виды реакций отщепления:- межмолекулярная дегидратация
- внутримолекулярная дегидратация
- дегидрирование
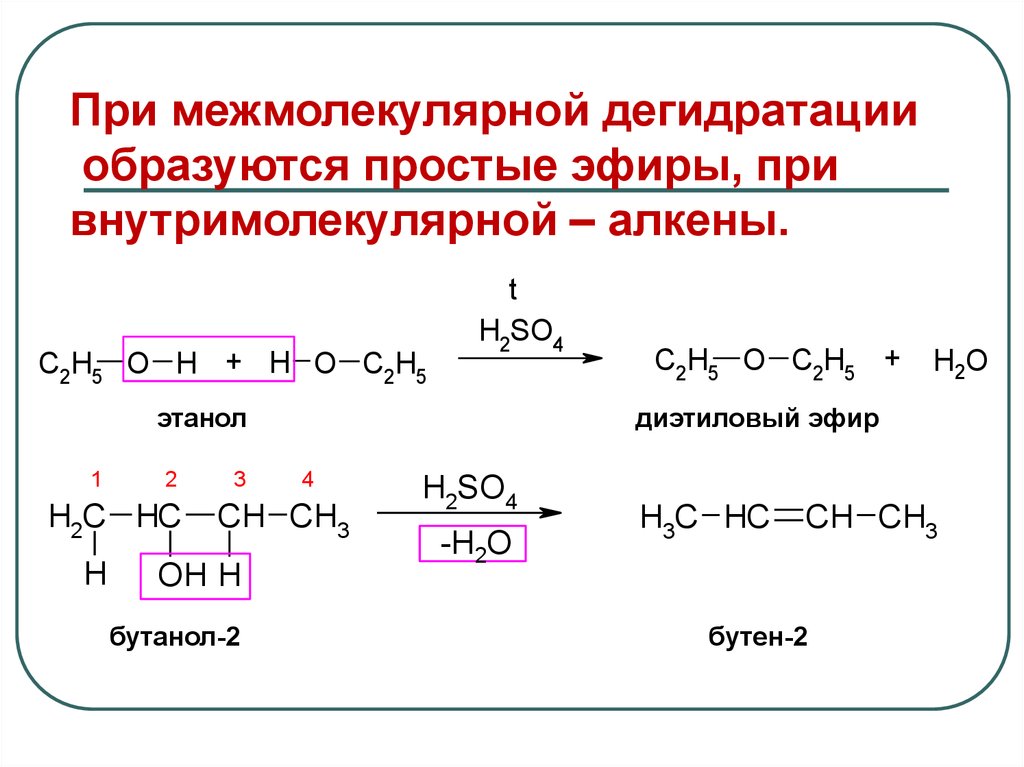
39.
При межмолекулярной дегидратацииобразуются простые эфиры, при
внутримолекулярной – алкены.
C2H5 O H + H O C2H5
t
H2SO4
этанол
1
2
H2C HC
H
3
бутанол-2
H2O
диэтиловый эфир
4
CH CH3
OH H
C2H5 O C2H5 +
H2SO4
-H2O
H3C HC
CH CH3
бутен-2
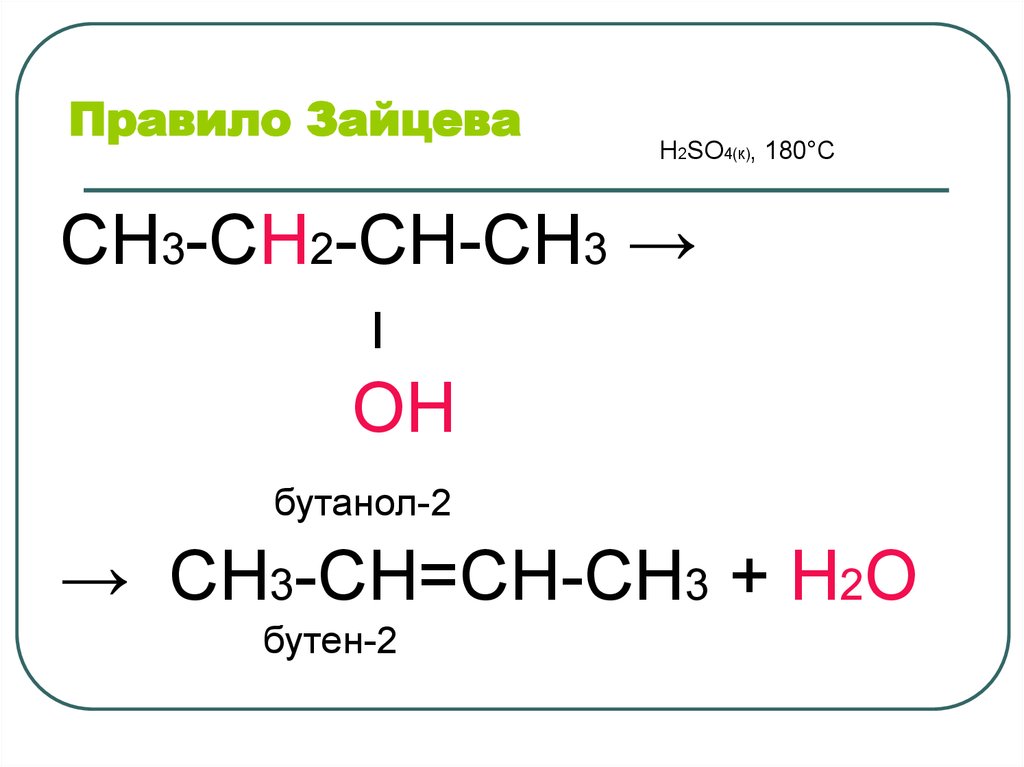
40. Правило Зайцева
H2SO4(к), 180°ССН3-СН2-СН-СН3 →
׀
ОН
бутанол-2
→ СН3-СН=СН-СН3 + Н2О
бутен-2
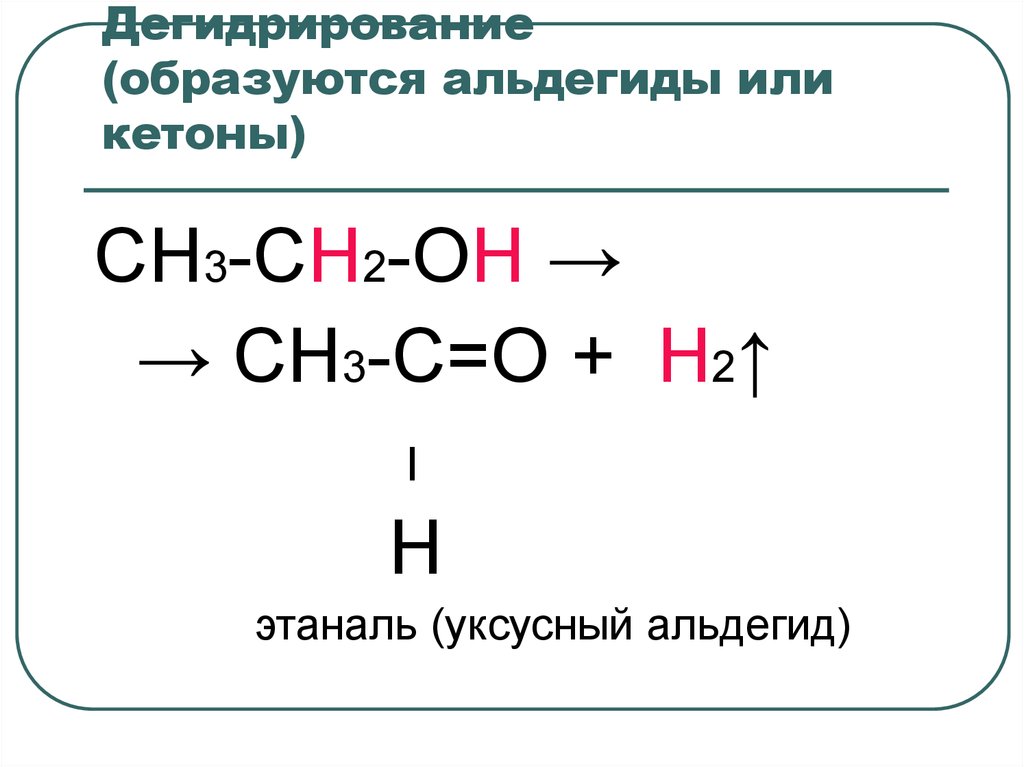
41. Дегидрирование (образуются альдегиды или кетоны)
CH3-CH2-OH →→ CH3-C=O + H2↑
׀
H
этаналь (уксусный альдегид)
42.
СН3-СН-СН3 → (Cu,t)׀
ОН
→ CH3-C-СH3 + H2↑
׀׀
O
этанон (ацетон, диэтилкетон)
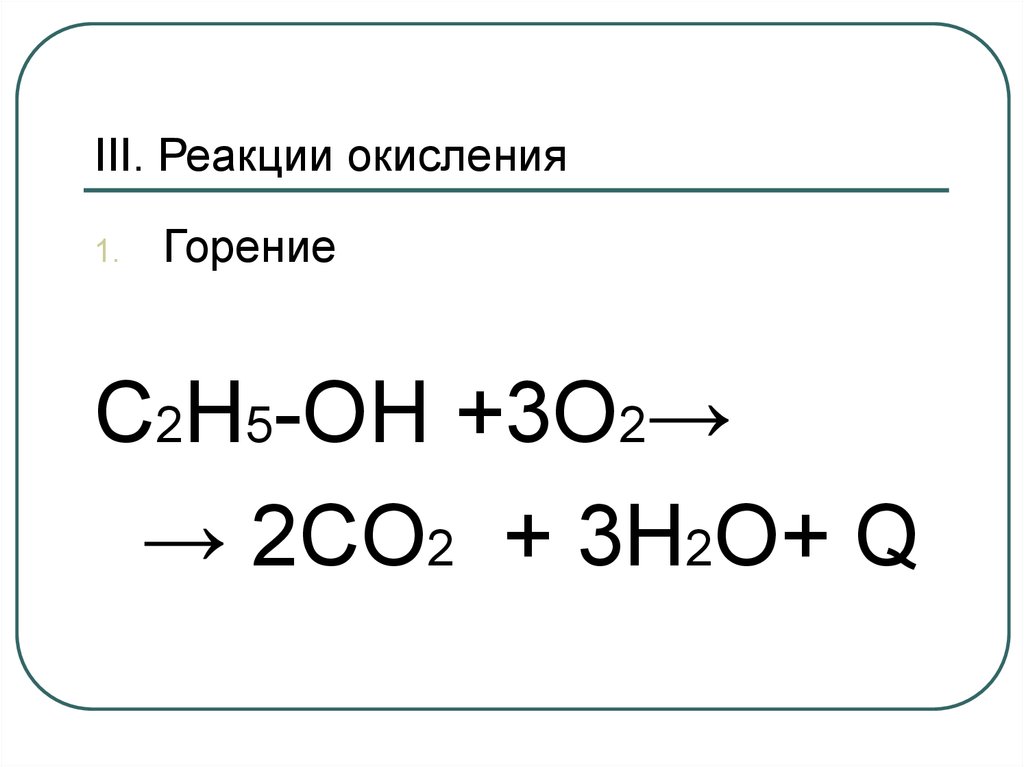
43. III. Реакции окисления
1.Горение
C2H5-OH +3О2→
→ 2CO2 + 3H2O+ Q
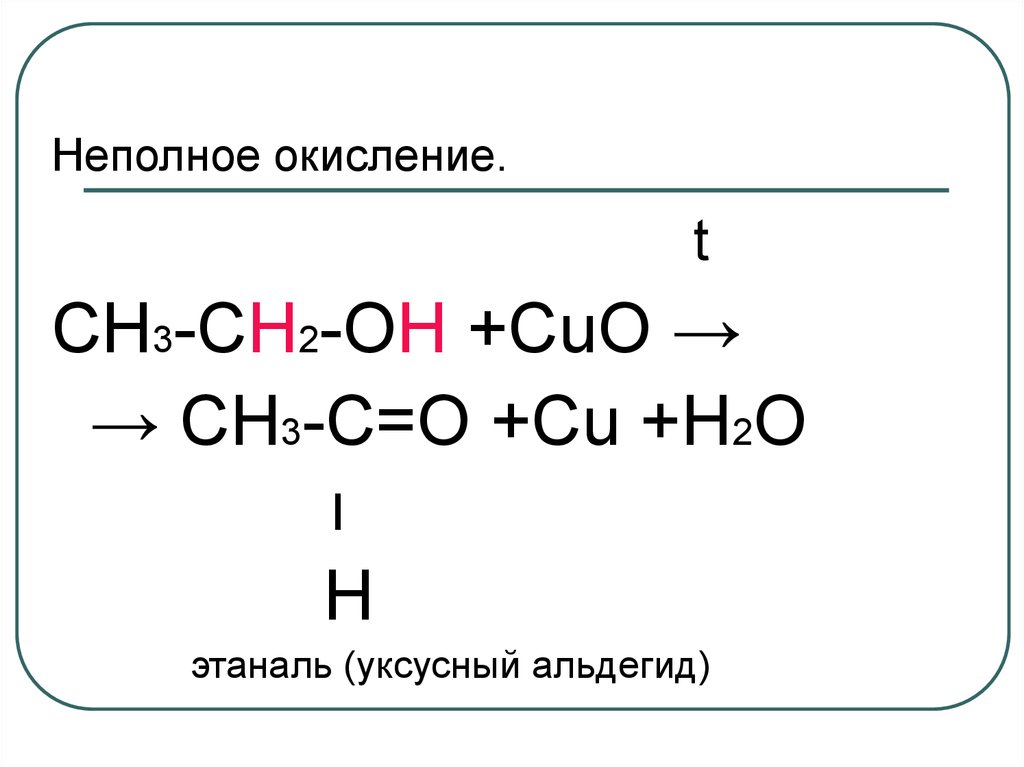
44. Неполное окисление.
tCH3-CH2-OH +CuO →
→ CH3-C=O +Cu +H2О
׀
H
этаналь (уксусный альдегид)
45. Способы получения спиртов
1.2.
3.
4.
Гидратация алкенов
Щелочной гидролиз
галогеноалканов (в присутствии
водного раствора щелочи)
Гидрирование альдегидов и
кетонов(восстановление
альдегидов и кетонов)
Гидролиз сложных эфиров
46. Специфические способы получения метанола и этанола
1. Синтез метанола из водяного газа(катализатор, давление, температура):
СО+ Н2→ СН3ОН
2. Спиртовое брожение глюкозы (под
действием ферментов):
С6Н12О6→
→ 2С2Н5ОН+2СО2↑
47. 3.
Многоатомные спирты48. Многоатомные спирты
Присутствие в молекулах многоатомныхспиртов двух и более гидроксильных
групп обуславливает некоторые отличия
в их свойствах по сравнению с
одноатомными спиртами:
- гликоли и другие многоатомные
спирты реагируют со щелочами , образуя
соли по одной из гидроксильных групп;
- многоатомные спирты взаимодействуют с
гидроксидом меди (II)
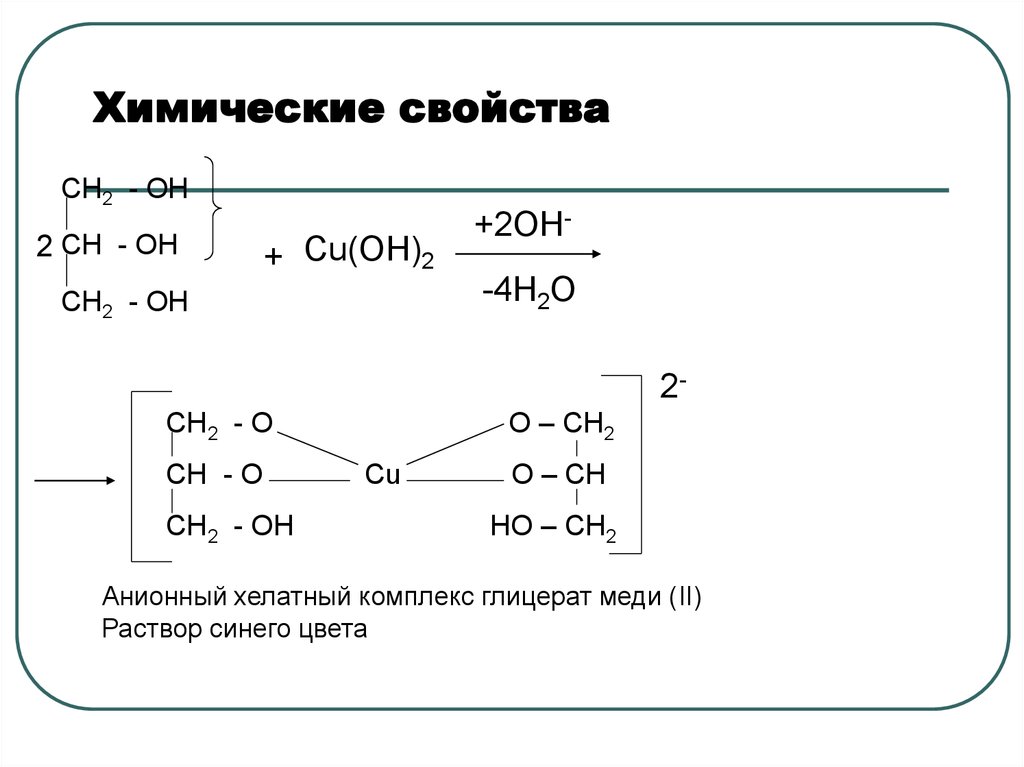
49. Химические свойства
CH2 - OH2 CH - OH
+ Cu(ОН)2
CH2 - OH
+2ОН-4Н2О
2О – СН2
CH2 - O
CH - O
CH2 - OH
Cu
О – СН
НО – СН2
Анионный хелатный комплекс глицерат меди (II)
Раствор синего цвета
50.
51.
Данная реакция используется длякачественного
обнаружения
многоатомных спиртов.
В реакцию при этом вступает αдиольный фрагмент.
52. 2. Реакция этерификации с органическими и неорганическими кислотами
53. Способы получения
Получение гликолей1. Окисление алкенов перманганатом
калия в нейтральной среде
(гидроксилирование)
2. Щелочной гидролиз дигалогеналканов
2. Получение глицерина
1. Кислотный гидролиз животных жиров
или растительных масел
2. Щелочной гидролиз природных жиров
1.
54. Физические свойства
Этиленгликоль и глицерин при обычныхусловиях представляют собой бесцветные
вязкие жидкости, легко смешивающиеся с
водой; температура кипения этиленгликоля
около 2000С, а глицерина – чуть ниже
3000С.
Этиленгликоль ядовит,
глицерин сладкий на вкус.
55. 4.
Фенолы: характеристика, способыполучения, свойства, применение
56. Фенолы
Фенолы – гидроксисоединения, в молекулахкоторых OH-группы непосредственно связаны с
атомами углерода бензольного кольца.
По количеству OH-групп различают:
a) Одноатомные фенолы
OH
фенол
57.
58.
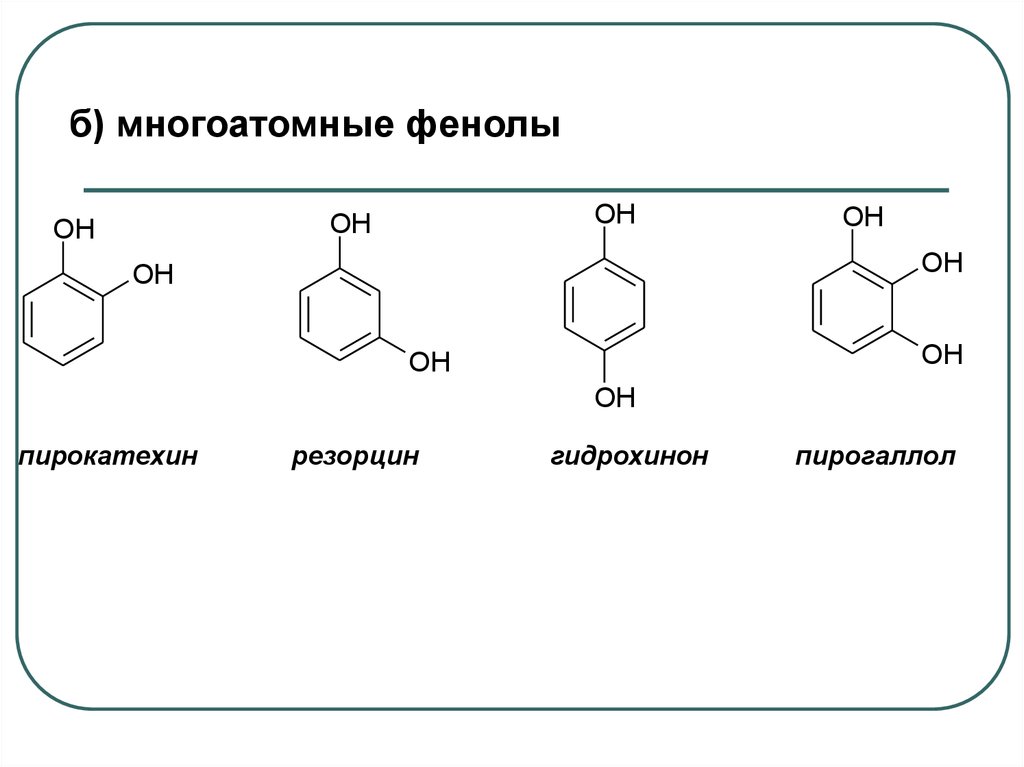
б) многоатомные фенолыOH
OH
OH
OH
OH
OH
OH
OH
OH
пирокатехин
резорцин
гидрохинон
пирогаллол
59. Физические свойства фенола
Фенол- кристаллическое вещество, антисептик.60. Химические свойства фенолов
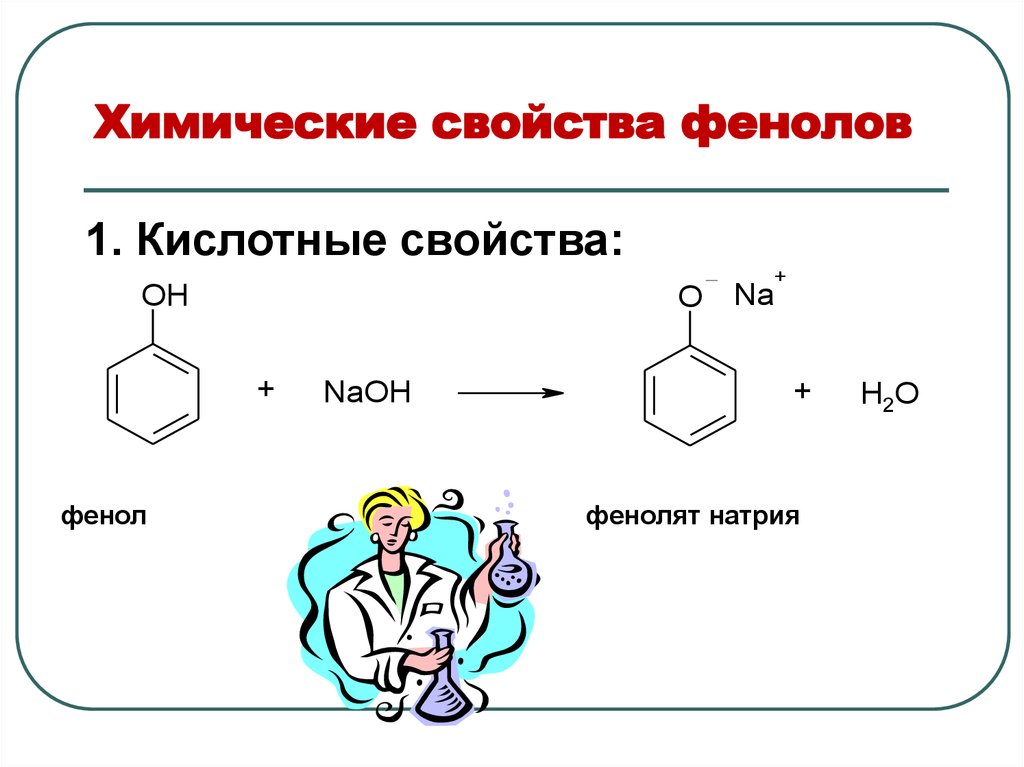
1. Кислотные свойства:OH
O
+
фенол
NaOH
Na
+
+
фенолят натрия
H2O
61.
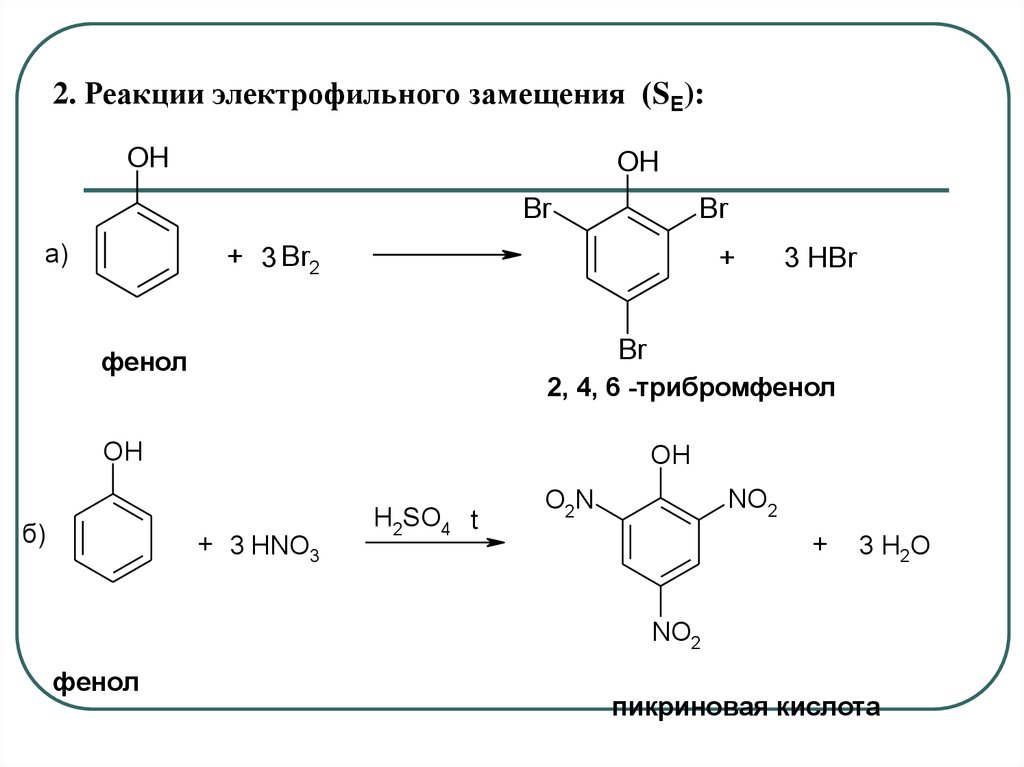
2. Реакции электрофильного замещения (SE):OH
OH
Br
Br
а)
+ 3 Br2
+
3 HBr
Br
фенол
2, 4, 6 -трибромфенол
OH
б)
OH
+ 3 HNO3
H2SO4 t
NO2
O2N
+
3 H2O
NO2
фенол
пикриновая кислота
62.
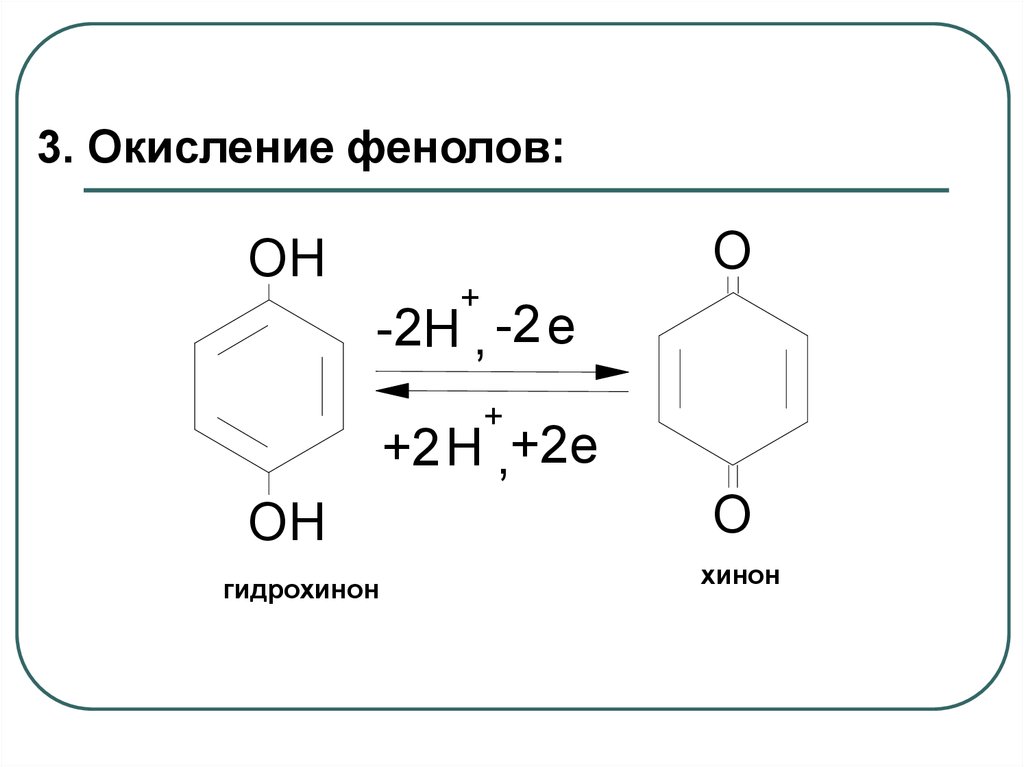
3. Окисление фенолов:O
OH
+
-2H , -2 e
+
+2H ,+2e
OH
гидрохинон
O
хинон
63.
4. Реакции присоединения(гидрирование) с образованием
алициклических спиртов
(циклогексанол)
5. Качественная реакция с хлоридом
железа (III):
Одноатомные фенолы + хлорид железа
→ сине-фиолетовая окраска,
исчезающая при подкислении
Многоатомные фенолы + хлорид железа
→ окраска различных оттенков
64.
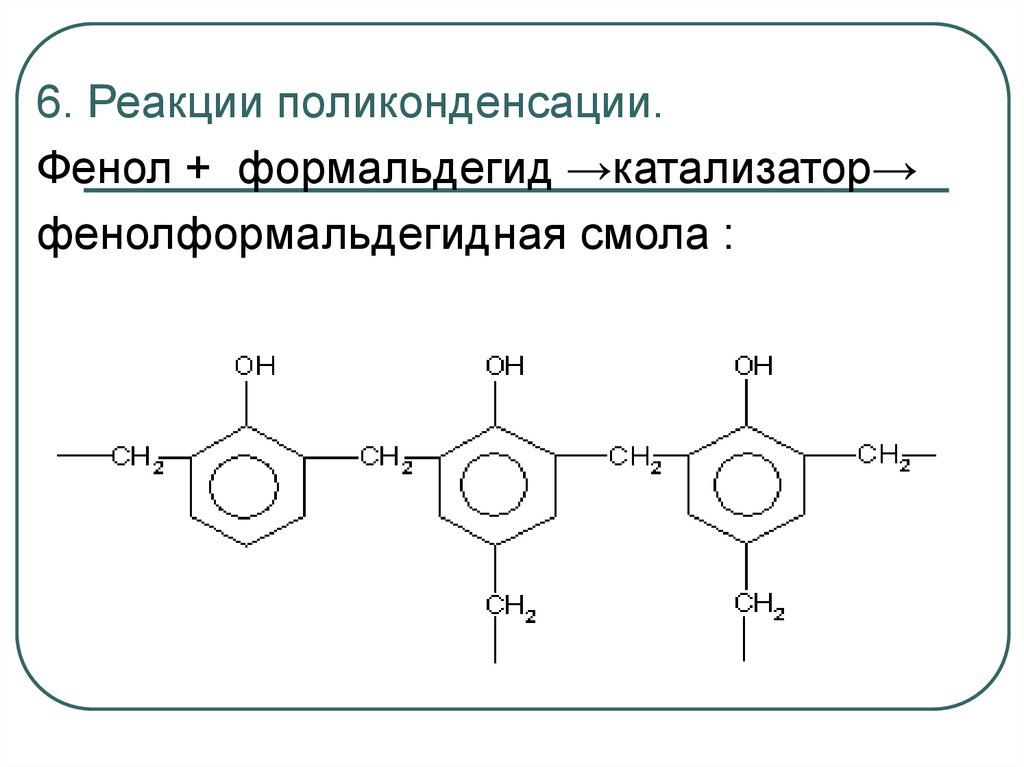
6. Реакции поликонденсации.Фенол + формальдегид →катализатор→
фенолформальдегидная смола :
65.
Спасибо завнимание!






































 Химия
Химия








