Похожие презентации:
Гидроксилпроизводные углеводородов
1. Гидроксипроизводные углеводородов
2.
Гидроксилпроизводные – это такие производные углеводородов, всостав молекулы которых входит одна или несколько
гидроксильных групп.
O
H
3. Классификация
В зависимости от количества гидроксильных групп различают:Одноатомные;
Двухатомные;
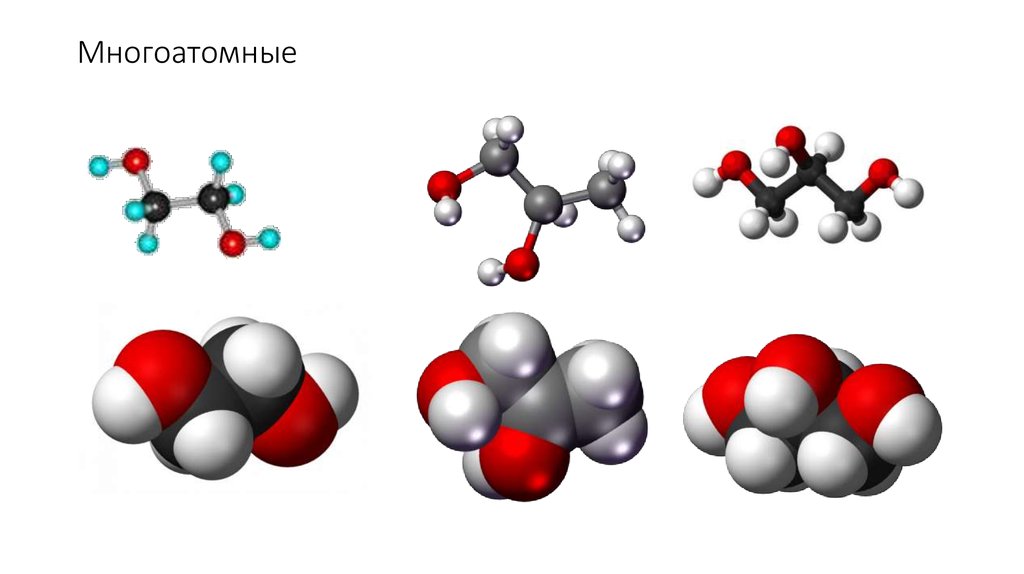
Трех- и многоатомные.
В зависимости от типа углеродного скелета различают:
Нециклические (ациклические);
Циклические.
В зависимости от наличия кратных связей различают:
Насыщенные;
Ненасыщенные.
4. Номенклатура
5. классификация
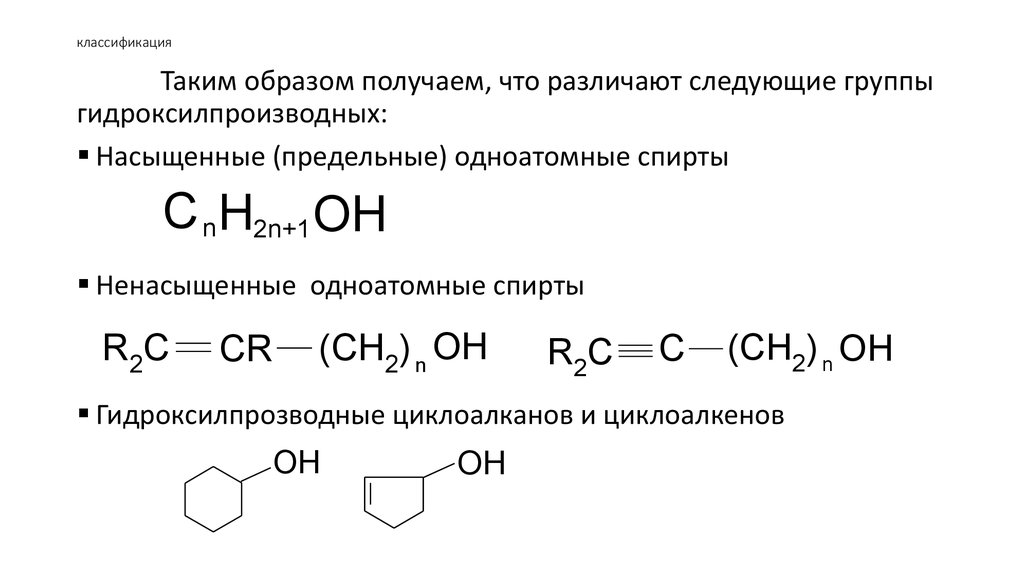
Таким образом получаем, что различают следующие группыгидроксилпроизводных:
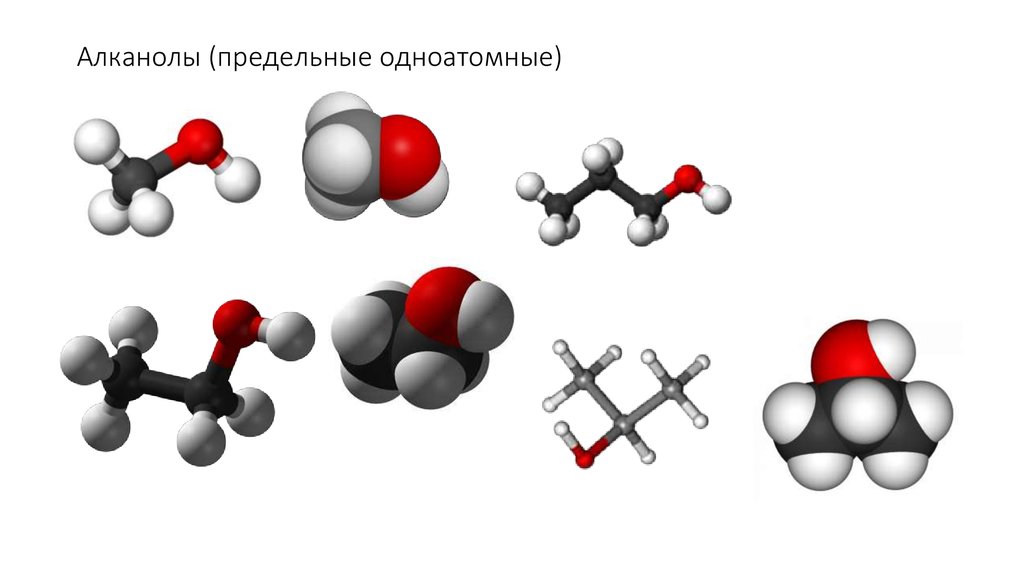
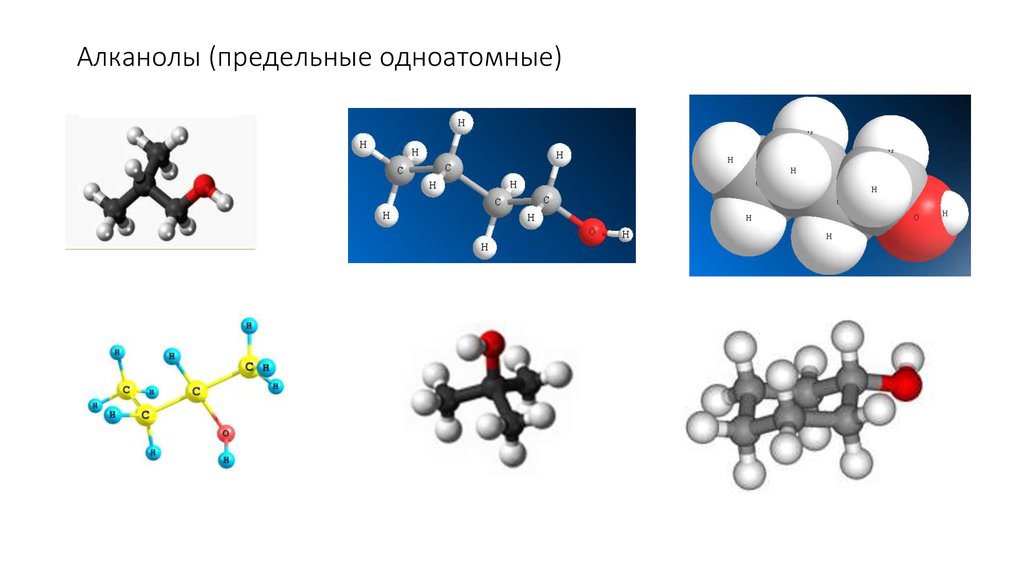
Насыщенные (предельные) одноатомные спирты
C nH2n+1 OH
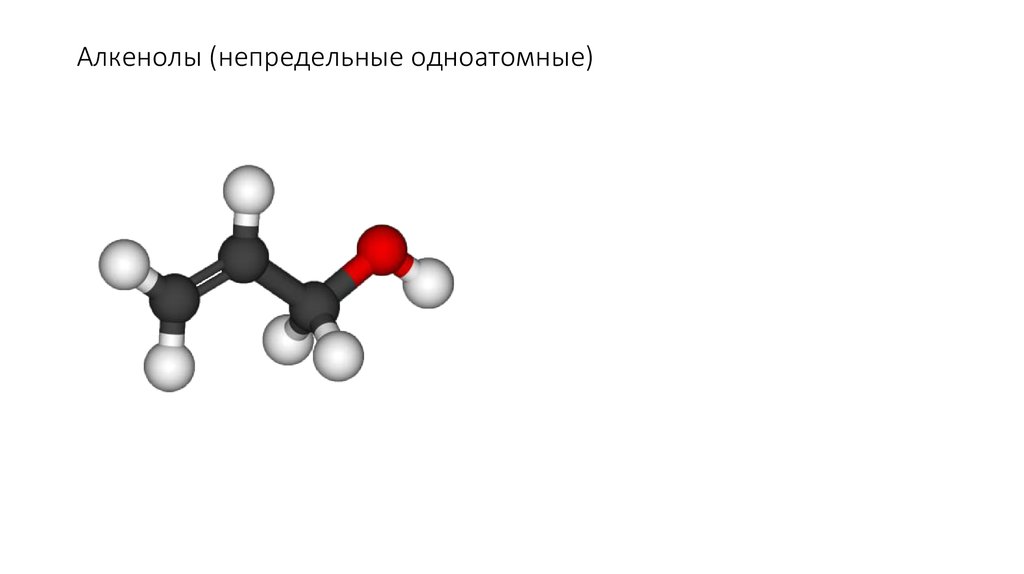
Ненасыщенные одноатомные спирты
R2C
CR
(CH2) n OH
R2C
C
(CH2) n OH
Гидроксилпрозводные циклоалканов и циклоалкенов
OH
OH
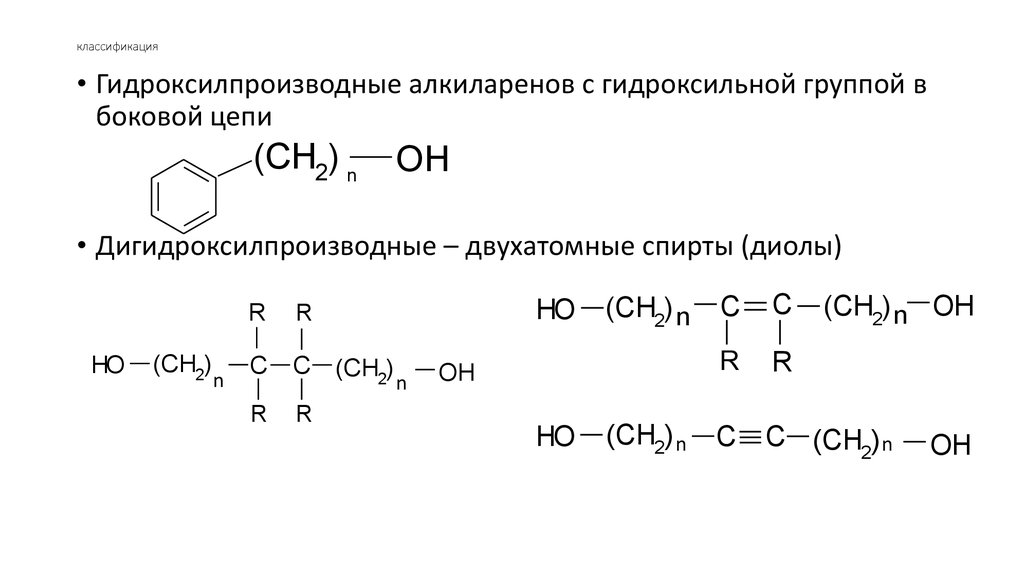
6. классификация
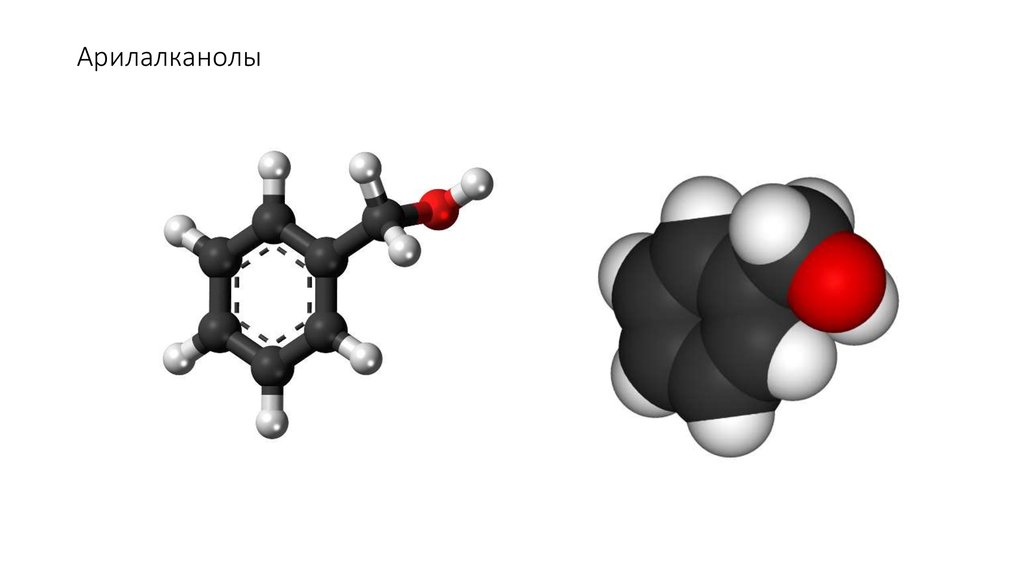
• Гидроксилпроизводные алкиларенов с гидроксильной группой вбоковой цепи
(CH2) n
OH
• Дигидроксилпроизводные – двухатомные спирты (диолы)
HO
(CH2)
n
R
R
C
C (CH2)
R
R
HO
n
(CH2) n
OH
HO
(CH2) n
C
C
R
R
C
C (CH2) n
(CH2) n OH
OH
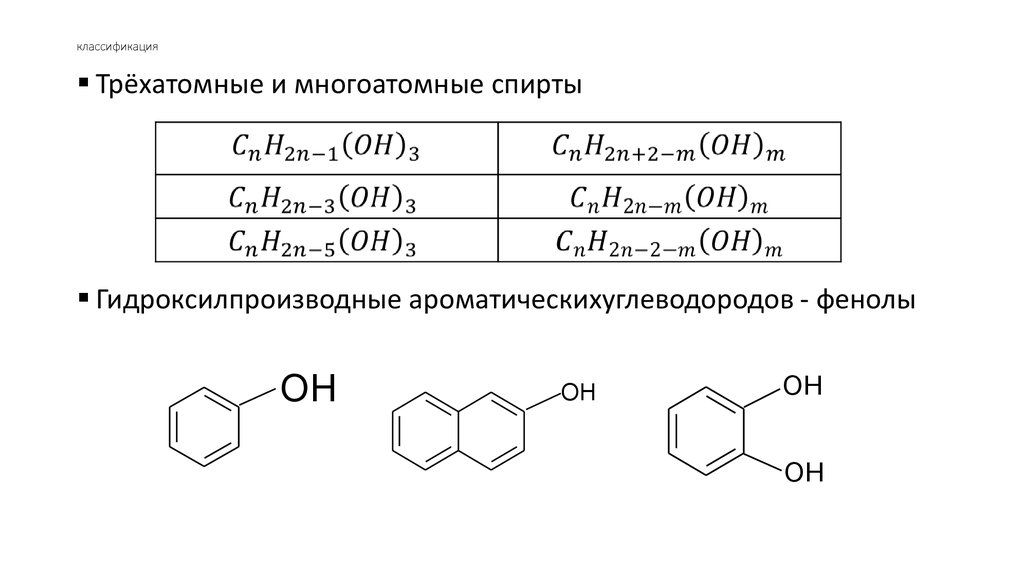
7. классификация
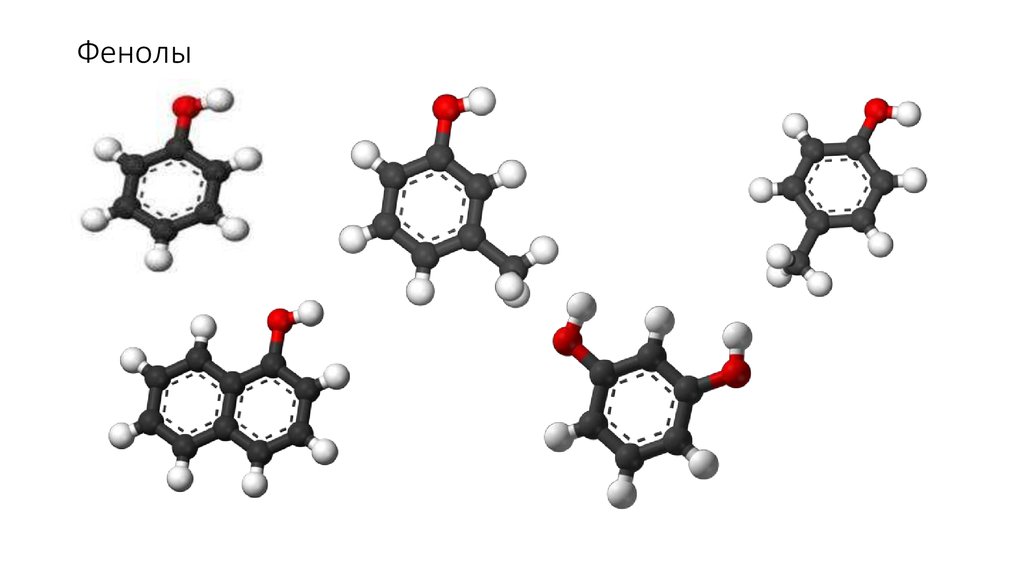
Трёхатомные и многоатомные спиртыГидроксилпроизводные ароматическихуглеводородов - фенолы
OH
OH
OH
OH
8. Алканолы (предельные одноатомные)
9. Алканолы (предельные одноатомные)
10. Алкенолы (непредельные одноатомные)
11. Арилалканолы
12. Многоатомные
13. Фенолы
14. Спирты
15.
Спирты - это производныеуглеводородов, содержащие одну или
несколько гидроксильных групп (-O-H)
R-OH
16.
17.
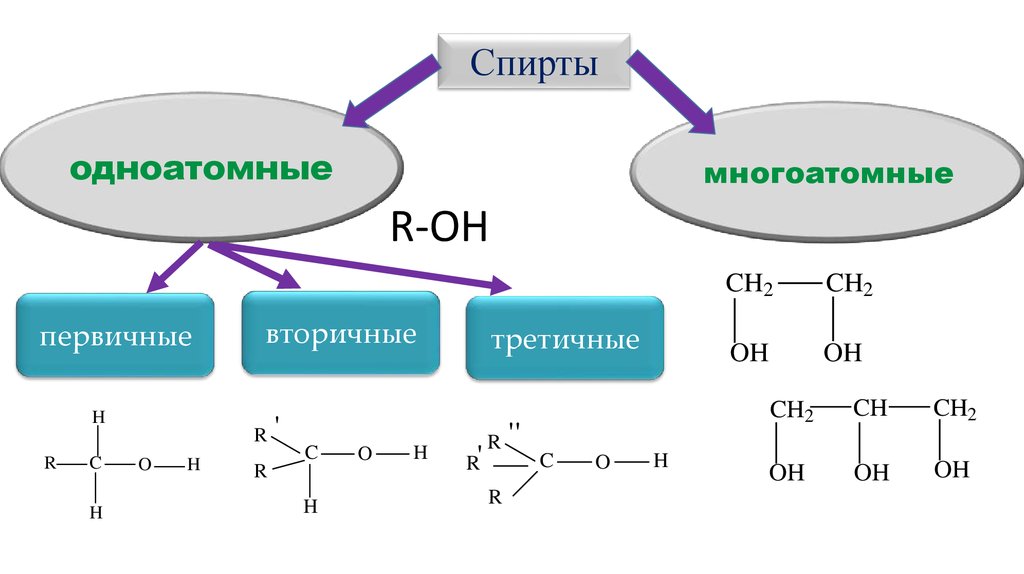
Спиртыодноатомные
многоатомные
R-OH
первичные
вторичные
H
R
R
C
H
O
H
третичные
'
C
R
H
O
H
R'
R
R
''
C
O
H
CH2
CH2
OH
OH
CH2
CH
CH2
OH
OH
OH
18.
19.
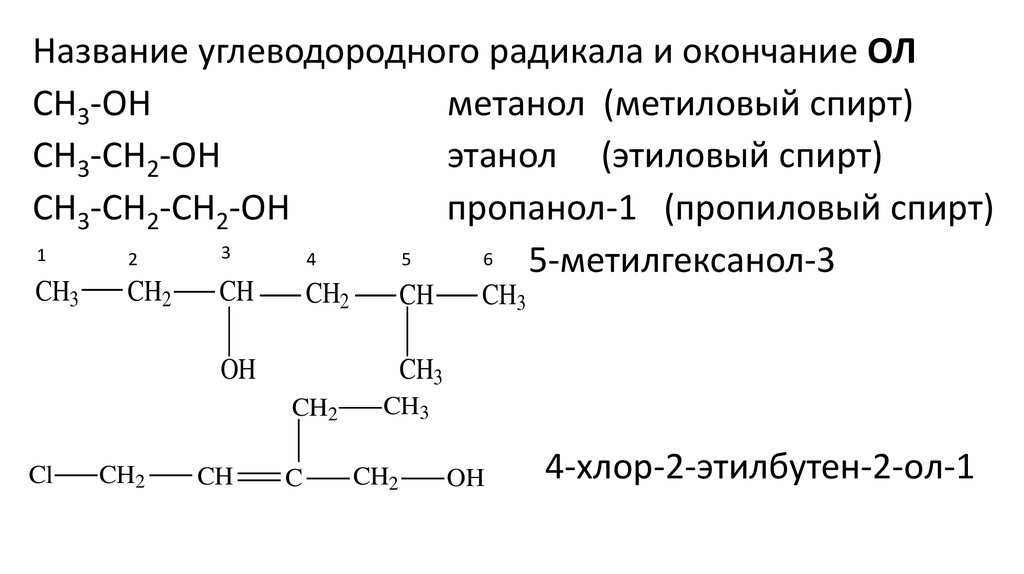
Название углеводородного радикала и окончание ОЛCH3-OH
метанол (метиловый спирт)
CH3-CH2-OH
этанол (этиловый спирт)
CH3-CH2-CH2-OH
пропанол-1 (пропиловый спирт)
3
1
2
4
5
6
5-метилгексанол-3
CH3
CH2
CH
CH2
CH
OH
CH3
CH2
Cl
CH2
CH
CH3
C
CH3
CH2
OH
4-хлор-2-этилбутен-2-oл-1
20.
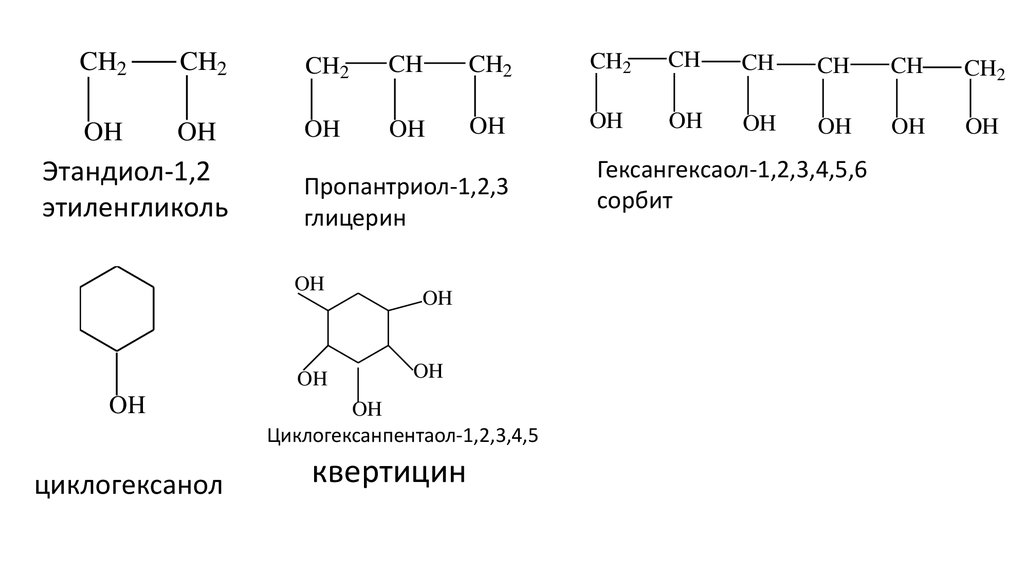
CH2CH2
CH2
CH
CH2
CH2
CH
CH
CH
CH
CH2
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
Этандиол-1,2
этиленгликоль
Пропантриол-1,2,3
глицерин
OH
OH
OH
циклогексанол
OH
OH
OH
Циклогексанпентаол-1,2,3,4,5
квертицин
Гексангексаол-1,2,3,4,5,6
сорбит
21.
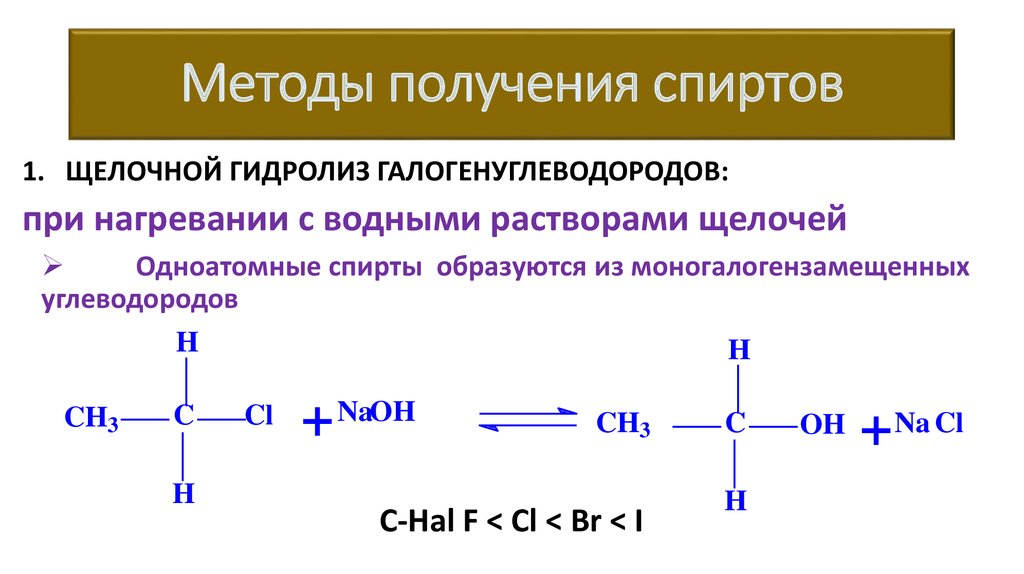
Методы получения спиртов1. ЩЕЛОЧНОЙ ГИДРОЛИЗ ГАЛОГЕНУГЛЕВОДОРОДОВ:
при нагревании с водными растворами щелочей
Одноатомные спирты образуются из моногалогензамещенных
углеводородов
H
H
CH3
C
H
Cl
+
NaOH
CH3
C-Hal F < Cl < Br < I
C
H
OH
+ Na Cl
22.
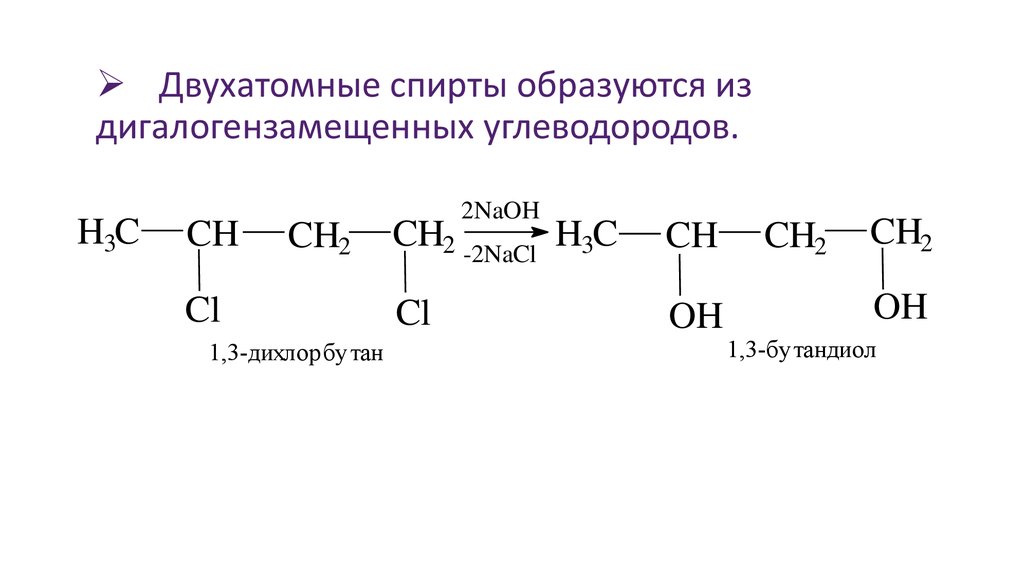
Двухатомные спирты образуются издигалогензамещенных углеводородов.
H3C
CH
CH2
Cl
1,3-дихлорбутан
2NaOH
CH2 -2NaCl H3C
CH
Cl
OH
CH2
CH2
OH
1,3-бутандиол
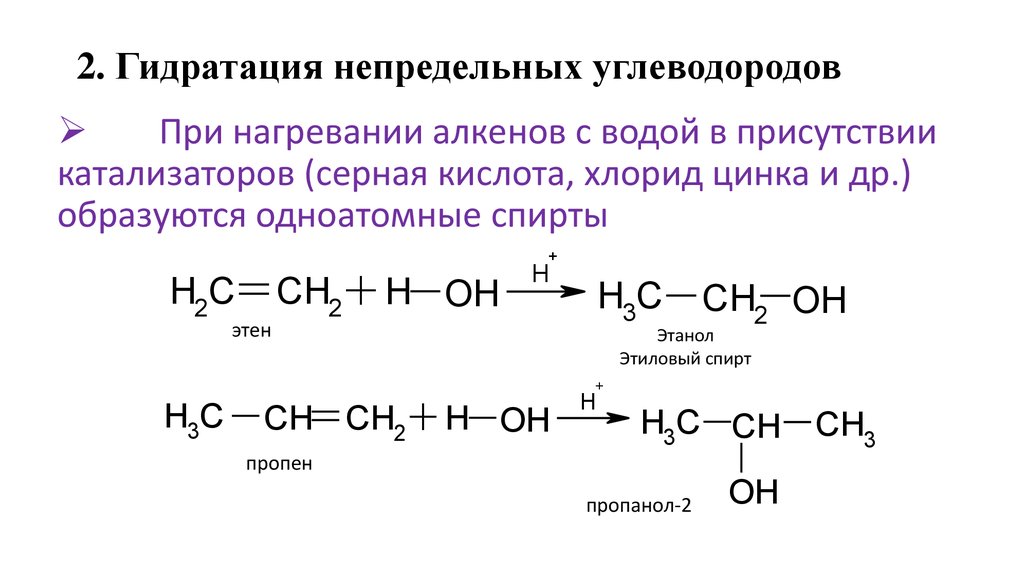
23. 2. Гидратация непредельных углеводородов
При нагревании алкенов с водой в присутствиикатализаторов (серная кислота, хлорид цинка и др.)
образуются одноатомные спирты
H2C
этен
H3C
CH2 + H OH
+
H
CH CH2 + H OH
H3C
CH2 OH
Этанол
Этиловый спирт
+
H
H3C CH CH3
пропен
пропанол-2
OH
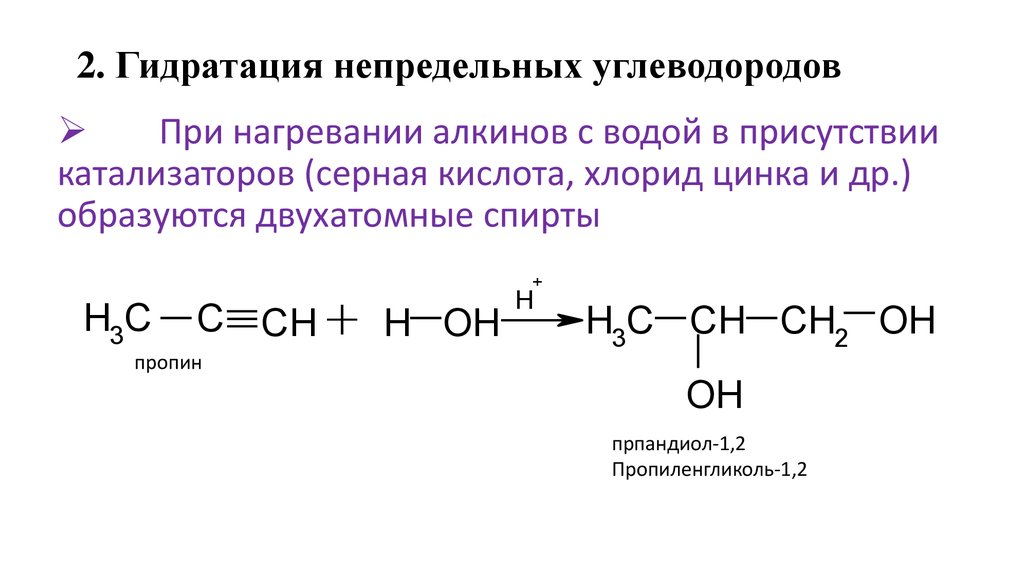
24. 2. Гидратация непредельных углеводородов
При нагревании алкинов с водой в присутствиикатализаторов (серная кислота, хлорид цинка и др.)
образуются двухатомные спирты
H3C
C CH + H OH
+
H
H3C CH CH2 OH
пропин
OH
прпандиол-1,2
Пропиленгликоль-1,2
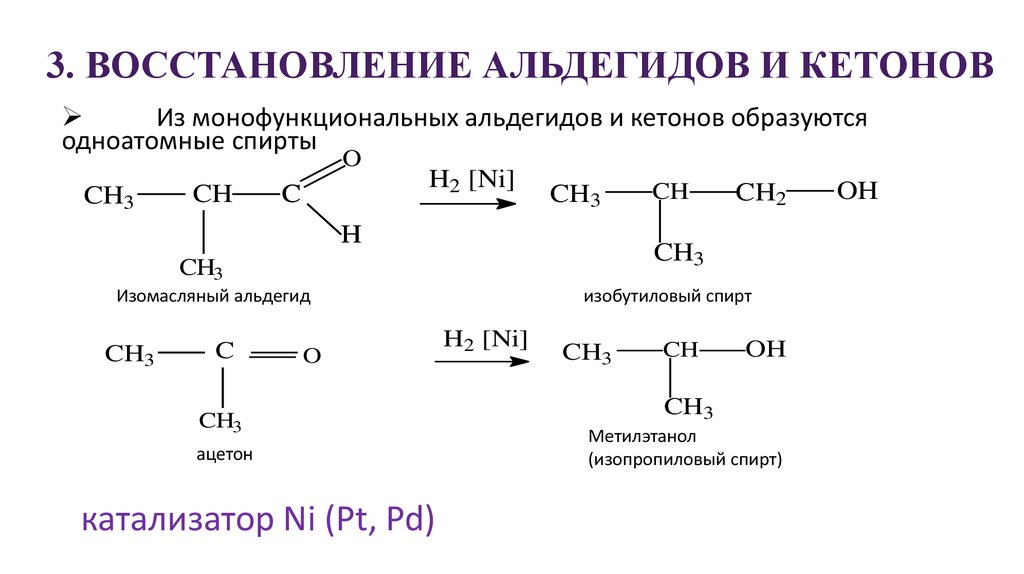
25. 3. ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
Из монофункциональных альдегидов и кетонов образуютсяодноатомные спирты
O
CH3
CH
C
H2 [Ni]
CH3
H
Изомасляный альдегид
C
O
CH3
ацетон
катализатор Ni (Pt, Pd)
CH2
CH3
CH3
CH3
CH
изобутиловый спирт
H2 [Ni]
CH3
CH
OH
CH3
Метилэтанол
(изопропиловый спирт)
OH
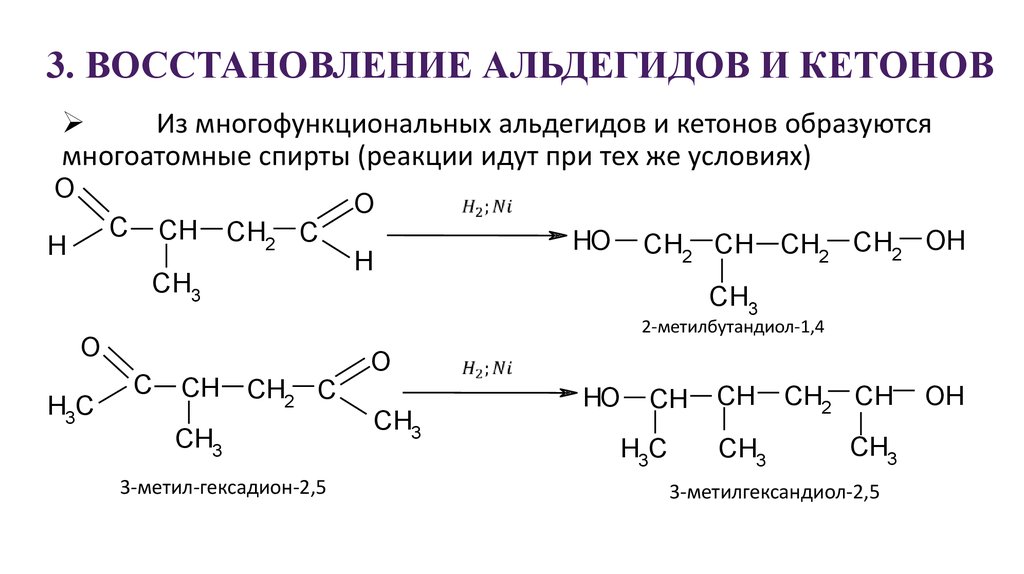
26. 3. ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
Из многофункциональных альдегидов и кетонов образуютсямногоатомные спирты (реакции идут при тех же условиях)
O
O
C
H
CH
CH2 C
CH3
CH2 CH CH2 CH2 OH
CH3
2-метилбутандиол-1,4
O
H3C
H
HO
C
O
CH
CH2 C
CH3
3-метил-гексадион-2,5
CH3
HO
CH
H3C
CH
CH3
CH2 CH
CH3
3-метилгександиол-2,5
OH
27. 4. Синтез спиртов с помощью реактивов Гриньяра:
CH3CH2
δ+
δ-
C
O
+
Hδ-3C
Mg
δ+
I
H
Пропионовый альдегид
метилмагнийиодид
OH
CH3
CH2
Алкоголят
C
H
O MgI
H3C
HI
CH3
CH2
CH
CH3
вторичный бутиловый спирт
+ MgI2
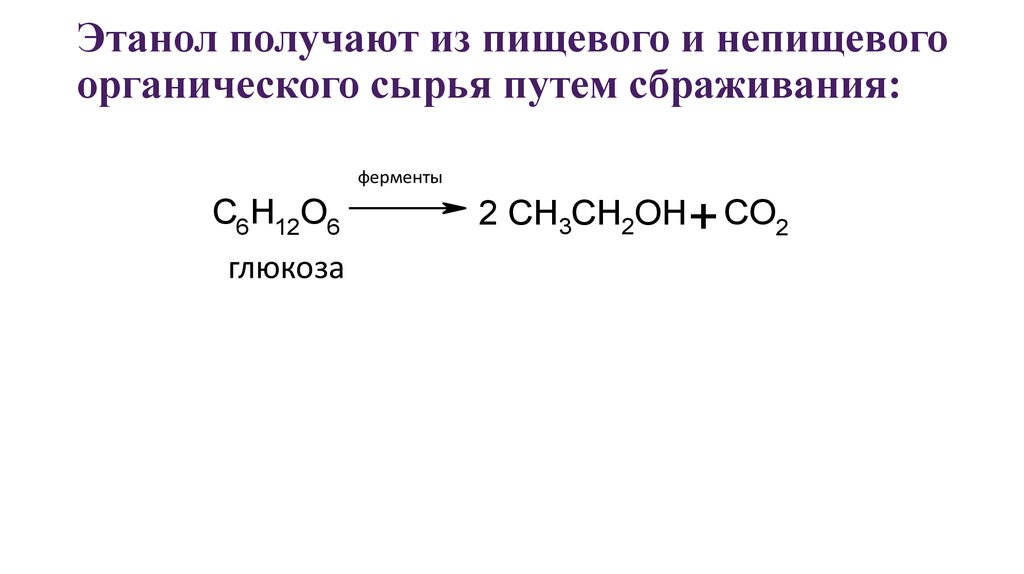
28. Этанол получают из пищевого и непищевого органического сырья путем сбраживания:
ферментыC6H12O6
глюкоза
2 CH3CH2OH+ CO2
29. Гликоли получают окислением алкенов под действием водного раствора KMnO4
H2C CH2 + KMnO4 + H2OH2C CH2
OH OH
30. Получение смеси спиртов - синтола
Условия: Нагревание, высокое давление,катализатор (Fe, Co)
nCO +2nH2 → CnH2n+1OH + (n-1)H2O
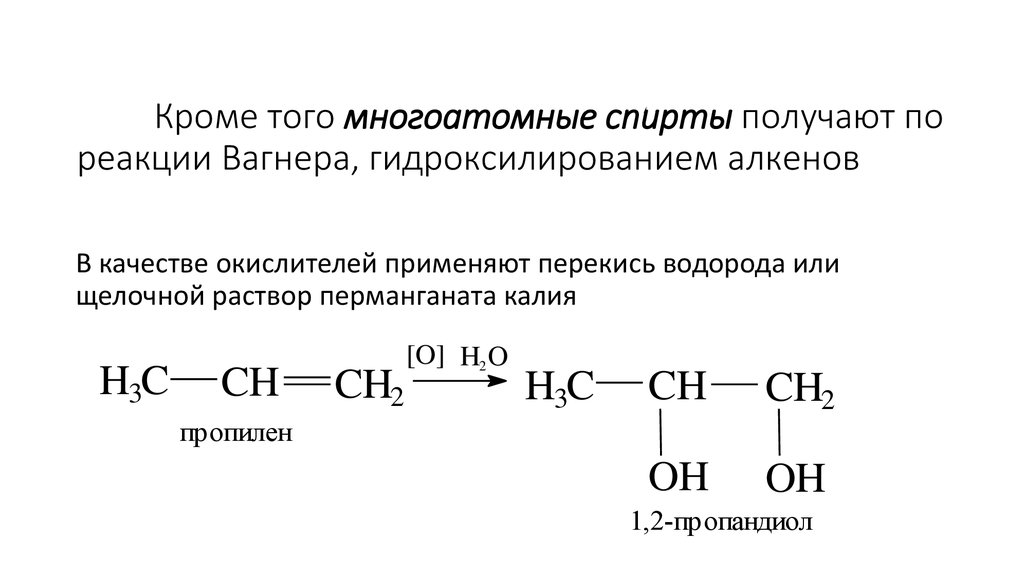
31. Кроме того многоатомные спирты получают по реакции Вагнера, гидроксилированием алкенов
В качестве окислителей применяют перекись водорода илищелочной раствор перманганата калия
H3C
CH
CH2
[O] H2 O
H3C
CH
CH2
OH
OH
пропилен
1,2-пропандиол
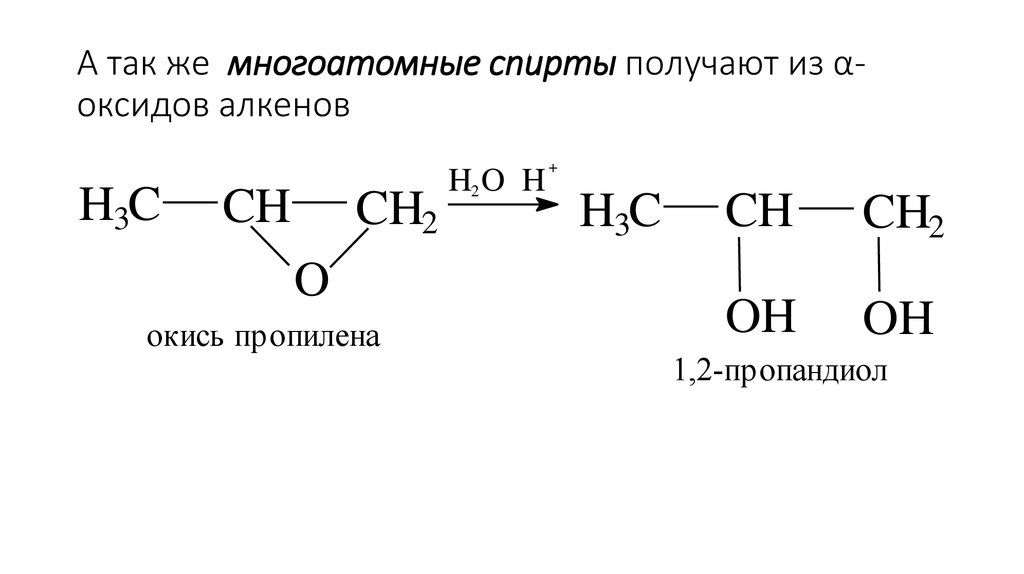
32. А так же многоатомные спирты получают из α-оксидов алкенов
А так же многоатомные спирты получают из αоксидов алкеновH3C
CH
CH2
O
окись пропилена
H2 O H
+
H3C
CH
CH2
OH
OH
1,2-пропандиол
33.
Физические свойства спиртовМолекулы спиртов ассоциированы за счет
.. H . . . : O R
образования межмолекулярных водородных R O
H
..
связей:
..
.
Низшие и средние предельные одноатомные
H .. R
O
спирты, содержащие от одного до одиннадцати
.
.
.
..
..
атомов углерода-жидкости.
.
.
O
.
Высшие спирты(начиная с С12Н25ОН) при
H .. R
комнатной температуре-твердые вещества.
Низшие спирты имеют характерный алкогольный
запах и жгучий вкус, они хорошо растворимы в
воде.
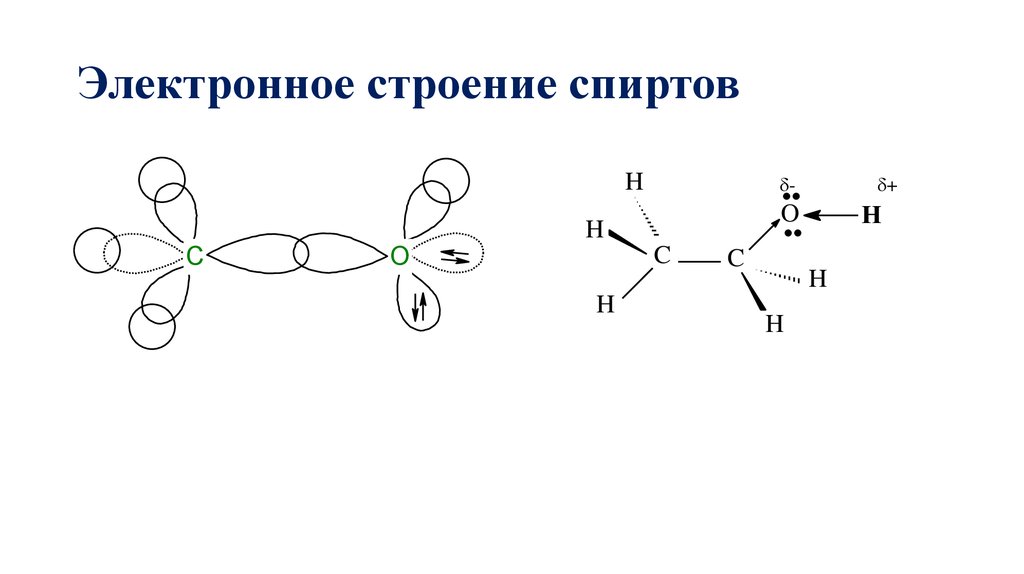
34. Электронное строение спиртов
Hδ-
O
H
C
C
O
H
δ+
C
H
H
H
35.
Химические свойства спиртовСпирты очень слабые электролиты (слабее воды)
CH3-CH2-O-H ↔CH3-CH2-O- + H+
Типы реакций
I. Реакции с участием водорода гидроксильной группы.
II. Реакции с отщеплением или замещением гидроксилдьной группы
III. Реакции окисления
36.
I. Реакции с участием водородагидроксильной группы.
1. Замещение гидроксильного атома водорода на металл.
(Na,Mg,Al)
2R-O-H + 2Na →2R-O-Na + H2
Алкоголят натрия
CH3-CH2-O-Na +H2O→CH3-CH2-O-H +NaOH
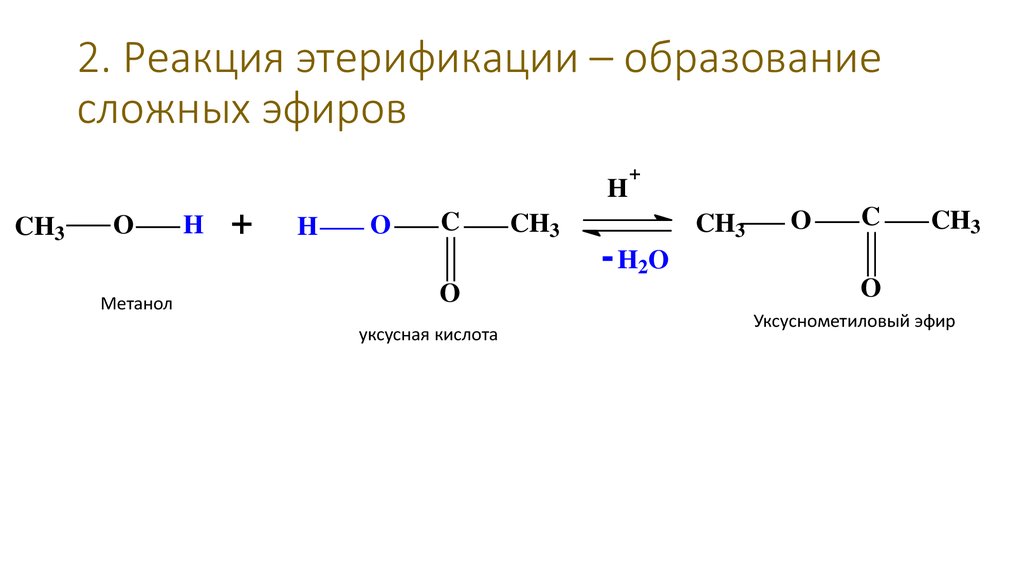
37. 2. Реакция этерификации – образование сложных эфиров
HCH3
O
Метанол
H
+
H
O
C
O
уксусная кислота
CH3
+
- H2O
CH3
O
C
CH3
O
Уксуснометиловый эфир
38. II. Реакции с отщеплением или замещением гидроксильной группы
1. Замещение гидроксила на галоген:CH3OH +PBr5 ↔ CH3Br + POBr3 + HBr
метанол
бромметан
C3H7OH +SOCl2 ↔ C3H7Cl +SO2 + HCl
пропанол
хлорпропан
C2H5OH + HBr ↔ C2H5Br + HOH
этанол
бромэтан
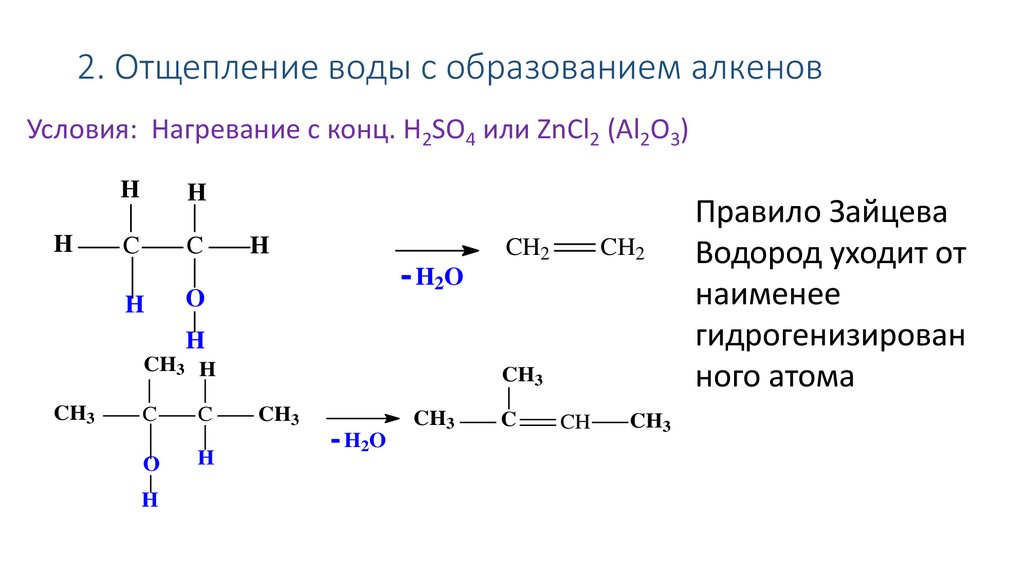
39. 2. Отщепление воды с образованием алкенов
Условия: Нагревание с конц. H2SO4 или ZnCl2 (Al2O3)H
H
H
C
C
H
H
- H2O
O
CH2
CH2
H
CH3 H
CH3
C
O
H
C
H
CH3
CH3
- H2O
CH3
C
CH
CH3
Правило Зайцева
Водород уходит от
наименее
гидрогенизирован
ного атома
40. 3. Межмолекулярная дегидратация
Условия: нагревание избытка спирта с серной кислотой или пары спиртапри 2000С через порошок сульфата алюминия
CH3-CH2-O-H + H-O-CH2-CH3 →CH3–CH2-O-CH2-CH3 + HOH
Этанол
диэтиловый эфир
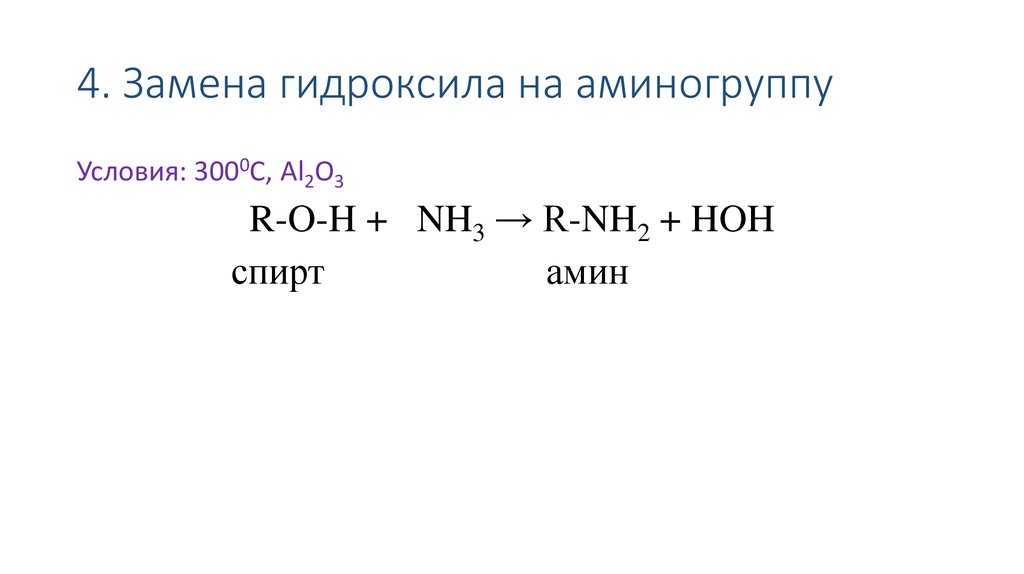
41. 4. Замена гидроксила на аминогруппу
Условия: 3000С, Al2O3R-O-H + NH3 → R-NH2 + HOH
спирт
амин
42.
III. Реакции окисления, в которых одновременнопринимают участие гидроксильная группа,
α-водородные атомы или соседние связи С-С
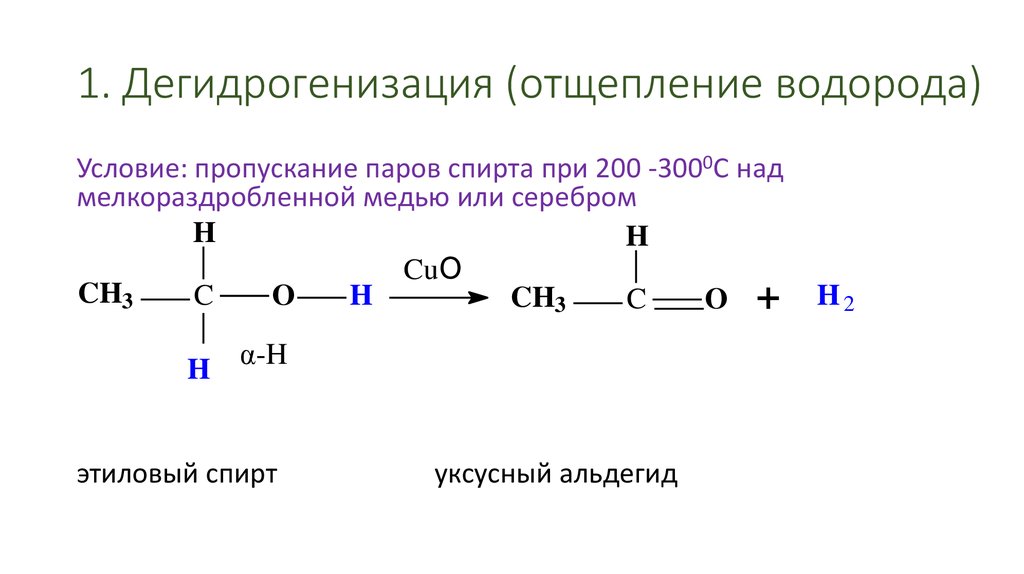
43. 1. Дегидрогенизация (отщепление водорода)
Условие: пропускание паров спирта при 200 -3000С надмелкораздробленной медью или серебром
H
H
CuO
CH3
C
O
H
CH3
C
O +
H
α-H
этиловый спирт
уксусный альдегид
H2
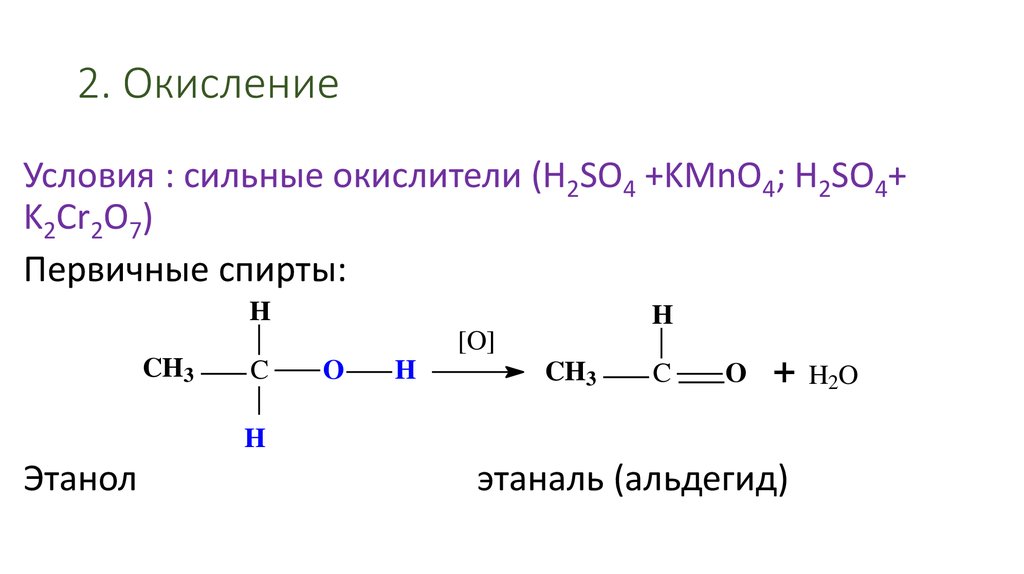
44. 2. Окисление
Условия : сильные окислители (H2SO4 +KMnO4; H2SO4+K2Cr2O7)
Первичные спирты:
H
H
[O]
CH3
C
O
H
CH3
C
O
+
H
Этанол
этаналь (альдегид)
H2O
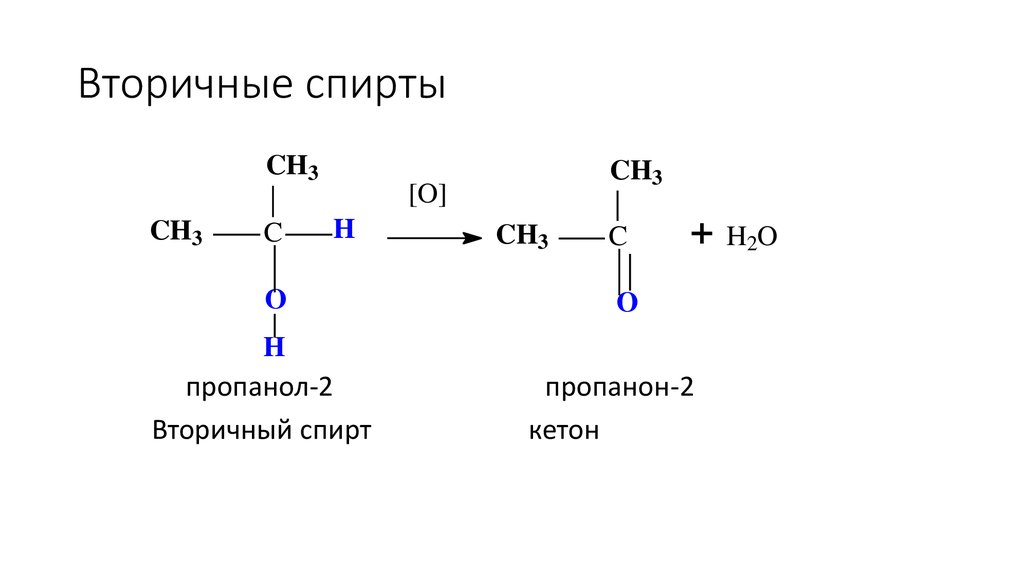
45. Вторичные спирты
CH3CH3
C
CH3
[O]
H
O
CH3
C
+
O
H
пропанол-2
Вторичный спирт
пропанон-2
кетон
H2O
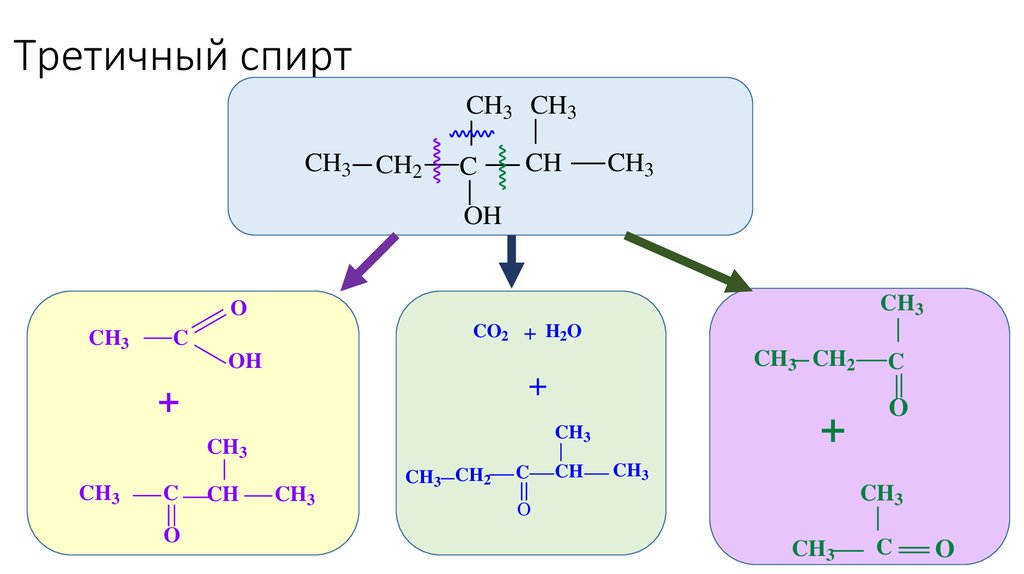
46. Третичный спирт
CH3 CH3CH3 CH2
C
CH
CH3
OH
CH3
O
CH3
CO2 + H2O
C
OH
+
+
C
O
CH
+
CH3
CH3
CH3
CH3 CH2
CH3
CH3 CH2
C
CH
C
O
CH3
CH3
O
CH3
C
O
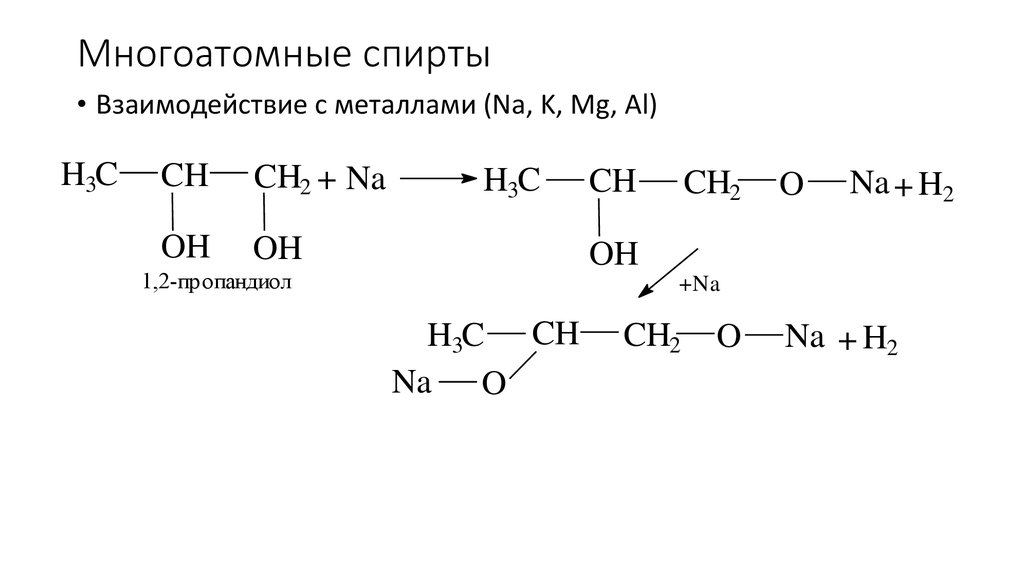
47. Многоатомные спирты
• Взаимодействие с металлами (Na, K, Mg, Al)H3C
CH
CH2 + Na
OH
OH
H3C
CH
CH2
O
Na + H2
OH
1,2-пропандиол
+Na
H3C CH
Na O
CH2
O
Na + H2
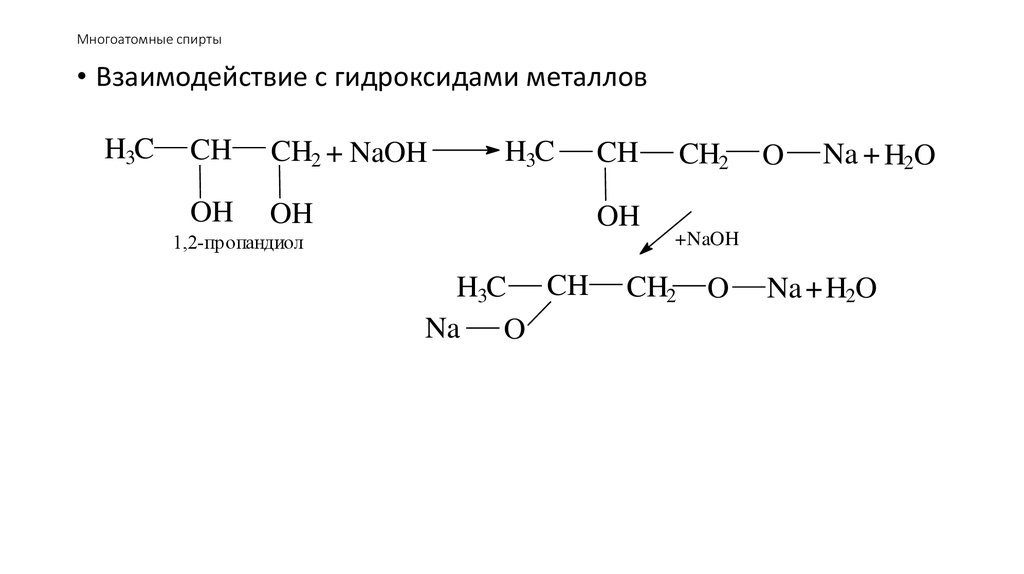
48. Многоатомные спирты
• Взаимодействие с гидроксидами металловH3C
CH
CH2 + NaOH
OH
OH
H3C
CH
OH
1,2-пропандиол
H3C CH
Na O
CH2
O
Na + H2O
+NaOH
CH2
O
Na + H2O
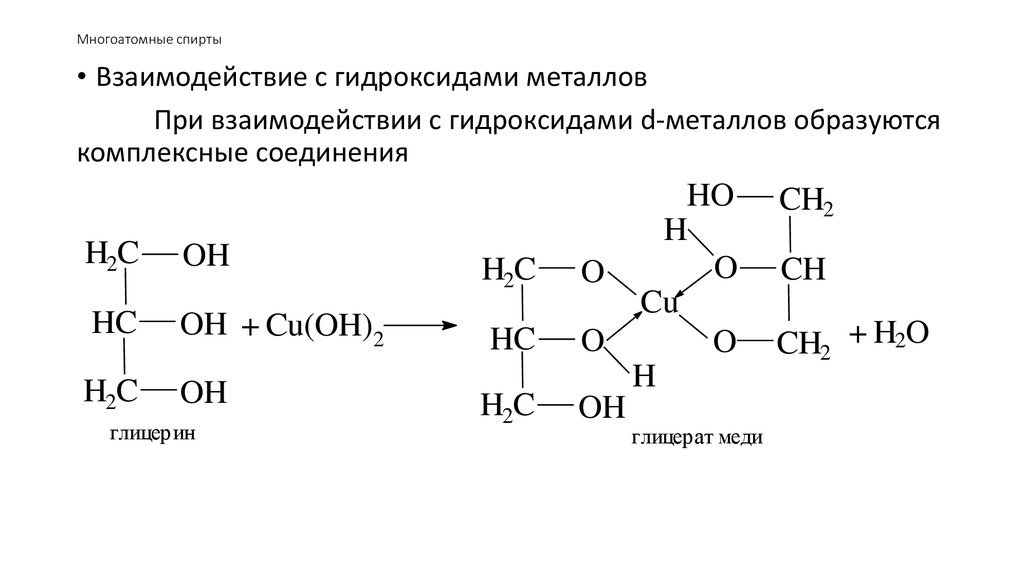
49. Многоатомные спирты
• Взаимодействие с гидроксидами металловПри взаимодействии с гидроксидами d-металлов образуются
комплексные соединения
H2C
OH
H2C
HC
OH + Cu(OH)2
HC
H2C
OH
H2C
глицерин
HO
H
O
O
Cu
O
O
H
OH
глицерат меди
CH2
CH
CH2 + H2O
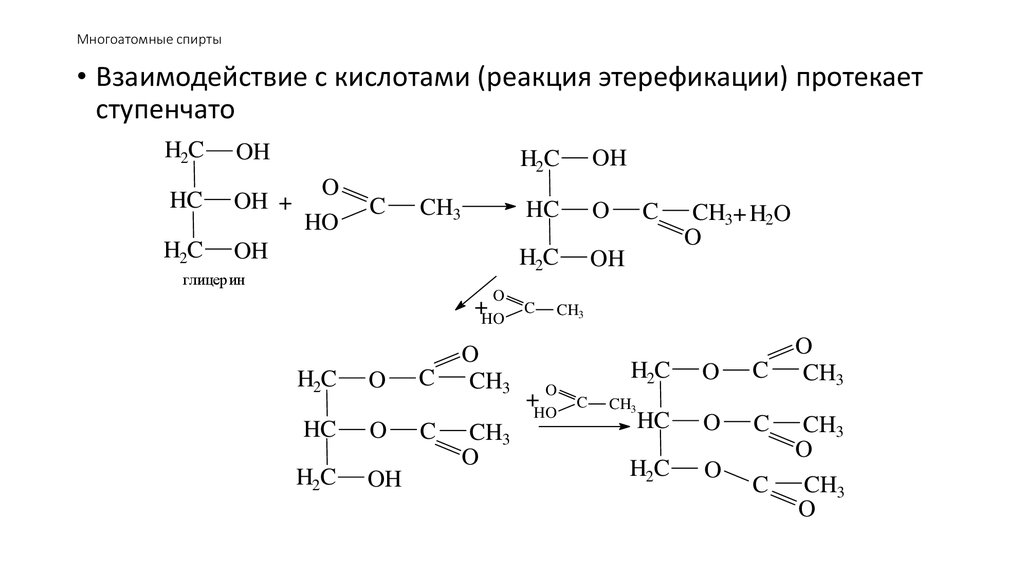
50. Многоатомные спирты
• Взаимодействие с кислотами (реакция этерефикации) протекаетступенчато
H2C
OH
HC
OH +
H2C
OH
O
HO
C
CH3
глицерин
O
+HO
H2C
O
HC
O
H2C
OH
C
C
O
CH3
CH3
O
H2C
OH
HC
O
H2C
OH
C
C
CH3+ H2O
O
CH3
+HOO
H2C
C
O
C
HC
O
C
H2C
O
CH3
C
O
CH3
CH3
O
CH3
O
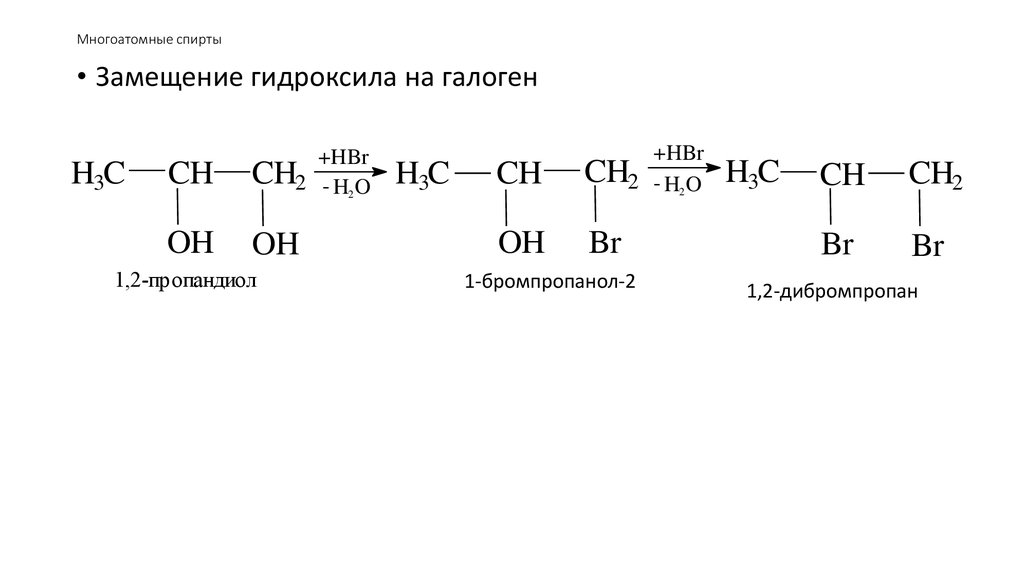
51. Многоатомные спирты
• Замещение гидроксила на галогенH3C
CH
+HBr
CH2 - H2 O
OH
OH
1,2-пропандиол
H3C
CH
+HBr
CH2 - H2 O
OH
Br
1-бромпропанол-2
H3C
CH
CH2
Br
Br
1,2-дибромпропан
52. Многоатомные спирты
• Дегидратация• Межмолекулярная
При нагревании со спиртами в присутствии сильных кислот
(серной или ортофосфорной)
H3C
CH
CH2 + HO
OH
OH
CH3
+
t H
H3C
1,2-пропандиол
- H2 O
t
H
+
CH
CH2 + H2O
OH
O
3-метоксипропанол-2
H3C
CH
+ HO
CH2
H3C
O
O
1,2-диметоксипропан
CH3
CH3
CH3
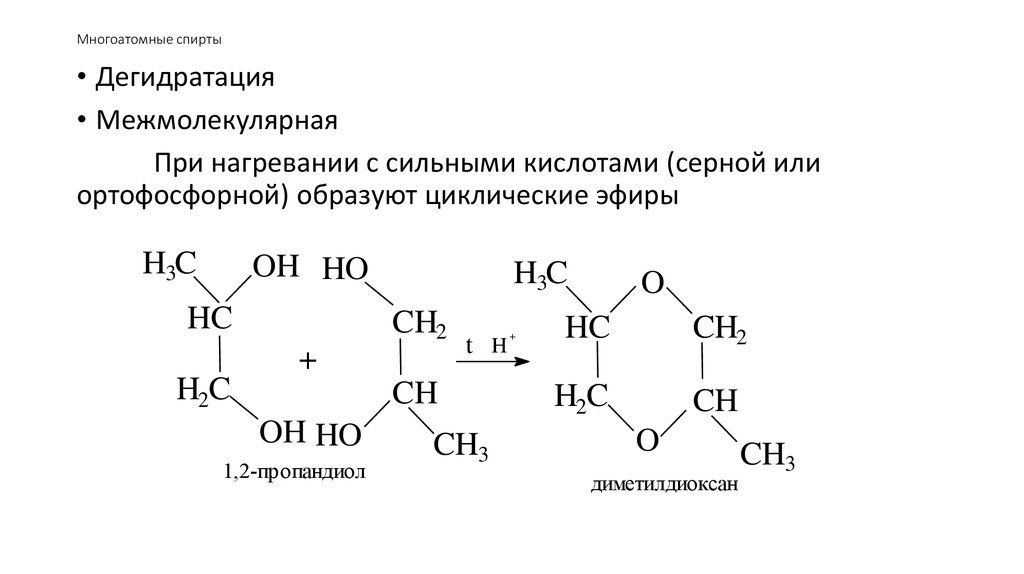
53. Многоатомные спирты
• Дегидратация• Межмолекулярная
При нагревании с сильными кислотами (серной или
ортофосфорной) образуют циклические эфиры
H3C
OH HO
HC
H3C
CH2
+
H2C
+
t H
CH
OH HO
1,2-пропандиол
CH3
O
HC
CH2
H2C
CH
O
диметилдиоксан
CH3
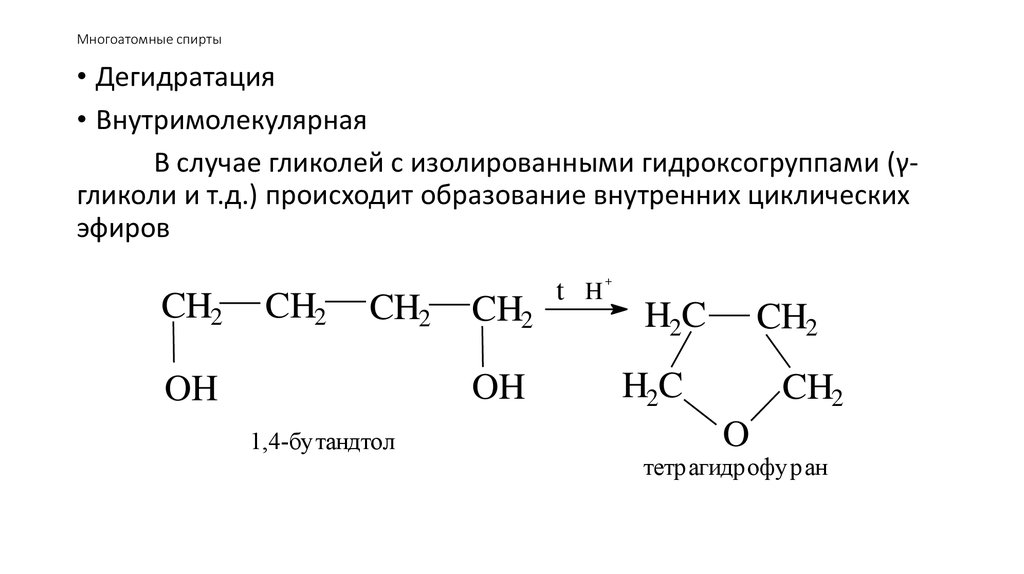
54. Многоатомные спирты
• Дегидратация• Внутримолекулярная
В случае гликолей с изолированными гидроксогруппами (γгликоли и т.д.) происходит образование внутренних циклических
эфиров
CH2
CH2
CH2
CH2
OH
OH
1,4-бутандтол
+
t H
H2C
CH2
H2C
CH2
O
тетрагидрофуран
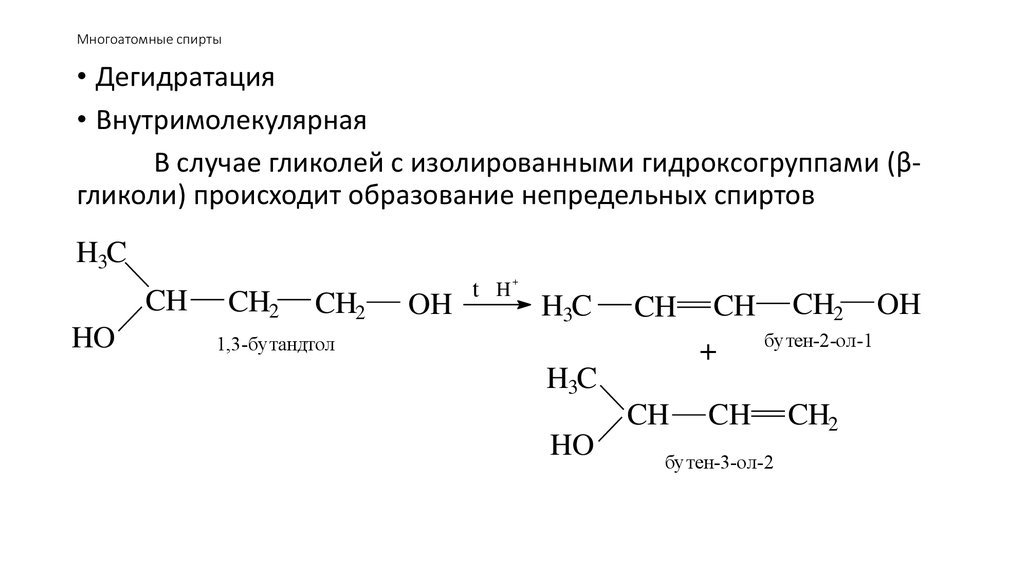
55. Многоатомные спирты
• Дегидратация• Внутримолекулярная
В случае гликолей с изолированными гидроксогруппами (βгликоли) происходит образование непредельных спиртов
H3C
CH
HO
CH2
CH2
OH
+
t H
H3C
CH
CH CH2 OH
бутен-2-ол-1
+
CH
CH
1,3-бутандтол
H3C
HO
бутен-3-ол-2
CH2
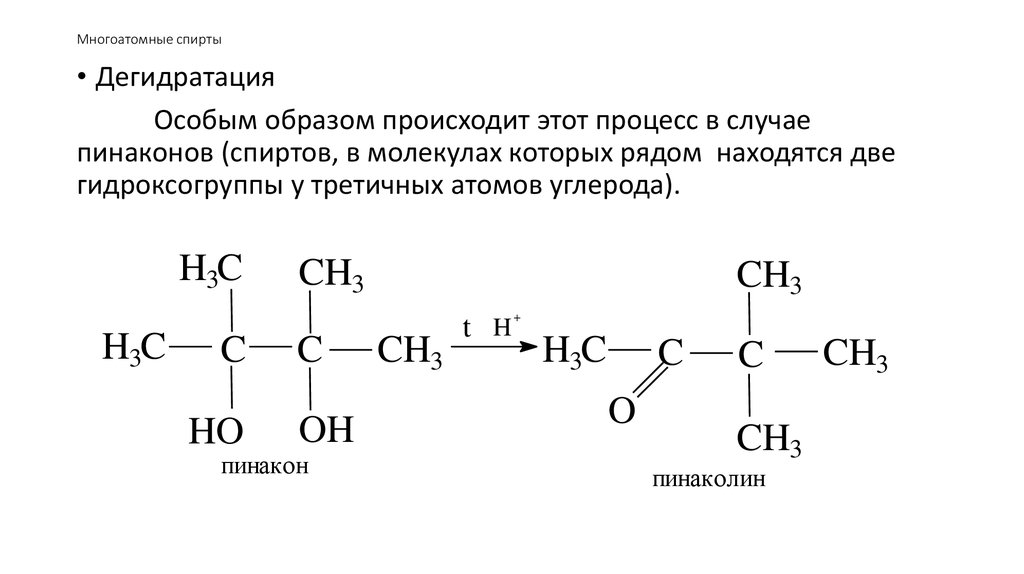
56. Многоатомные спирты
• ДегидратацияОсобым образом происходит этот процесс в случае
пинаконов (спиртов, в молекулах которых рядом находятся две
гидроксогруппы у третичных атомов углерода).
H3C
H3C
C
HO
CH3
C
OH
пинакон
CH3
CH3
t H
+
H3C
C
O
C
CH3
пинаколин
CH3
57. Многоатомные спирты
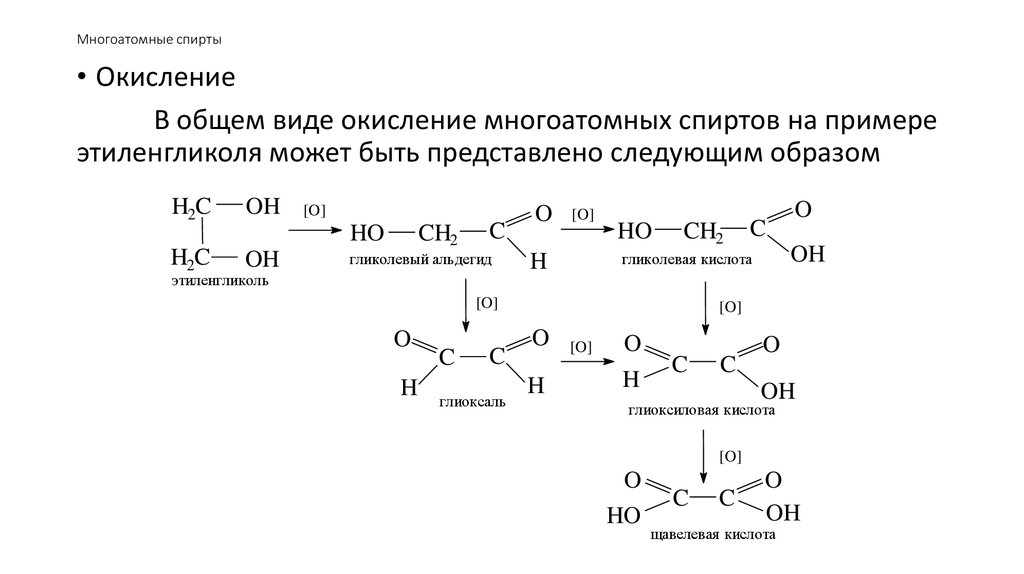
• ОкислениеВ общем виде окисление многоатомных спиртов на примере
этиленгликоля может быть представлено следующим образом
H2C
OH
[O]
HO
H2C
OH
CH2
C
гликолевый альдегид
этиленгликоль
O
[O]
HO
CH2
H
C
C
глиоксаль
OH
гликолевая кислота
H
[O]
O
C
O
[O]
O
H
[O]
O
H
C
C
O
OH
глиоксиловая кислота
[O]
O
HO
C
C
O
OH
щавелевая кислота
58. Многоатомные спирты
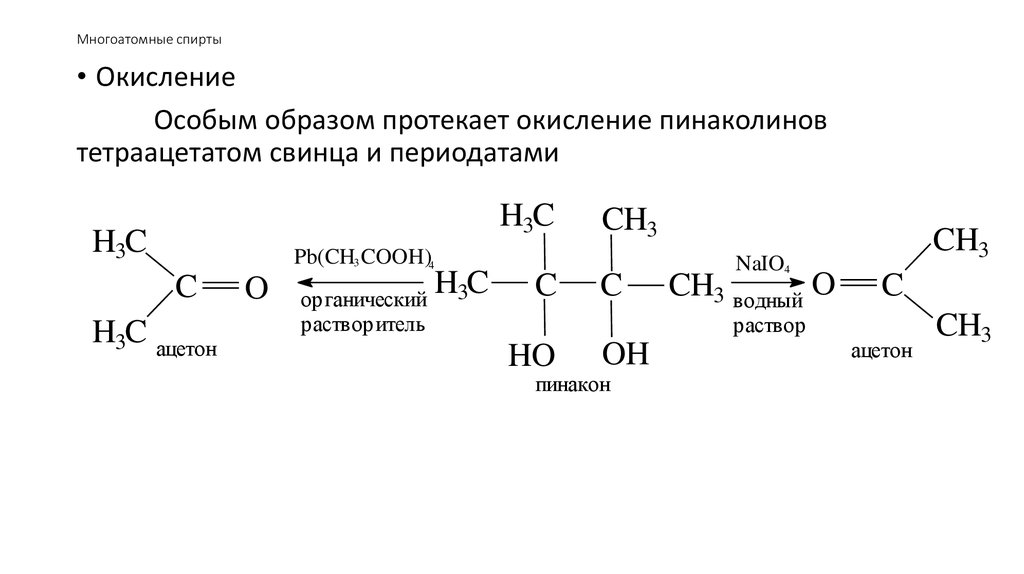
• ОкислениеОсобым образом протекает окисление пинаколинов
тетраацетатом свинца и периодатами
H3C
H3C
CH3
Pb(CH3 COOH)4
C
H3C ацетон
O
органический
растворитель
H3C
C
C
NaIO4
CH3 водный O
CH3
C
раствор
HO
OH
пинакон
ацетон
CH3
59.
Отдельные представители спиртов60.
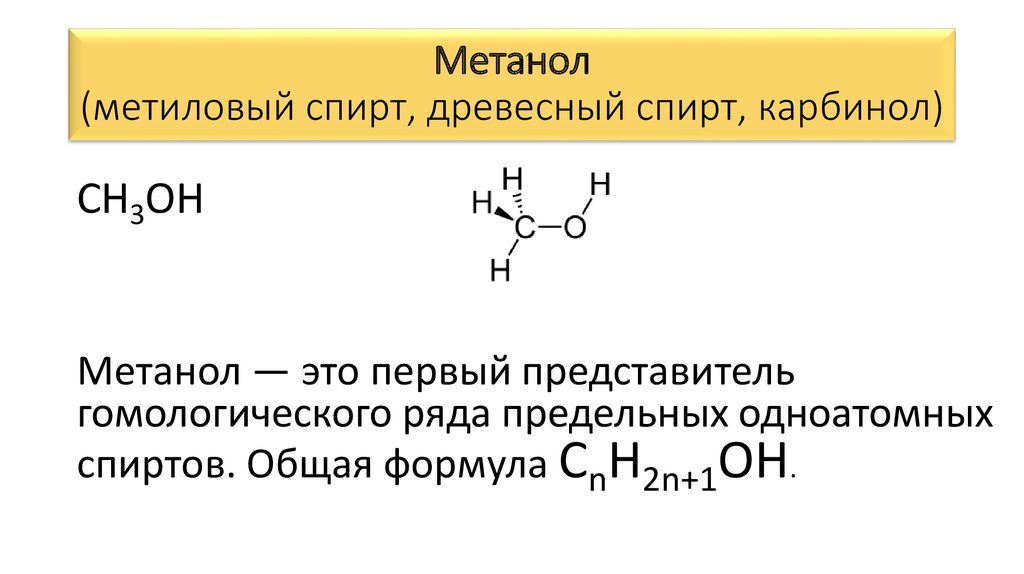
Метанол(метиловый спирт, древесный спирт, карбинол)
CH3OH
Метанол — это первый представитель
гомологического ряда предельных одноатомных
спиртов. Общая формула СnH2n+1OH.
61.
Метанол-жидкость без цвета с температурой кипения 64 0С,
с характерным запахом, легче воды, горит бесцветным
пламенем.
С воздухом в объёмных концентрациях 6,72—36,5 %
образует взрывоопасные смеси (температура вспышки
15,6 °C).
Метанол смешивается в любых соотношениях с водой и
большинством органических растворителей.
62.
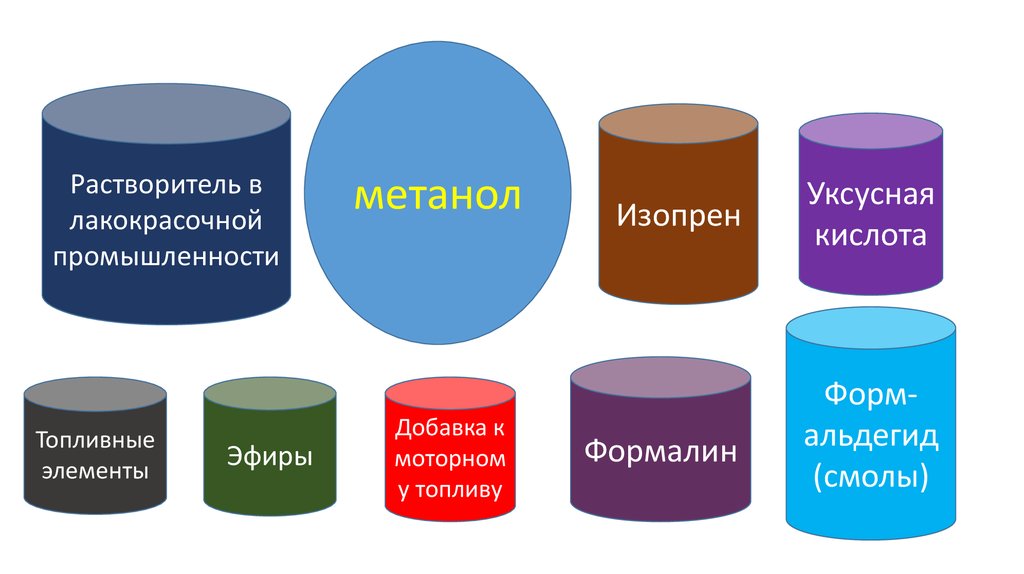
ПРИМЕНЕНИЕметилового спирта
63.
Растворитель влакокрасочной
промышленности
Топливные
элементы
Эфиры
метанол
Добавка к
моторном
у топливу
Изопрен
Уксусная
кислота
Формалин
Формальдегид
(смолы)
64.
В газовой промышленности используетсядля борьбы с образованием гидратов.
(При добыче газа гидраты могут
образовываться в стволах скважин,
промышленных коммуникациях и
магистральных газопроводах. Отлагаясь на
стенках труб, гидраты резко уменьшают их
пропускную способность. )
65.
Во многих странах метанол применяется в качестведобавки к этиловому спирту при производстве
парфюмерии.
В России использование метанола в потребительских
товарах запрещено.
66.
Метанол — опаснейший яд, приём внутрь5—10 мл метанола приводит к тяжёлому
отравлению и слепоте, а 30 граммов и
более — к смерти.
ПДК метанола в воздухе рабочей зоны
равна 5 мг/м³
(у этанола — 1000 мг/м³).
67. Этиловый спирт (Этанол)
68.
Этанол-бесцветная жидкость с характерным запахом ижгучим вкусом, температурой кипения78 0С.
Легче воды. Смешивается с ней в любых отношениях.
Легко воспламеняется, горит слабо светящимся
голубоватым пламенем.
69.
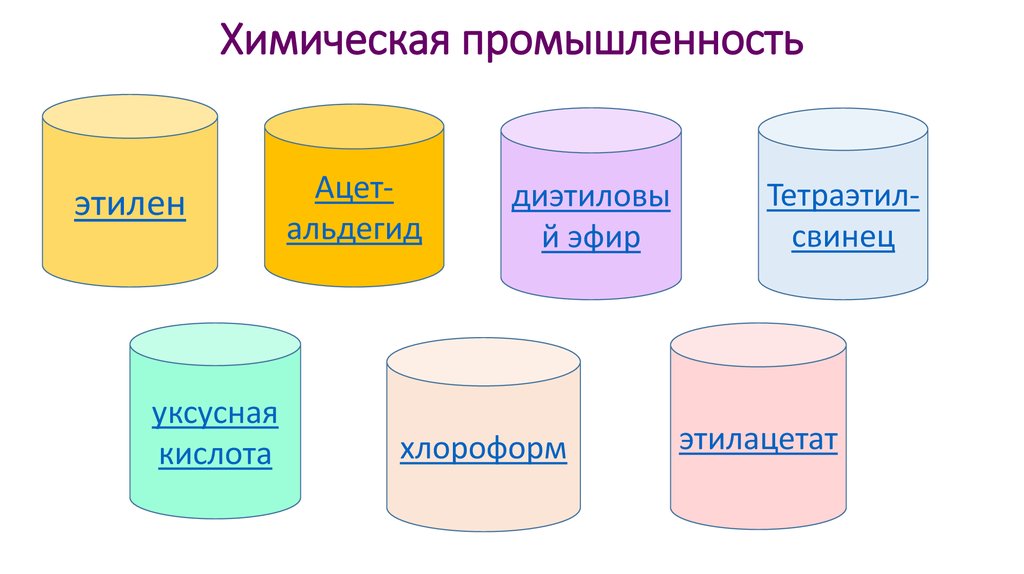
Применение этанола70. Химическая промышленность
этиленуксусная
кислота
Ацетальдегид
диэтиловы
й эфир
хлороформ
Тетраэтилсвинец
этилацетат
71. Растворитель
• В лакокрасочной промышленности,• в производстве товаров бытовой химии (в
чистящих и моющих средствах, в
особенности для ухода за стеклом и
сантехникой) ;
• является компонентом антифризов и
стеклоомывателей;
• получение репеллентов
72. Парфюмерия и косметика
Является универсальнымрастворителем различных
веществ и основным
компонентом духов, аэрозолей.
Входит в состав зубных паст,
шампуни, средств для душа.
73.
• Этиловый спирт также используется как топливо.• Применяется для консервирования биологических препаратов.
• Является наполнителем в спиртовых термометрах*.
Этанол
Т пл = -114,3 0С
Т кип = 78,4 0С
Ртуть
Т пл = +2,295 0С
Т кип = 626 0С
74. В медицине
• антисептик;• подсушивающие и дубящие свойства 96%-го этилового
спирта используются для обработки операционного поля
или для обработки рук хирурга;
• растворитель для лекарственных средств, для
приготовления настоек, экстрактов из растительного
сырья и др.;
• пеногаситель при подаче кислорода, искусственной
вентиляции легких;
• в согревающих компрессах;
• компонент общей анестезии в ситуации дефицита
медикаментозных средств;
• противоядие при отравлении некоторыми токсичными
метанолом и этиленгликолем.
75. Пищевая промышленность
• Является основным компонентом спиртных напитков.• В небольших количествах содержится в ряде напитков,
получаемых брожением, но не причисляемых к алкогольным.
• Растворитель для пищевых ароматизаторов.
• Может быть использован как консервант для хлебобулочных
изделий, а также в кондитерской промышленности.
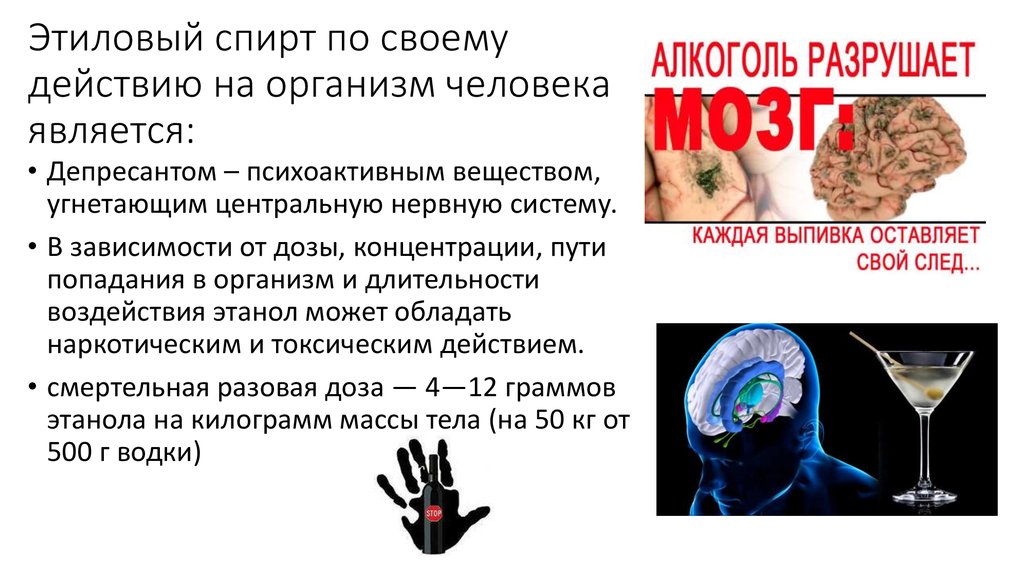
76. Этиловый спирт по своему действию на организм человека является:
• Депресантом – психоактивным веществом,угнетающим центральную нервную систему.
• В зависимости от дозы, концентрации, пути
попадания в организм и длительности
воздействия этанол может обладать
наркотическим и токсическим действием.
• смертельная разовая доза — 4—12 граммов
этанола на килограмм массы тела (на 50 кг от
500 г водки)
77.
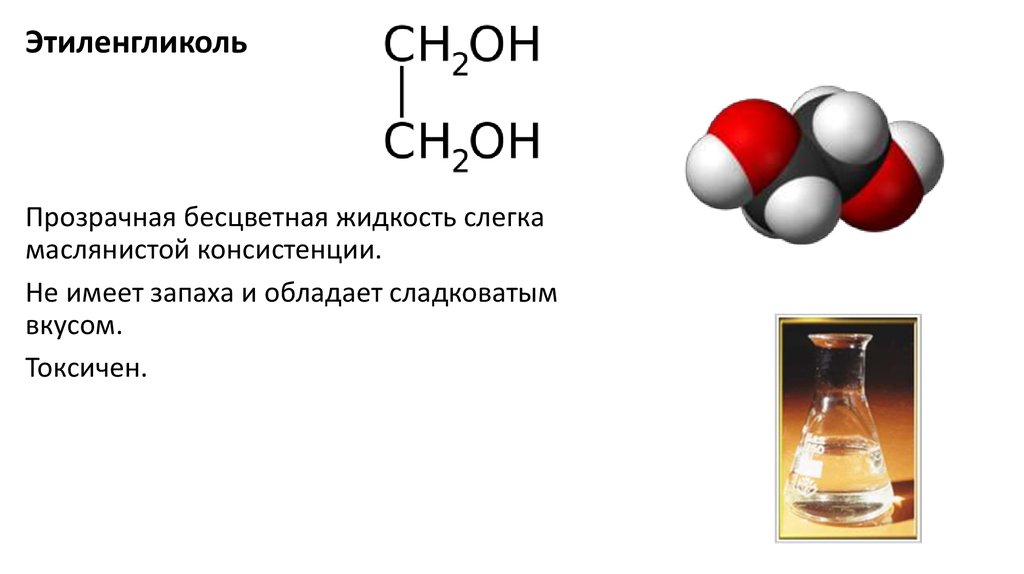
ЭтиленгликольПрозрачная бесцветная жидкость слегка
маслянистой консистенции.
Не имеет запаха и обладает сладковатым
вкусом.
Токсичен.
78. Применение
• Как компонент автомобильных антифризов и тормозныхжидкостей. Смесь 60 % этиленгликоля и 40 % воды замерзает при
−45 °С. Коррозионно активен, поэтому применяется с
ингибиторами коррозии;
• В производстве целофана, полиуританов, лавсана и других
полимеров.
• В качестве теплоносителя в виде раствора в автомобилях, в
системах жидкого охлаждения компьютеров;
• Как растворитель красящих веществ;
79.
• В органическом синтезе для получения многих веществ и каквысокотемпературный растворитель
• Как компонент жидкости «И», используемой для предотвращения
обводнения авиационных топлив.
• Для поглощения воды, для предотвращения образования гидрата
метана.
• Этиленгликоль является исходным сырьём для производства
взрывчатого вещества нитрогликоля.
• Компонент крема для обуви (1—2 %)
• Входит в состав для мытья стёкол
80.
• Этиленгликоль — горючее вещество. Температура вспышки паров120 °C
• Этиленгликоль токсичен. По степени воздействия на организм
относится к веществам 3-го класса опасности. Летальная доза при
однократном употреблении составляет 100—300 мл.
81. Глицерин
- трехатомный предельный спирт.Бесцветная, вязкая, гигроскопичная, сладкая (гликос —
сладкий) на вкус жидкость.
Смешивается с водой в любых отношениях.
82.
Применяется• в производстве взрывчатых
веществ нитроглицерина.
• При обработке кожи.
• Как компонент некоторых клеев.
• При производстве пластмасс
глицерин используют в качестве
пластификатора.
• В производстве кондитерских
изделий и напитков (как пищевая
добавка E422).
83. Гидроксилпроизводные ароматических углеводородов
Фенолы84.
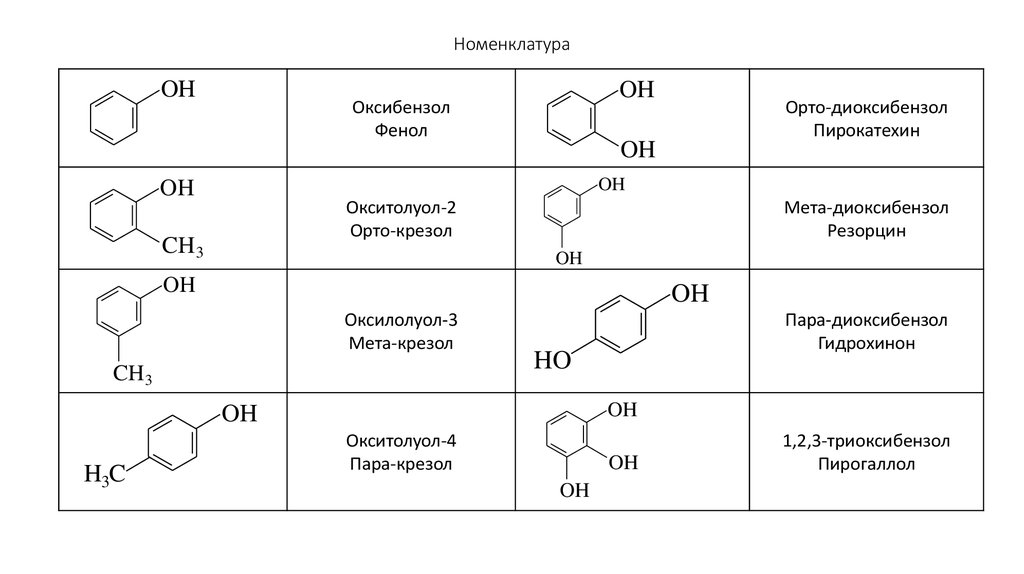
85. Номенклатура
86. Номенклатура
OHOH
Оксибензол
Фенол
OH
OH
OH
Окситолуол-2
Орто-крезол
CH 3
Мета-диоксибензол
Резорцин
OH
OH
OH
Оксилолуол-3
Мета-крезол
CH 3
Пара-диоксибензол
Гидрохинон
HO
OH
OH
H3C
Орто-диоксибензол
Пирокатехин
Окситолуол-4
Пара-крезол
OH
OH
1,2,3-триоксибензол
Пирогаллол
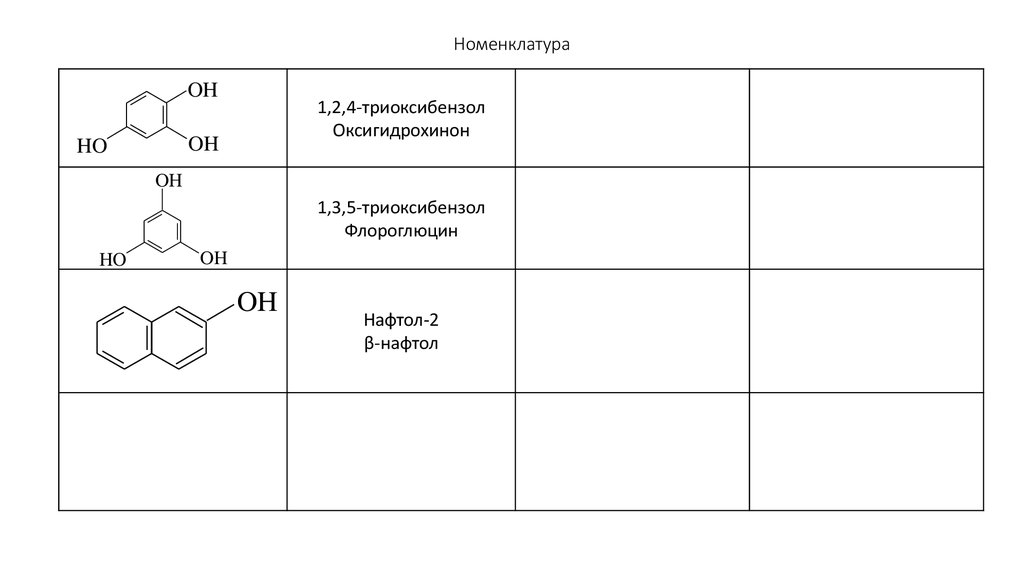
87. Номенклатура
OH1,2,4-триоксибензол
Оксигидрохинон
OH
HO
OH
1,3,5-триоксибензол
Флороглюцин
HO
OH
OH
Нафтол-2
β-нафтол
88. Изомерия
Положения гидроксильных группСтроения и положения заместителей
Межклассовая изомерия
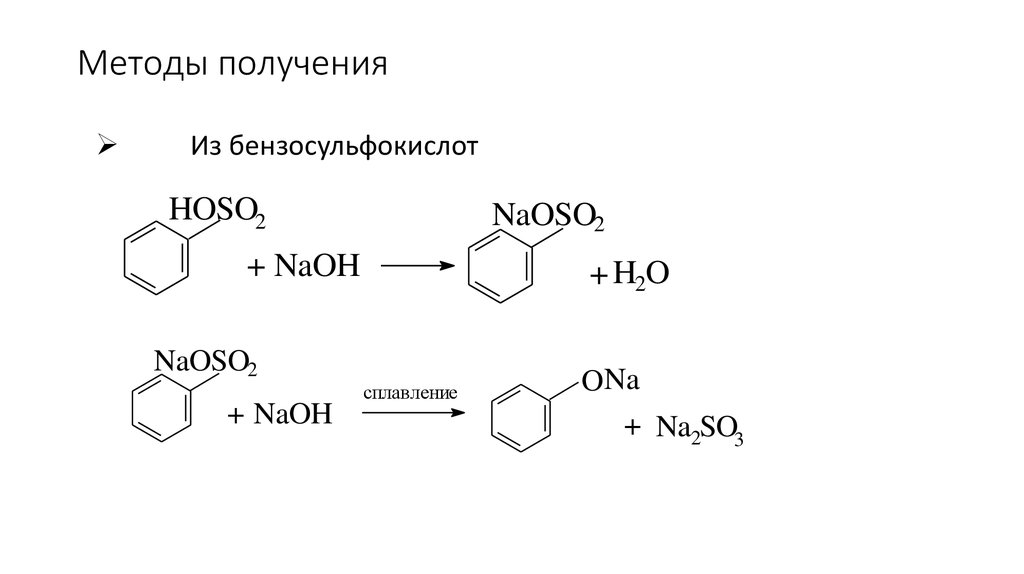
89. Методы получения
Из бензосульфокислотHOSO2
NaOSO2
+ NaOH
+ H2O
NaOSO2
+ NaOH
сплавление
ONa
+ Na2SO3
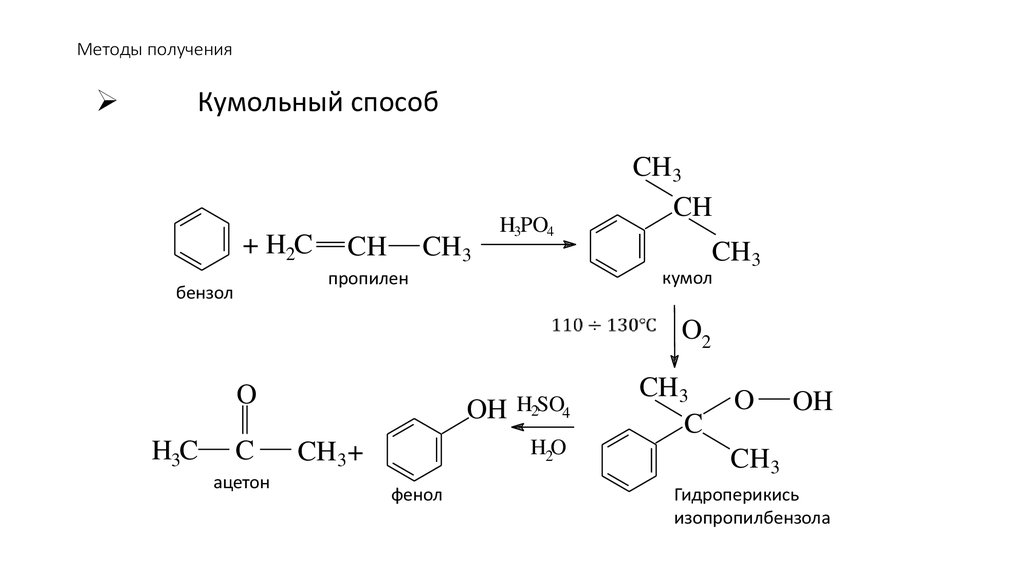
90. Методы получения
Кумольный способ+ H2C
CH
CH3
H3PO4
CH3
кумол
пропилен
бензол
CH3
CH
O2
O
H3C
C
ацетон
OH
H2SO4
H2O
CH3 +
фенол
CH3
C
O
OH
CH3
Гидроперикись
изопропилбензола
91. Методы получения
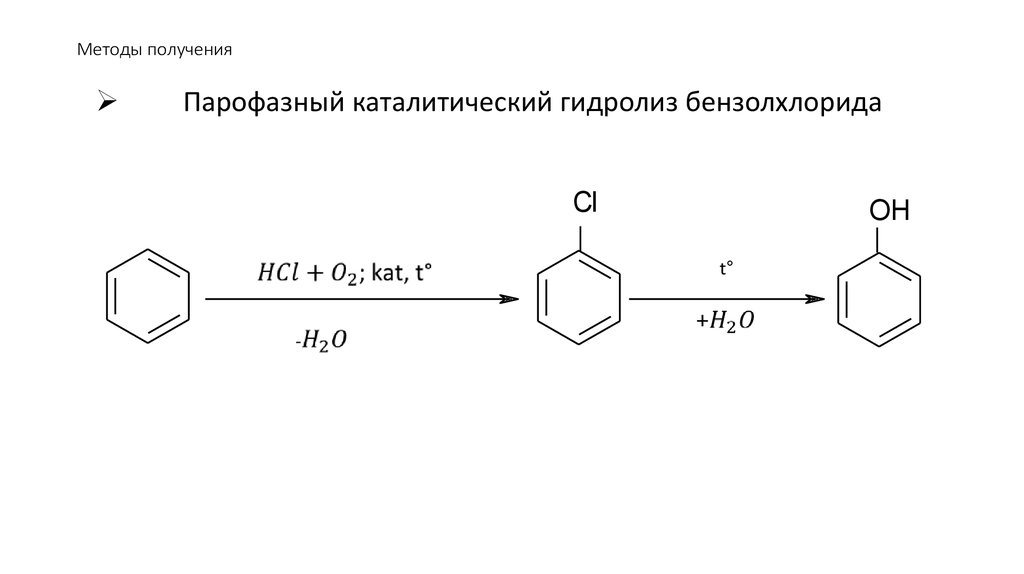
Парофазный каталитический гидролиз бензолхлоридаCl
OH
t°
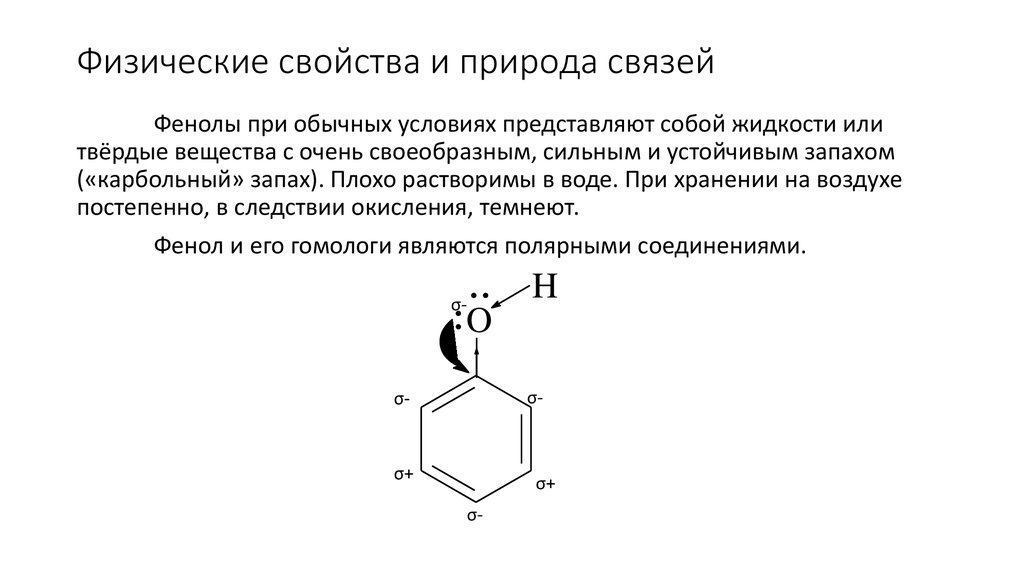
92. Физические свойства и природа связей
Фенолы при обычных условиях представляют собой жидкости илитвёрдые вещества с очень своеобразным, сильным и устойчивым запахом
(«карбольный» запах). Плохо растворимы в воде. При хранении на воздухе
постепенно, в следствии окисления, темнеют.
Фенол и его гомологи являются полярными соединениями.
..
.. O
σ-
H
σ-
σ-
σ+
σ+
σ-
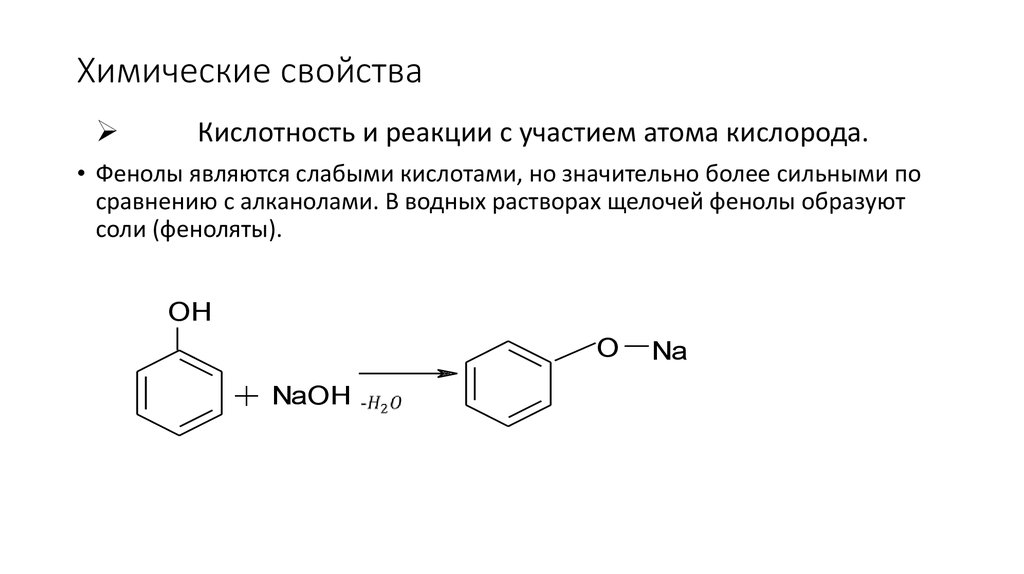
93. Химические свойства
Кислотность и реакции с участием атома кислорода.• Фенолы являются слабыми кислотами, но значительно более сильными по
сравнению с алканолами. В водных растворах щелочей фенолы образуют
соли (феноляты).
OH
O
+
NaOH
Na
94. Химические свойства. Кислотность и реакции с участием атома кислорода.
• Фенолы имеют очень характерную цветную реакцию: в водных растворах сFeCl3 они дают красно-фиолетовое окрашивание, которое исчезает после
прибавления сильной кислоты или этанола.
95. Химические свойства. Кислотность и реакции с участием атома кислорода.
• Алкилирование96. Химические свойства. Кислотность и реакции с участием атома кислорода.
• Ацилирование97. Химические свойства.
Окисление.98. Химические свойства.
Реакции с электрофильными реагентами.• Галогенирование.
















































 Химия
Химия








