Похожие презентации:
Спирты. Состав и строение спиртов
1. Лекция “Спирты”
2. План:
1.2.
3.
4.
5.
Классификация, номенклатура, изомерия.
Методы получения спиртов.
Химические свойства.
Особенности многоатомных спиртов.
Применение.
3. Спирты –
это органические соединения, вмолекулах которых одна или
несколько групп —ОН соединены с
углеводородным радикалом.
R(OH)n≥1
4. 1.Классификация, номенклатура, изомерия
5. 1. Классификация спиртов по количеству гидроксильных групп
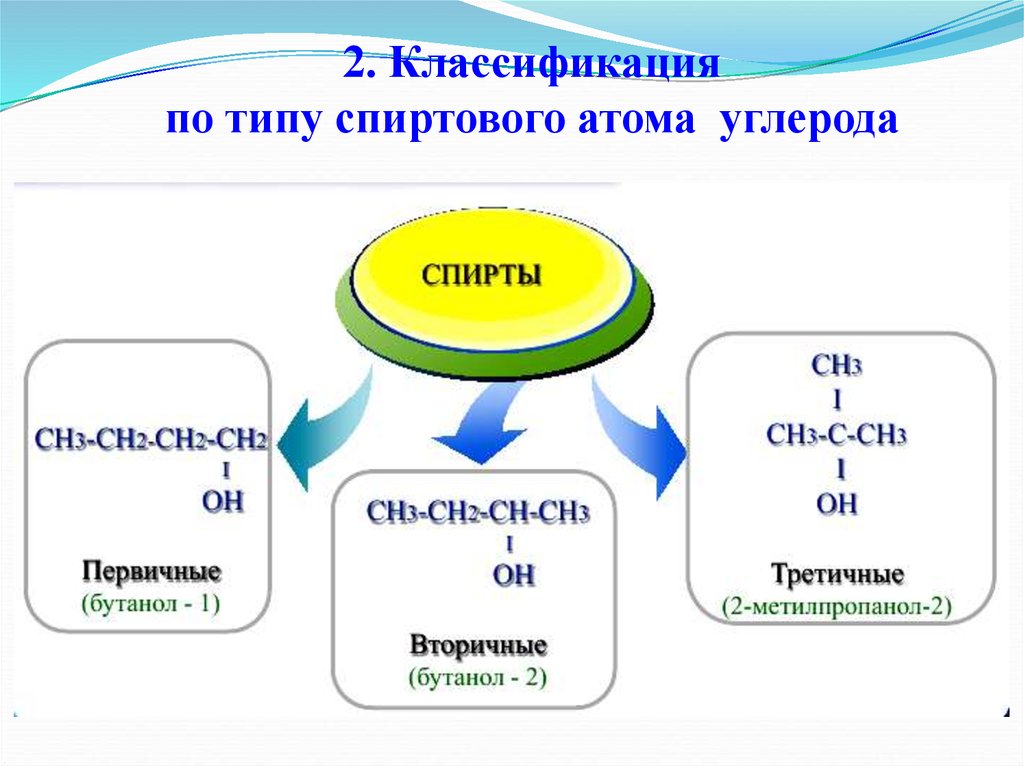
1) Одноатомные спирты (моноолы)CH3 CH2 OH
2) Двухатомные спирты (диолы)
CH3 CH OH
OH
этандиол-1,1
CH2 OH
CH2 CH2
CH3 CH CH2
OH
OH OH
OH OH
метандиол
этандиол-1,2
(этиленгликоль)
пропандиол-1,2
(пропиленгликоль)
6.
3) Многоатомные спиртыCH2 CH CH2
CH2 CH CH CH2
OH OH OH
OH OH OH OH
пропантриол-1,2,3
(глицерин)
бутантетраол-1,2,3,4
(эритрит)
7. 2. Классификация по типу спиртового атома углерода
8. Номенклатура
формулаCH3 OH
тривиальное
название
древесный спирт
CH3 CH CH3
OH
название по ИЮПАК
метиловый спирт
метанол
этиловый спирт
этанол
-
пропиловый спирт
пропанол-1
-
изопропиловый спирт
пропанол-2
CH3 CH2 OH винный спирт
CH3 CH2 CH2 OH
радикальнофункциональное
название
9. Номенклатура
CH3CH3 CH CH2 CH2 OH
CH2 CH CH2 CH2 OH
бутен-3-ол-1
3-метилбутанол-1
CH3 CH COOH
OH
2-гидроксипропановая кислота
2-оксипропановая кислота
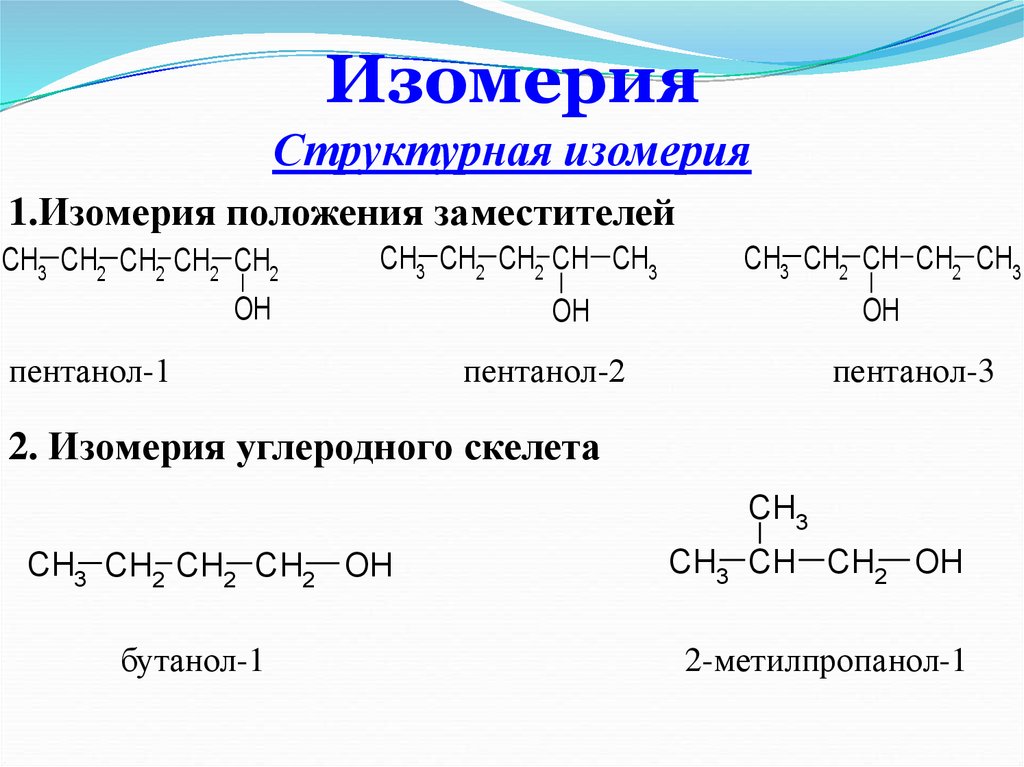
10. Изомерия
Структурная изомерия1.Изомерия положения заместителей
CH3 CH2 CH2 CH2 CH2
CH3 CH2 CH2 CH CH3
OH
пентанол-1
CH3 CH2 CH CH2 CH3
OH
OH
пентанол-2
пентанол-3
2. Изомерия углеродного скелета
CH3
CH3 CH2 CH2 CH2 OH
бутанол-1
CH3 CH CH2 OH
2-метилпропанол-1
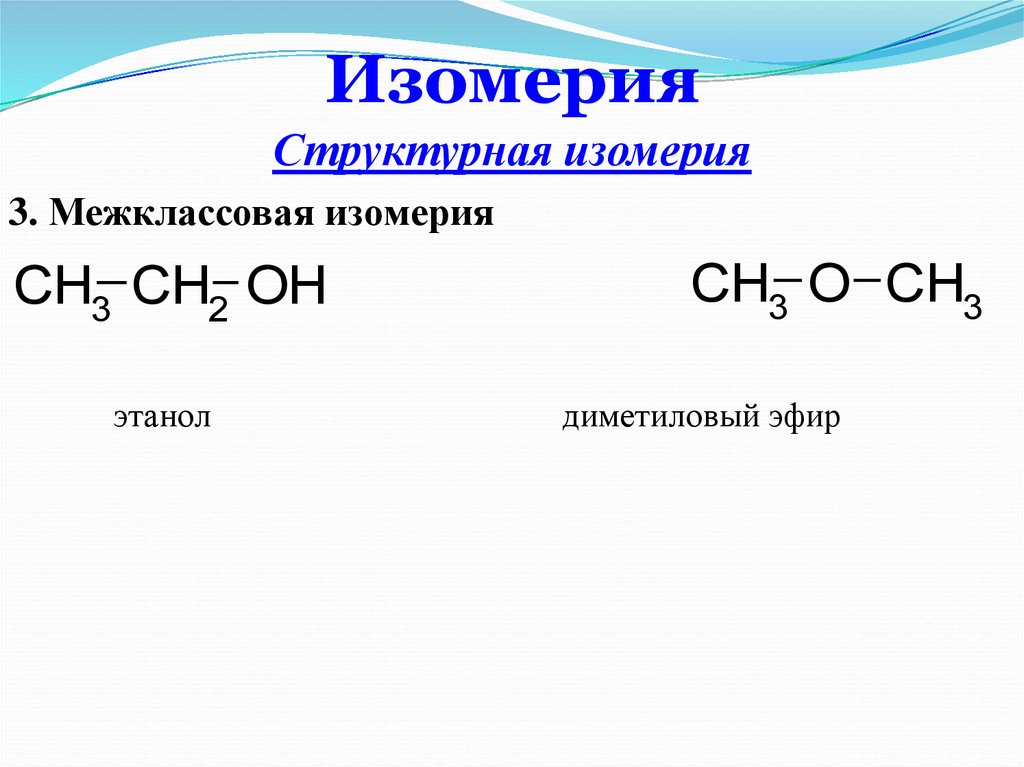
11. Изомерия
Структурная изомерия3. Межклассовая изомерия
CH3 CH2 OH
этанол
CH3 O CH3
диметиловый эфир
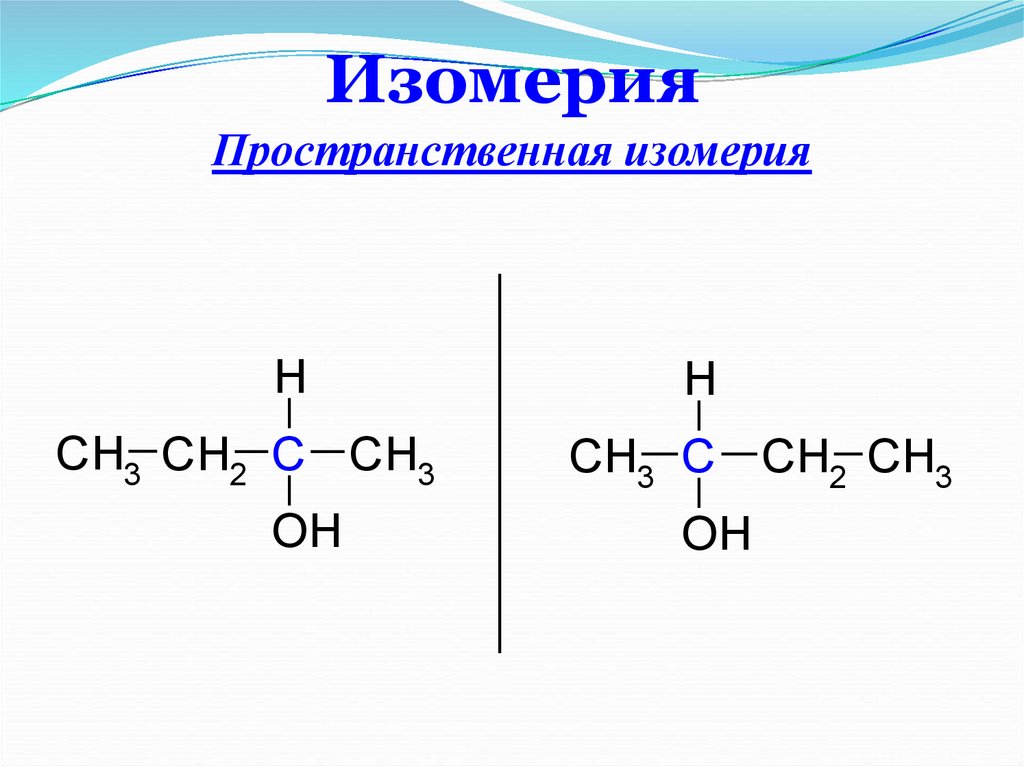
12. Изомерия
Пространственная изомерияH
CH3 CH2 C CH3
OH
H
CH3 C CH2 CH3
OH
13. Физические и биологические свойства
•Гидроксигруппа является сильно полярной группой, поэтомунизшие спирты растворяются в воде неограниченно: метанол,
этанол, пропанол смешиваются с водой во всех отношениях.
14. Физические и биологические свойства
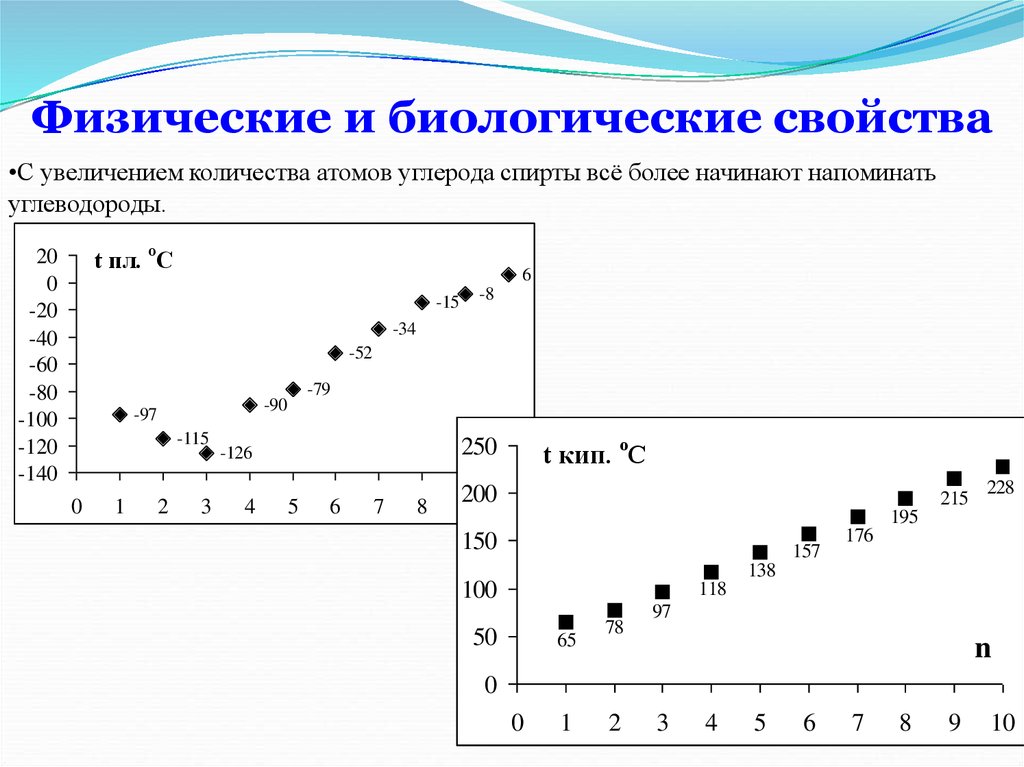
•С увеличением количества атомов углерода спирты всё более начинают напоминатьуглеводороды.
t пл. оС
20
0
-20
-40
-60
-80
-100
-120
-140
6
-15
-8
-34
-52
-97
-115
0
1
-79
-90
2
3
4
t кип. оС
250
n
-126
5
6
7
8
200
9 10
215
228
195
150
157
176
138
100
118
50
65
78
97
n
0
0
1
2
3
4
5
6
7
8
9
10
15. 2. Методы получения спиртов
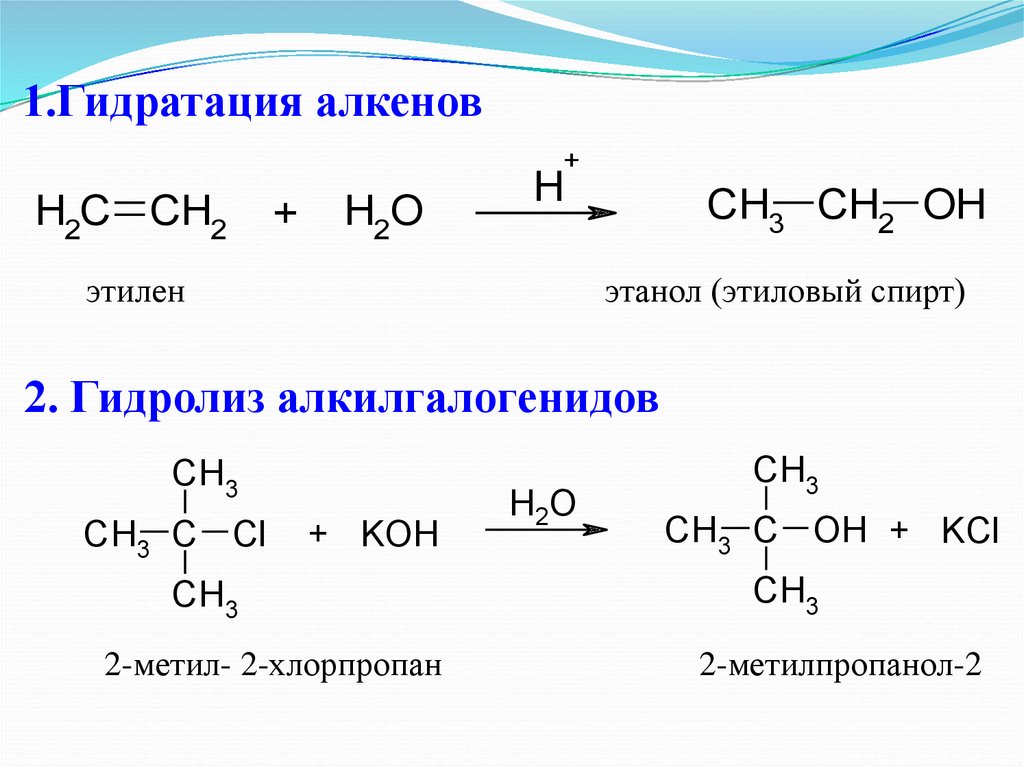
16. 1.Гидратация алкенов
+H2C CH2
+
H2O
H
этилен
CH3 CH2 OH
этанол (этиловый спирт)
2. Гидролиз алкилгалогенидов
CH3
CH3 C Cl
+ KOH
CH3
2-метил- 2-хлорпропан
H2O
CH3
CH3 C OH + KCl
CH3
2-метилпропанол-2
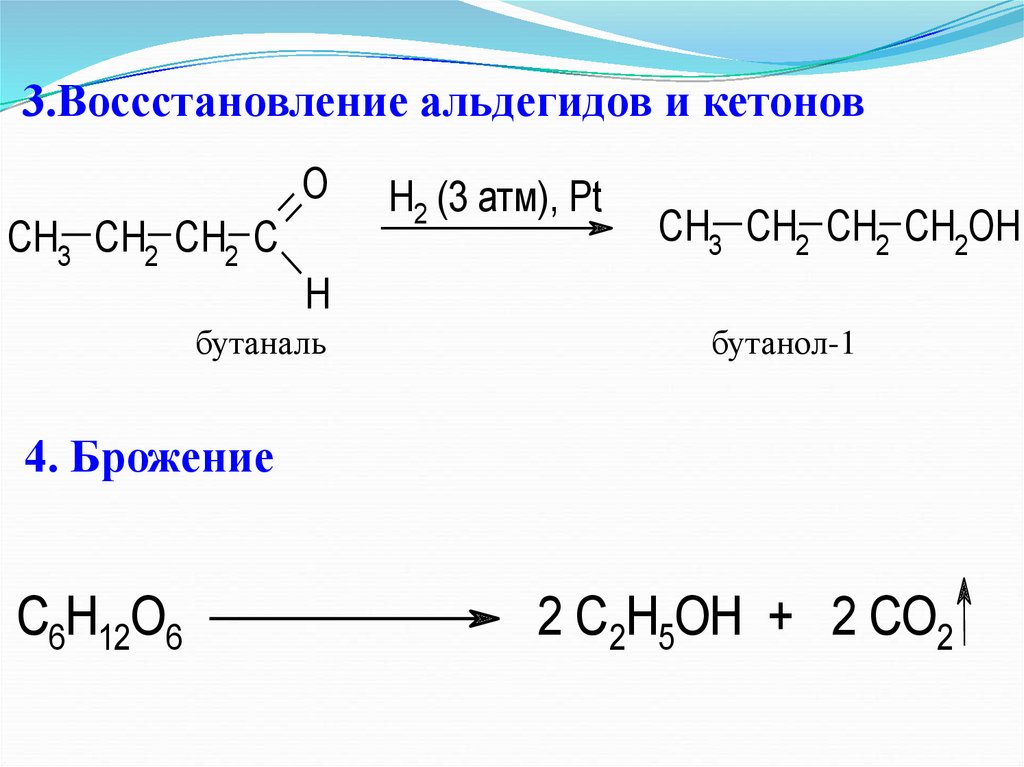
17. 3.Воссстановление альдегидов и кетонов
OCH3 CH2 CH2 C
H2 (3 атм), Pt
CH3 CH2 CH2 CH2OH
H
бутаналь
бутанол-1
4. Брожение
C6H12O6
2 C2H5OH + 2 CO2
18. 5. Получение диолов
Реакция ВагнераH2C
CH2
KMnO4 OH-MnO2
этен
H2C
CH2
HO
OH
этандиол-1,2
Реакция Прилежаева
CH3
t, кат.
CH3
-H2
этан
CH2 O2, Ag, 250 oC
H2C
CH2
H2C
этилен
+
O
этиленоксид
H2O , H
CH2 OH
CH2 OH
этиленгликоль
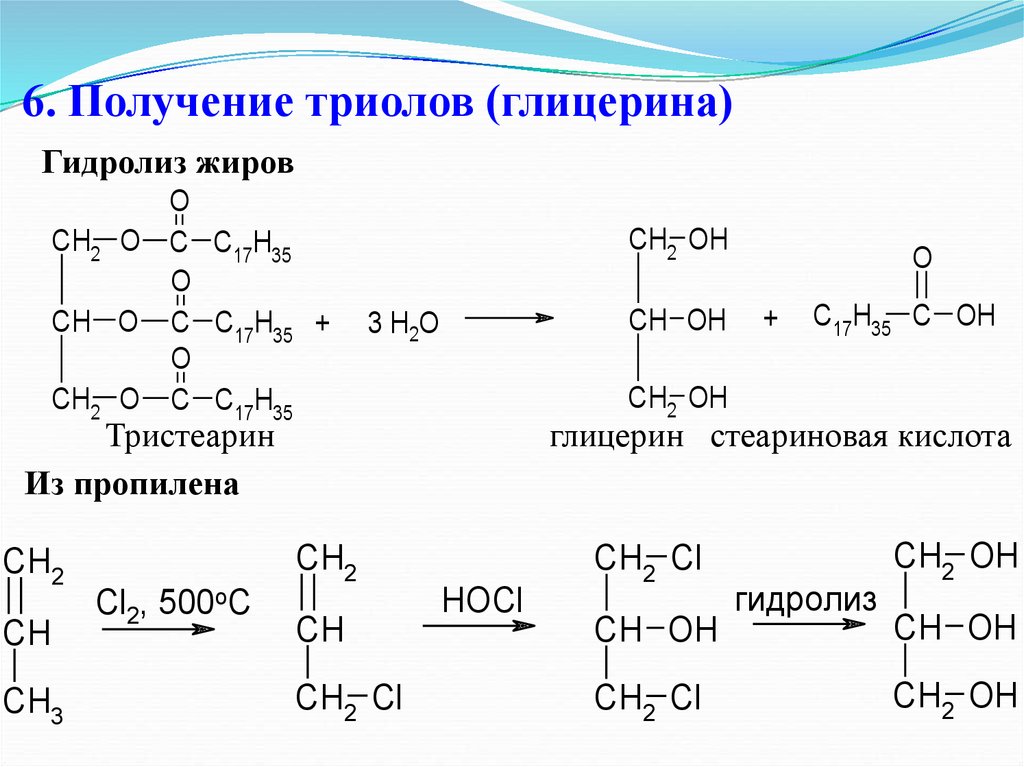
19. 6. Получение триолов (глицерина)
Гидролиз жировO
CH2 O C C17H35
O
CH O C C17H35 +
O
CH2 O C C17H35
CH2 OH
CH OH
3 H2O
CH
CH3
CH
CH2 Cl
C17H35 C OH
глицерин стеариновая кислота
CH2
Cl2, 500oC
+
CH2 OH
Тристеарин
Из пропилена
CH2
O
CH2 Cl
HOCl
CH OH
CH2 Cl
гидролиз
CH2 OH
CH OH
CH2 OH
20. 3.Химические свойства
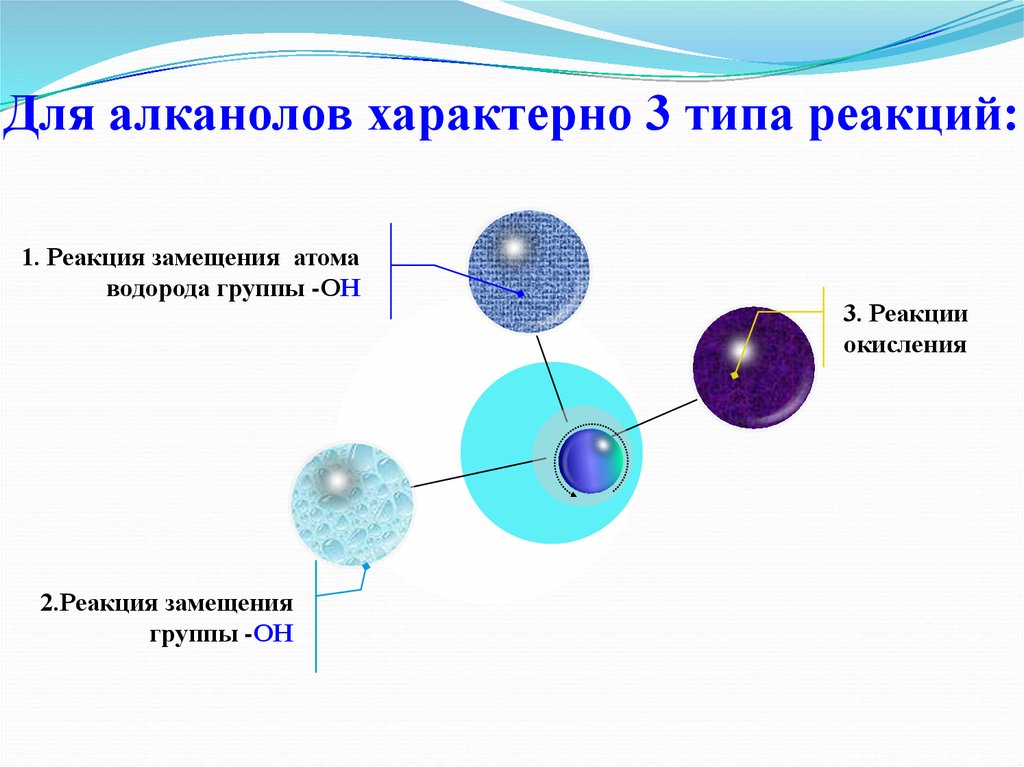
21. Для алканолов характерно 3 типа реакций:
1. Реакция замещения атомаводорода группы -ОН
2.Реакция замещения
группы -ОН
3. Реакции
окисления
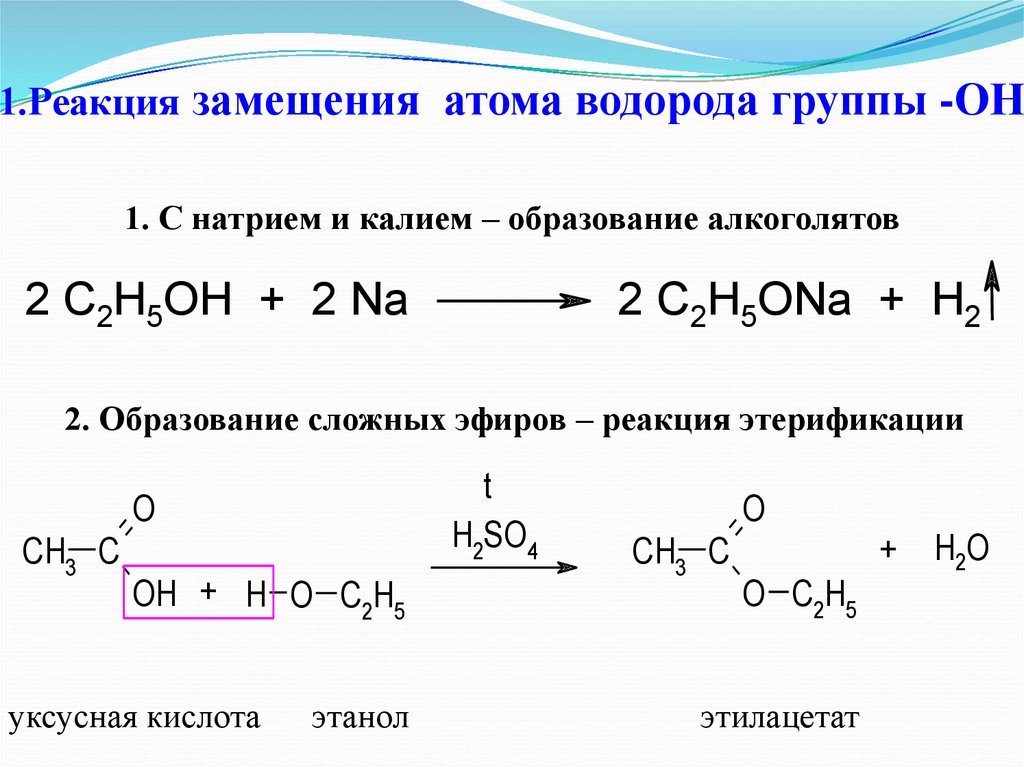
22. 1.Реакция замещения атома водорода группы -ОН
1. С натрием и калием – образование алкоголятов2 C2H5OH + 2 Na
2 C2H5ONa + H2
2. Образование сложных эфиров – реакция этерификации
t
H2SO4
O
CH3 C
OH + H O C2H5
уксусная кислота
этанол
O
CH3 C
+
O C2H5
этилацетат
H2O
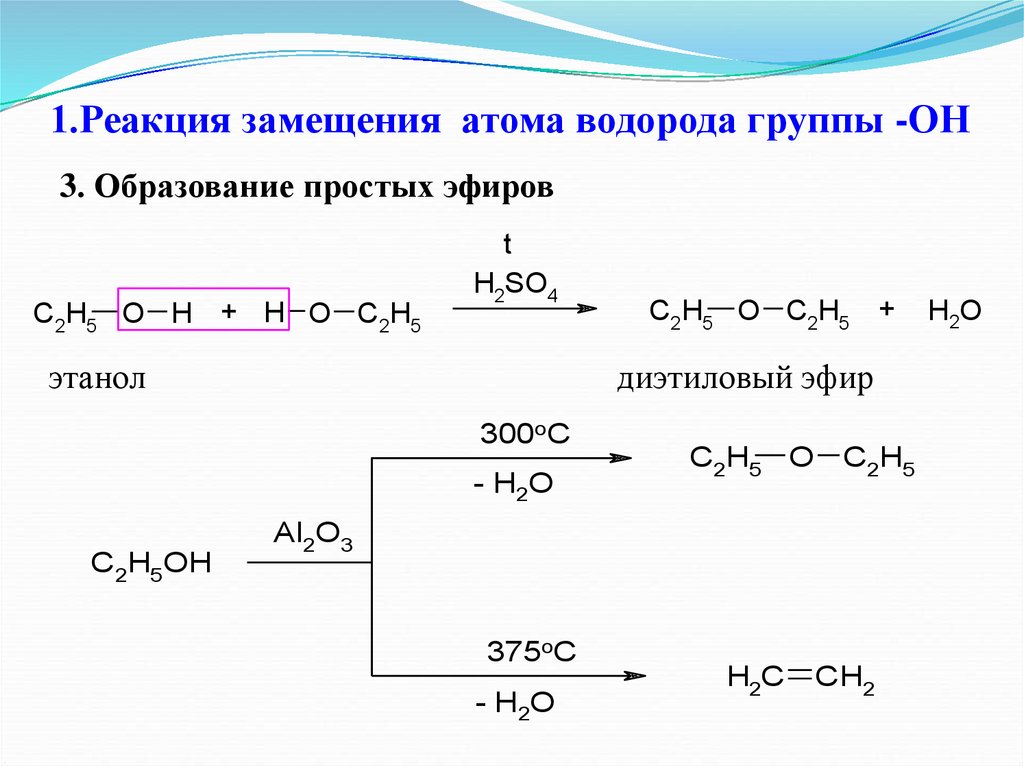
23. 1.Реакция замещения атома водорода группы -ОН
3. Образование простых эфировC2H5 O H + H O C2H5
t
H2SO4
этанол
диэтиловый эфир
300oC
- H2O
C2H5OH
C2H5 O C2H5 +
C2H5 O C2H5
Al2O3
375oC
- H2O
H2C
CH2
H2O
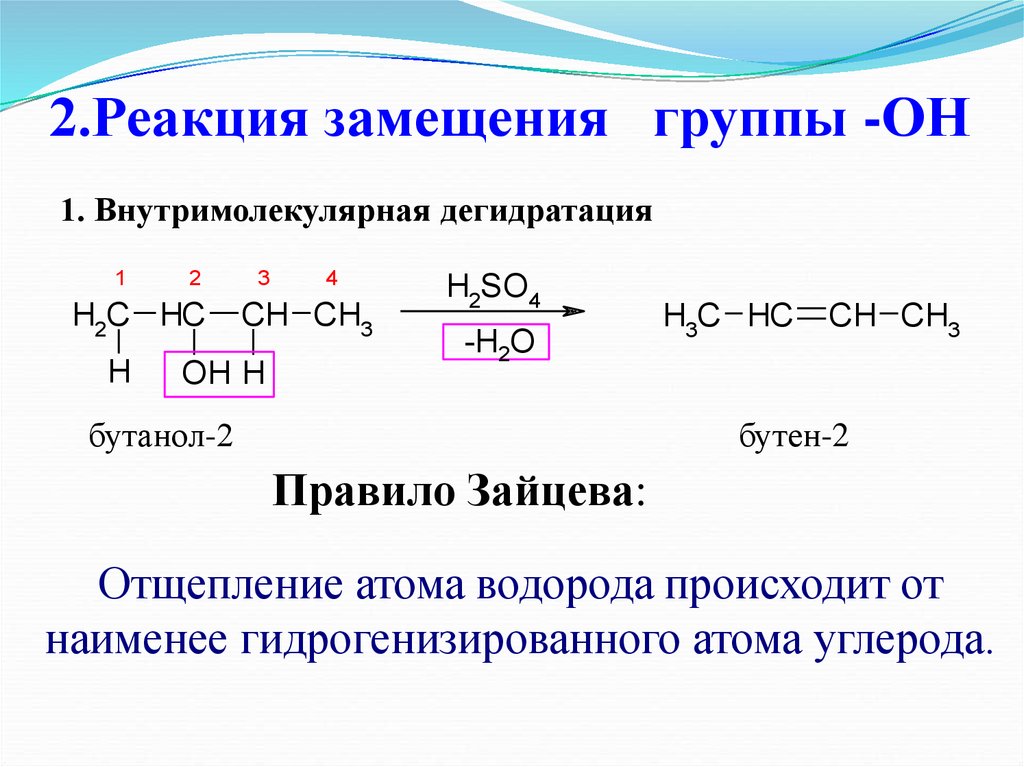
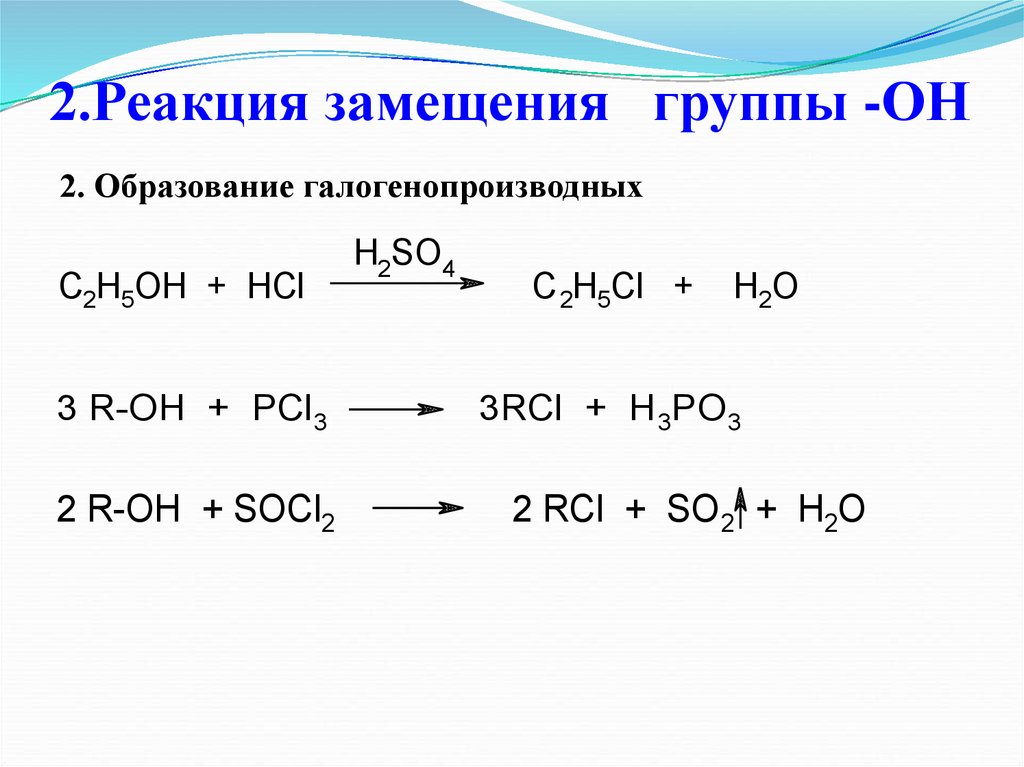
24. 2.Реакция замещения группы -ОН
1. Внутримолекулярная дегидратация1
2
H2C HC
H
3
4
CH CH3
OH H
H2SO4
-H2O
бутанол-2
H3C HC
CH CH3
бутен-2
Правило Зайцева:
Отщепление атома водорода происходит от
наименее гидрогенизированного атома углерода.
25. 2.Реакция замещения группы -ОН
C2H5OH + HCl2
4
C 2H5Cl +
H2O
C2H5OH + HBrзамещения
C 2H5Br
+ H2O -ОН
2.Реакция
группы
H2SO4
2. Образование галогенопроизводных
3CR-OH
++PCl
H
OH
HCl
3
2 5
C2H5OH + HCl
CR-OH
HBr
2H5OH+ +PCl
5
C2H5OH + HBr
3 R-OH
R-OH ++ PI
PCl
3 3
H2SO4
3RCl +C HH3PO
2 5Cl 3 +
H2O
C 2H5Cl + H2O
+ H O
RCl + C
POCl
2H5Br
3 + HCl 2
C 2H5Br + H2O
33RCl
RI + +H3H
PO
3PO
3 3
3 R-OH + PCl3
R-OH ++ SOCl
PCl52
2 R-OH
3RCl + H3PO3
RCl
+ POCl
2 RCl
+ SO
H2O
3 2 ++ HCl
R-OH + PCl5
3 R-OH + PI3
RCl + POCl3 + HCl
3 RI + H3PO3
3 R-OH + PI3
2 R-OH + SOCl2
3 RI + H3PO3
2 RCl + SO 2 + H2O
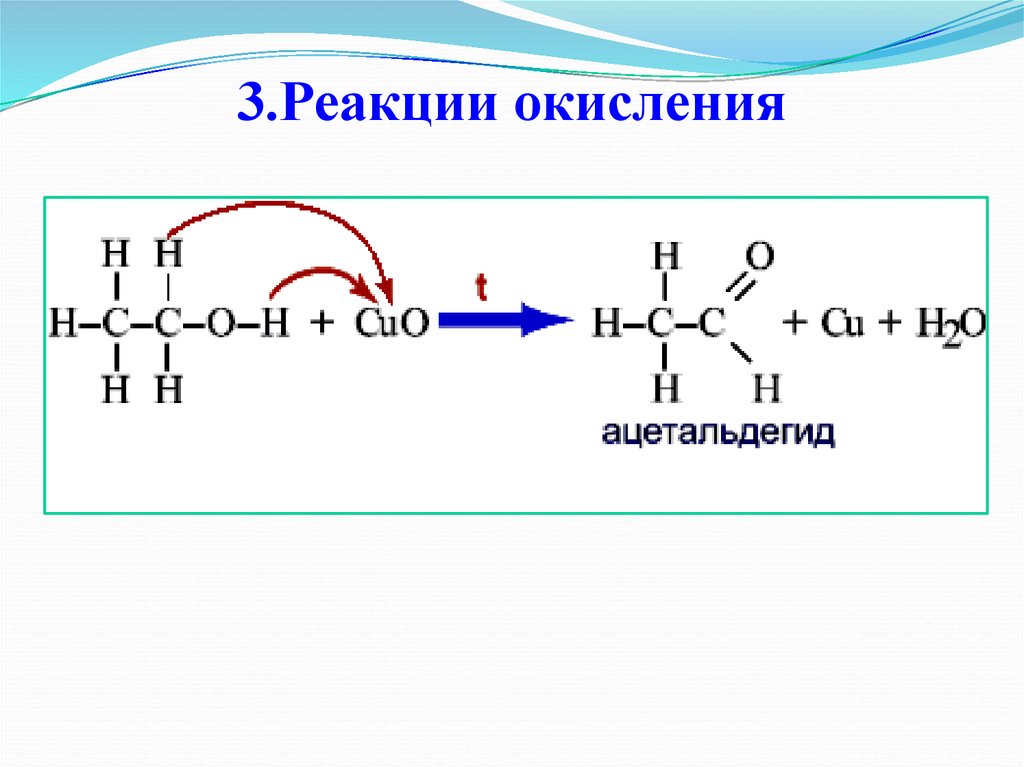
26. 3.Реакции окисления
R CH2 OHKMnO4 , H+
O
R C
H
первичный спирт
альдегид
OH
R
CH
KMnO4 , H+
R
вторичный спирт
KMnO4 ,
O
R C
OH
карбоновая кислота
O
H+
R
C
R
кетон
Третичные спирты окисляются в жёстких условиях с разрывом
связи C-C с образованием кислот и кетонов.
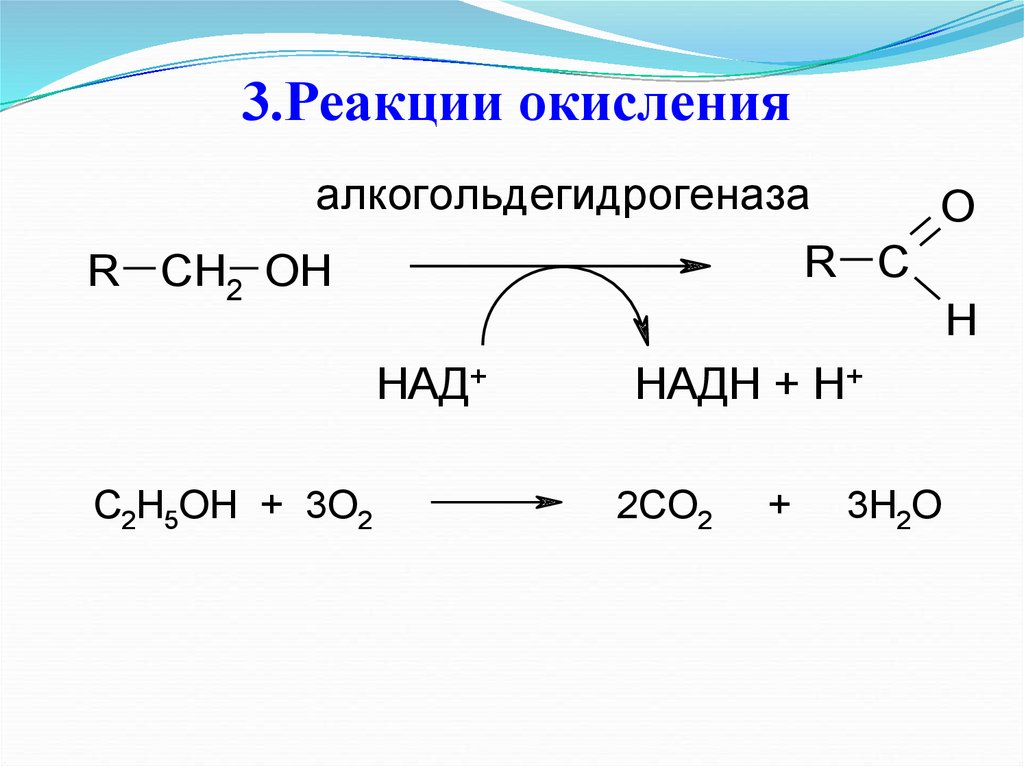
27. 3.Реакции окисления
28. 3.Реакции окисления
алкогольдeгидрогeназаR C
R CH2 OH
H
НАД+
C2H5OH + 3O2
O
НАДН + H+
2CO2
+
3H2O
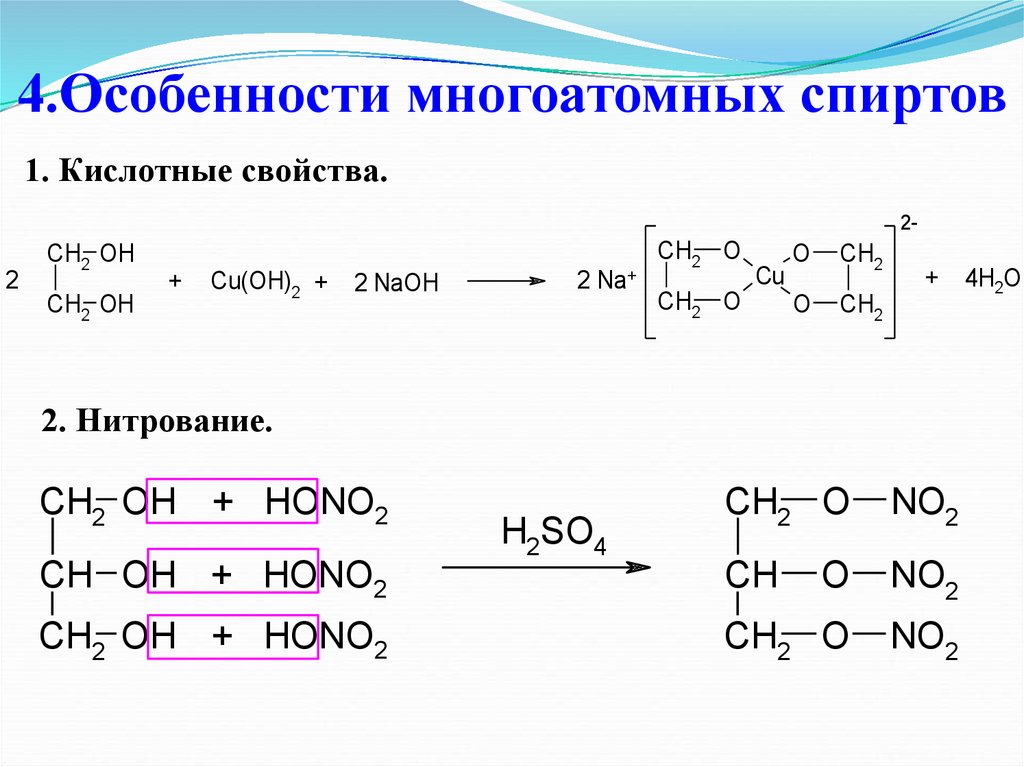
29. 4.Особенности многоатомных спиртов
1. Кислотные свойства.2-
2
CH2 OH
CH2 OH
+
Cu(OH)2 +
2 NaOH
2
Na+
CH2 O
Cu
CH2 O
O
O
CH2
+
CH2
2. Нитрование.
CH2 OH + HONO2
CH2 O
NO2
CH OH + HONO2
CH
O
NO2
CH2 OH + HONO2
CH2 O
NO2
H2SO4
4H2O
30. 4.Особенности многоатомных спиртов
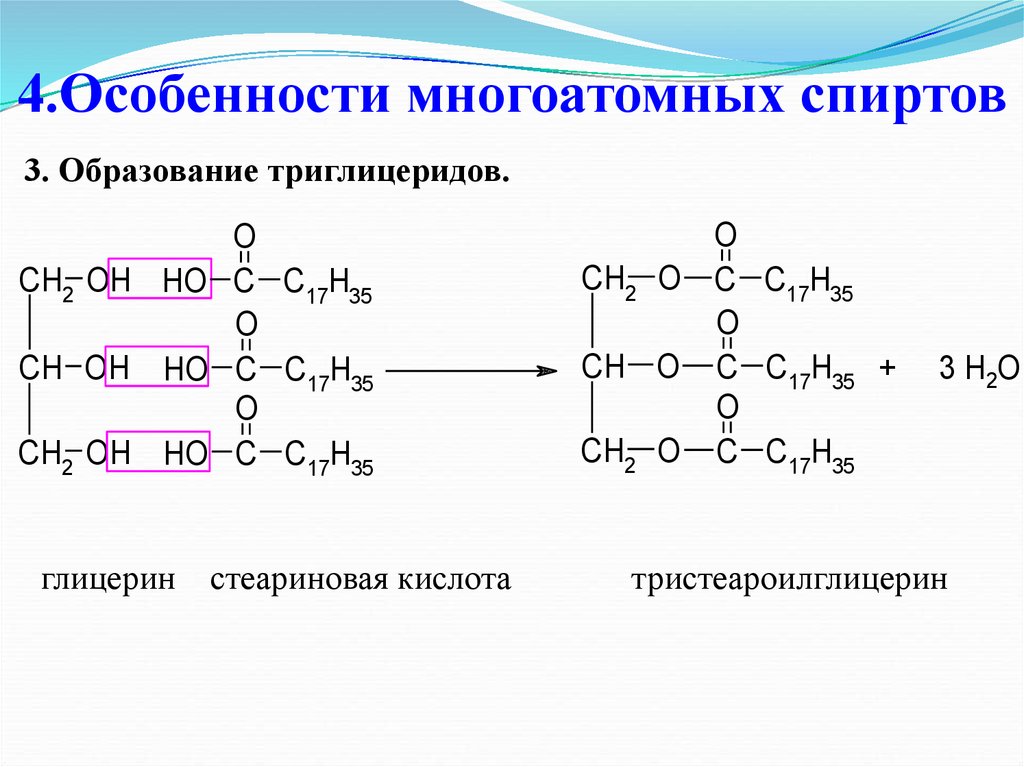
3. Образование триглицеридов.O
CH2 OH HO C C17H35
O
CH OH HO C C17H35
O
CH2 OH HO C C17H35
глицерин
стеариновая кислота
O
CH2 O C C17H35
O
CH O C C17H35 +
O
CH2 O C C17H35
3 H2O
тристеароилглицерин
31. 4.Особенности многоатомных спиртов
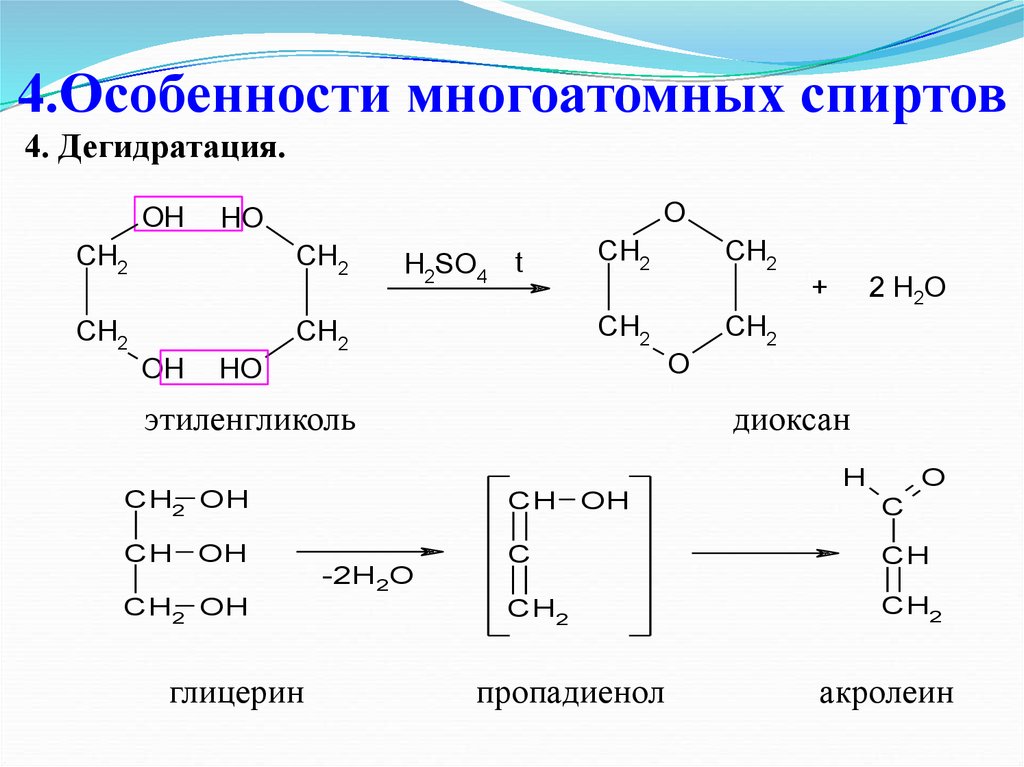
4. Дегидратация.OH
O
HO
CH2
CH2
CH2
CH2
OH
H2SO4
t
CH2
CH2
+
CH2
2 H2O
CH2
O
HO
этиленгликоль
диоксан
H
O
CH2 OH
CH OH
C
CH OH
C
CH
CH2
CH2
CH2 OH
глицерин
-2H2O
пропадиенол
акролеин
32. 4.Особенности многоатомных спиртов
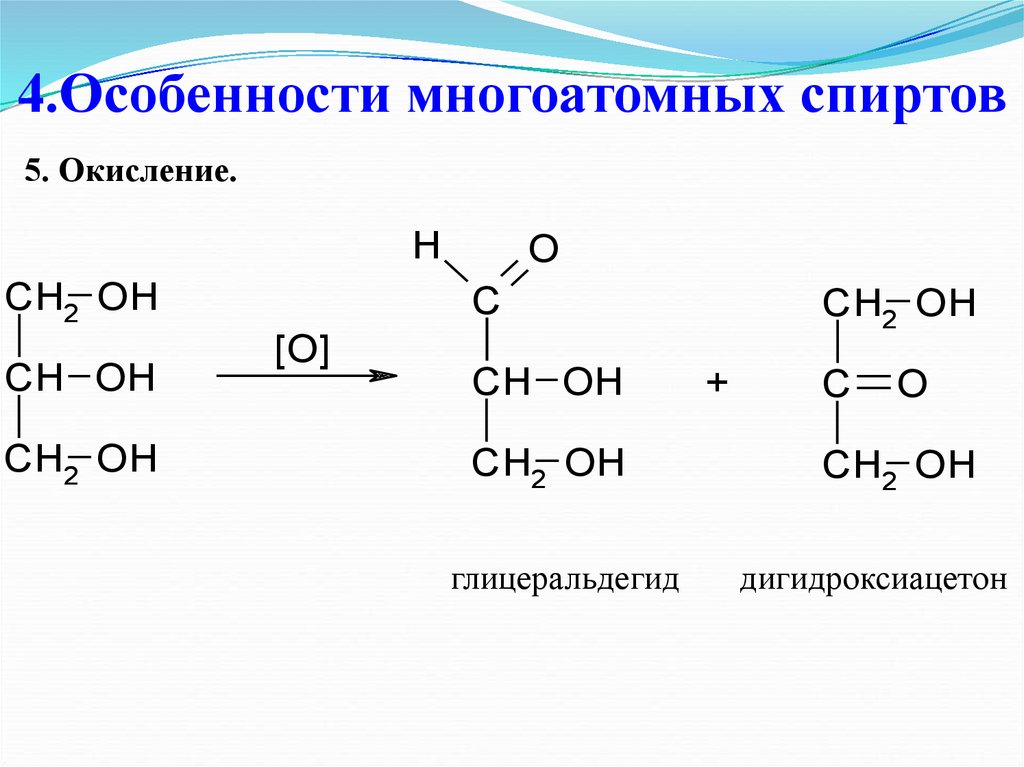
5. Окисление.H
CH2 OH
CH OH
CH2 OH
O
C
[O]
CH OH
CH2 OH
глицеральдегид
CH2 OH
+
C
O
CH2 OH
дигидроксиацетон
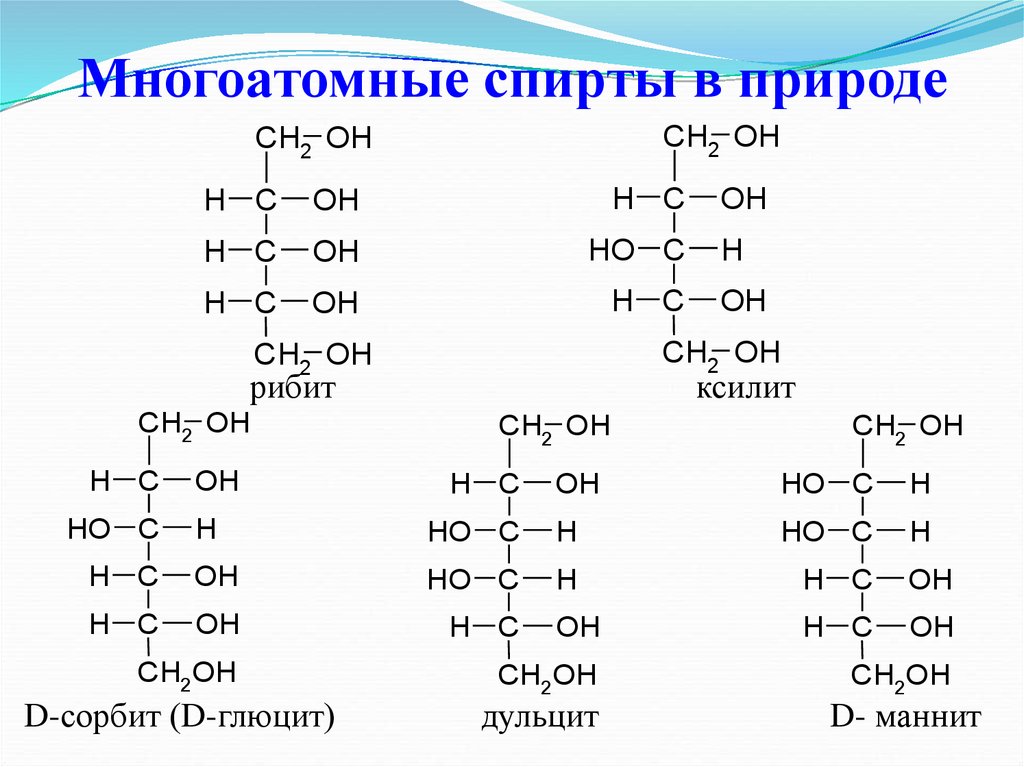
33. Многоатомные спирты в природе
CH2 OHCH2 OH
H C
OH
H C
H C
OH
HO C
H C
OH
H C
рибит
H C
HO C
OH
H
OH
CH2 OH
CH2 OH
CH2 OH
OH
ксилит
CH2 OH
H C
CH2 OH
OH
HO C
H
H
H
HO C
H
HO C
H C
OH
HO C
H
H C
OH
H C
OH
H C
OH
H C
OH
CH2OH
D-сорбит (D-глюцит)
CH2OH
дульцит
CH2OH
D- маннит
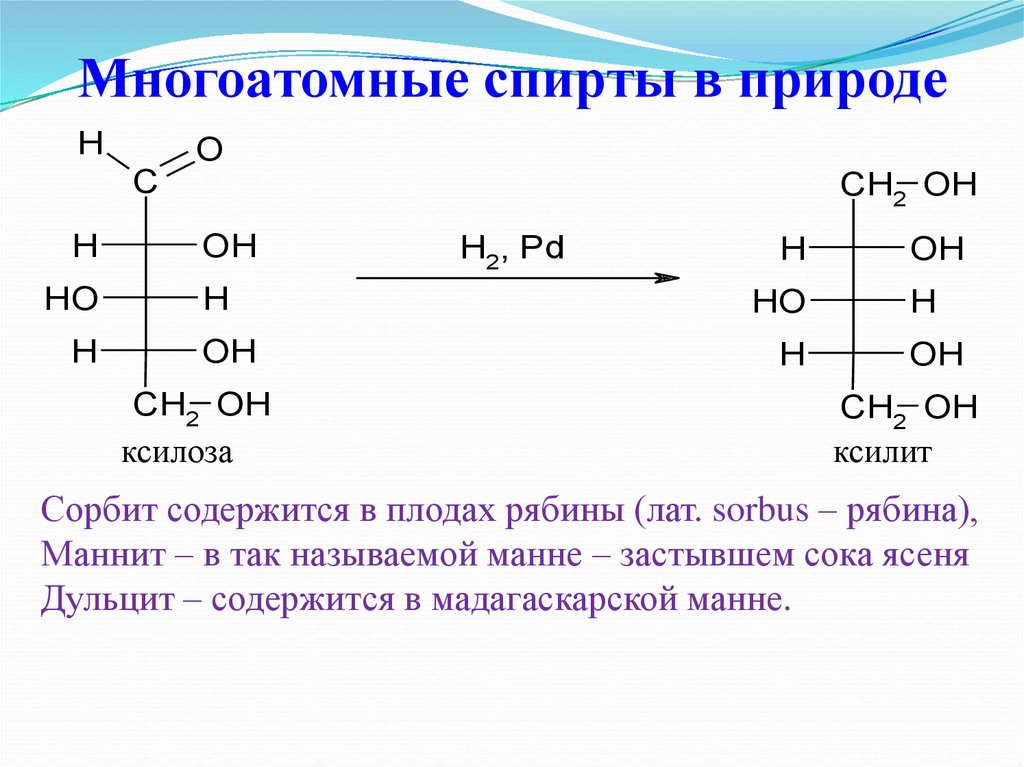
34. Многоатомные спирты в природе
HO
C
H
HO
H
CH2 OH
OH
H
OH
CH2 OH
ксилоза
H2, Pd
H
HO
H
OH
H
OH
CH2 OH
ксилит
Сорбит содержится в плодах рябины (лат. sorbus – рябина),
Маннит – в так называемой манне – застывшем сока ясеня
Дульцит – содержится в мадагаскарской манне.















 Химия
Химия








