Похожие презентации:
Механизмы реакций
1.
Проф., д.х.н. Исляйкин Михаил Константинович2.
Целью дисциплины является изучение механизмов реакций химикотехнологическихпроцессов
тонкого
органического,
основного
органического и нефтехимического синтеза.
Теоретический курс включает разделы:
- введение;
- механизмы органических реакций
электрофильных,
нуклеофильных,
радикальных;
- влияние растворителей.
3.
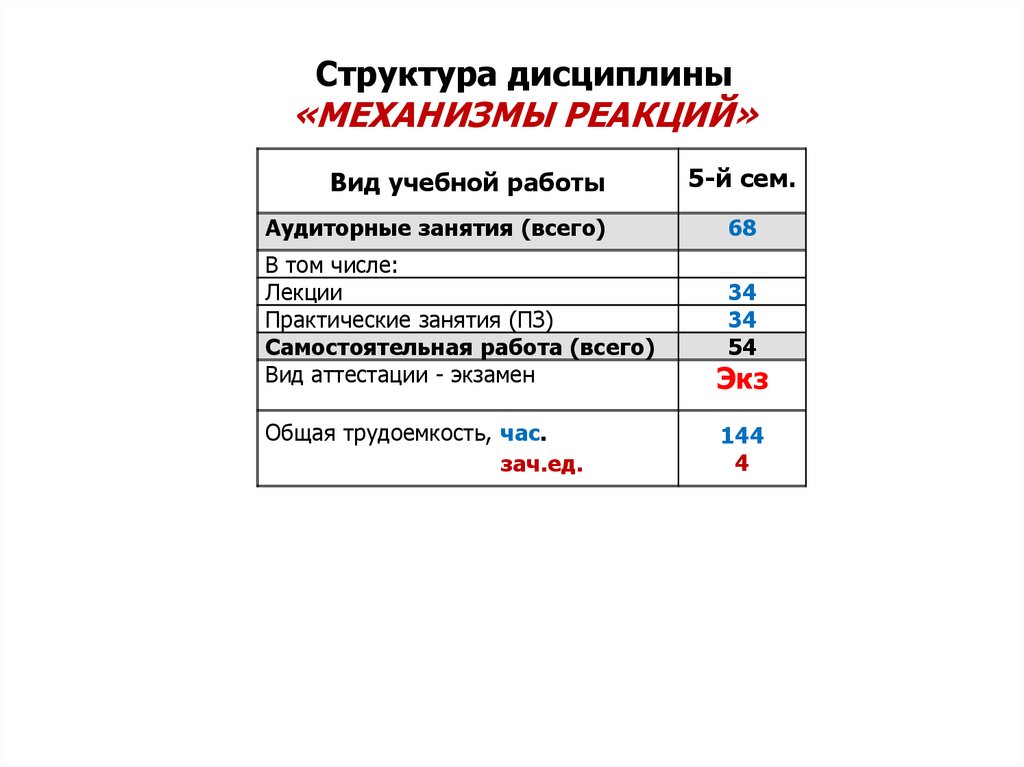
Структура дисциплины«МЕХАНИЗМЫ РЕАКЦИЙ»
Вид учебной работы
5-й сем.
Аудиторные занятия (всего)
68
В том числе:
Лекции
Практические занятия (ПЗ)
Самостоятельная работа (всего)
Вид аттестации - экзамен
34
34
54
Экз
Общая трудоемкость, час.
зач.ед.
144
4
4.
ЛИТЕРАТУРАОсновная:
1. Исляйкин М.К. Теория химико-технологических процессов органического
синтеза. Механизмы органических реакций. Учеб. пособие.
Иваново: ИГХТУ. 2016. 129 с.
2. Потехин В.М., Потехин В.В. Основы теории химических процессов
технологии органических веществ и нефтепереработки. – СПб.:
Химиздат, 2007. – 944 с.
5.
Дополнительная:ЛИТЕРАТУРА
1. Кудрик Е.В., Колесников Н.А., Любимцев А.В. Теория химикотехнологических процессов органического синтеза. Часть 1. Механизмы
органических реакций. / Под ред. Г.П.Шапошникова. Иван. Гос. Хим.технол. Ун-т. 2004. 156с.
2. Сайкс П. Механизмы реакций в органической химии. М.: Химия, 1991.
448с.
3. Лебедев Н.Н., Манаков М.Н., Швец В.Ф. Теория химических процессов
основного органического и нефтехимического синтеза. – М.: Химия, 1984. –
376 с. http://www.twirpx.com/file/105004/
4. Теоретические основы органической химии; строение, реакционная
способность и механизмы реакций органических соединений: Учебник /
А. С. Днепровский, Т. И. Темникова. – 2-е изд., перераб. – Л.: Химия, 1991.
– 560 с.
5. Пассет Б.В. Основные процессы химического синтеза биологически
активных веществ.: Учебник. – М.: ГЭОТАР-МЕД, 2002. 376с.
6.
6. Исляйкин, М.К. Применение квантово-химических методов для описаниясвойств органических соединений: метод. указания/ М.К.Исляйкин; Иван.
гос. хим.-технол. ун-т - Иваново 2005. -44 с.
7. Интернет-ресурсы: http://rushim.ru/books/books.htm;
www.xumuk.ru.
Главная страница дисциплины: «МЕХАНИЗМЫ РЕАКЦИЙ»
https://edu.isuct.ru/
Код доступа 2023:
7.
ВВЕДЕНИЕ8.
Александр Михайлович Бутлеров25 августа (6 сентября) 1828 г
5 (17) августа 1886 г
русский химик, заслуженный профессор,
создатель теории химического строения органических веществ,
родоначальник «бутлеровской школы» русских химиков,
ректор Императорского Казанского университета в 1860—1863 годах.
9.
«… химическая натура сложной частицы определяется натуройэлементарных составных частей, количеством их и химическим
строением».
Атомы в органических соединениях связаны друг с другом в
определённом порядке химическими силами.
Каждое вещество имеет одну определённую формулу строения.
Фундаментальная зависимость «структура-свойство»
органических соединений
«Нет ничего практичнее хорошей теории»
КИРХГОФ Густав Робер
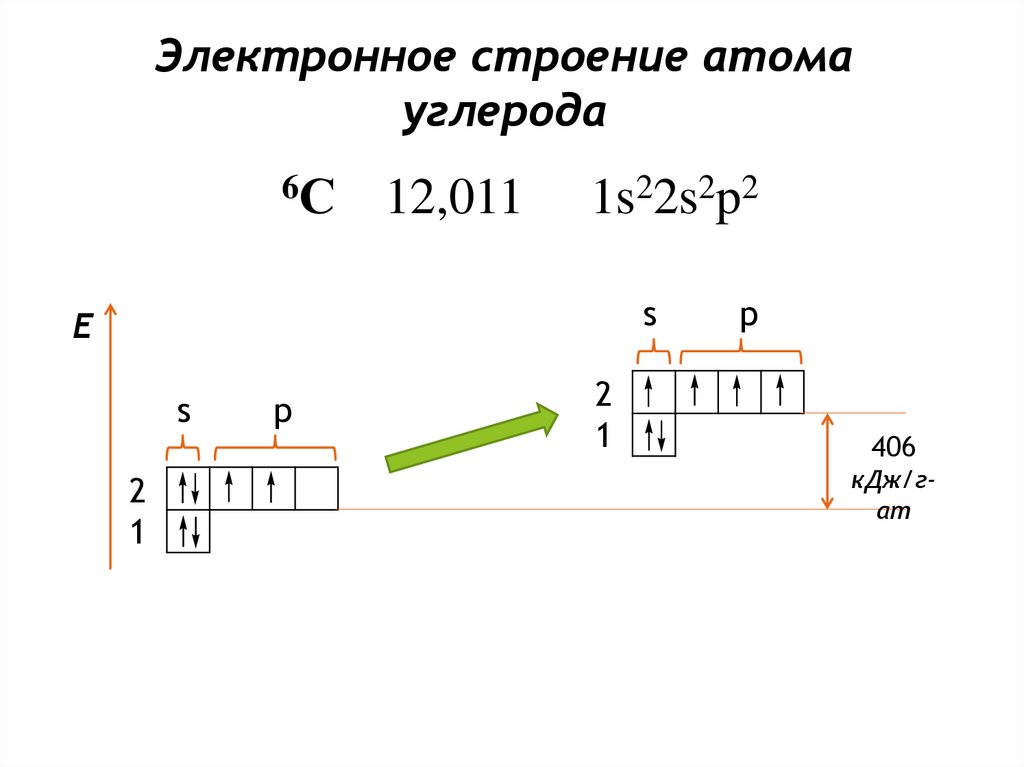
10.
Электронное строение атомауглерода
6С
12,011
1s22s2p2
s
E
s
2
1
p
2
1
p
406
кДж/гат
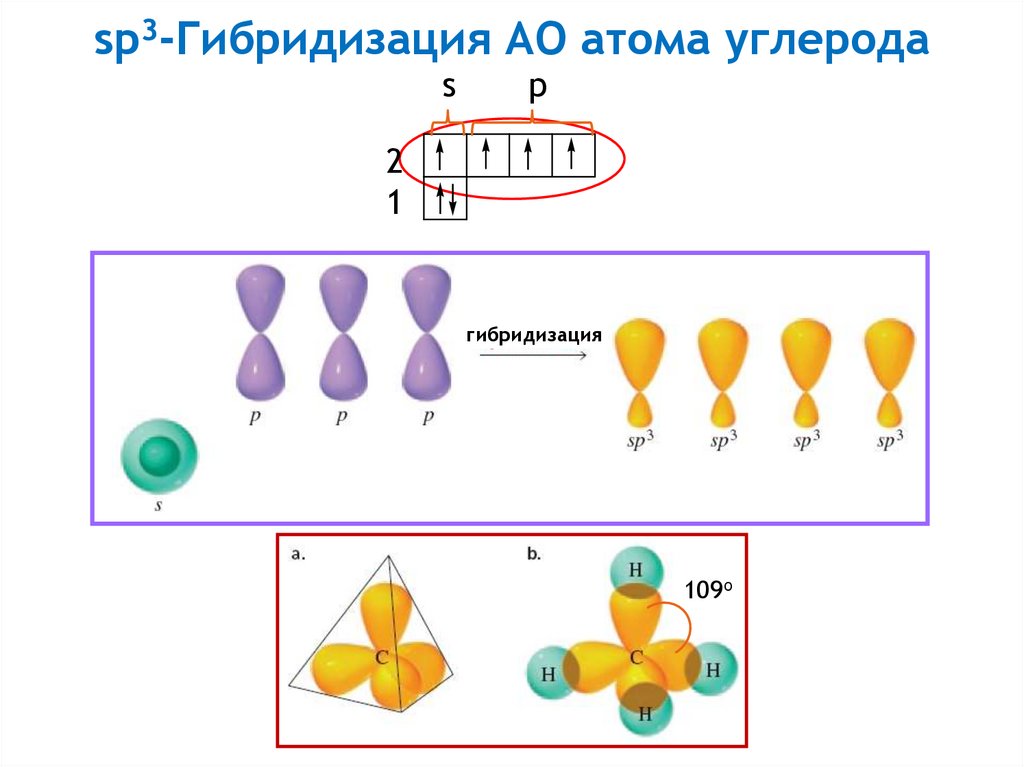
11.
sp3-Гибридизация АО атома углеродаs
p
2
1
гибридизация
109o
12.
Взаимодействие sp3 гибридизованных АО собразованием -связи (H3C-CH3 – этан)
1.54
Å
Энергия
Разрыхляющая МО
sp3 АО
sp3 АО
Связывающая МО
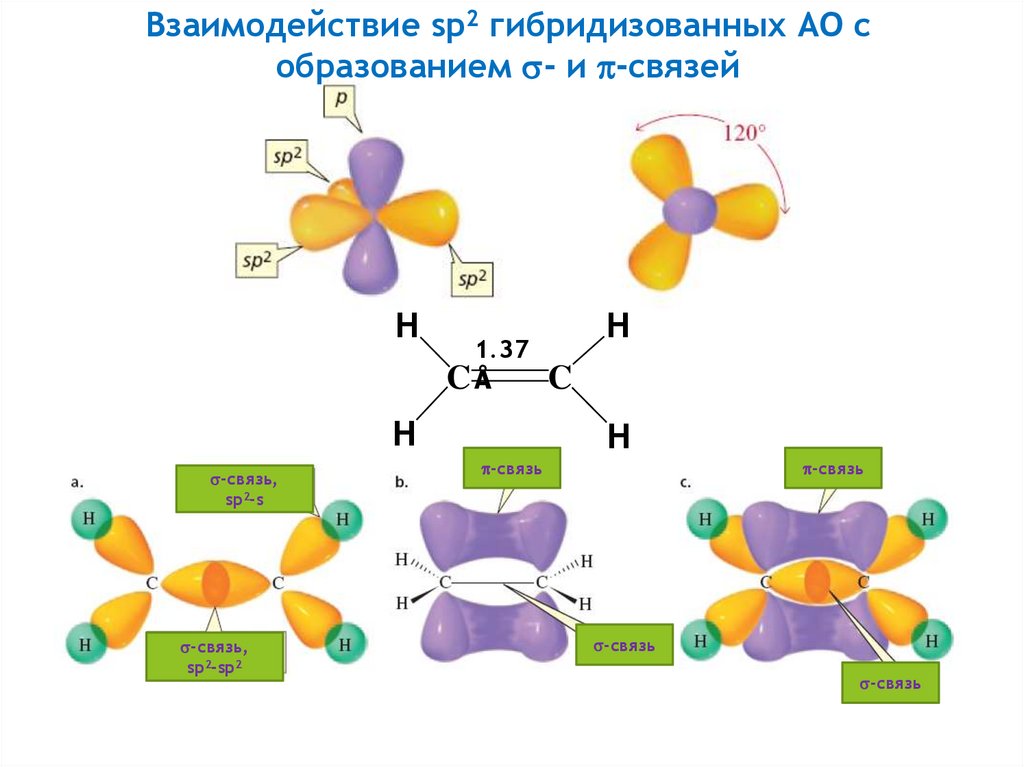
13.
Взаимодействие sp2 гибридизованных АО собразованием - и -связей
H
1.37
CÅ
H
-связь,
sp2-s
-связь,
sp2-sp2
H
C
H
-связь
-связь
-связь
-связь
14.
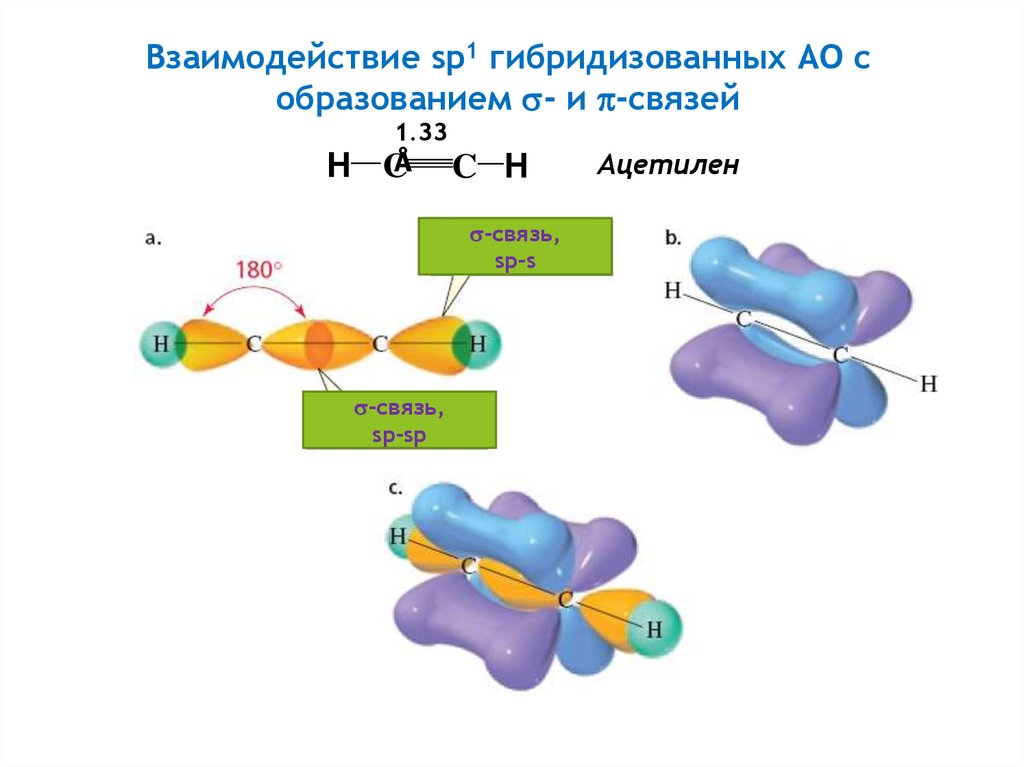
Взаимодействие sp1 гибридизованных АО собразованием - и -связей
H
1.33
CÅ C
H
-связь,
sp-s
-связь,
sp-sp
Ацетилен
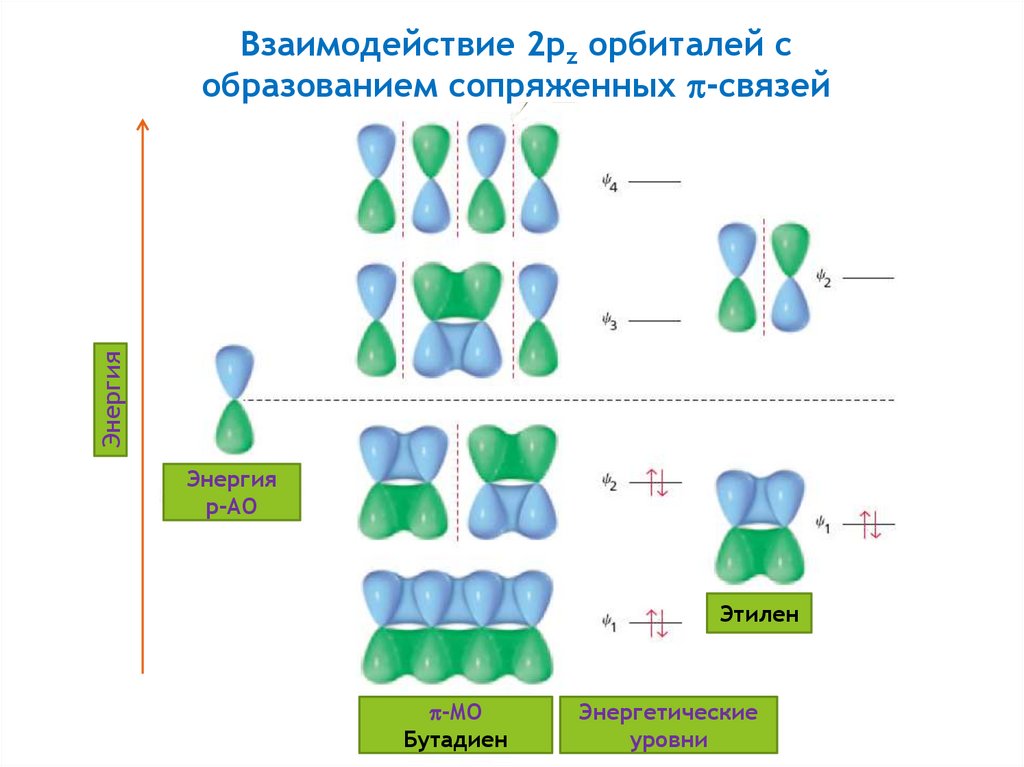
15.
ЭнергияВзаимодействие 2pz орбиталей с
образованием сопряженных -связей
Энергия
p-АО
Этилен
-MO
Бутадиен
Энергетические
уровни
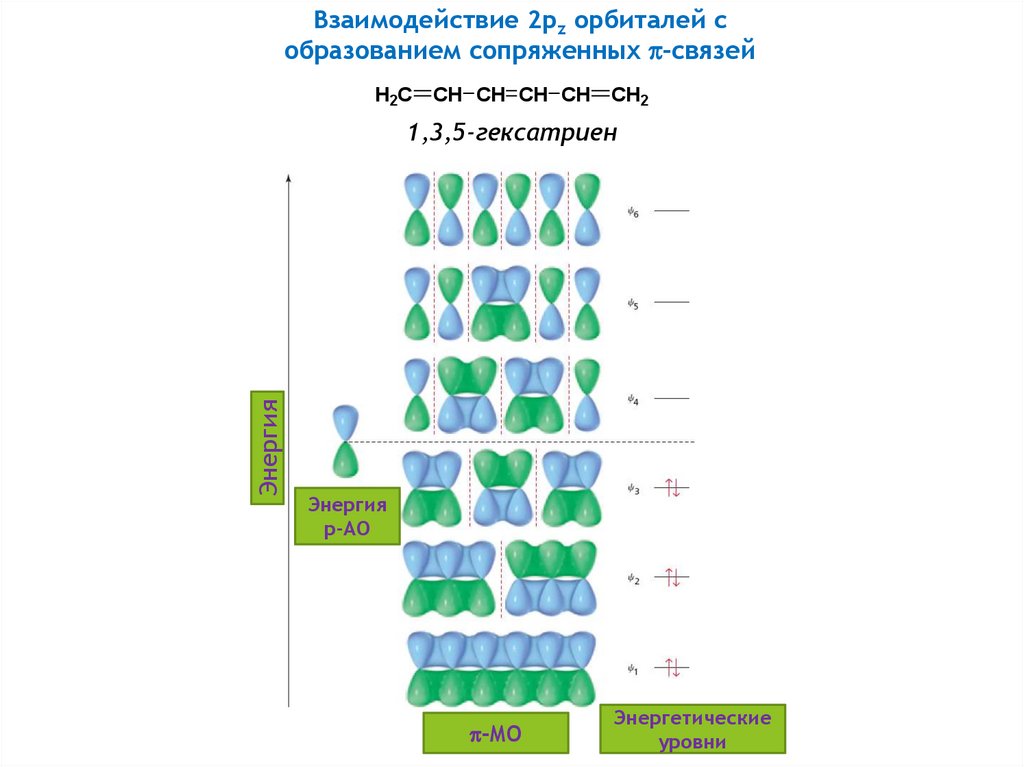
16.
Взаимодействие 2pz орбиталей собразованием сопряженных -связей
H2C
CH CH CH CH
CH2
Энергия
1,3,5-гексатриен
Энергия
p-АО
-MO
Энергетические
уровни
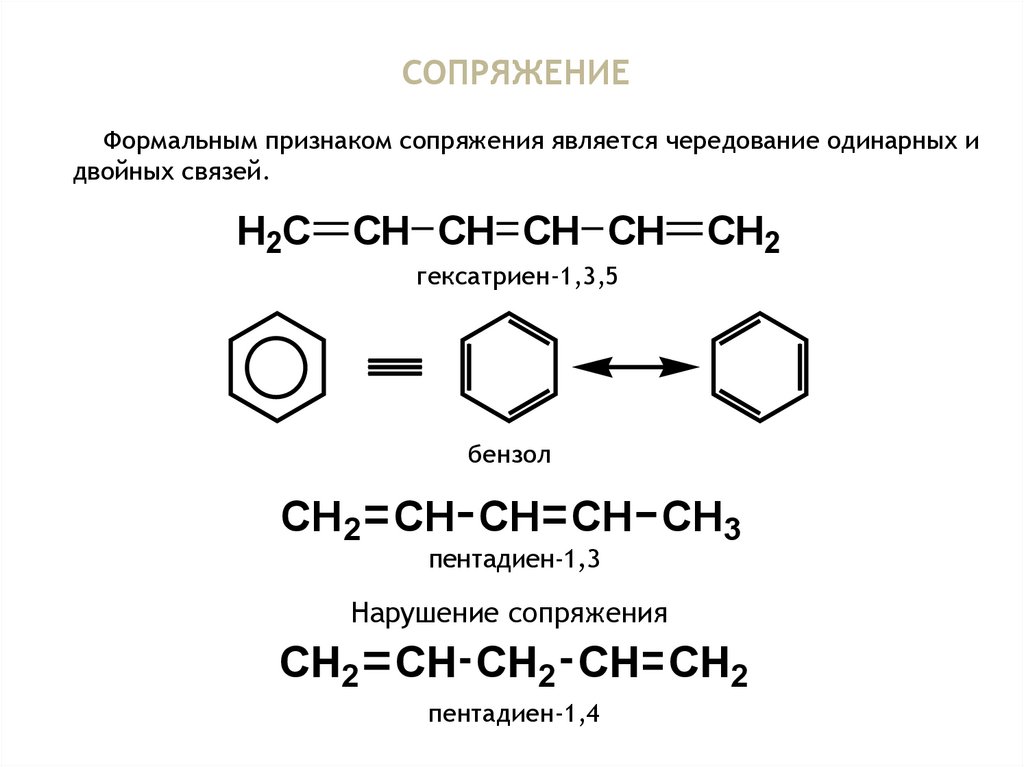
17.
СОПРЯЖЕНИЕФормальным признаком сопряжения является чередование одинарных и
двойных связей.
H2C
CH CH CH CH
гексатриен-1,3,5
бензол
CH2
18.
СОПРЯЖЕНИЕФормальным признаком сопряжения является чередование одинарных и
двойных связей.
H2C
CH CH CH CH
CH2
гексатриен-1,3,5
бензол
CH2 CH CH CH CH3
пентадиен-1,3
Нарушение сопряжения
CH2 CH CH2 CH CH2
пентадиен-1,4
19.
Свойства -орбиталей1. Боковое перекрывание рz-АО;
2. Эффективность перекрывания -связи меньше, чем в случае
-связи; => -связь менее прочна, чем -связь.
Энергия связи: этилен
598 кДж/моль,
этан
347 кДж/моль
------------251 кДж/моль.
3. Сильная зависимость перекрывания от планарности молекулы;
4. Возможность формирования протяженных сопряженных систем;
5. -Электроны более подвижны, чем -электроны;
6. -Электронная плотность локализована над и под плоскостью молекулы;
=> Склонность к взаимодействию с электронодефицитными
(электрофильными) реагентами.
20.
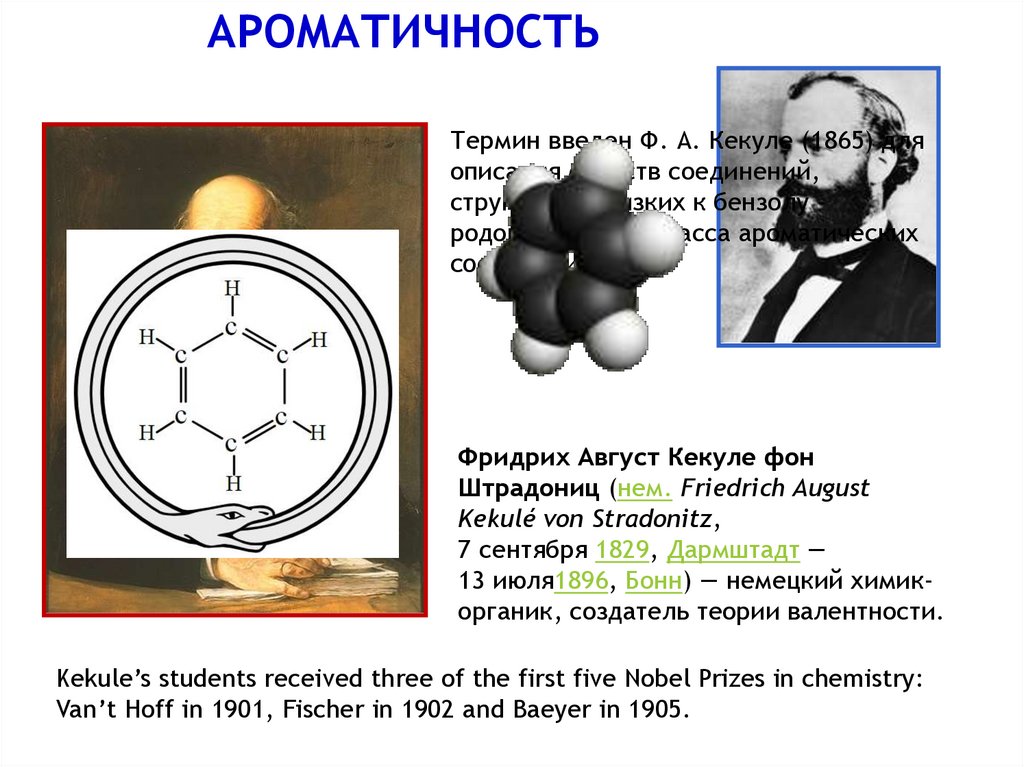
АРОМАТИЧНОСТЬТермин введен Ф. А. Кекуле (1865) для
описания свойств соединений,
структурно близких к бензолу родоначальнику класса ароматических
соединении.
Фридрих Август Кекуле фон
Штрадониц (нем. Friedrich August
Kekulé von Stradonitz,
7 сентября 1829, Дармштадт —
13 июля1896, Бонн) — немецкий химикорганик, создатель теории валентности.
Kekule’s students received three of the first five Nobel Prizes in chemistry:
Van’t Hoff in 1901, Fischer in 1902 and Baeyer in 1905.
21.
АРОМАТИЧНОСТЬОдним из фундаментальных понятий органической химии является
ароматичность.
Термин
ароматичность
или
ароматический
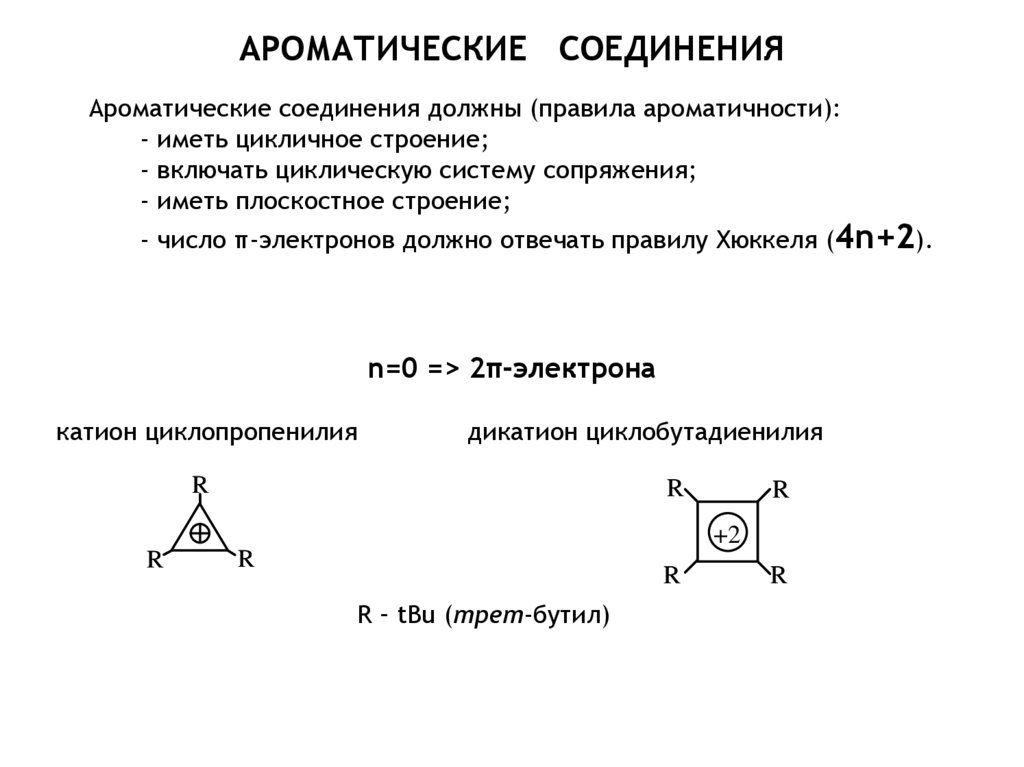
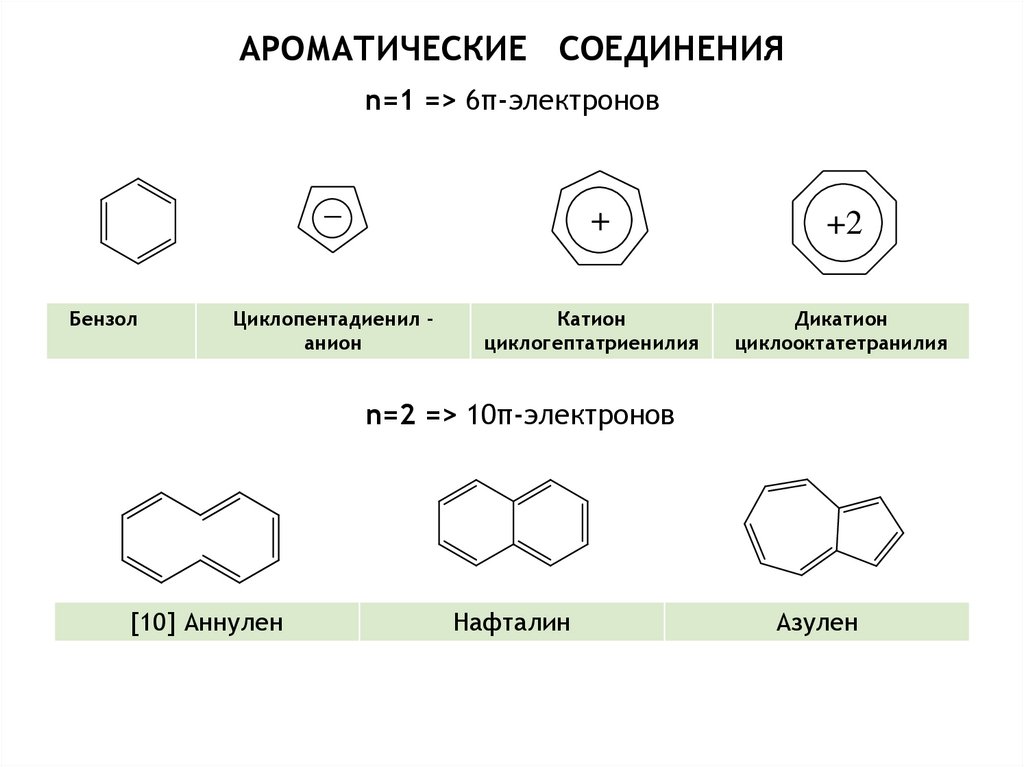
характер ассоциируют со свойствами соединений, которые в основном
состоянии имеют циклическую -электронную систему, включающую
(4n + 2) электронов, и которые
- более устойчивы, чем их ациклические аналоги;
- характеризуются связями, длины которых лежат между длинами типично
одинарной и типично двойной связей;
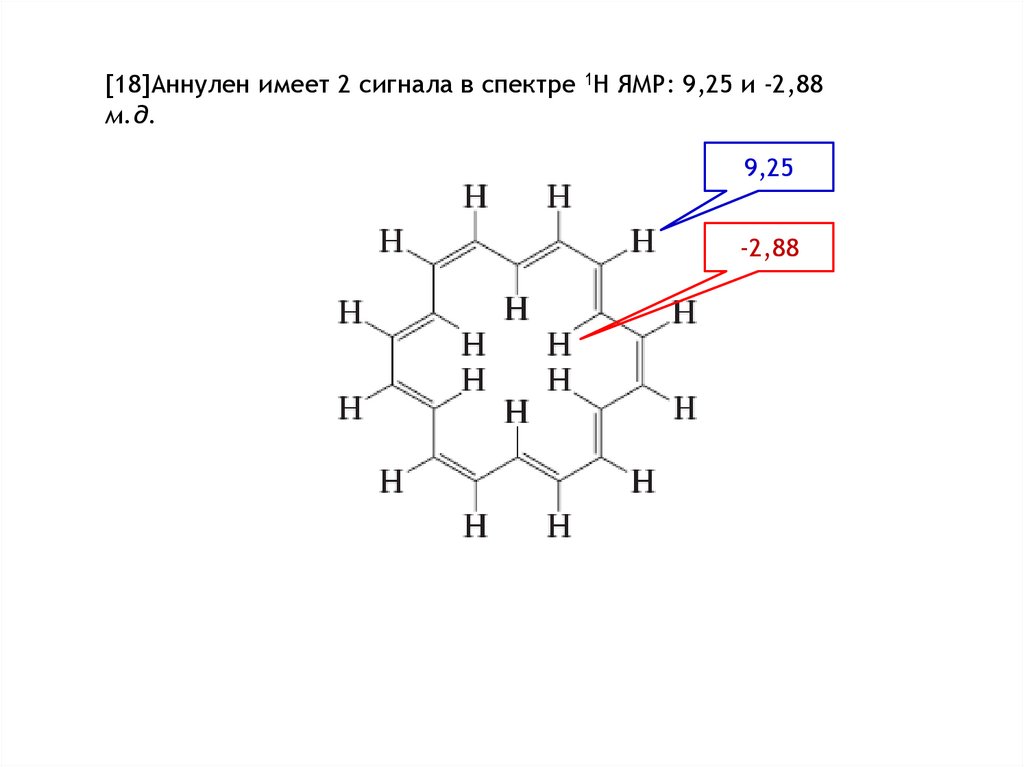
- обнаруживают -электронный кольцевой ток, который индуцируется под
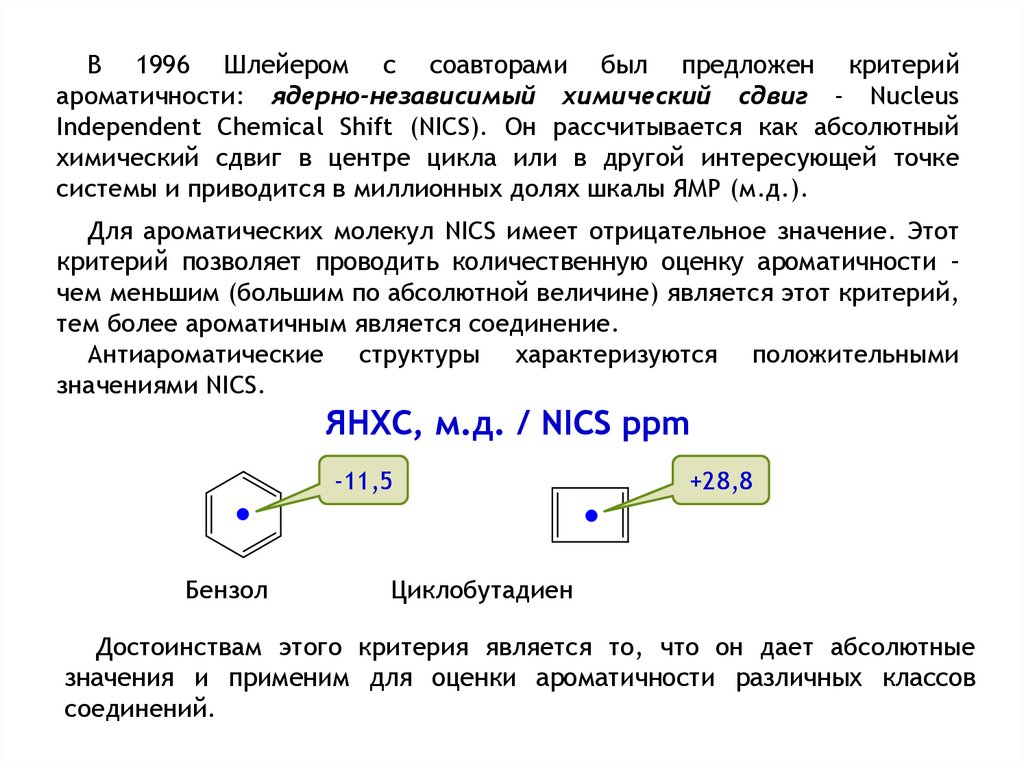
воздействием внешнего магнитного поля, что приводит к возрастанию
величин магнитной восприимчивости и специфическим химическим сдвигам
в спектрах 1Н ЯМР;
- проявляют особую реакционную способность, заключающуюся в склонности
ароматических соединений вступать в реакции замещения, а не
присоединения.
Ароматичность – это свойство, которое нельзя непосредственно измерить.
В связи с этим были разработаны различные критерии (индексы) для
оценки ароматического характера. Наибольшее распространение получили
энергетические, геометрические и магнитные критерии.
22.
Энергетические критерииОснованы на сравнении -электронной энергии ароматической и
модельной молекулы. Для расчета этих критериев достаточно
использовать методы, основанные на -электронном приближении.
Энергия
делокализации
(ЭД)
или
энергия
резонанса
рассчитывается как разность между -электронной энергией молекулы
и энергией соответствующего количества изолированных двойных
связей. Эта разность характеризует выигрыш в энергии за счет
делокализации -электронов.
ЭД = E - nEC=C
По данным простого метода Хюккеля для бензола E =6 + 8 .
-Электронная энергия изолированной двойной связи EC=C = 2 + 2 .
Тогда энергия делокализации будет равна:
ЭД = 6 + 8 - 3(2 + 2 ) = 2
Для циклобутадиена: E =4 + 4 , а ЭД=4 + 4 - 2(2 + 2 )=0.
23.
Однако этот подход оказался неприемлемым, так как при увеличенииразмеров -электронной системы он предсказывает увеличение ЭД и,
следовательно, ароматичности, что не соответствует экспериментальным
данным.
Дьюаром был предложен другой критерий, названный дьаровской
энергией резонанса (ДЭР). Он основан на сравнении энергии
циклической сопряженной молекулы с соответствующим соединением с
открытой цепью, рассчитанными методом ППП.
Бензол
1,3,5-Гексатриен
Например, в случае бензола сравнение проводится с гексатриеном,
который получается при разрыве молекулы бензола по одной из
формально одинарных связей.
24.
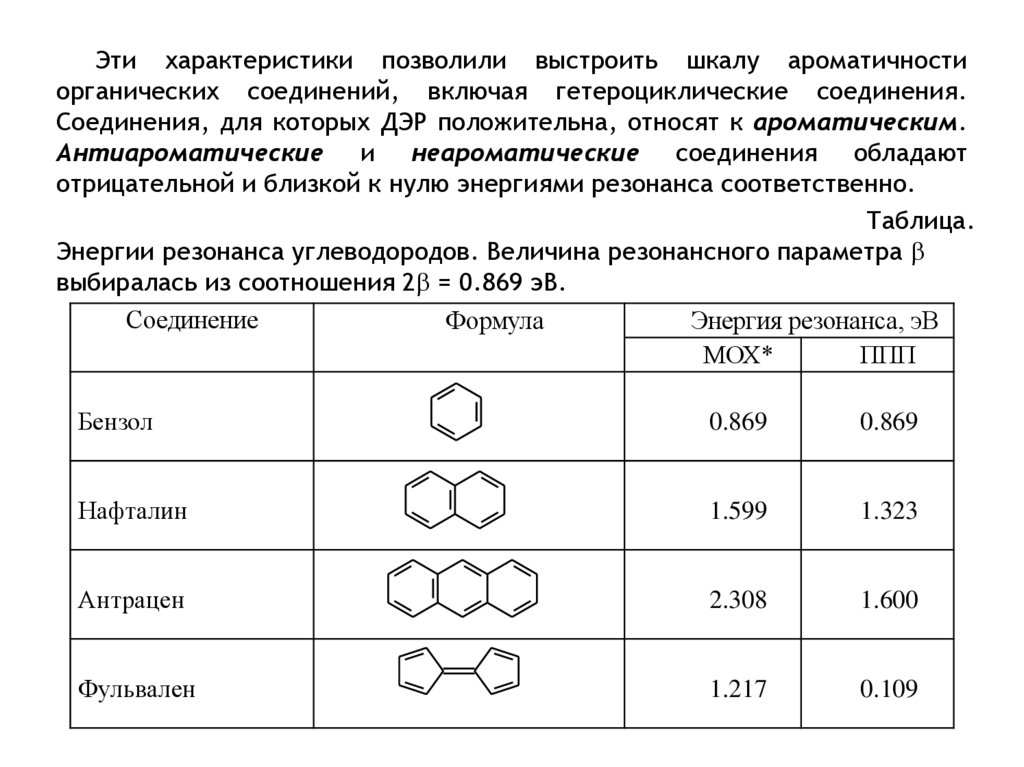
Эти характеристики позволили выстроить шкалу ароматичностиорганических соединений, включая гетероциклические соединения.
Соединения, для которых ДЭР положительна, относят к ароматическим.
Антиароматические и неароматические соединения обладают
отрицательной и близкой к нулю энергиями резонанса соответственно.
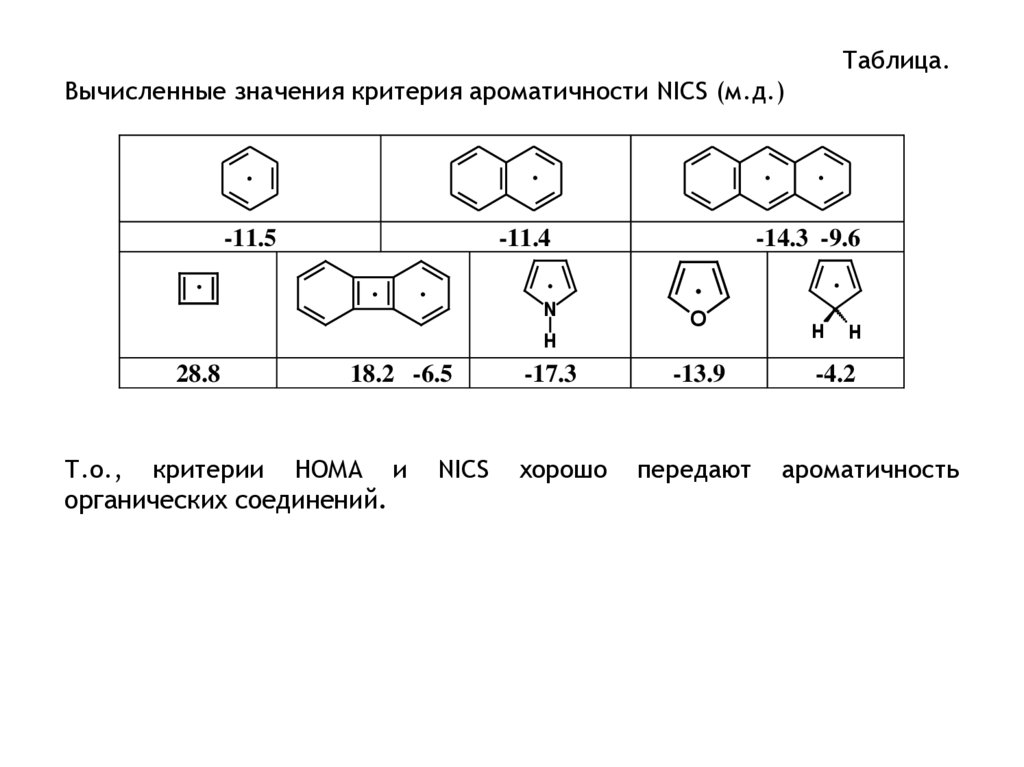
Таблица.
Энергии резонанса углеводородов. Величина резонансного параметра
выбиралась из соотношения 2 = 0.869 эВ.
Соединение
Формула
Энергия резонанса, эВ
МОХ*
ППП
Бензол
0.869
0.869
Нафталин
1.599
1.323
Антрацен
2.308
1.600
Фульвален
1.217
0.109
25.
Длясравнения
молекул
с
различным
количеством
-электронов использовали удельную дьюаровскую энергию резонанса
(УдДЭР).
УдДЭР = ДЭР/Nel ,
где Nel – число -электронов в системе.
26.
Геометрические критерииОснованы на способности ароматических соединений к выравниванию
связей по контуру сопряжения. К достоинствам этих критериев следует
отнести то, что они позволяют проводить оценку ароматичности с
использованием как экспериментальных (данные рентгеноструктурного
анализа, газовая электронография), так и вычисленных с помощью
квантово-химических методов длин связей. Кроме того, они позволяют
анализировать не только общую, но и локальную ароматичность, т.е.
ароматичность отдельных контуров сопряжения сложных молекул,
например, порфиринов и их аналогов.
К настоящему времени разработано большое количество критериев
ароматичности, основанных на геометрических характеристиках
молекул. Например, критерий А, учитывающий отклонение длин связей
от среднего значения:
2
225
Ri
A 1
(1 )
n
Rav
n – число связей в цикле;
Ri – длина i-ой связи;
Rav – средняя длина связи.
Однако данный индекс не учитывает отклонение средней длины связи от
оптимального значения.
27.
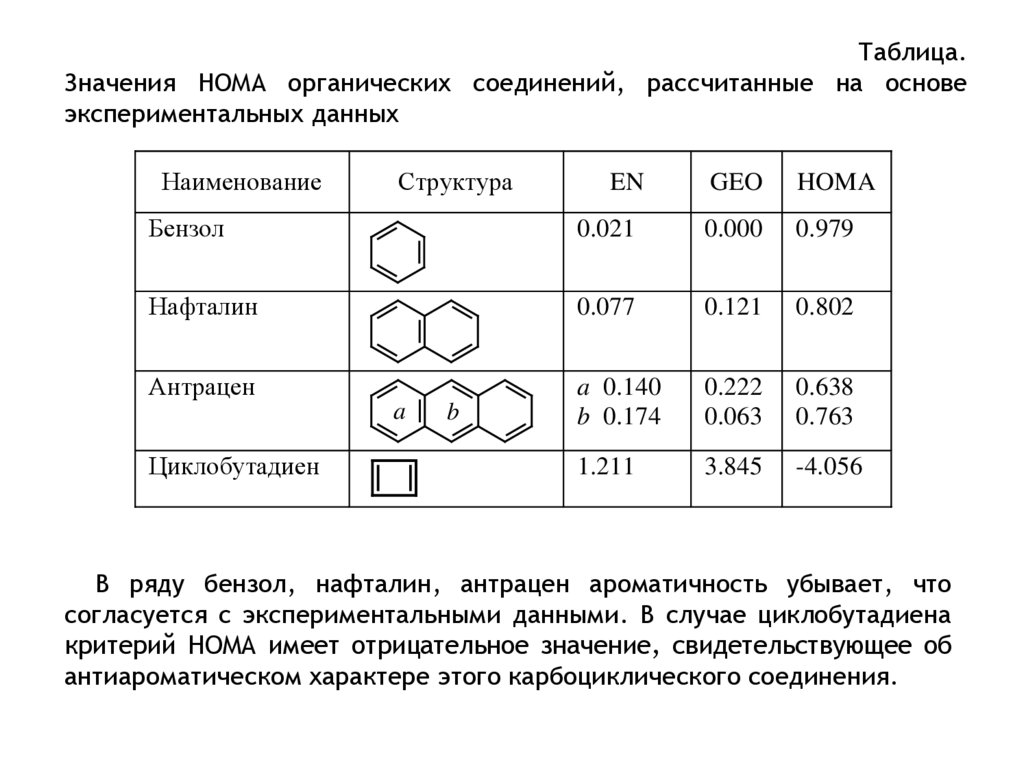
Это недостаток был учтен при разработке критерия, называемогомоделью гармонического осциллятора ароматичности (Harmonic
Oscillator Model of Aromaticity, HOMA). Ключевой в этом подходе является
концепция оптимальной длины связи (Ropt), которая находится для
углеводородов как длина связи, соответствующая минимальной энергии
(оцененной с использованием гармонического потенциала) сжатия
одинарной связи до длины двойной и удлинения двойной связи до длины
одинарной в1,3-бутадиене. Критерий НОМА рассчитывается по формуле :
HOMA
R R
n
2
opt
i
где
n - число связей в цикле;
- эмпирическая константа, выбранная таким образом, чтобы НОМА=0
для гипотетической структуры бензола Кекуле и НОМА = 1 для системы,
у которой все длины связей равны величине Ropt;
для углеводородов = 257.7.
Ri – длина i-ой связи.



















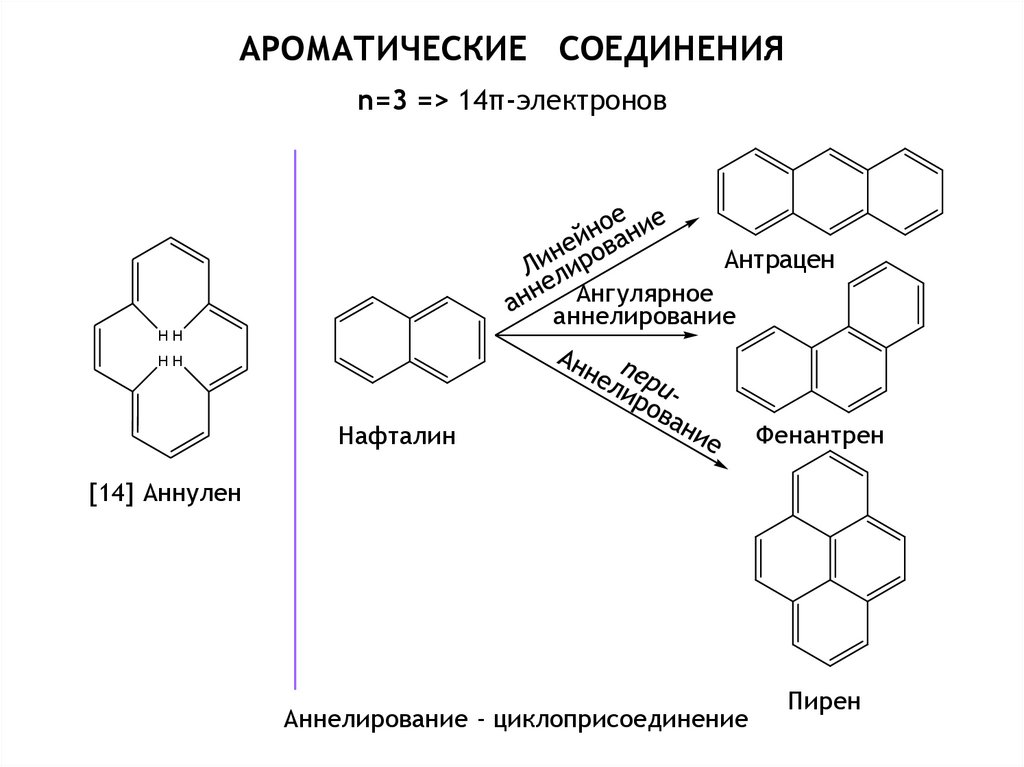






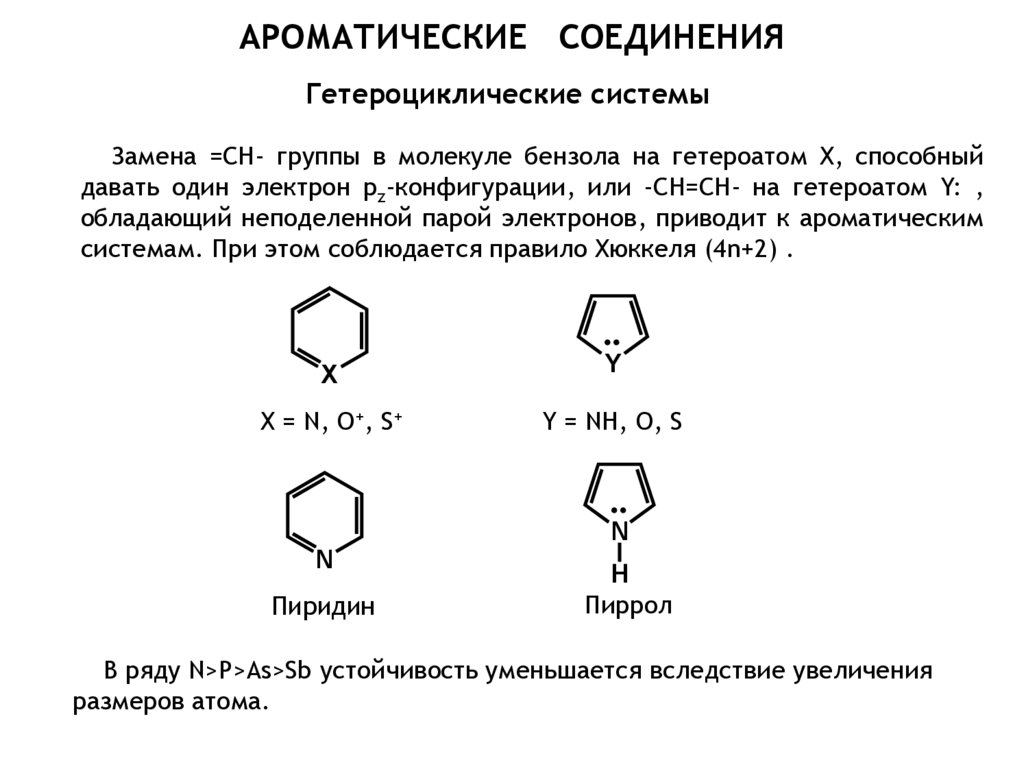
 Химия
Химия








