Похожие презентации:
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул
1.
ХИМИЧЕСКАЯ СВЯЗЬ.ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕ.
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ
СТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ. ЛЕКЦИЯ 1.
1
2.
План1. Типы химических связей
2. Сопряжение. Сопряженные системы. Ароматичность
3. Взаимное влияние атомов в молекуле. Эффекты заместителей
4. Классификация реакций и реагентов
2
3.
1. Типы химических связей3
4.
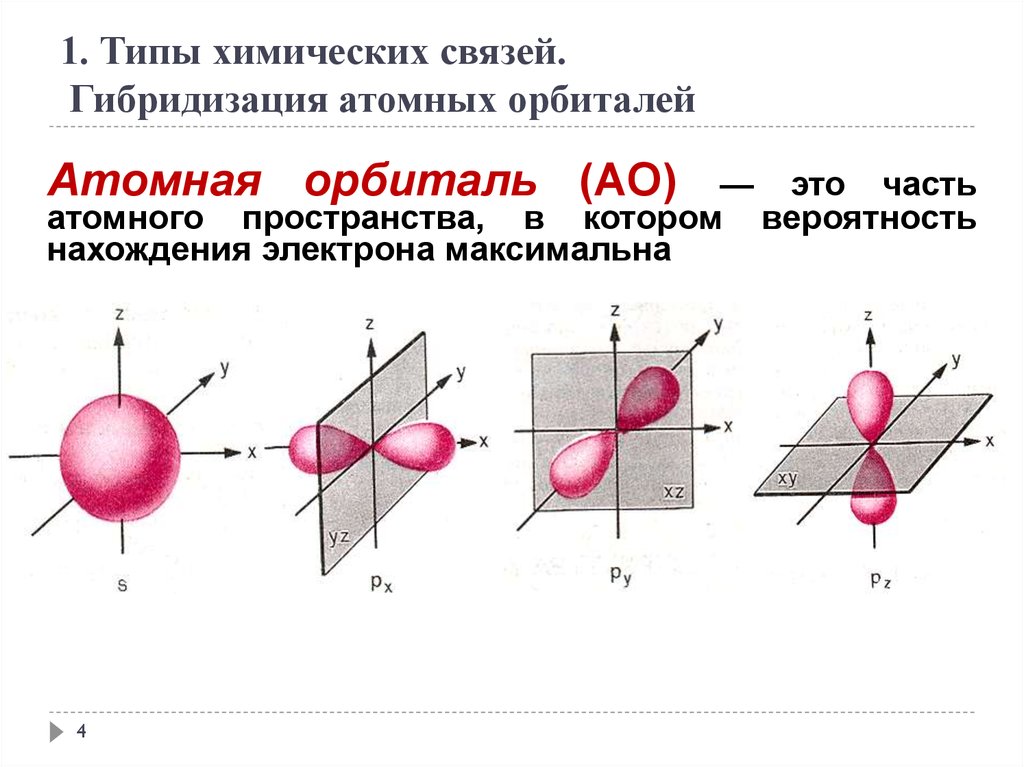
1. Типы химических связей.Гибридизация атомных орбиталей
Атомная орбиталь (АО)
— это часть
атомного пространства, в котором вероятность
нахождения электрона максимальна
4
5.
1. Типы химических связей.Гибридизация атомных орбиталей
Заполнение АО электронами
Принцип
устойчивости:
АО
заполняются
электронами в порядке повышения их энергетических
уровней:
1s < 2s < 3s < 3p < 4s < 3d < 4p < 5s
Правило
Паули:
на
орбитали могут
располагаться не более двух электронов с
противоположными спинами
Правило Хунда (Гунда):
подуровня
электрону
5
заполняются
Орбитали данного
сначала по одному
6.
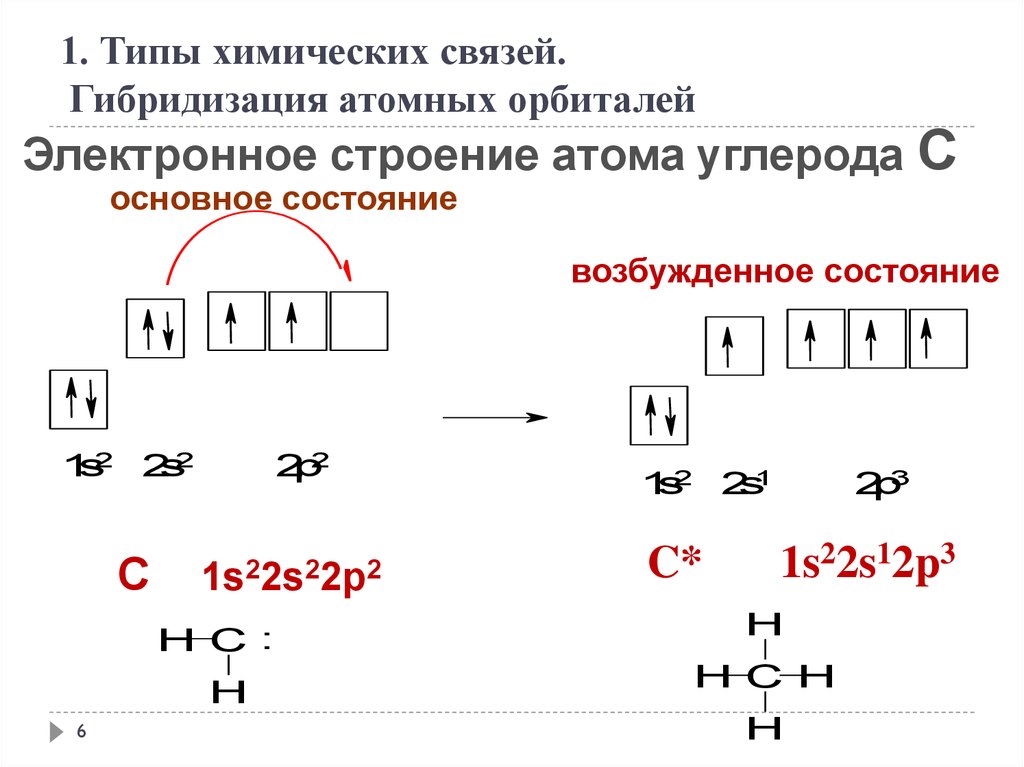
1. Типы химических связей.Гибридизация атомных орбиталей
Электронное строение атома углерода С
основное состояние
возбужденное состояние
1s2 2s2
C
2p2
1s22s22p2
H C:
H
6
1s2 2s1
C*
2p3
1s22s12p3
H
H C H
H
7.
1. Типы химических связей.Гибридизация атомных орбиталей
Гибридизация перестройка близких по энергии орбиталей, в ходе которой
образуются орбитали с одинаковой формой и энергией.
.
Гибридные
орбитали
образовании связей.
7
обеспечивают
более
полной
перекрывание
при
8.
1. Типы химических связей.Гибридизация атомных орбиталей
C sp3 1s22(sp3)4
8
C sp2 1s22(sp2)32p1
C sp 1s22(sp)22p2
9.
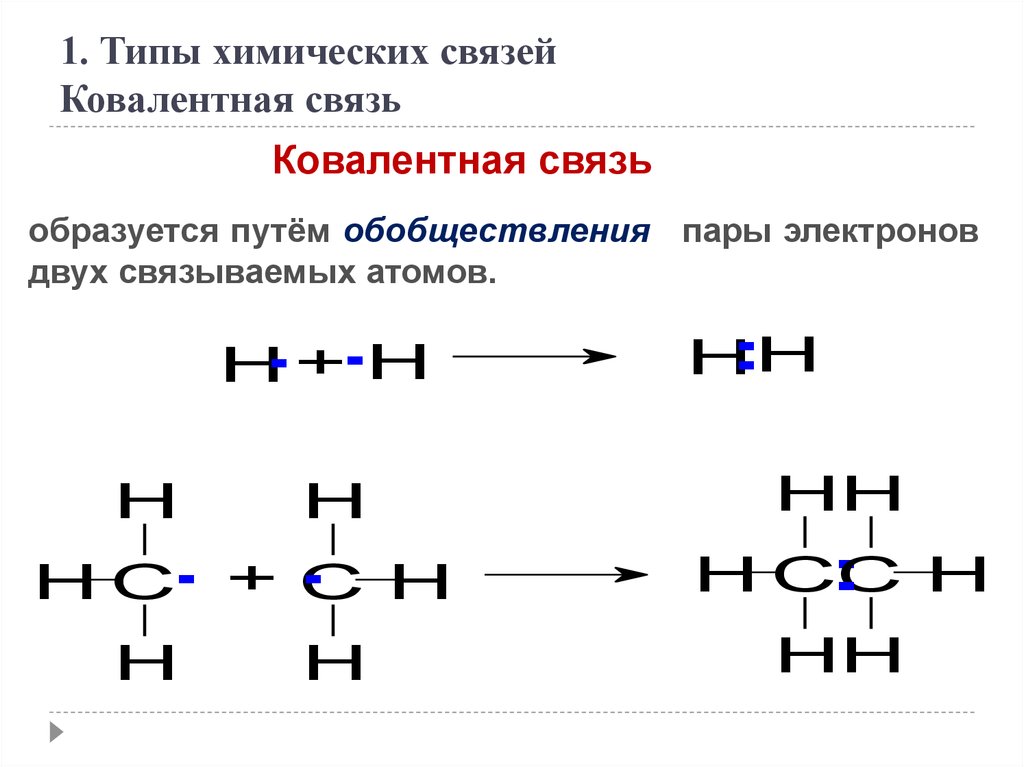
1. Типы химических связейКовалентная связь
Ковалентная связь
образуется путём обобществления пары электронов
двух связываемых атомов.
.+.H
H
.
.H
H
HH
H
H
.
H C.
C H
H
H
HH
H C. + .
C H
10.
1. Типы химических связейКовалентная связь
-связь – одинарная ковалентная связь, образованная при «осевом»
перекрывании АО вдоль оси, соединяющей ядра атомов с максимумом
перекрывания на этой прямой
10
11.
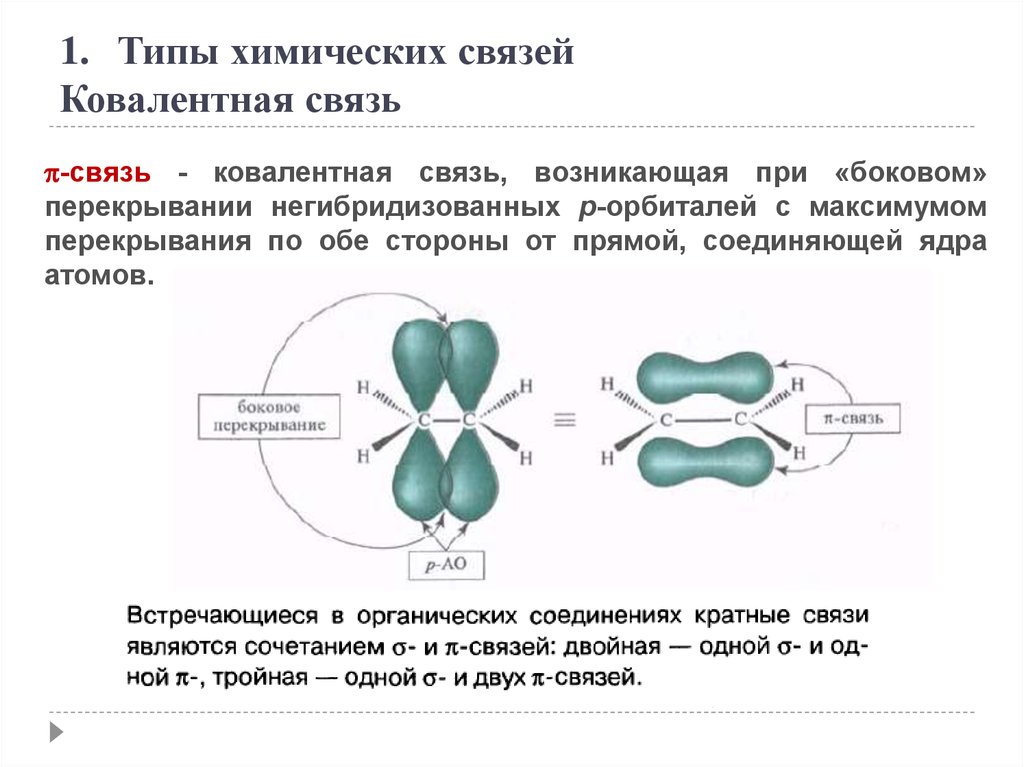
1. Типы химических связейКовалентная связь
-связь - ковалентная связь, возникающая при «боковом»
перекрывании негибридизованных p-орбиталей с максимумом
перекрывания по обе стороны от прямой, соединяющей ядра
атомов.
12.
1. Типы химических связейКовалентная связь. Характеристики
12
13.
1. Типы химических связейКовалентная связь. Характеристики
13
14.
15.
1. Типы химических связейКовалентная связь. Характеристики
15
16.
1. Типы химических связейКовалентная связь. Характеристики
16
17.
1. Типы химических связейКовалентная связь. Механизмы образования
обменный механизм
донорно-акцепторная связь
носители неподеленных пар
17
18.
1. Типы химических связейКовалентная связь. Механизмы образования
донорно-акцепторная связь
18
19.
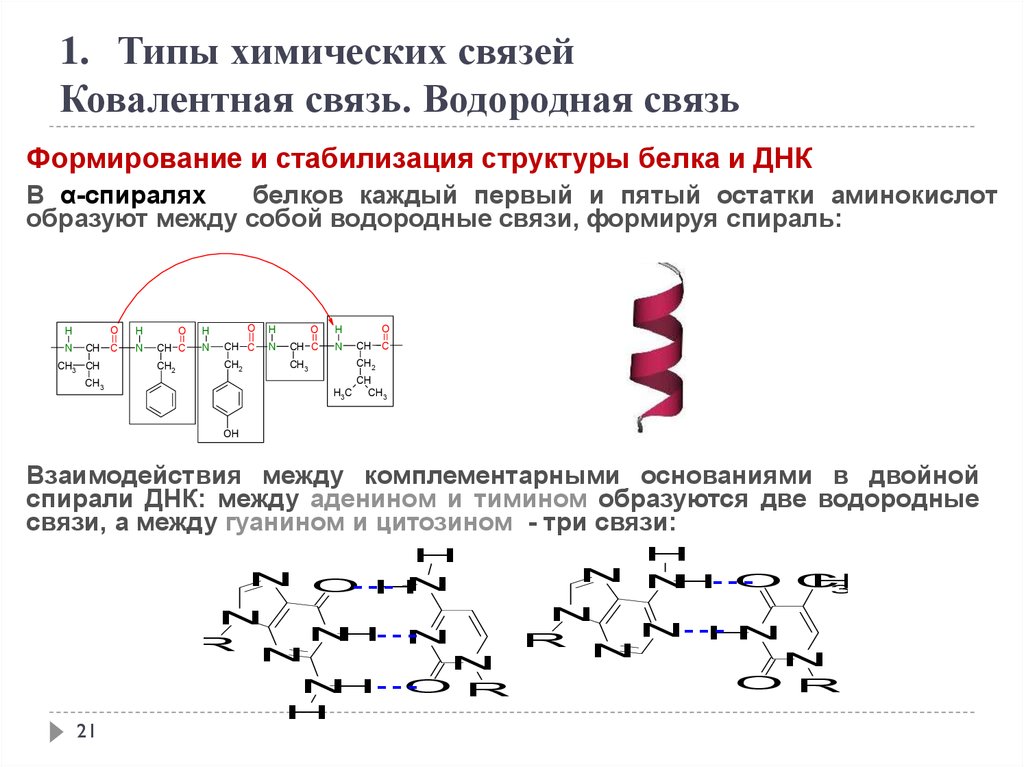
1. Типы химических связейКовалентная связь. Водородная связь
19
20.
1. Типы химических связейКовалентная связь. Водородная связь
20
21.
1. Типы химических связейКовалентная связь. Водородная связь
Формирование и стабилизация структуры белка и ДНК
В α-спиралях
белков каждый первый и пятый остатки аминокислот
образуют между собой водородные связи, формируя спираль:
H
N
CH
CH3 CH
O
H
O
H
O
H
O
H
C
N
CH C
N
CH C
N
CH C
N
CH2
CH2
CH3
O
CH
C
CH2
CH3
H3C
CH
CH3
OH
Взаимодействия между комплементарными основаниями в двойной
спирали ДНК: между аденином и тимином образуются две водородные
связи, а между гуанином и цитозином - три связи:
H
N O
..
.N
H
N
...
N
H
N
R
N
N
21
..
N
H.
O R
H
N
H
..O
. C
H
N
H
3
N
.H
.N
N.
R
N
N
O R
22.
1. Типы химических связейПроверка усвоения материала
1.Определите тип гибридизации атомов углерода,
соединениях
А, Б, В. Назовите
соединения ,
номенклатуры IUPAC.
А.
В.
СН3-СН2- СН2-ОН
СН3- NН–С2 Н5
Б.
кислорода, азота в
используя правила
СН2 = СН – СН2 - СН=О
2. Сделайте обозначения, характеризующие направление поляризации
всех указанных связей в соединениях ( А – Г )
А. СН3 – Вr
Б.
С2Н5– О-Н
В. СН3-NН - С2Н5
Г.
С2Н5 – СН= О
22
23.
2. Сопряжение. Сопряженные системы23
24.
2. Сопряжение. Сопряженные системыСопряжение – это образование в молекуле единого делокализованного
электронного облака в результате перекрывания негибридизованных рорбиталей.
24
25.
2. Сопряжение. Сопряженные системы.Ароматичность
В результате сопряжения выделяется энергия, внутренняя энергия уменьшается, и молекула
становится термодинамически более устойчивой.
Энергия сопряжения – это энергия, выделяющаяся в результате сопряжения (т.е. это
энергетический выигрыш в результате сопряжения)
CH2 =CH-CH 2-CH=CH 2 _ E 1
CH =CH-CH=CH-CH
_
Энергия сопря жения :
E = E 1_ E 2
E2
2 цепи сопряжения
3
С увеличением
энергия
сопряжения увеличивается.
25
26.
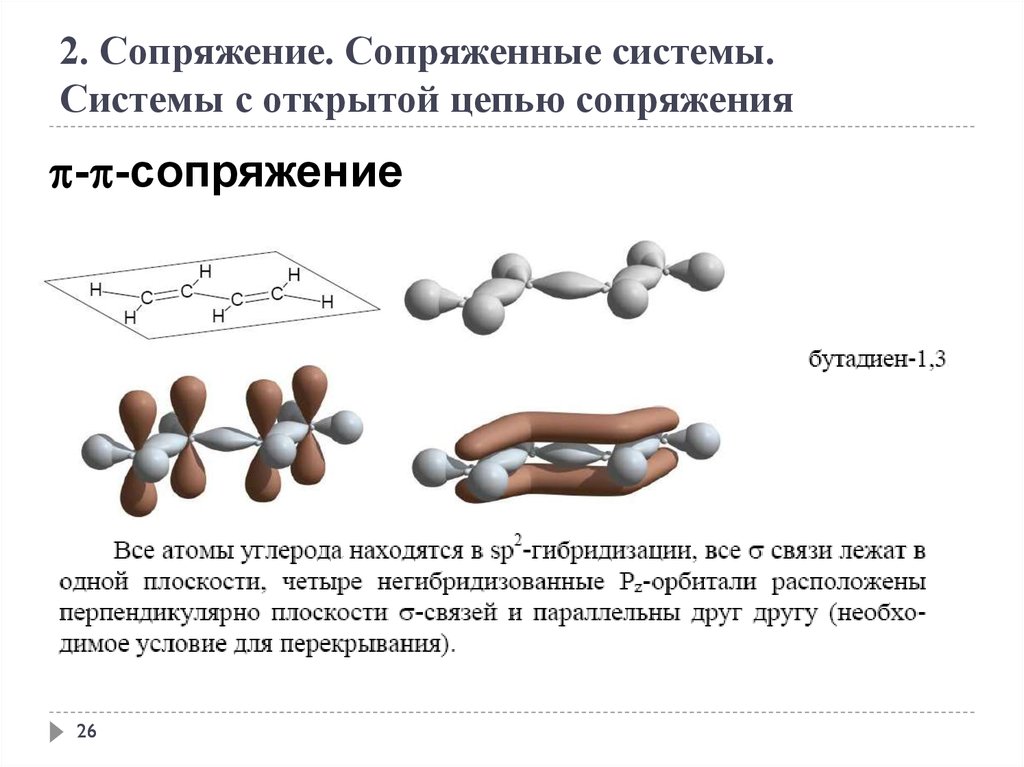
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
- -сопряжение
26
27.
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
- -сопряжение
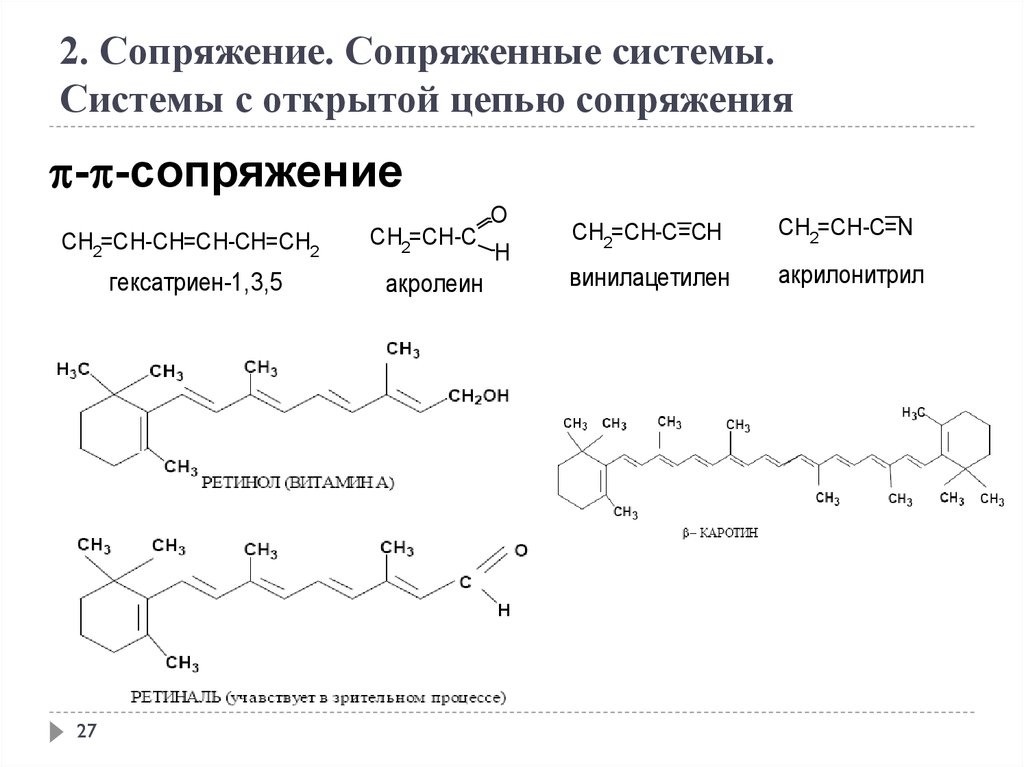
CH2=CH-CH=CH-CH=CH2
гексатриен-1,3,5
27
CH2=CH-C
акролеин
O
H
CH2=CH-C=CH
CH2=CH-C=N
винилацетилен
акрилонитрил
28.
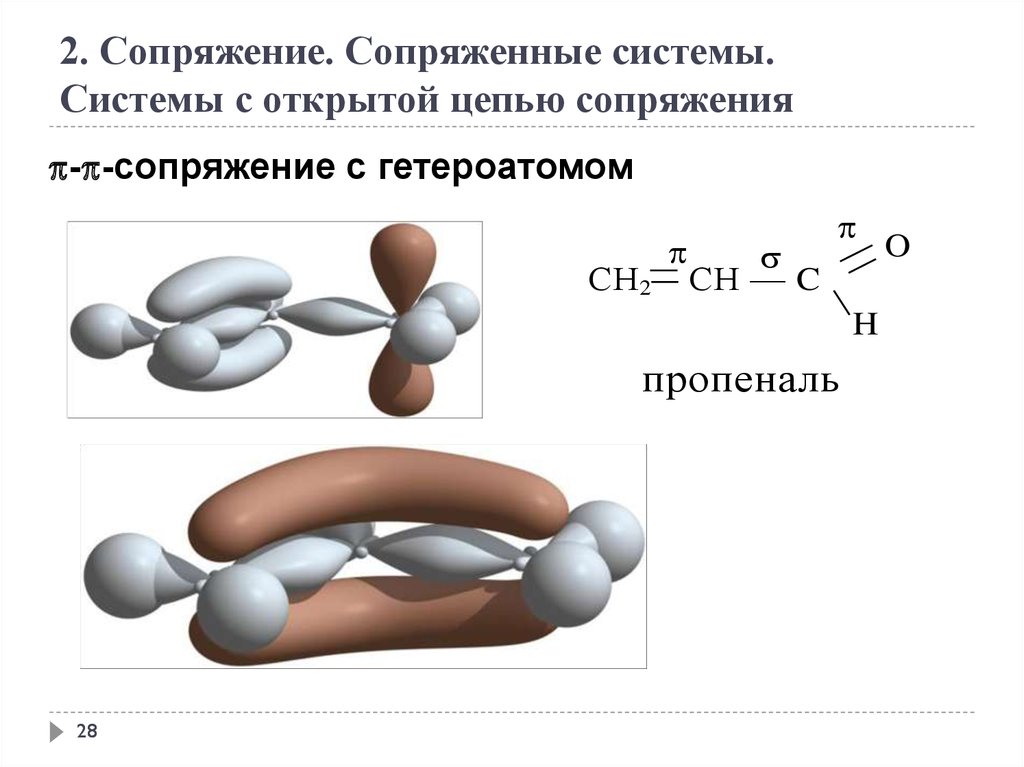
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
- -сопряжение с гетероатомом
СН 2
СН — C
H
пропеналь
28
O
29.
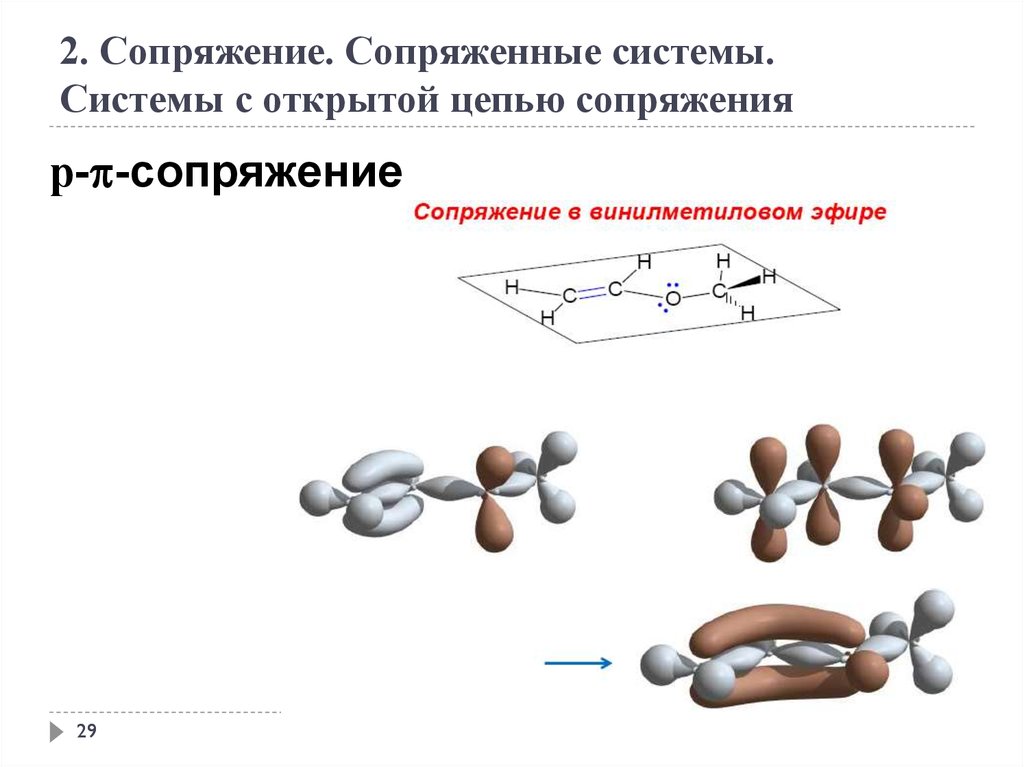
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
р- -сопряжение
29
30.
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
р- -сопряжение
30
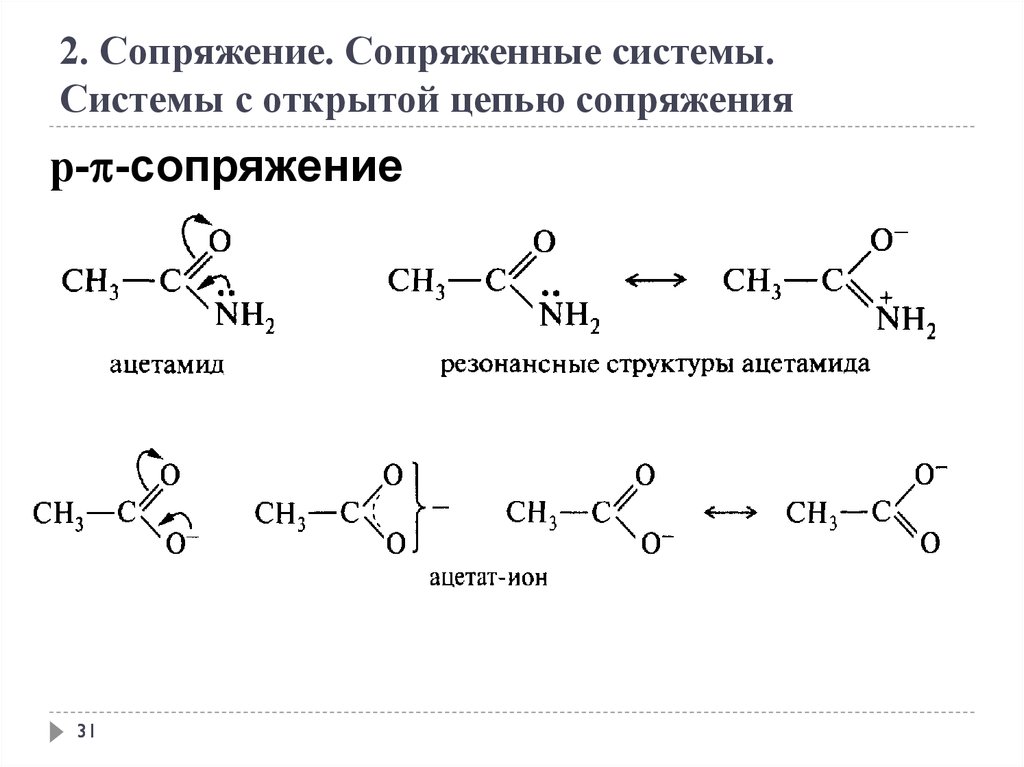
31.
2. Сопряжение. Сопряженные системы.Системы с открытой цепью сопряжения
р- -сопряжение
31
32.
33.
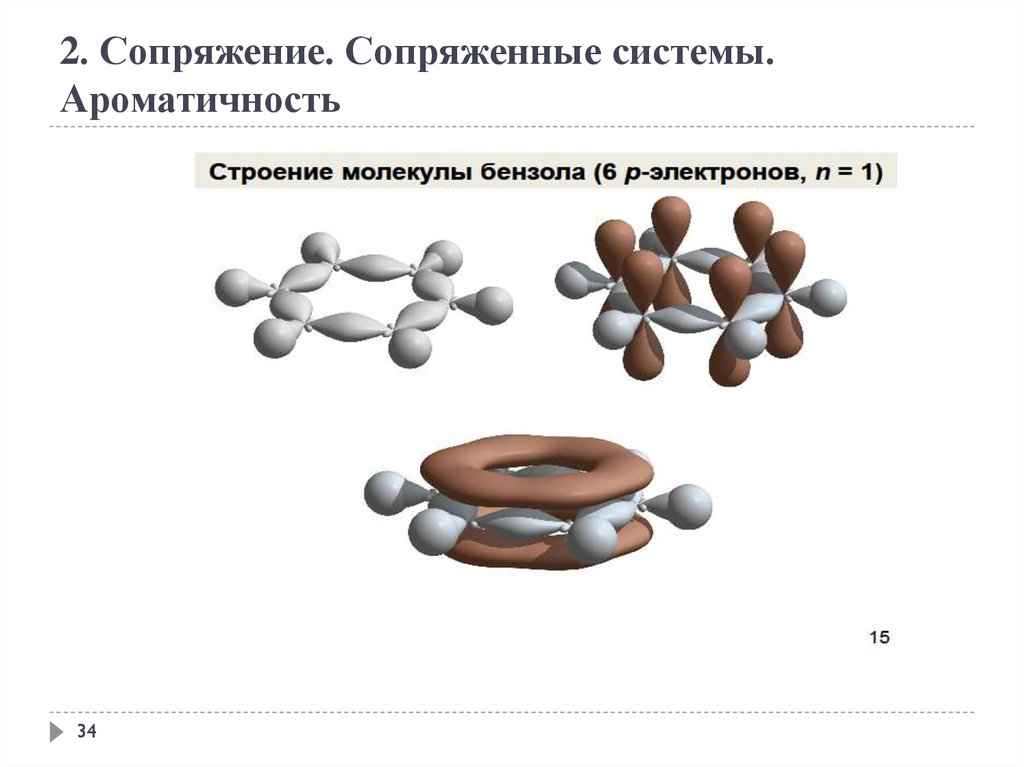
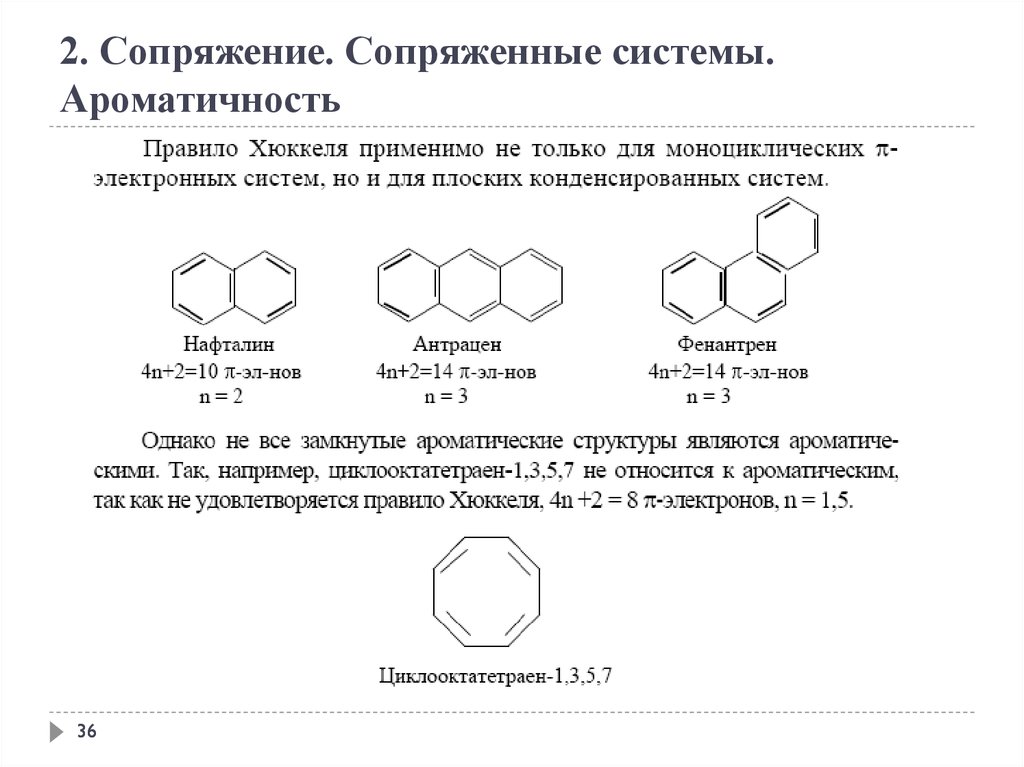
2. Сопряжение. Сопряженные системы.Ароматичность
Ароматичность — особое свойство некоторых химических соединений,
благодаря которому сопряженное кольцо ненасыщенных связей
проявляет аномально высокую стабильность; большую, чем та, которую
можно было бы ожидать только при одном сопряжении.
Правило Хюккеля.
Система ароматична, если она обладает совокупностью
следующих признаков:
а) все атомы в цикле находятся в sр2-гибридизации
(следовательно, -скелет плоскостной);
б) молекула имеет циклическую систему сопряжения;
в) в сопряжении участвует (4n+2) - -электронов, где n —
целое число (n=0,1,2,3,4...).
33
34.
2. Сопряжение. Сопряженные системы.Ароматичность
34
35.
2. Сопряжение. Сопряженные системы.Ароматичность
35
36.
2. Сопряжение. Сопряженные системы.Ароматичность
36
37.
2. Сопряжение. Сопряженные системы.Ароматичность
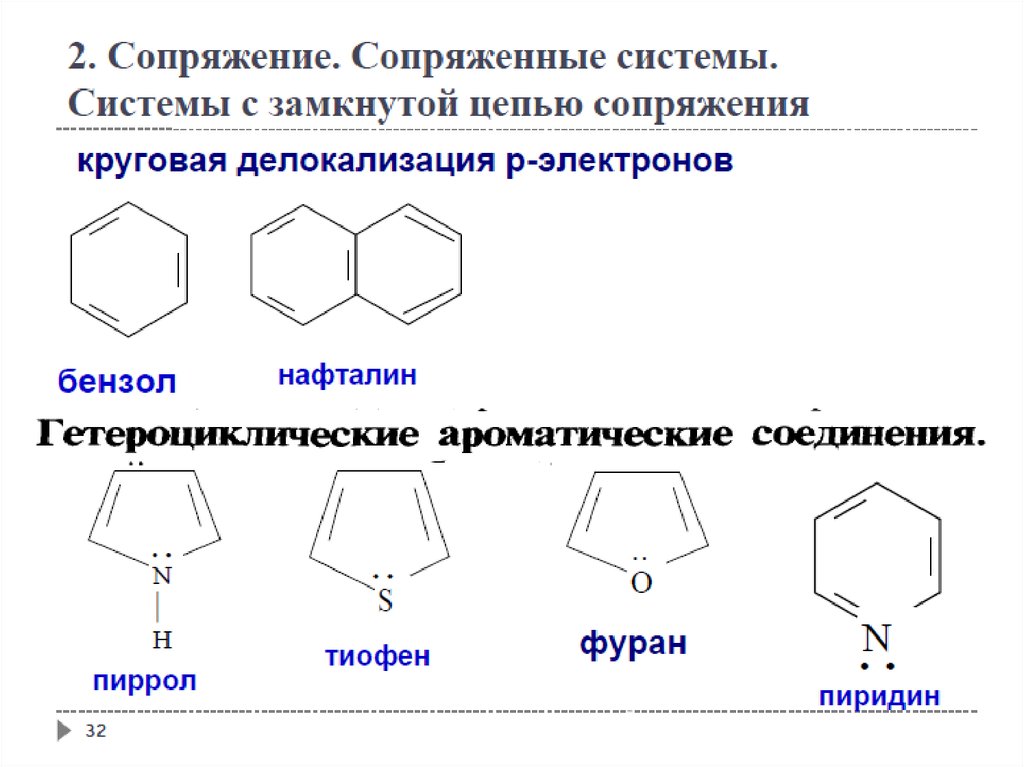
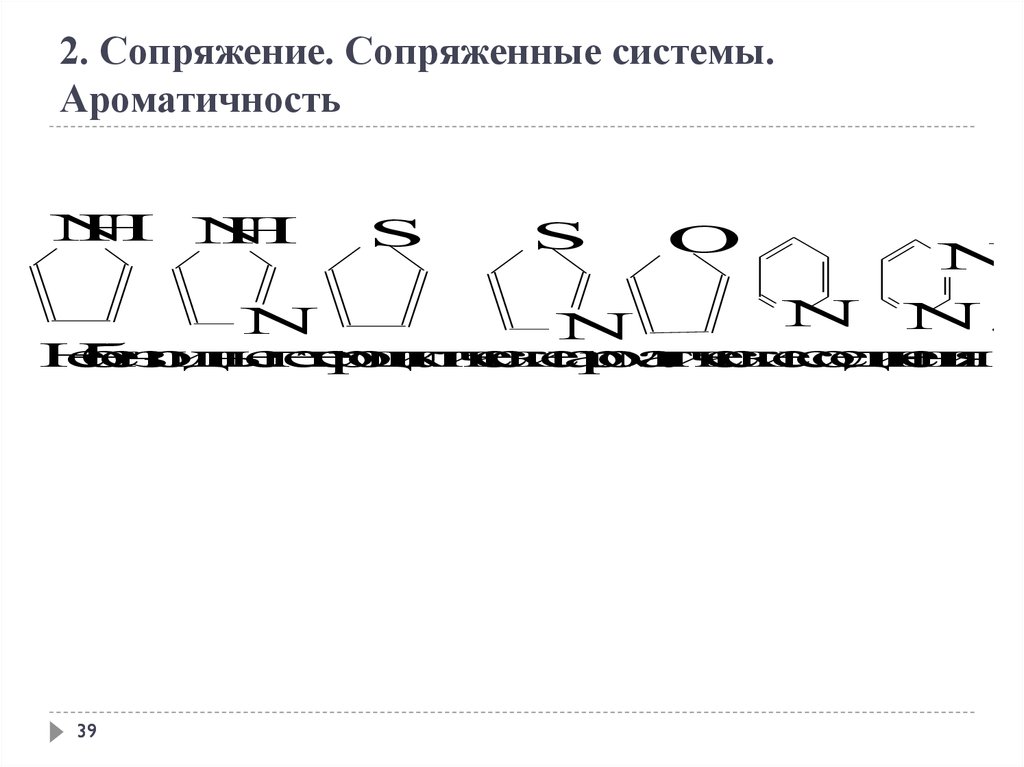
Гетероциклические ароматические соединения
37
38.
2. Сопряжение. Сопряженные системы.Ароматичность
Гетероциклические ароматические соединения
38
39.
2. Сопряжение. Сопряженные системы.Ароматичность
N
H N
H
N
S
S
N
O
N
N
N.
Н
е
б
е
н
з
о
и
д
н
ы
е
г
е
т
е
р
о
ц
и
к
л
и
ч
е
с
к
и
е
а
р
о
м
а
т
и
ч
е
с
к
и
е
с
о
е
д
и
н
е
н
и
я
39
40.
2. Сопряжение. Сопряженные системы.Ароматичность
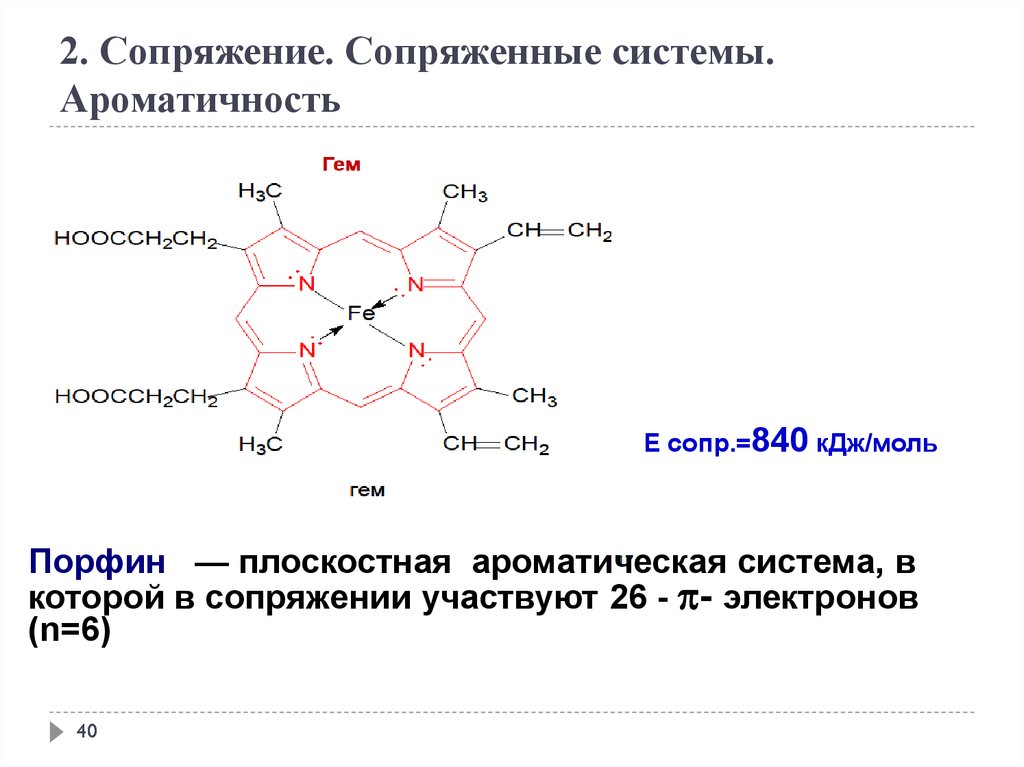
Е сопр.=840 кДж/моль
Порфин — плоскостная ароматическая система, в
которой в сопряжении участвуют 26 - - электронов
(n=6)
40
41.
2. Сопряжение. Сопряженные системы.Ароматичность
Для проверки усвоения раздела
.
1.Укажите число π -электронов в сопряженной системе циклооктатетраена1,3,5,7.
Варианты ответа а. 4 б. 6. в. 7. г. 8 д. 10. е. 12.
2.Несколько циклических соединений имеют плоское строение,
сопряженную систему связей .Число π –электронов в этих соединениях
может быть ( несколько ответов):
а. 14
б 12.
в 10
Какие из них являются ароматическими.?
41
г. 8
д. 6
е. 4
42.
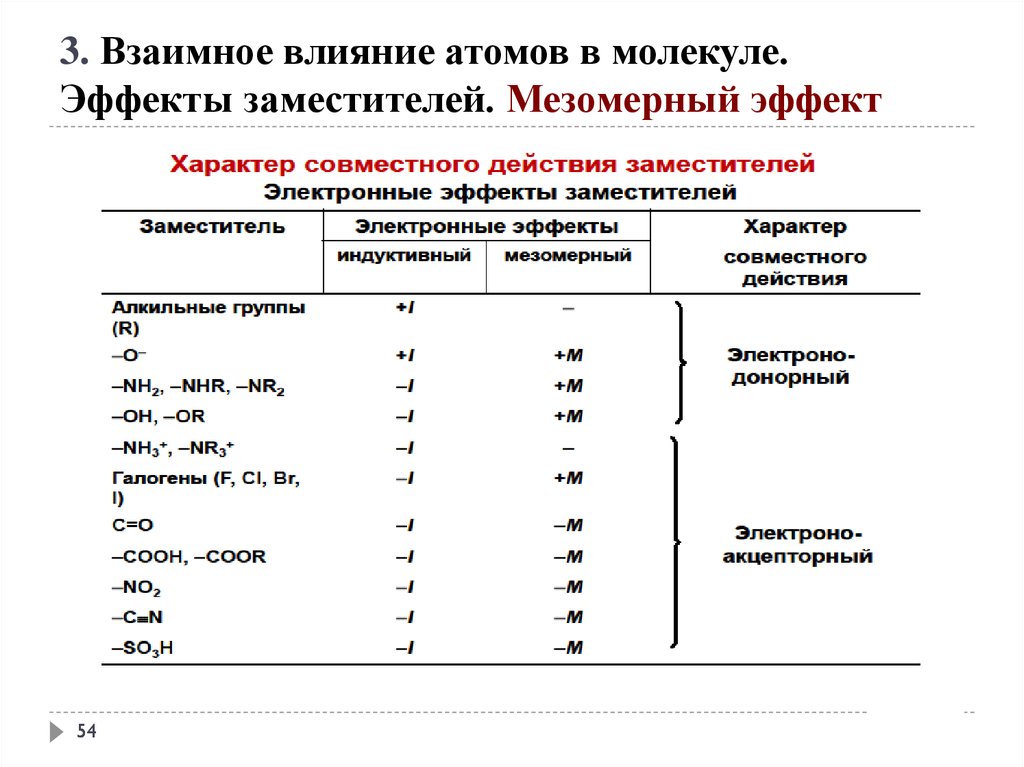
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
42
43.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
Электроноакцепторные
заместители
X,
т.е. атом или группа атомов, смещающие
электронную плотность -связи от атома
углерода,
проявляют
отрицательный
индуктивный эффект (-I-эффект).
C
X
Электронодонорные заместители X, т. е. атом
или группа атомов, смещающие электронную
плотность
к
атому
углерода,
проявляют
положительный
индуктивный
эффект
(+I-эффект).
C
X
43
44.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
44
45.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
45
46.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
–I эффект проявляют
1. заместители, которые содержат атомы с большей ЭО, чем у
углерода:
-F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.;
2. катионы.
+I эффект проявляют заместители, содержащие атомы
с низкой электроотрицательностью:
1. - насыщенные углеводородные радикалы
(-CH3, -C2H5) и т.п.,
(СН3)3С- > (СН3)2 СН- > СН3 — СН2 - > CН3трет.бутил
изопропил
этил
метил
2. -металлы (-Mg-, -Li);
3. - анионы
46
47.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
47
48.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Индуктивный эффект
48
49.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
49
50.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
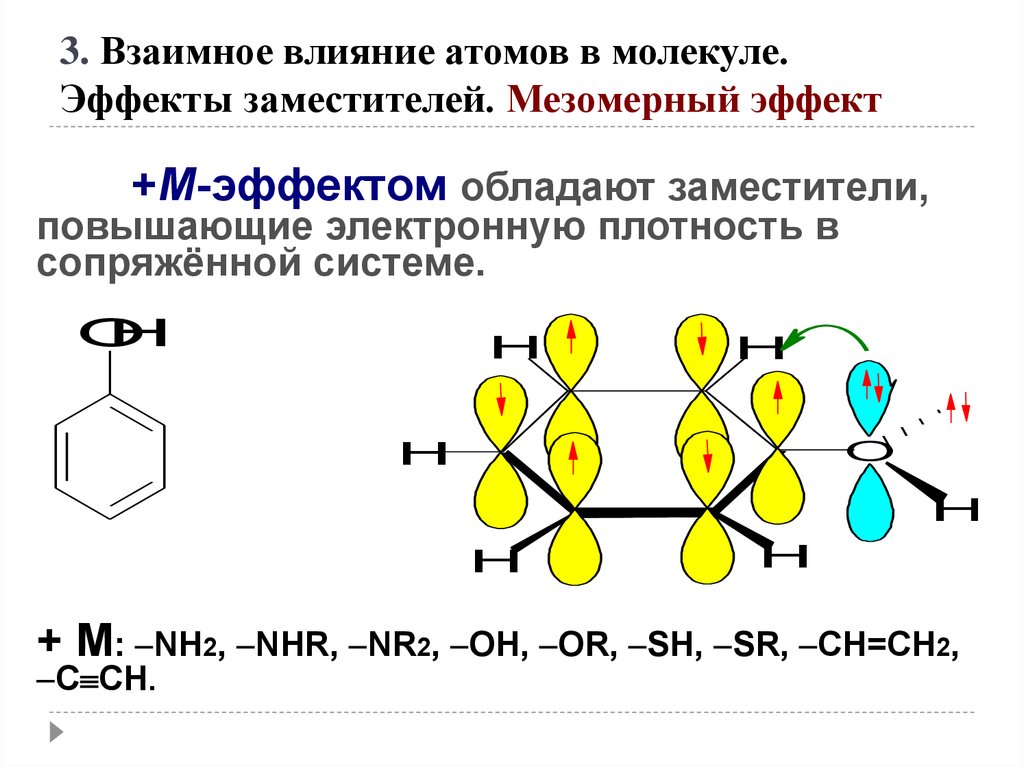
+М-эффектом обладают заместители,
повышающие электронную плотность в
сопряжённой системе.
O
H
H
H
.
O
H
H
H
H
+ М: NH2, NHR, NR2, OH, OR, SH, SR, CH=CH2,
C CH.
51.
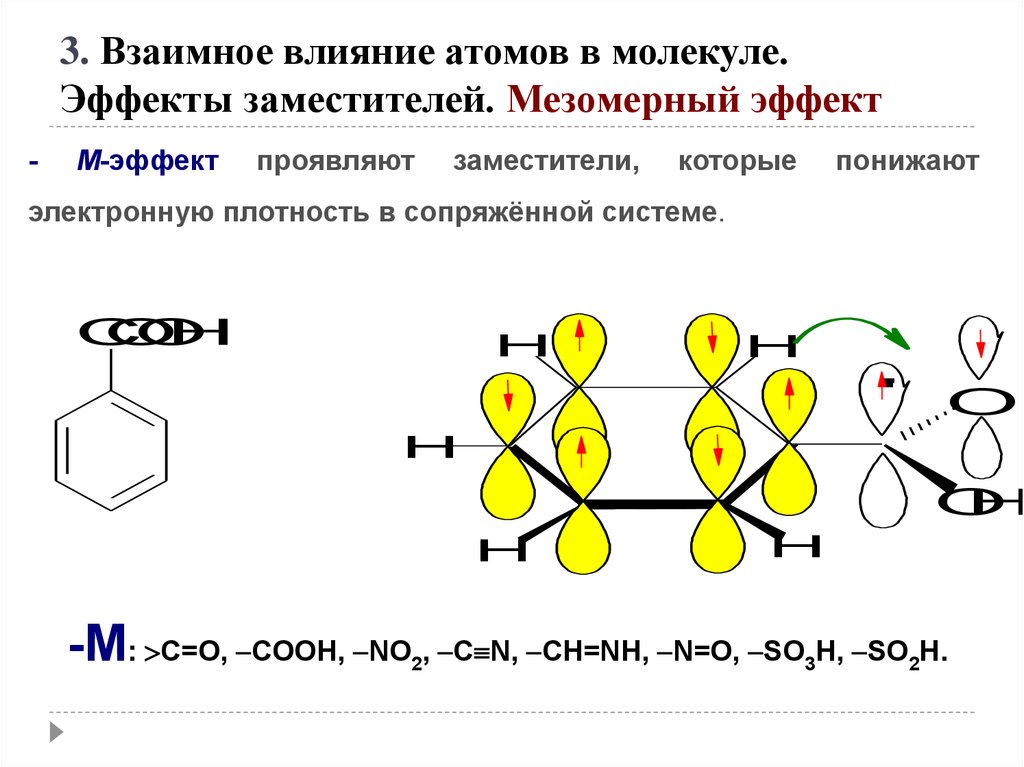
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
-
М-эффект
проявляют
заместители,
которые
понижают
электронную плотность в сопряжённой системе.
C
O
O
H
H
H
.
O
H
O
H
H
H
-M: C=O, COOH, NO , C N, CH=NH, N=O, SO H, SO H.
2
3
2
52.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
52
53.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
53
54.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
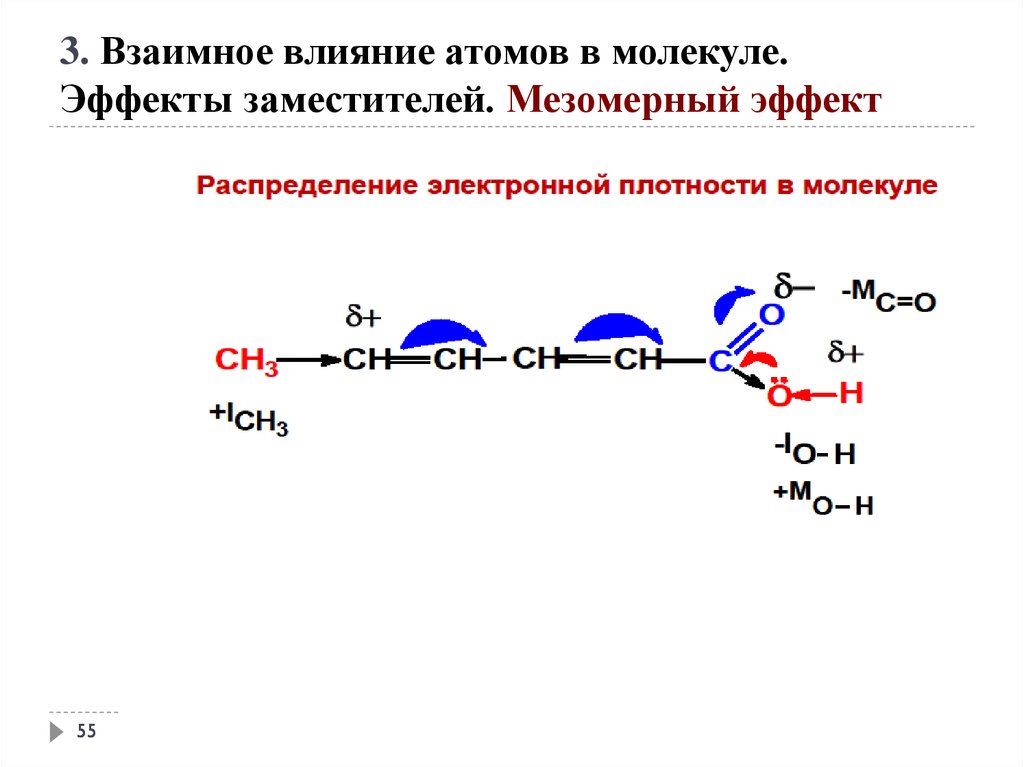
54
55.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
55
56.
3. Взаимное влияние атомов в молекуле.Эффекты заместителей. Мезомерный эффект
Для контроля усвоения
раздела
56





































 Химия
Химия








