Похожие презентации:
Обмен сложных белков. Особенности обмена гемпротеинов и гема
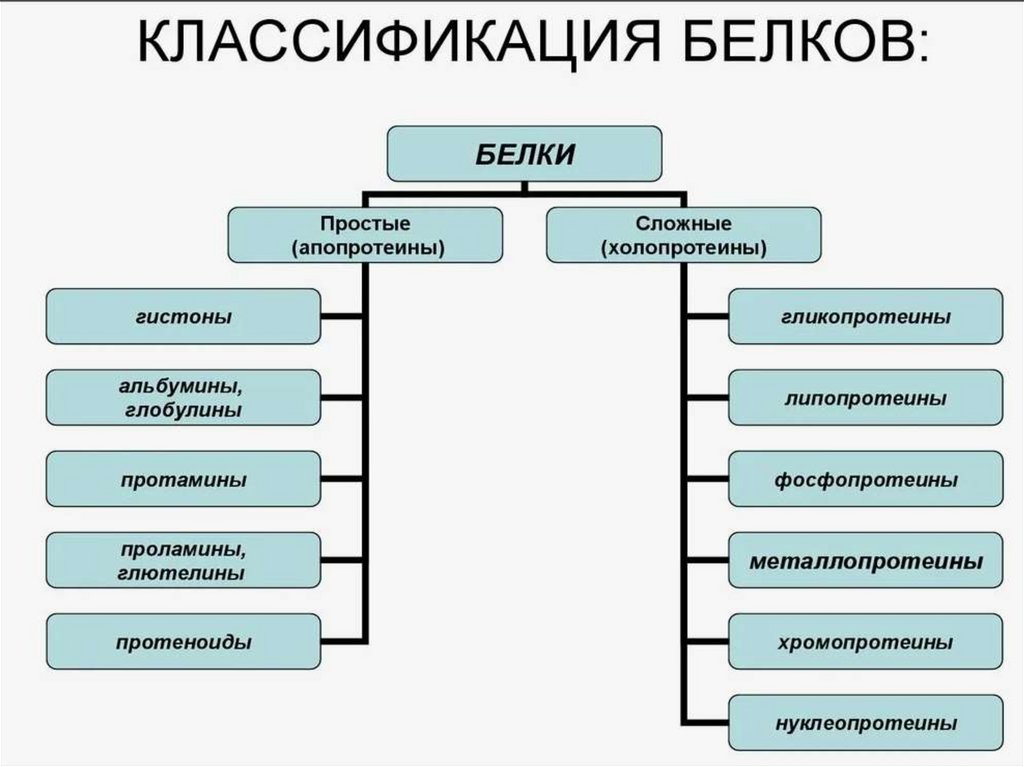
1.
ПЯТИГОРСКИЙ МЕДИКО-ФАРМАЦЕВТИЧЕСКИЙ ИНСТИТУТ-филиал федеральногогосударственного бюджетного образовательного учреждения высшего образования
«Волгоградский государственный медицинский университет» Министерства
здравоохранения Российской Федерации.
Кафедра биологической химии
Специальность: Фармация, 3 курс, 6
семестр
Пятигорск, 2024
2.
3.
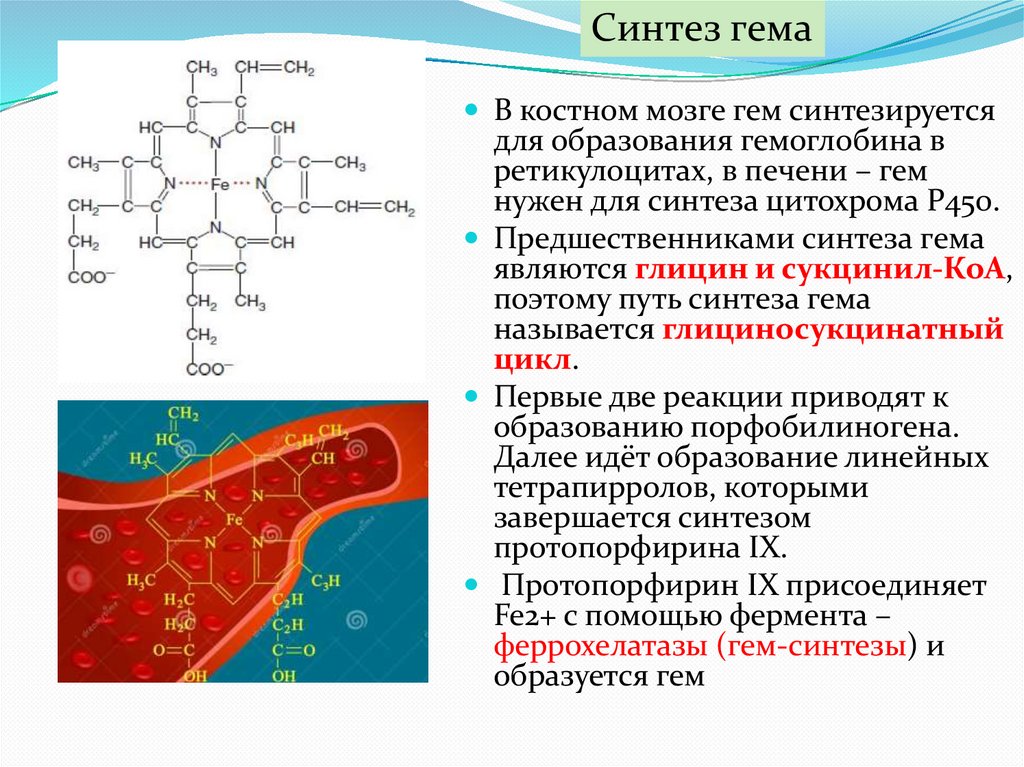
Синтез гемаВ костном мозге гем синтезируется
для образования гемоглобина в
ретикулоцитах, в печени – гем
нужен для синтеза цитохрома P450.
Предшественниками синтеза гема
являются глицин и сукцинил-КоА,
поэтому путь синтеза гема
называется глициносукцинатный
цикл.
Первые две реакции приводят к
образованию порфобилиногена.
Далее идёт образование линейных
тетрапирролов, которыми
завершается синтезом
протопорфирина IX.
Протопорфирин IX присоединяет
Fe2+ с помощью фермента –
феррохелатазы (гем-синтезы) и
образуется гем
4.
5.
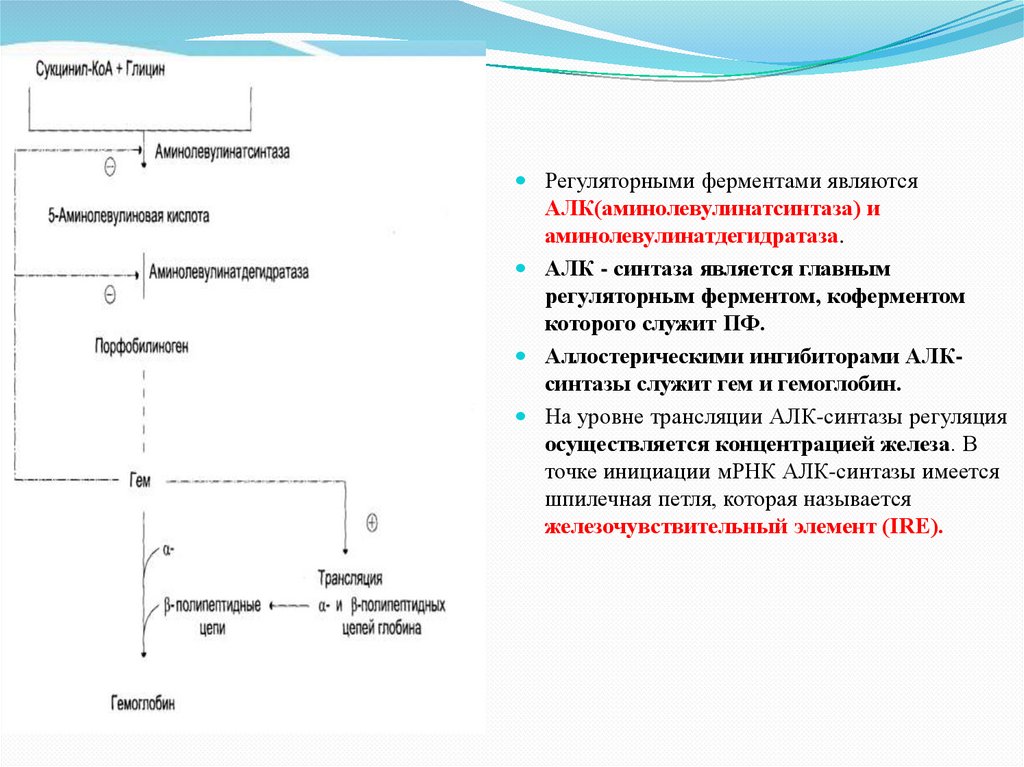
Регуляторными ферментами являютсяАЛК(аминолевулинатсинтаза) и
аминолевулинатдегидратаза.
АЛК - синтаза является главным
регуляторным ферментом, коферментом
которого служит ПФ.
Аллостерическими ингибиторами АЛКсинтазы служит гем и гемоглобин.
На уровне трансляции АЛК-синтазы регуляция
осуществляется концентрацией железа. В
точке инициации мРНК АЛК-синтазы имеется
шпилечная петля, которая называется
железочувствительный элемент (IRE).
6.
Регуляторный железосвязывающий белокпри высокой концентрации железа
связывается с железом и вызывает
снижение сродства этого белка к IRE –
элементу мРНК АЛК-синтазы и это
стимулирует продолжение трансляции.
При низких концентрациях железа
увеличивается сродство
железосвязывающего белка к IREэлементу мРНК АЛК-синтазы и
трансляция аминолевулинатсинтетазы
тормозится.
Недостаток ПФ и ЛС – аналоги ПФ
снижают активность АЛК-синтазы.
Стероиды, барбитураты,
сульфаниламиды, эстрогены – индукторы
синтеза АЛК
7.
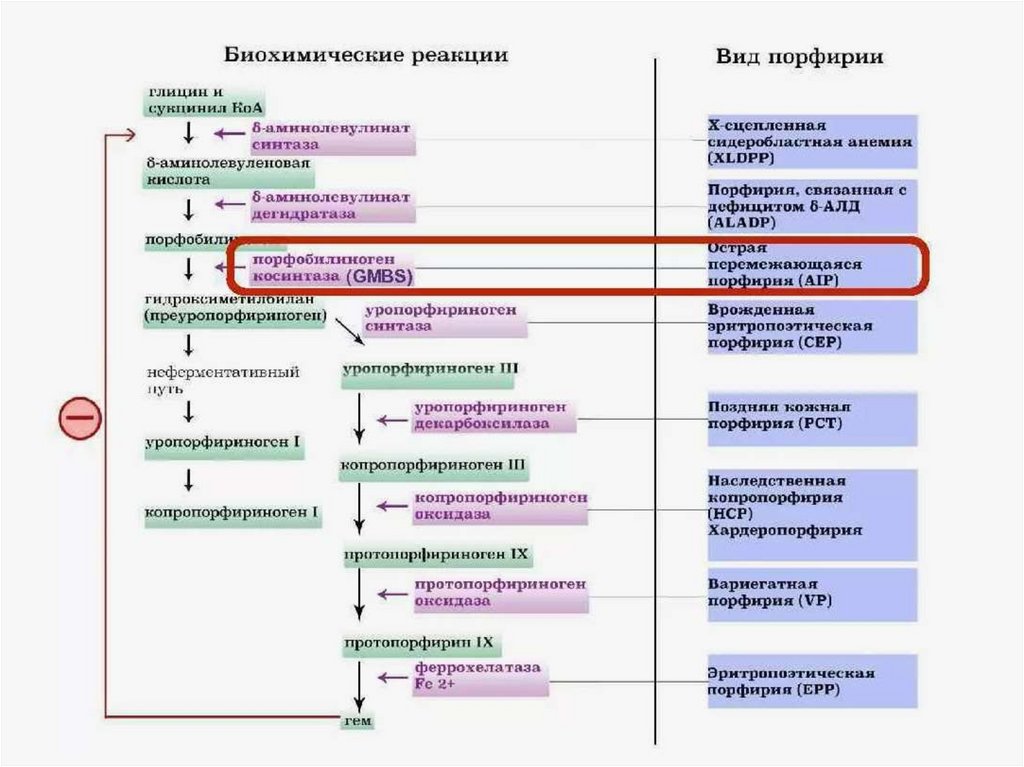
Нарушения синтеза гема. ПорфирииПорфирии – болезни, связанные с
нарушением работы ферментов синтеза гема.
Первичные порфирии обусловлены
генетическими дефектами ферментов
синтеза гема, вторичные связаны с
нарушениями регуляции синтеза гема.
В зависимости от основной локализации
патологического процесса различают
печёночные и эритропоэтические
наследственные порфирии. При этом
эритропоэтические порфирии
сопровождаются накоплением порфиринов в
нормобластах и эритроцитах, а печёночные –
в гепатоцитах.
Порфириногены не окрашены, но на свету
они легко переходят в порфирины, которые
проявляют красную флуоресценцию в
ультрафиолетовых лучах.
8.
В коже на солнце кислород реагирует с порфиринами и переходитв синглетное состояние. В этой форме он вызывает ПОЛ
клеточных мембран и разрушение клеток, поэтому порфирии
часто сопровождаются фотосенсибилизацией и изъязвлением
открытых участков кожи.
Аминолевулинат и порфириногены являются нейротоксинами,
что приводит к нейропсихическим расстройствам.
Приём лекарств – индукторов АЛК – синтазы – сульфаниламидов,
барбитуратов, диклофенака, стероидов, гестогенов – может
вызвать обострение порфирии.
В период полового созревания при повышении образования βстероидов идёт индукция синтеза АЛК-синтазы и проявляются
симптомы порфирий.
Порфирии наблюдаются и при отравлении солями свинца, т.к.
свинец ингибирует АЛК-дегидратазу и феррохелатазу.
9.
10.
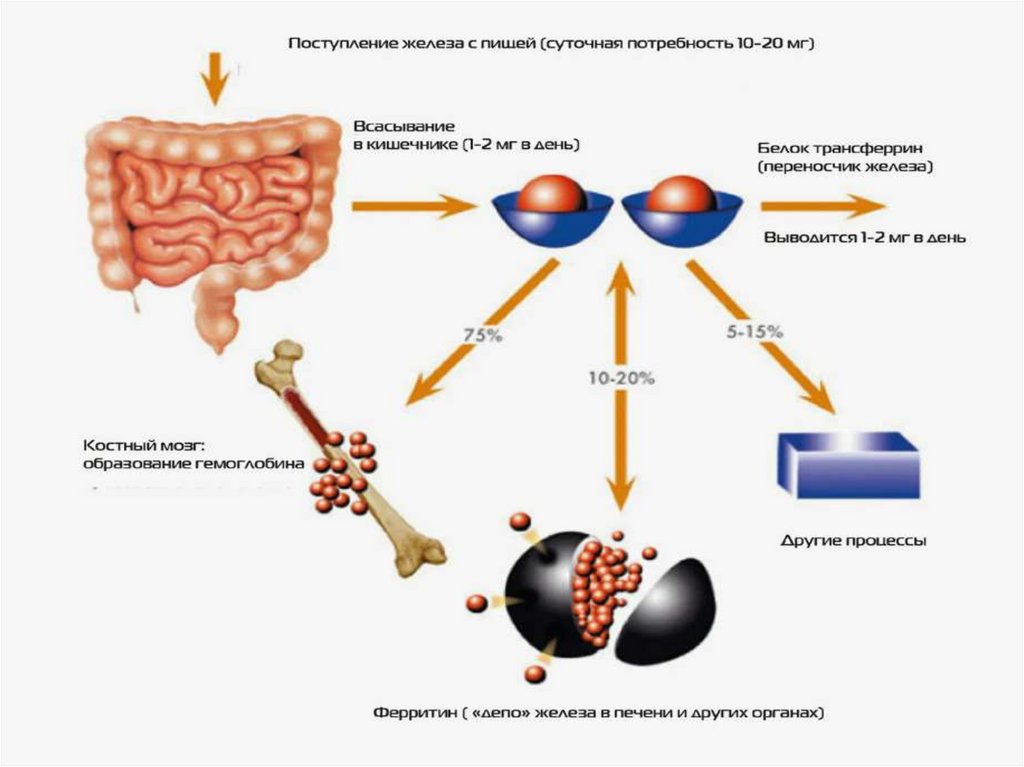
Обмен железаИсточником железа для синтеза гема служат пищевые продукты и железо,
освобождающееся при распаде эритроцитов.
Основные источники железа:
- Экзогенный – пищевые продукты. Средний суточный прием железа с пищей – 20 мг .
Всасывается менее 10% от этого количества (1-2 мг/сутки) .Покрывает физиологические
потери железа (1-2 мг/сутки)
Эндогенный – железо, освобождающееся при распаде гемоглобина в печени и селезенке (21
– 24 мг/сутки) используется вновь для синтеза гемоглобина (97% ежедневной потребности в
железе). В организме не существует механизма физиологической экскреции железа,
поэтому адсорбция контролирует его глобальное содержание в организме.
В гем-содержащих белках железо находится в составе гема.
В негемовых железосодержащих белках железо непосредственно связывается с
белком. К таким белкам относят трансферрин, ферритин,
рибонуклеотидредуктазу, ксантиноксидазу и др.
В организме взрослого человека содержится 3-5 г. железа. В пище железо находится в
окисленном состоянии (Fe+3 ). При кислом значении pH желудка железо выделяется из
солей органических кислот. Аскорбиновая кислота , содержащаяся в пище, восстанавливает
железо и улучшает его всасывание и в клетки слизистой оболочки кишечника поступает
железо в виде Fe+2 .
11.
12.
Регуляция адсорбции железаПервый – отражает потребность в железе для образования эритроцитов. Этот
процесс стимулируется эритропоэтином. Дефицит эритропоэтина при
почечной недостаточности приводит к анемии.
Второй – свидетельствует о запасах железа в организме. При дефиците железа
происходит повышение адсорбции. При максимальном запасании железа в
печени синтезируется гормон гепсидин. Он выделяется в мочу, ингибирует
адсорбцию железа в кишечнике и связывается с ферропортином, вызывая его
дегратацию. Данный белок является основным экспортером железа, поэтому
большая часть железа остается в энтероците и запасается в ферритине.
13.
14.
Трансферрин и ферритинАпоферритин в энтероцитах связывает железо и
превращается в ферритин – запасную форму
железа.
Железо по крови транспортируется
трансферрином. Трансферрин –
гликопротеин, который синтезируется в печени
и связывает только окисленное железо (Fe+3 ).
Трансферрин синтезируется в печени в
зависимости от потребностей запаса железа.
Каждая молекула трасферрина может связать
максимум 2 иона железа Fe+3 ,связанного с
бикарбонатом.
Биологическая функция трансферрина
Образование диссоциирующих комплексов с
железом. Обеспечение легкодоступного и
нетоксичного пула железа в кровотоке .
Поступающее в кровь железо окисляется
ферментом феррооксидазой (церулоплазмином).
Этом фермент содержит медь.
15.
ФерритинФерритин – олигомерный белок, состоит из 24
протомеров и служит для запасания железа в
клетке. В разных тканях существуют его
изоформы. Ферритин имеет полость, внутри
которой может содержаться до 4500 ионов Fe+3 .
Fe+2 окисляют в Fe+3 тяжёлые цепи ферритина.
Комплекс железа в виде гидрофосфата хранится
внутри сферы, образованной белковой частью
молекулы. Наибольшая часть ферритина
содержится в печени, селезёнке и костном мозге
16.
17.
18.
19.
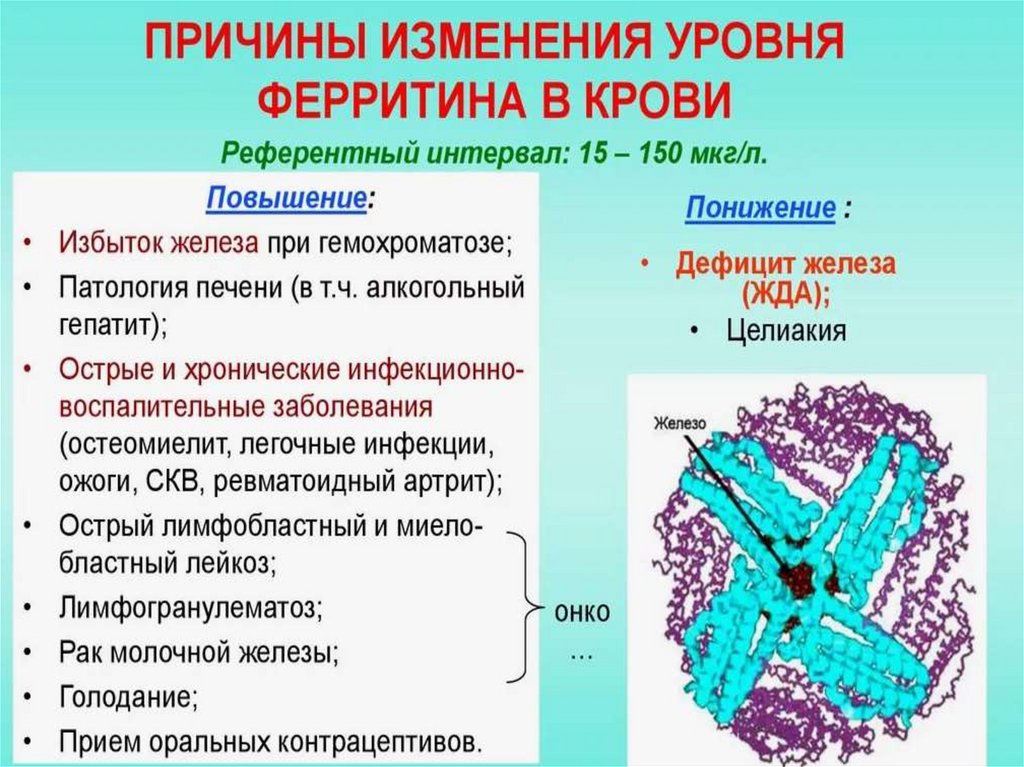
Нарушение метаболизма железаЖелезодефицитная анемия – уменьшение размера
эритроцитов, уменьшение содержания гемоглобина.
Причина: недостаток железа в организме из-за
повторяющихся кровотечений, беременности, частых
родов, язвах и опухолях ЖКТ, после операций на ЖКТ.
Гемохроматоз – увеличение содержания железа в
клетке. При этом ферритин превращается в
гемосидерин. Гемосидерин плохо растворяется в воде,
его накопление приводит к поражению селезёнки,
печени, поджелудочной железы.
Причина: наследственное увеличение всасывания
железа в кишечнике, частые переливания крови
20.
21.
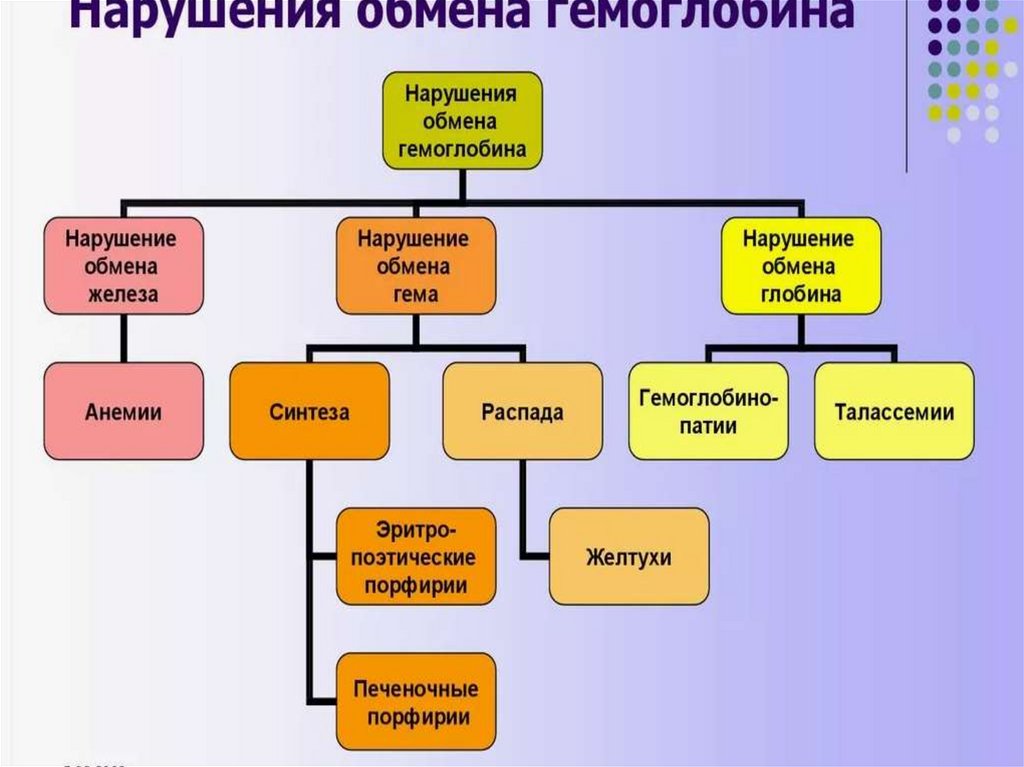
Катаболизм сложных белков, на примерегемоглобина
За сутки у человека распадается около
9 г гемопротеинов, в основном это
гемоглобин эритроцитов.
Эритроциты в норме живут 90-120
дней, после чего
лизируются в клетках
ретикулоэндотелиальной системы –
макрофагах селезенки (главным
образом), купферовских клетках
печени и макрофагах костного мозга.
При разрушении эритроцитов
в кровеносном
русле высвобождаемый гемоглобин
образует комплекс с белкомпереносчиком гаптоглобином (фракц
ия α2-глобулинов крови) и также
переносится в клетки РЭС селезенки,
печени и костного мозга.
22.
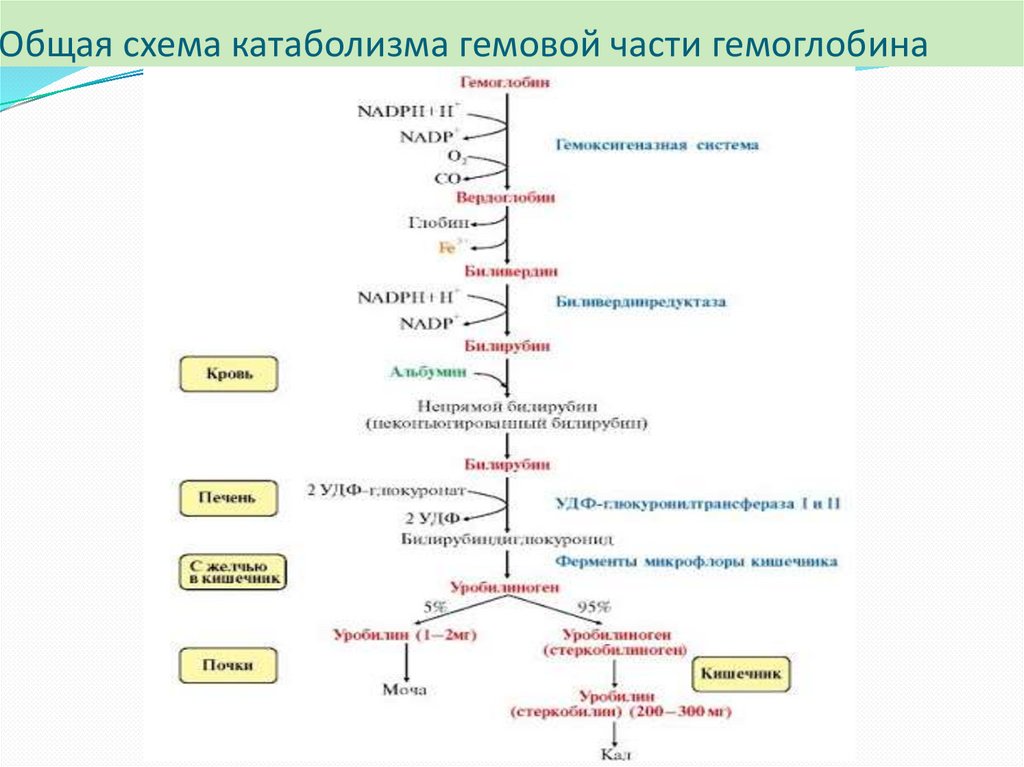
Катаболизм гемоглобинаФагоцитоз «старых» эритроцитов происходит в
макрофагах РЭС селезёнки, печени, костном мозге.
Гемоглобин в этих клетках распадается на гем и
глобин. Глобин затем гидролизуется ферментами
лизосом.
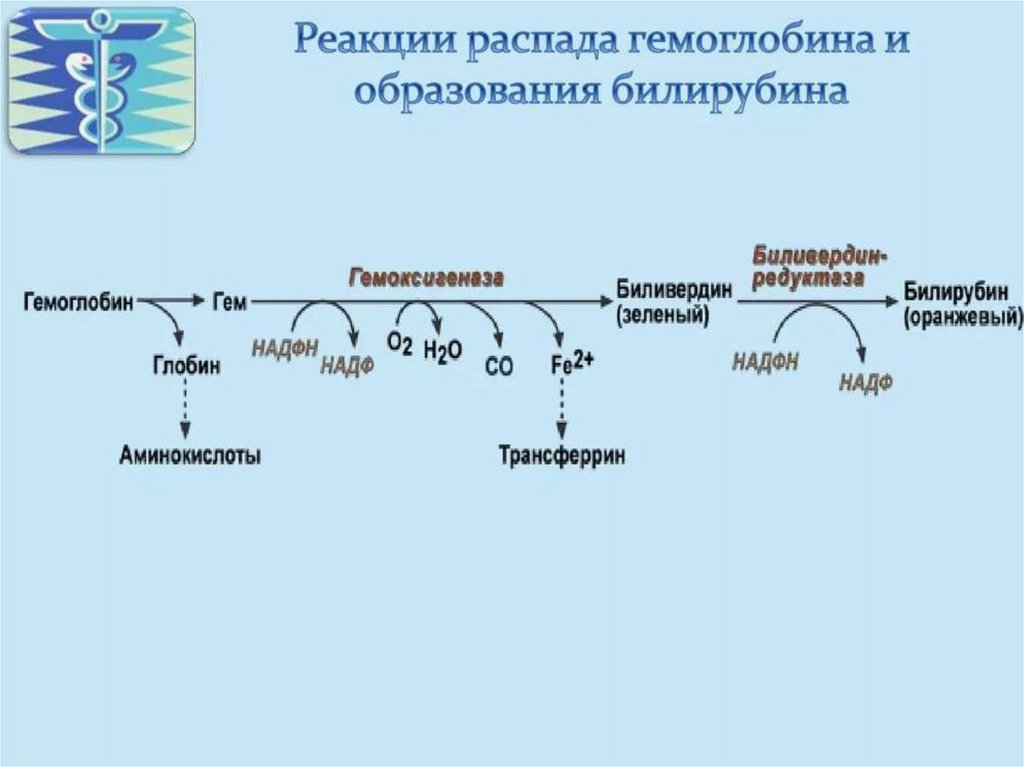
Первая реакция катаболизма гема происходит при
участии НАДФ Н - зависимого фермента
(гемоксигеназы). Образуется биливердин (пигмент
жёлтого цвета). Этот фермент абсолютно специфичен
к гему, его синтез ускоряется гемом через
транскрипцию гемоксигеназы.
23.
24.
25.
Биливердин восстанавливается до билирубина НАДФ Н – зависимойбиливердинредуктазой (в сутки ~ 250-350 мг).
Билирубин – токсичное, жирорастворимое вещество, способное
разобщать окислительное фосфорилирование в клетках. Особенно
чувствительны к нему клетки нервной ткани.
Билирубин плохо растворяется в воде, поэтому в печень
транспортируется в виде комплекса с белками крови - альбуминами
(«непрямой» или неконьюгированный билирубин).
В печень билирубин переносится через мембрану гепатоцитов
белками – лигандином и протеином Z. Эти белки обнаружены так же в
клетках почек и кишечника
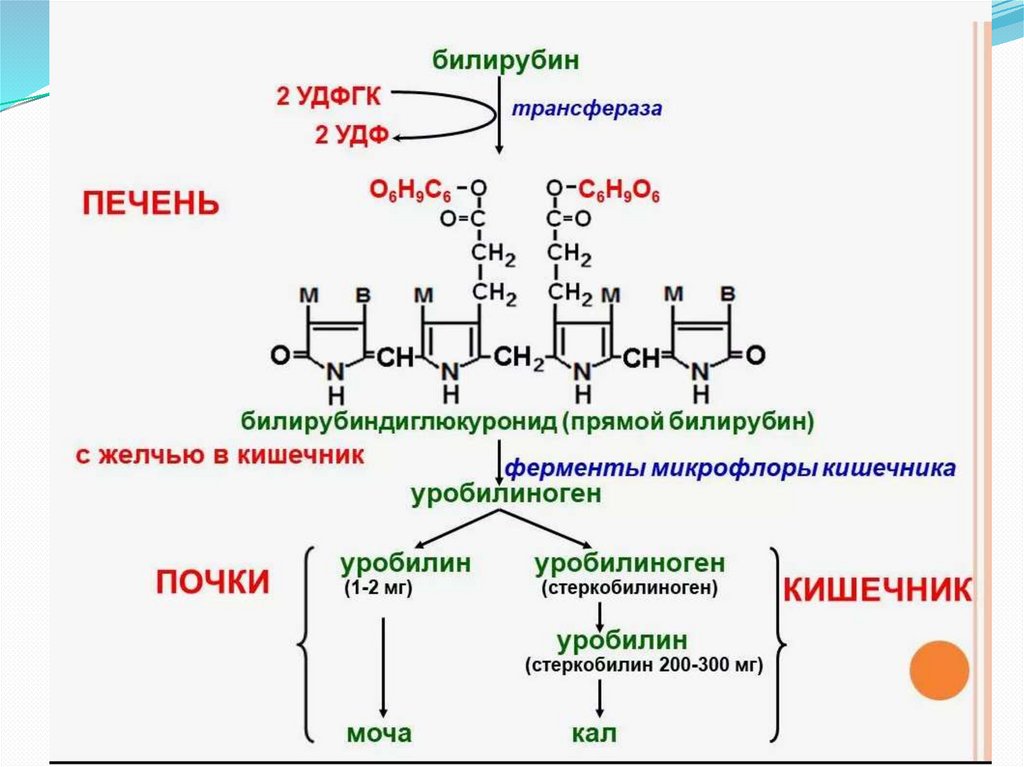
В гладком ЭПР гепатоцитов к билирубину присоединяются две
глюкуроновой кислоты, образуя билирубиндиглюкуронид
(«прямой», или коньюгированный билирубин). Этот коньюгат
хорошо растворим в воде.
26.
27.
Донором глюкуроновой кислоты служитУДФ-глюкуронат. Реакция катализируется
уридинфосфоглюкуронилтрансферазой.
Билирубин – диглюкуронид активным
транспортом переносится с желчью в
кишечник.
В кишечнике билирубинглюкуронид
гидролизуется бактериальными ферментами
β-глюкуронидазами. Освободившийся
билирубин под действием кишечной
микрофлоры восстанавливается в
уробилиногены.
Часть уробилиногенов всасывается в толстой
кишке и попадает в печень, затем вместе с
желчью выводится в кишечник и выделяется
с фекалиями из организма.
Часть уробилиногена из печени попадает в
кровь и удаляется с мочой в виде уробилина.
В норме большая часть бесцветных
уробилиногенов под действием кишечной
микрофлоры окисляется в прямой кишке до
пигмента коричневого цвета – уробилина
(стеркобилин) и удаляется с фекалиями. . В
прямой кишке и на воздухе стеркобилиноген
окисляется в стеркобилин, который
окрашивает кал.
28.
Общая схема катаболизма гемовой части гемоглобина29.
Таким образом, в плазме крови обычноприсутствуют две формы билирубина: свободный
(непрямой), попадающий сюда из клеток РЭС (80% и
более всего количества), и связанный (прямой),
попадающий из желчных протоков (в норме не более
20%).
Термины "связанный", "конъюгированный",
"свободный", "несвязанный" отражают
взаимодействие билирубина и глюкуроновой кислоты
(но не билирубина и альбумина!).
Термины "прямой" и "непрямой" введены, исходя из
возможности химической реакции билирубина
с диазореактивом Эрлиха.
Связанный билирубин реагирует с реактивом напрямую,
без добавления дополнительных реагентов, т.к. является
водорастворимым.
Несвязанный (жирорастворимый) билирубин требует
добавочных реактивов, реагирует не прямо.
30.
Гипербилирубинемия – повышение содержания билирубина в крови. Придостижении концентрации билирубина в крови более 50 мкмоль/л он начинает
диффундировать в ткани и окрашивает их в жёлтый цвет. Пожелтение тканей из-за
отложения в них билирубина называется желтухой.
Виды и причины желтух
Гемолитическая (надпечёночная) желтуха обусловлена усиленным распадом
эритроцитов, наблюдается избыток «непрямого» билирубина, увеличивается
выделение стеркобилиногена и уробилиногена с мочой. «Непрямой» билирубин
повышен до 103-171 мкмоль/л.
Причины: основной причиной являются наследственные или приобретённые
гемолитические анемии при сепсисе, лучевой болезни, дефиците глюкозо-6фосфатдегидрогеназы эритроцитов, талласемиях, отравлении сульфаниламидами).
Обтурационная (механическая или подпечёночная) желтуха обусловлена
закупоркой оттока желчи в кишечник, в крови повышается «прямой» и непрямой
билирубин, уробилина и стеркобилина в моче нет, кал бесцветен. Билирубин
придаёт моче оранжевокоричневый цвет.
Причины: закупорка желчных протоков камнями. Опухоли, послеоперационное
сужение общего желчного протока.
Паренхиматозная печёночная желтуха обусловлена поражением печени при
острых вирусных инфекциях, хроническом и токсическом гепатите.
Причины: поражение и некроз части печёночных клеток. Происходит задержка
билирубина в печени, снижается перевод прямого билирубина из клеток в желчь. В
поражённых гепатоцитах преобладают моноглюкурониды. В крови общий
билирубин повышен, кал меньше окрашен, моча приобретает более интенсивную
окраску.
31.
Желтуха новорождённых (физиологическая) обусловлена усиленной скоростьюраспада эритроцитов и замедленное удаление печенью билирубина крови.
Причина: недостаточность функций белков и ферментов печени, ответственных за
поглощение, коньюгацию и секрецию прямого билирубина. Новорождённым с
физиологической желтухой вводят лекарственный препарат фенобарбитал
(индуктор УДФ-глюкуронилтрансферазы). Осложнением физиологической желтухи
может быть билирубиновая энцефалопатия.
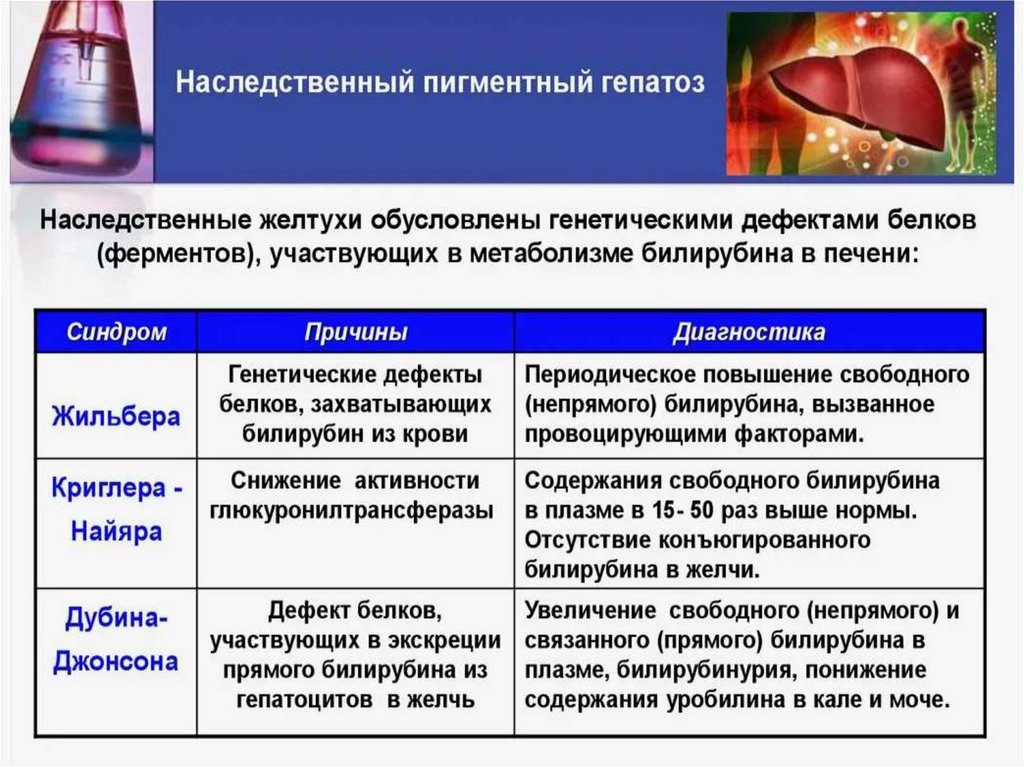
Наследственные желтухи.
Причина: генетические нарушения в структуре белков и ферментов, ответственных
за транспорт (захват) «непрямого» билирубина в печень и его коньюгацию с
глюкуроновой кислотой.
Первый тип наследственных желтух – полное отсутствие УДФглюкуронилтрансферазы (аутосомно-рецессивный тип). Введение фенобарбитала не
приводит к снижению уровня билирубина.
Второй тип наследственных желтух – снижение (недостаточности) УДФ –
глюкуронилтрансферазы. Повышен «непрямой» билирубин. Желтуха хорошо
поддаётся лечению фенобарбиталом.
Желтухи, связанные с нарушением активного траспорта билирубинглюкуронидов из
печени в желчь наследуется по аутосомно-доминантному типу. Проявляется
гипербилирубинемией за счёт «прямого» билирубина и билирубинурией (в моче
определяется «прямой» билирубин).
Семейная гипербилирубинемия новорождённых связана с наличием конкурентных
ингибиторов коньюгации билирубина (эстрогенов, свободных жирных кислот, в
материнском молоке). Это транзиторная гипербилирубинемия. Она исчезает при
переводе ребёнка на искусственное вскармливание. Не поддающаяся лечению
гипербилирубинемия приводит к развитию билирубиновой энцефалопатией и
ранней смерти.






















 Медицина
Медицина








