Похожие презентации:
Ионная полимеризация и синтез стереорегулярных полимеров
1.
1 Ионная полимеризация и синтезЛЕКЦИЯ 2
стереорегулярных полимеров
+
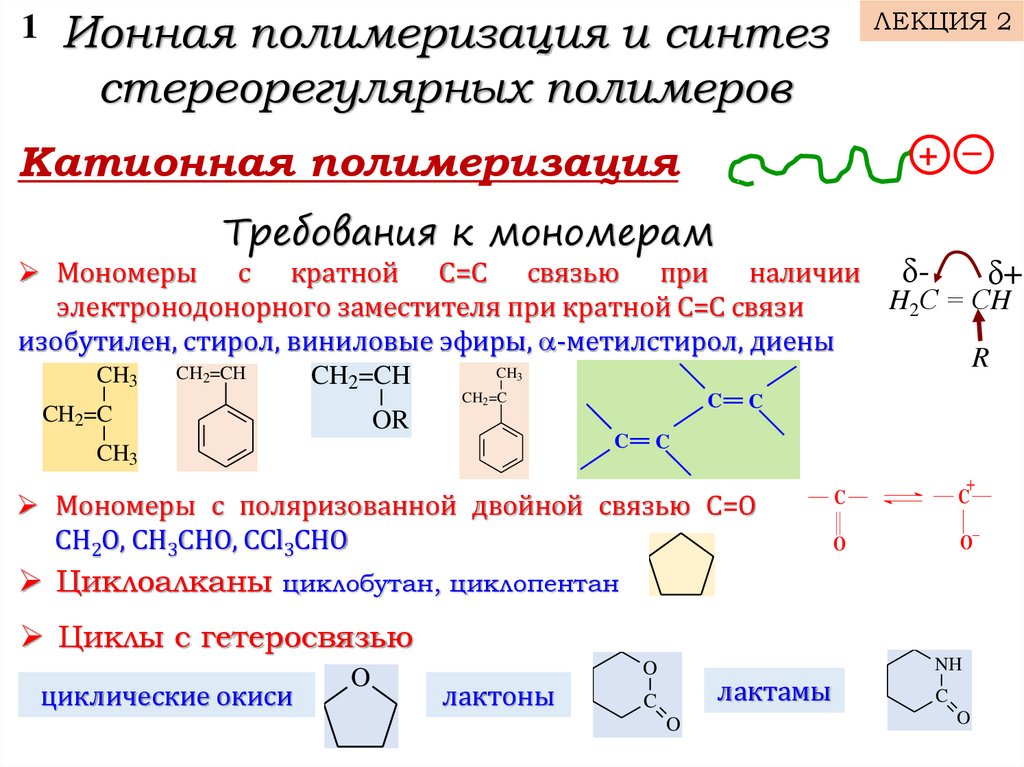
Катионная полимеризация
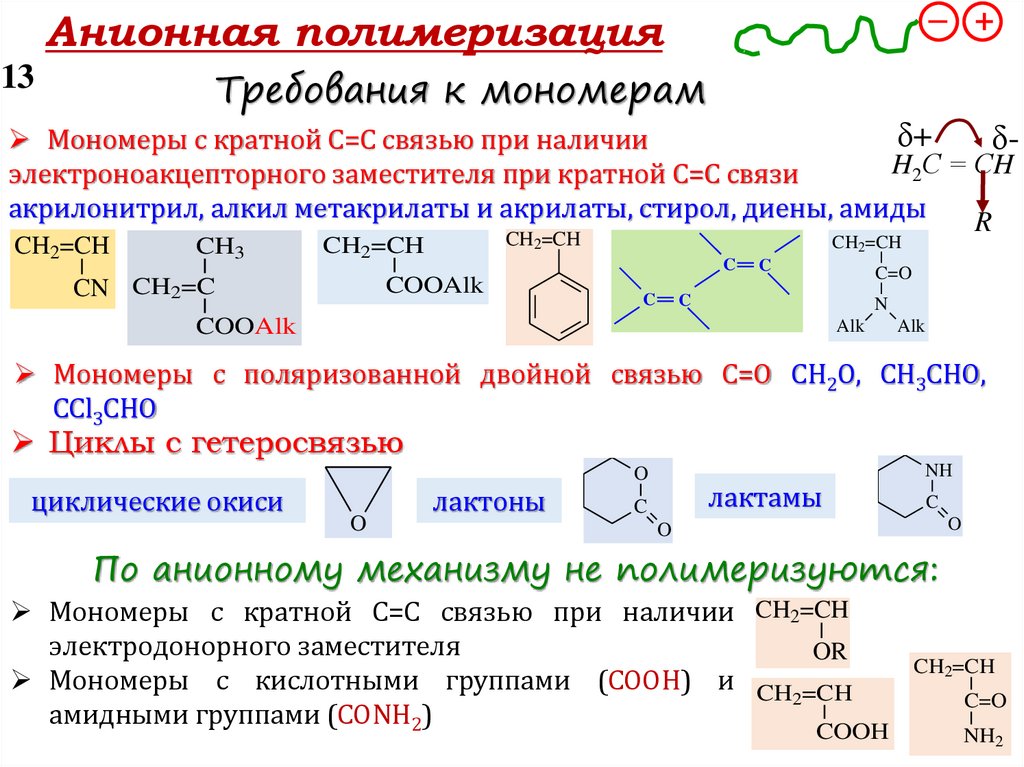
Требования к мономерам
Мономеры с кратной С=С связью при наличии δδ+
H2С = СH
электронодонорного заместителя при кратной С=С связи
изобутилен, стирол, виниловые эфиры, -метилстирол, диены
R
CH
CH =CH
CH3
2
CH2=CH
CH2=C
3
CH2=C
OR
C
C
CH3
C
C
Мономеры с поляризованной двойной связью С=О
СН2О, СН3СНО, СCl3СНО
C
C
O
O
Циклоалканы циклобутан, циклопентан
Циклы с гетеросвязью
циклические окиси
O
лактоны
O
лактамы
C
O
NH
C
O
2.
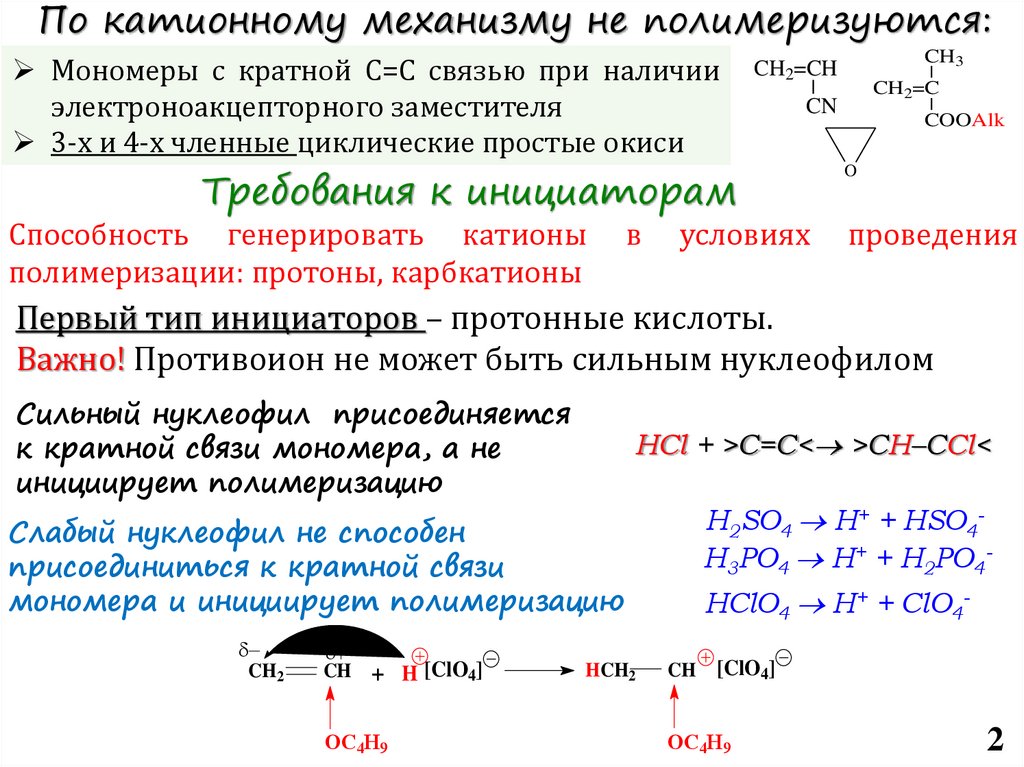
По катионному механизму не полимеризуются:Мономеры с кратной С=С связью при наличии
электроноакцепторного заместителя
3-х и 4-х членные циклические простые окиси
в
CH2=C
CN
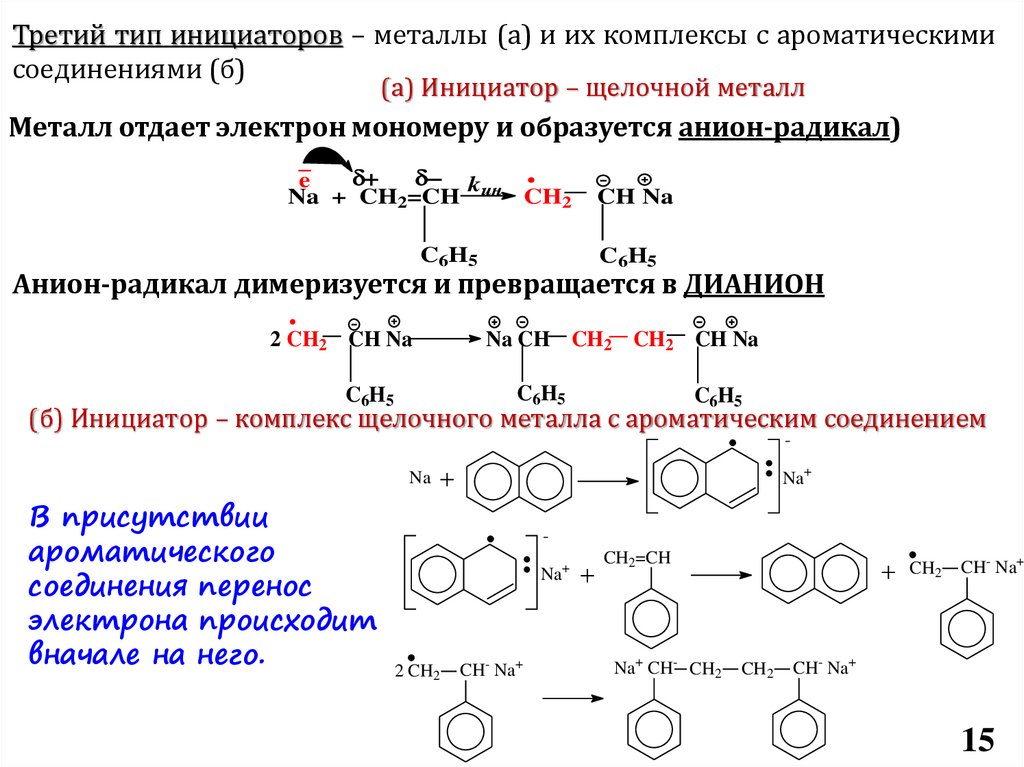
Требования к инициаторам
Способность генерировать катионы
полимеризации: протоны, карбкатионы
CH3
CH2=CH
условиях
COOAlk
O
проведения
Первый тип инициаторов – протонные кислоты.
Важно! Противоион не может быть сильным нуклеофилом
Сильный нуклеофил присоединяется
к кратной связи мономера, а не
инициирует полимеризацию
HCl + >C=C< >CH–CCl<
H2SO4 H+ + HSO4H3PO4 H+ + H2PO4-
Слабый нуклеофил не способен
присоединиться к кратной связи
мономера и инициирует полимеризацию
CH2
CH + H [ClO4]
OC4H9
HCH2
HClO4 H+ + ClO4CH
[ClO4]
OC4H9
2
3.
Второйтип
инициаторов
–
апротонные
кислоты
Льюиса
(химическое соединение, являющееся акцептором электронной пары,
т.е. способное принять пару электронов соединения-донора на
незаполненную орбиталь. ZnCl2, BF3, AlCl3, SnCl4 и др.)
Важно! Для инициирования необходим сокатализатор– источник катиона
– донор протона или карбкатиона (вода, галогенводородные кислоты,
спирты, простые эфиры)
В отсутствие сокатализатора полимеризация не происходит
CH3
BF3 + CH2
C
полимеризация не идет
CH3
В присутствии сокатализатора образуется активированный комплекс,
инициирующий полимеризацию
BF3 + H2O {BF3 H2O} H [BF3OH]
CH3
H[BF3OH]
CH2=C
CH3
CH3
H CH2 C[BF3OH]
CH3
Сокатализатором может быть и протонная кислота с противоионом –
сильным нуклеофилом: HCl.
3
4.
4Основные стадии катионной полимеризации
Инициирование цепи
Рост цепи
Обрыв цепи
Передача цепи
Специфические черты катионной полимеризации
существование нескольких типов активных центров в ходе
полимеризации: свободных ионов и ионных пар – контактных и
сольватно-разделенных, обладающих разной активностью;
~Rn+(X)-
контактная
ионная пара
~Rn+ Sm X-
сольватно разделенная
ионная пара
~Rn+ + X-
свободные
ионы
химизм стадий отличается: во всех реакциях обязательно
участвует ПРОТИВОИОН
обрыв цепи только МОНОМОЛЕКУЛЯРНЫЙ (в реакции участвует
один активный центр).
кинетика
полимеризации
растворителя
определяется
ПОЛЯРНОСТЬЮ
5.
Стадия 1. Инициирование5
Инициирование
включает
элементарных акта :
2
последовательных
а) образование первичных активных частиц или активного
комплекса I K+X-;
б) их присоединение к мономеру K+X- + M KM+XСкорость реакции инициирования определяется скоростью
наиболее медленной стадии – реакции активных частиц или
комплекса с мономером.
K+X- + M KM+X-
CH2
Vи = kи[M][I], где I = K+X-
CH
+
OC4H9
H [ClO4]
kи
HCH2
CH [ClO4]
OC4H9
6.
6CH2
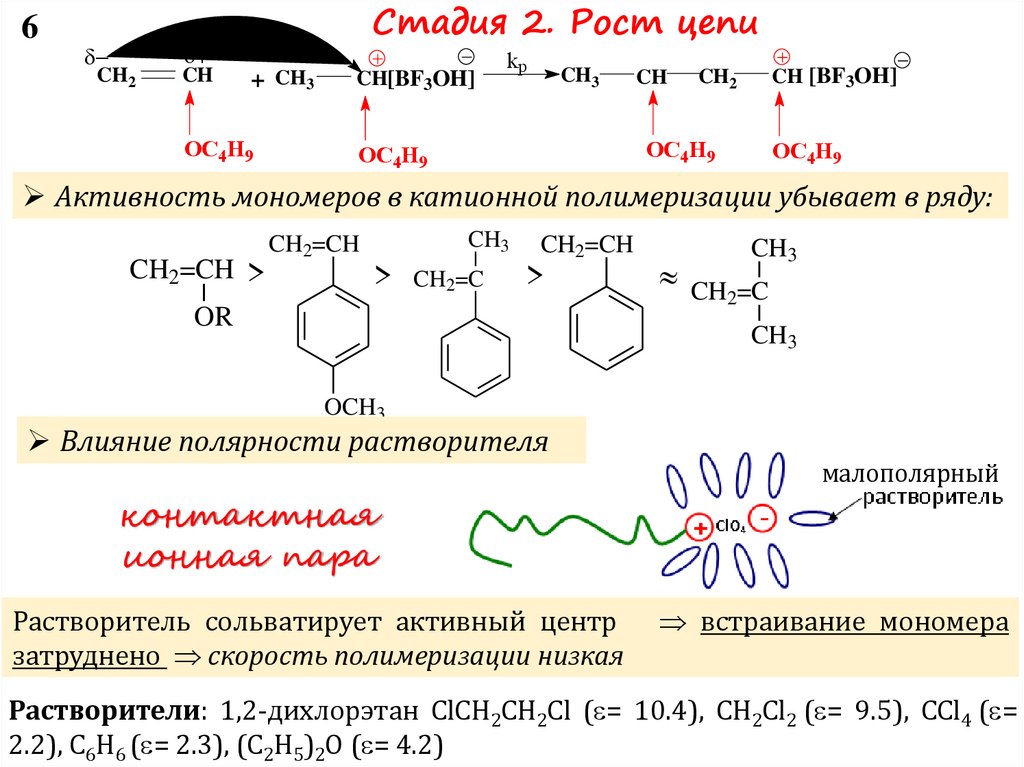
Стадия 2. Рост цепи
CH
+ CH3
OC4H9
CH[BF3OH]
kр
CH3
CH
CH [BF3OH]
CH2
OC4H9
OC4H9
OC4H9
Активность мономеров в катионной полимеризации убывает в ряду:
CH2=CH >
CH3
CH2=CH
> CH2=C
CH2=CH
>
OR
CH3
CH =C
2
CH3
OCH3
Влияние полярности растворителя
малополярный
контактная
ионная пара
Растворитель сольватирует активный центр
затруднено скорость полимеризации низкая
встраивание мономера
Растворители: 1,2-дихлорэтан ClCH2CH2Cl ( = 10.4), CH2Cl2 ( = 9.5), CCl4 ( =
2.2), C6H6 ( = 2.3), (C2H5)2O ( = 4.2)
7.
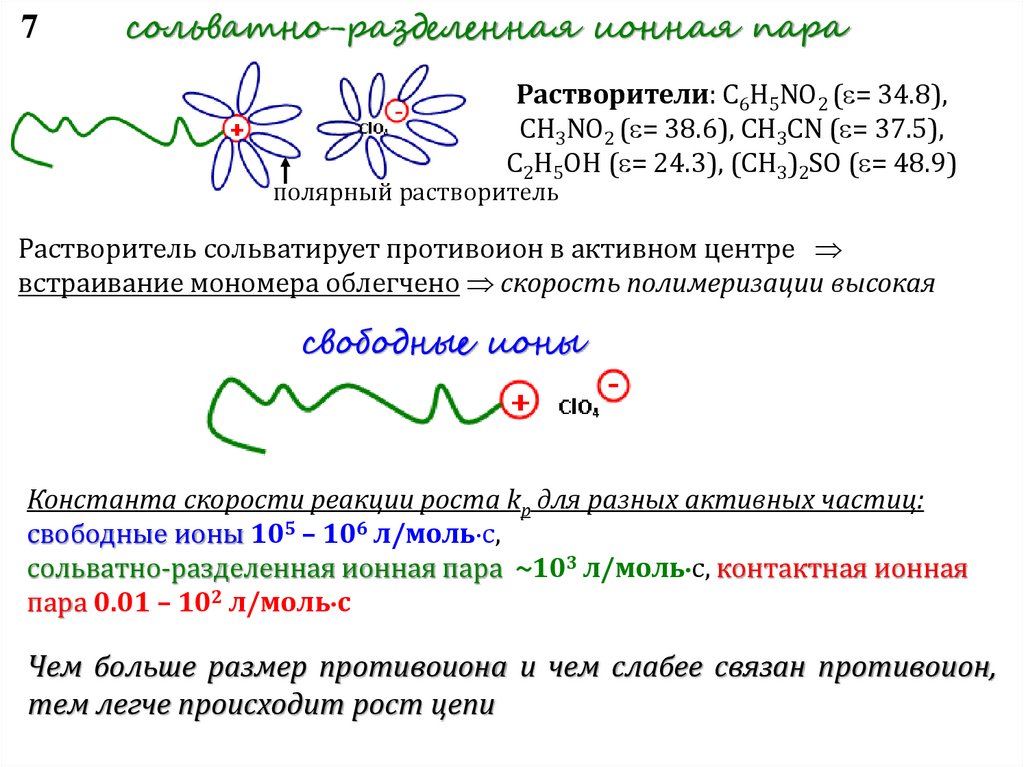
7сольватно-разделенная ионная пара
Растворители: C6H5NO2 ( = 34.8),
CH3NO2 ( = 38.6), CH3CN ( = 37.5),
C2H5OH ( = 24.3), (CH3)2SO ( = 48.9)
полярный растворитель
Растворитель сольватирует противоион в активном центре
встраивание мономера облегчено скорость полимеризации высокая
свободные ионы
Константа скорости реакции роста kp для разных активных частиц:
свободные ионы 105 – 106 л/моль с,
сольватно-разделенная ионная пара ~103 л/моль с, контактная ионная
пара 0.01 – 102 л/моль с
Чем больше размер противоиона и чем слабее связан противоион,
тем легче происходит рост цепи
8.
Стадия 3. Обрыв цепи8
Гибель активного центра – мономолекулярная реакция.
При реакции обрыва часто происходит регенерация катализатора,
способного реинициировать полимеризацию.
Реакции с противоионами могут быть двух типов:
1. Нейтрализация заряда на конце цепи
~CH2
CH [OCOCF3]
ko
~CH2
CH
OCOCF3
~CH2
OC4H9
OC4H9
CH[BF3OH]
ko
~CH2
CH
OH + BF3
OC4H9
OC4H9
CH3
CH3
2. Протонирование противоиона
CH2
CH2 - H
~CH2
C [BF3OH]
CH3
~CH2
+
C + H [BF3OH]
CH3
~CH2
C [BF3OH]
CH3
~CH
+
C + H [BF3OH]
CH3
Чем больше размер противоиона и чем слабее связан противоион,
тем труднее происходит обрыв цепи
9.
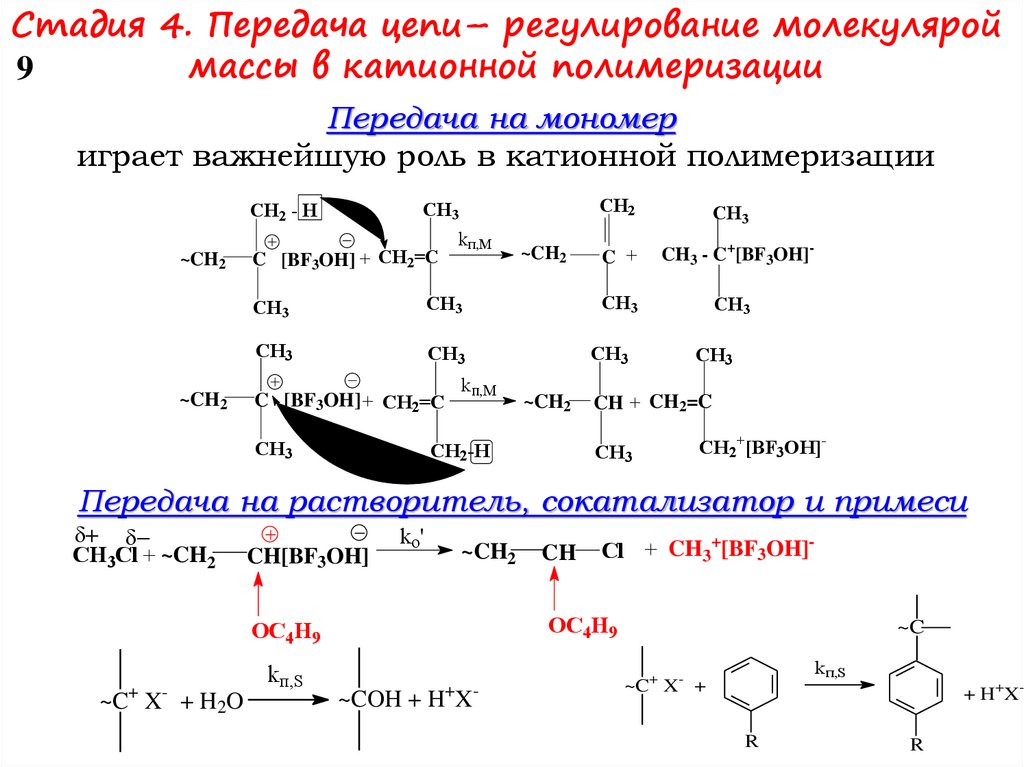
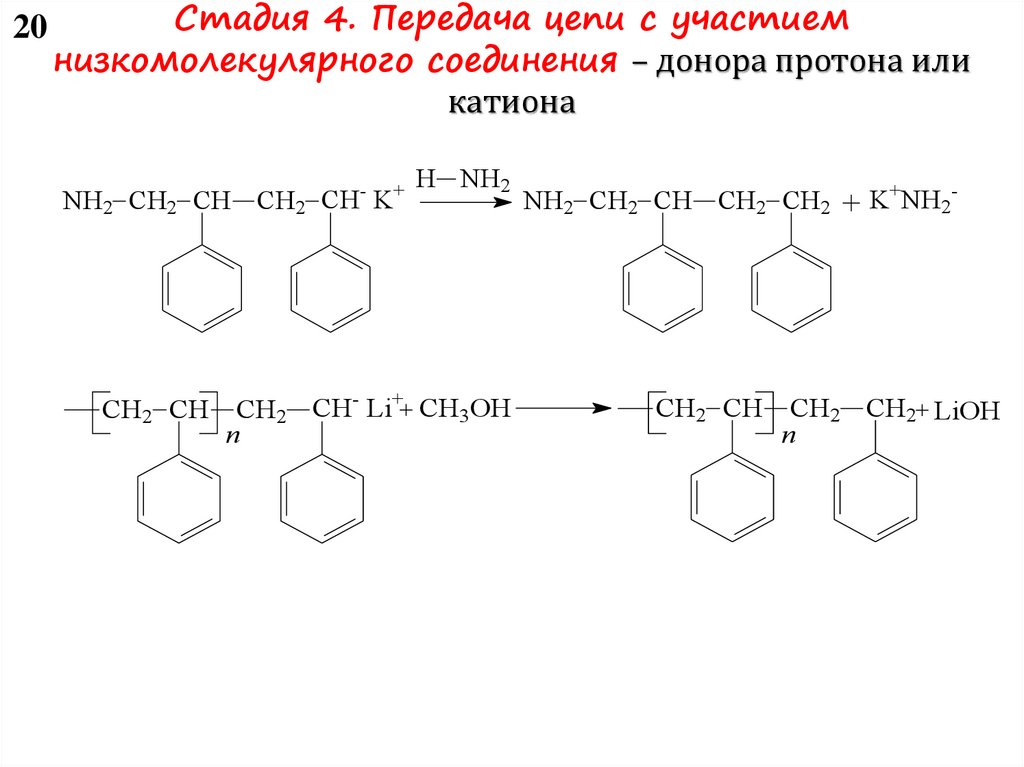
Стадия 4. Передача цепи– регулирование молекуляроймассы в катионной полимеризации
9
Передача на мономер
играет важнейшую роль в катионной полимеризации
CH3
CH2 - H
~CH2
~CH2
C [BF3OH] + CH2=C
kп,М
~CH2
CH2
CH3
C +
CH3 - C+[BF3OH]CH3
CH3
CH3
CH3
CH3
CH3
CH3
C [BF3OH] + CH2=C
CH3
kп,М
~CH2
CH2-H
CH3
CH + CH2=C
CH3
CH2+[BF3OH]-
Передача на растворитель, сокатализатор и примеси
CH3Cl + ~CH2
CH[BF3OH]
ko'
~CH2
~C+ X- + H2O
Cl + CH3+[BF3OH]-
OC4H9
OC4H9
kп,S
CH
~COH + H+X-
~C
kп,S
~C+ X- +
+ H+XR
R
10.
10Передача на полимер
с разрывом основной цепи – полимеризация мономеров,
содержащих гетероатом
+
~R' + ~R"-O-R'"~
kп,P
~R'-O-R'"~ + ~R"+
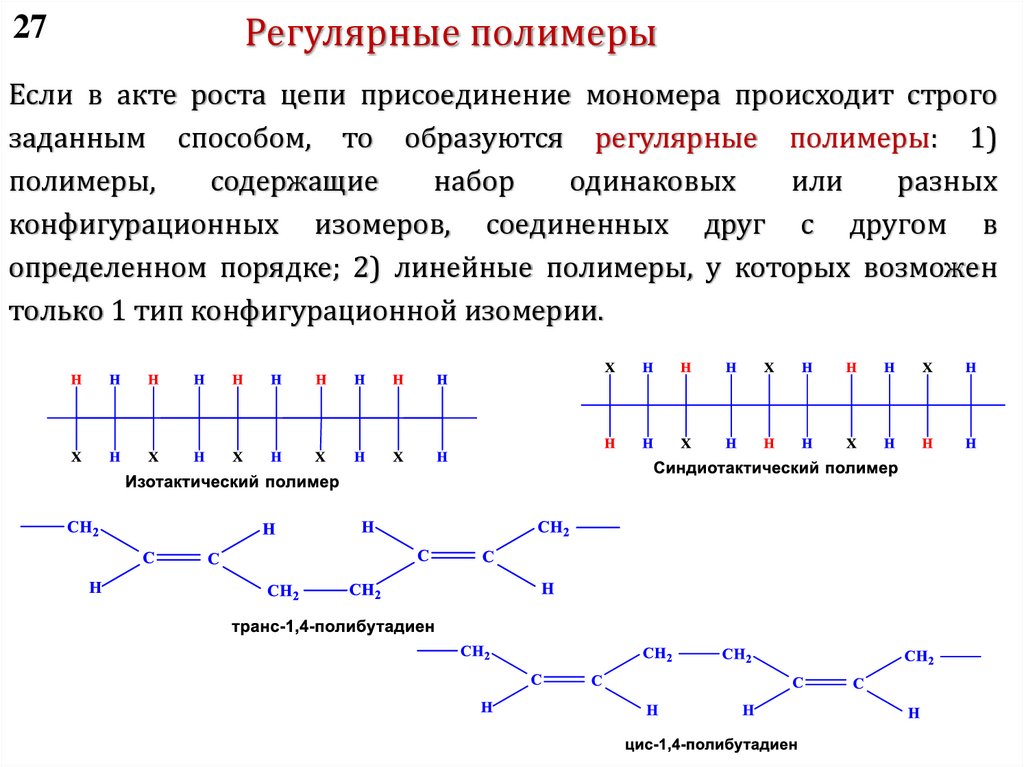
без разрыва основной цепи – полимеризация пропилена
R
CH2
CH
n
CH2
CH2
CH3
CH3
R
CH + R
CH2
CH
CH3
n
CH
n
CH2
CH3
CH3
CH2
CH2 + R
CH3
kп,P
CH2
CH2
CH
CH3
n
CH2
C
CH3
CH2
CH2
CH3
11.
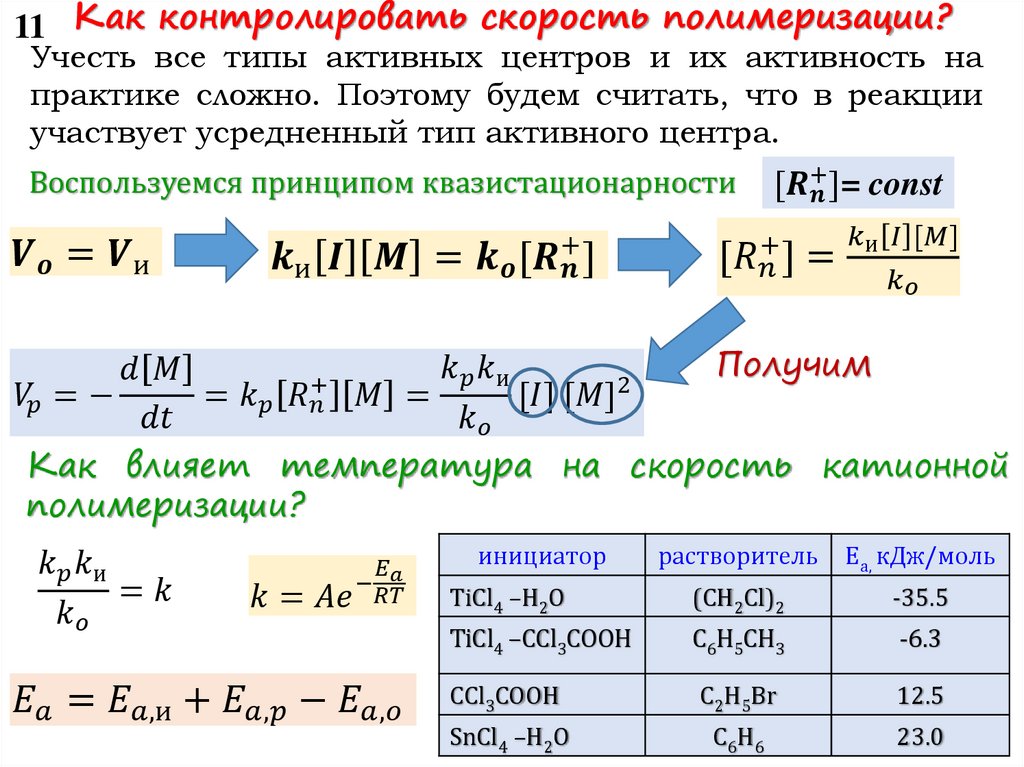
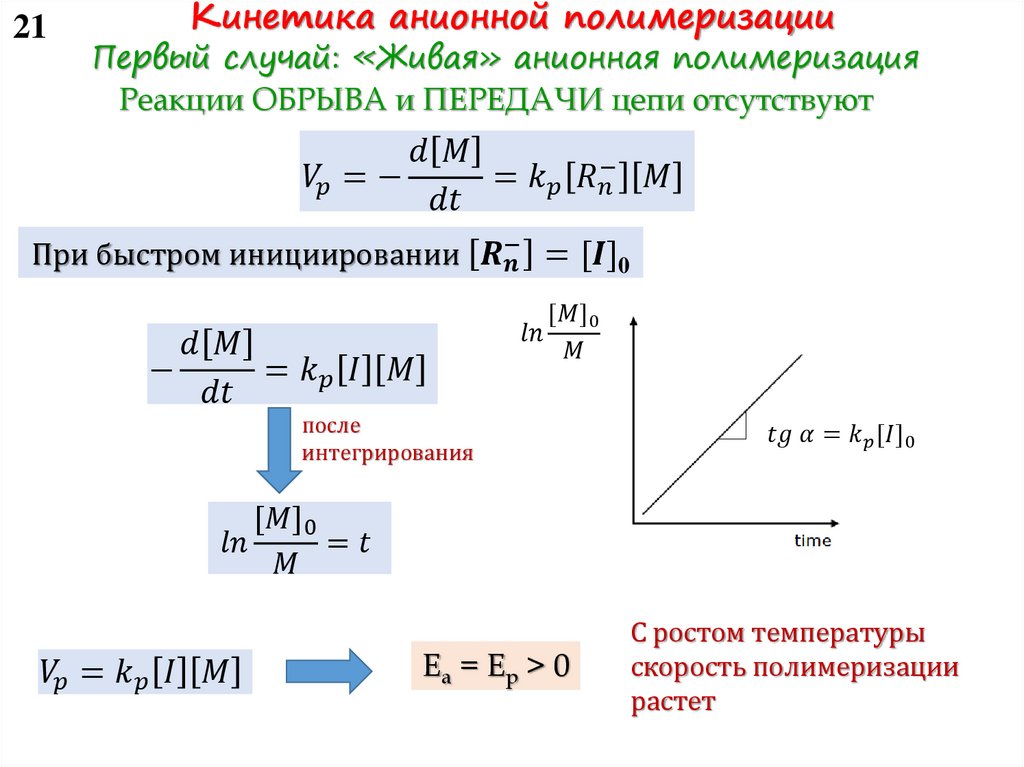
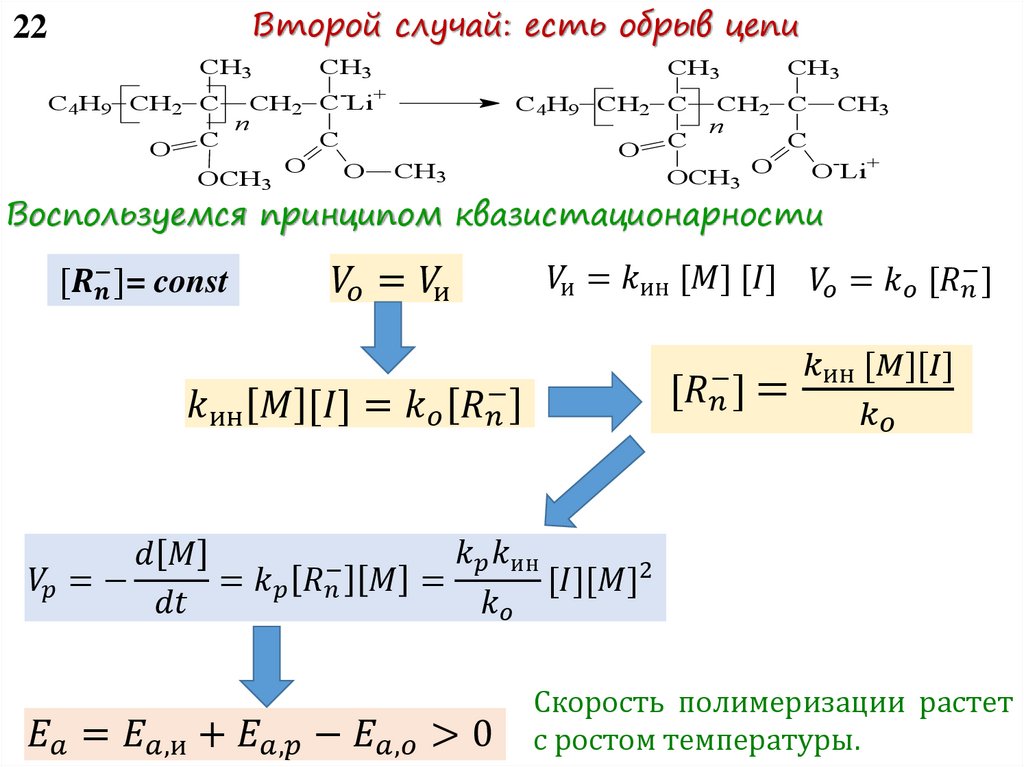
11 Как контролировать скорость полимеризации?Учесть все типы активных центров и их активность на
практике сложно. Поэтому будем считать, что в реакции
участвует усредненный тип активного центра.
Воспользуемся принципом квазистационарности



















 Химия
Химия








