Похожие презентации:
Механизмы реакций в органической химии
1.
Механизмы реакцийв органической химии
2.
Классификация реакций• Все органические реакции классифицируют по
следующим признакам:
• 1. Характер изменения связей в реагирующих
веществах (по типу разрыва связи и действующего
реагента).
• 2. Направление реакции (по конечному
результату).
• 3. Число молекул, принимающих участие в
стадии, определяющей скорость реакции (т.е.
медленной стадии реакции).
3.
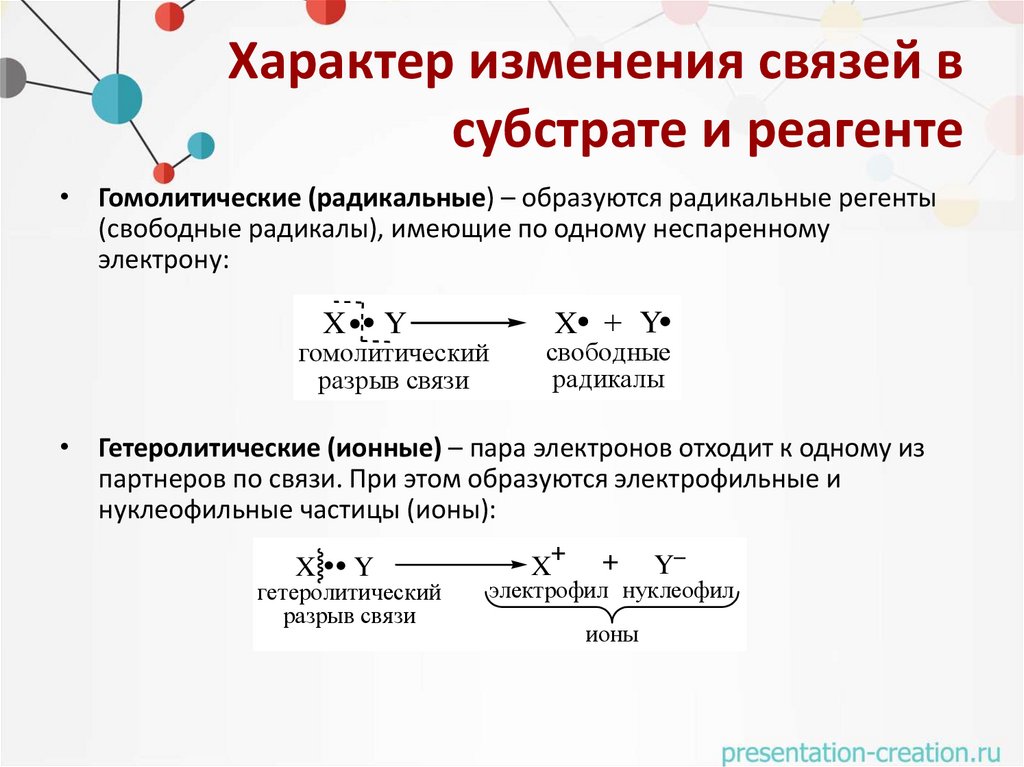
Характер изменения связей всубстрате и реагенте
• Гомолитические (радикальные) – образуются радикальные регенты
(свободные радикалы), имеющие по одному неспаренному
электрону:
X
Y
гомолитический
разрыв связи
X + Y
свободные
радикалы
• Гетеролитические (ионные) – пара электронов отходит к одному из
партнеров по связи. При этом образуются электрофильные и
нуклеофильные частицы (ионы):
X
Y
гетеролитический
разрыв связи
X+
+
Y
электрофил нуклеофил
ионы
4.
Направление реакции• Реакции замещения (S), от англ. Substitution – характерны для многих
классов соединений. В зависимости от природы атакующего реагента
м.б. радикальное (SR), электрофильное (SE) или нуклеофильное (SN).
• Реакции присоединения (А), от англ. Addition – характерны для
соединений, содержащих кратные связи. Может происходить по трем
возможным механизмам: радикальное (AR), электрофильное (АЕ) и
нуклеофильное присоединение (AN).
• Реакции отщепления (элиминирования) (Е), от англ. Elemination –
характерны для галогенопроизводных и спиртов, карбоновых кислот и
их функциональных производных.
• Реакции перегруппировки – характерны для алканов, 6-ти и 7-ми
членных циклоалканов и некоторых других. Происходит переход
(миграция) частиц от одного атома к другому.
5.
Направление реакцииОкислительно-восстановительные реакции.
• Реакции восстановления [H] – характерны для непредельных
соединений и других классов (оксосоединения, сложные эфиры).
Происходит передача электронов реагента органическому субстрату.
• Реакции окисления ( [ O ] ) – характерны для всех классов
органических соединений. Происходит переход электронов от
органического субстрата к реагенту-окислителю.
• Кислотно-основное взаимодействие – это обратимые реакции
ионной диссоциации:
B
A-H
+
кислота
основание
+
BH
A +
сопряженное сопряженная
-
основание
кислота
6.
Число молекул, участвующих вмедленной стадии реакции
• 1. Мономолекулярные реакции (диссоциативные).
В медленной стадии участвуют только молекулы одного из
реагирующих веществ. Это могут быть реакции
мономолекулярного замещения – SN1 или
мономолекулярного отщепления – Е1. Характерны для
третичных спиртов и галогенопроизводных.
• 2. Бимолекулярные реакции (ассоциативные).
В медленной стадии принимают участие молекулы двух
реагирующих веществ. Это могут быть реакции
бимолекулярного нуклеофильного замещения – SN2 или
бимолекулярного отщепления Е2. Характерны для
первичных, вторичных спиртов и галогенопроизводных.
7.
Радикальное замещение (SR)• I стадия. Инициирование (зарождение)
цепи. Молекулы брома поглощают энергию
кванта света и образуют свободные
радикалы:
h Br Br
Br
Br
+
8.
Радикальное замещение (SR)
II стадия. Рост цепи. Радикал брома отрывает менее прочно связанный с
углеродом атом водорода, и образуется новый наиболее устойчивый
алкильный радикал, где неспаренный электрон занимает pz-орбиталь:
H
а) CH3 СH CH3 + Br
CH3 СH CH3 + HBr
свободный вторичный
пропан
радикал изопропил
CH3
CH3
C
СH3
третичный
>
CH3
CH
CH3
вторичный
>
CH3
СH2
первичный
>
CH3
метильный
уменьшение устойчивости радикалов
Алкильный радикал взаимодействует бромом, получается продукт
замещения и новый свободный радикал брома, который повторяет
описанный цикл:
б) CH3 СH CH3 + Br Br
CH3 СH CH3 + Br
и т.д.
Br
Цепной процесс прекращается только после исчезновения всех свободных
радикалов, образующихся в ходе реакции.
9.
Радикальное замещение (SR)• III стадия. Обрыв цепи происходит в результате
рекомбинации (димеризации) двух одинаковых или
разных свободных радикалов:
Br + Br
Br2
CH3 СH CH3 + Br
CH3 СH CH3
Br
CH3 СH CH3 + CH3 СH CH3
CH3 СH CH3
CH3 СH CH3
2,3-диметилбутан
10.
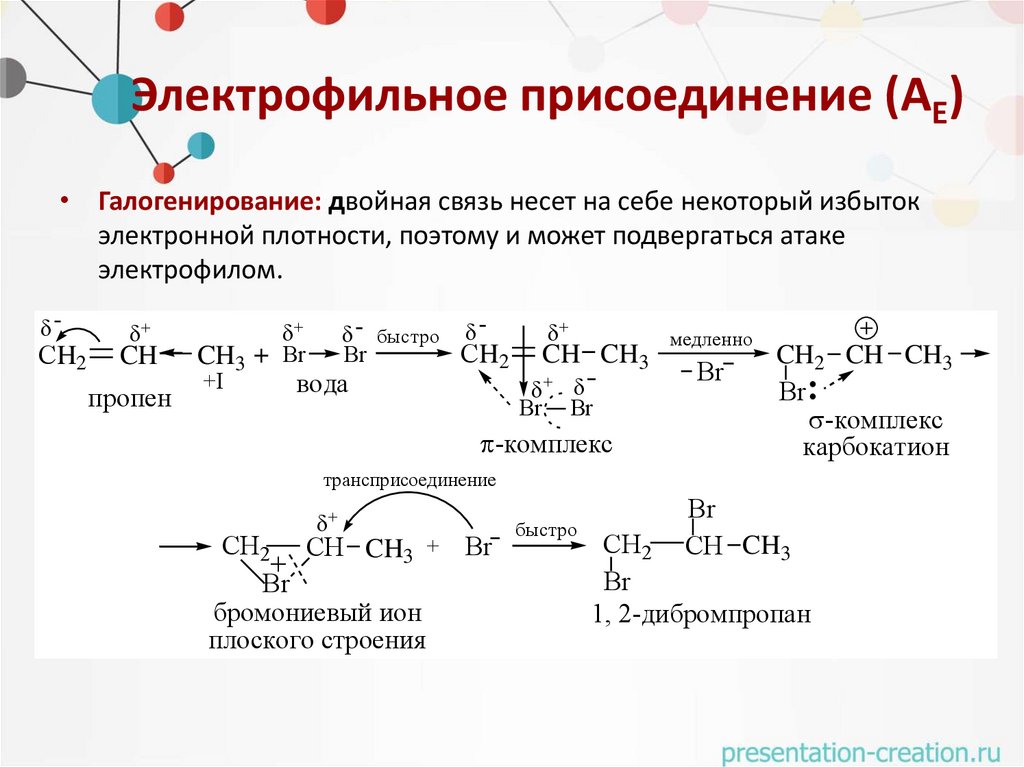
Электрофильное присоединение (АЕ)• Галогенирование: двойная связь несет на себе некоторый избыток
электронной плотности, поэтому и может подвергаться атаке
электрофилом.
СH2
CH
пропен
быстро
медленно
Br
Br
СH
+
CH
CH
CH2 CH CH3
CH3
2
3
Br
+I
вода
+
Br
Br Br
-комплекс
карбокатион
-комплекс
трансприсоединение
СH2 СH CH3 + Br
+
Br
бромониевый ион
плоского строения
быстро
Br
СH CH3
СH2
Br
1, 2-дибромпропан
11.
Электрофильное присоединение (АЕ)• Гидрогалогенирование
динамический фактор
статический фактор
СH2
+
CH
быстро
+ медленно
CH3+ H Br
CH3 CH CH3 + Br
CH3 CH CH3
Br
+I
вторичный
Br
карбкатион
CH3
CH3
C+
CH3
>
CH3
+
CH
> CH3
+
CH2
+
> CH3
CH3
уменьшение стабильности карбкатионов
12.
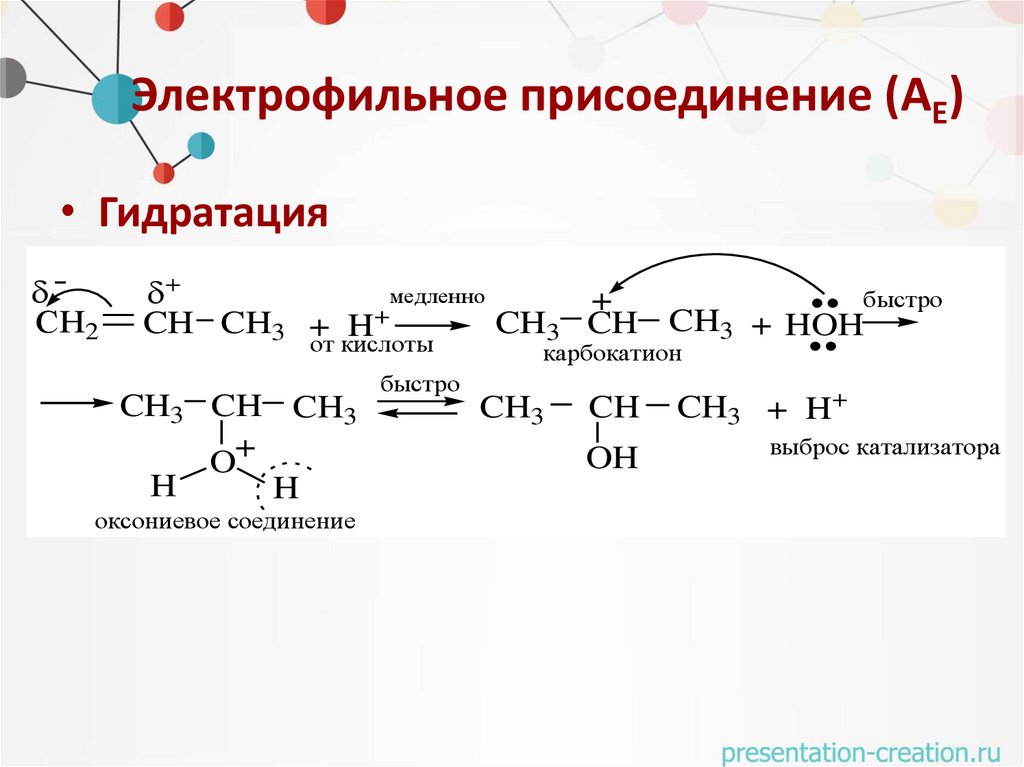
Электрофильное присоединение (АЕ)• Гидратация
СH2
медленно
быстро
+
+
CH CH3 + H
CH3 CH CH3 + HOH
от кислоты
карбокатион
CH3 CH CH3
O+
H
H
оксониевое соединение
быстро
CH3
CH
OH
CH3 + H+
выброс катализатора
13.
Радикальное присоединение (АR)• Перекисный эффект Хараша
14.
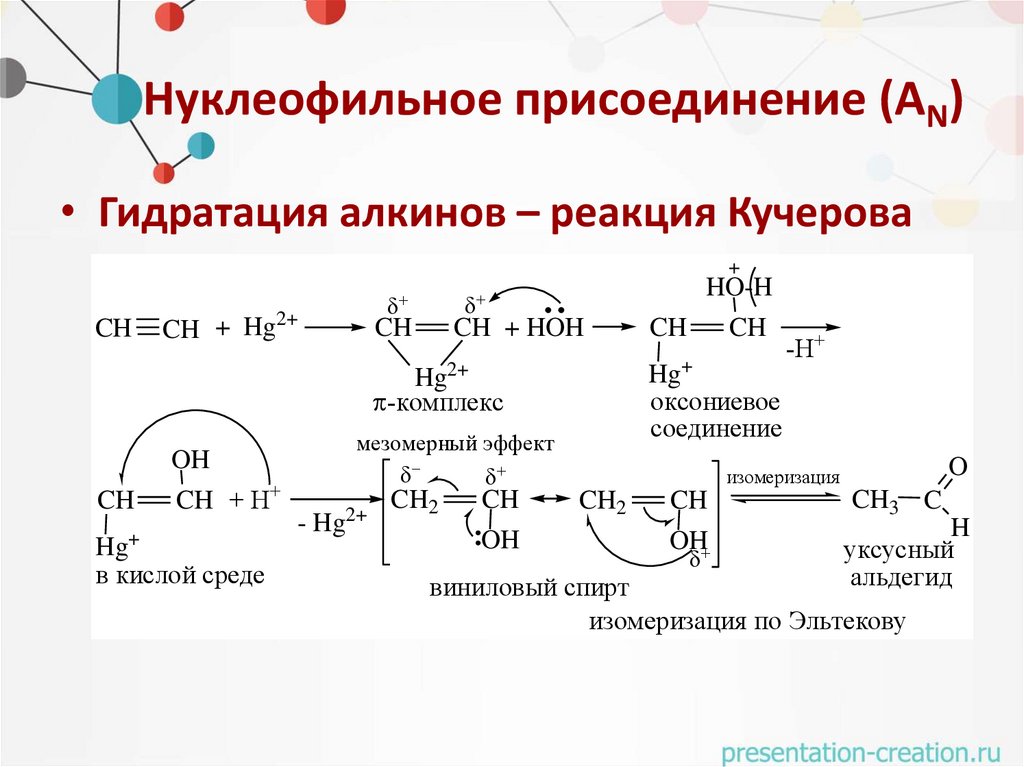
Нуклеофильное присоединение (AN)• Гидратация алкинов – реакция Кучерова
+
CH
CH + Hg2+
HO-H
CH + HOH
CH
Hg+
оксониевое
соединение
Hg2+
-комплекс
CH
+
OH
CH + H+
Hg
в кислой среде
мезомерный эффект
2+
- Hg
CH2
CH
OH
CH
CH
-H+
O
изомеризация
CH2
CH
OH
CH3 C
H
уксусный
альдегид
виниловый спирт
изомеризация по Эльтекову
15.
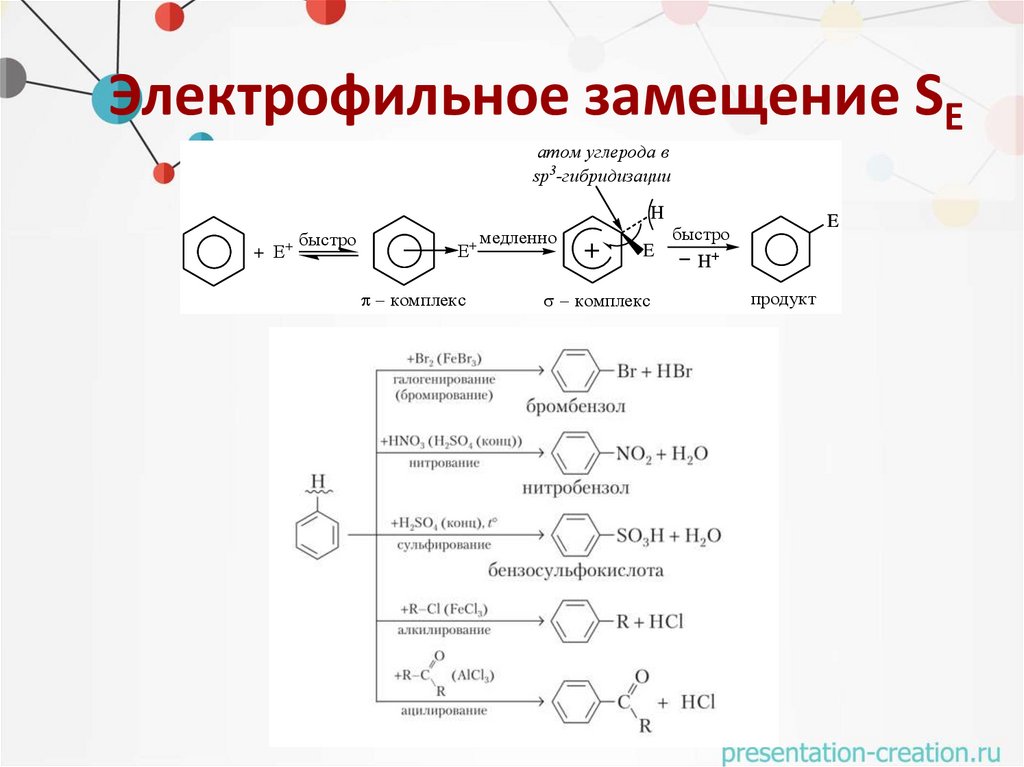
Электрофильное замещение SE• нитрование
HNO3 + 2H2SO4 →NO2+ H3O+ + 2HSO4• сульфирование
2H2SO4 →SO3+ + H3O+ + HSO4• галогенирование
Br-Br + AlCl3 → Br+ + [Br-AlCl3]• алкилирование
CH3-Br + AlCl3 → CH3+ + [Br-AlCl3]• ацилирование
CH3-CO-Br + AlCl3 → CH3CO+ + [Br-AlCl3]-
16.
Электрофильное замещение SEатом углерода в
sp3-гибридизации
H
+ Е
+ быстро
медленно
Е+
комплекс
+
E
быстро
E
H+
комплекс
продукт
17.
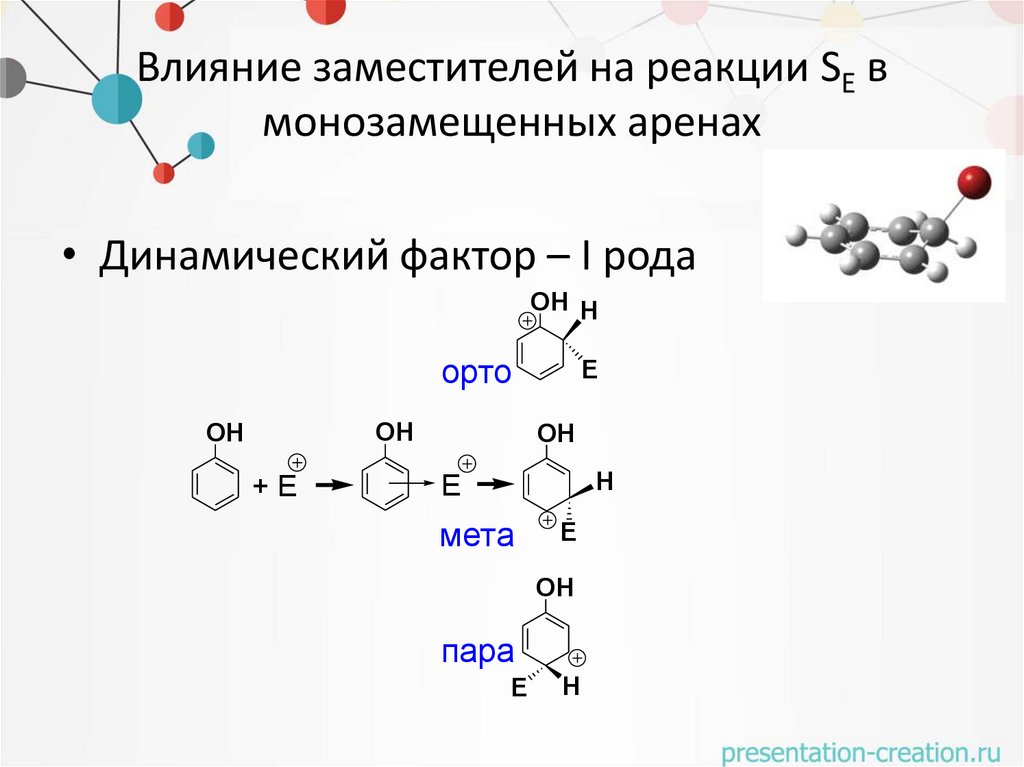
Влияние заместителей на реакции SE вмонозамещенных аренах
• Динамический фактор – I рода
OH H
орто
OH
OH
+E
E
OH
H
E
мета
E
OH
пара
E
H
18.
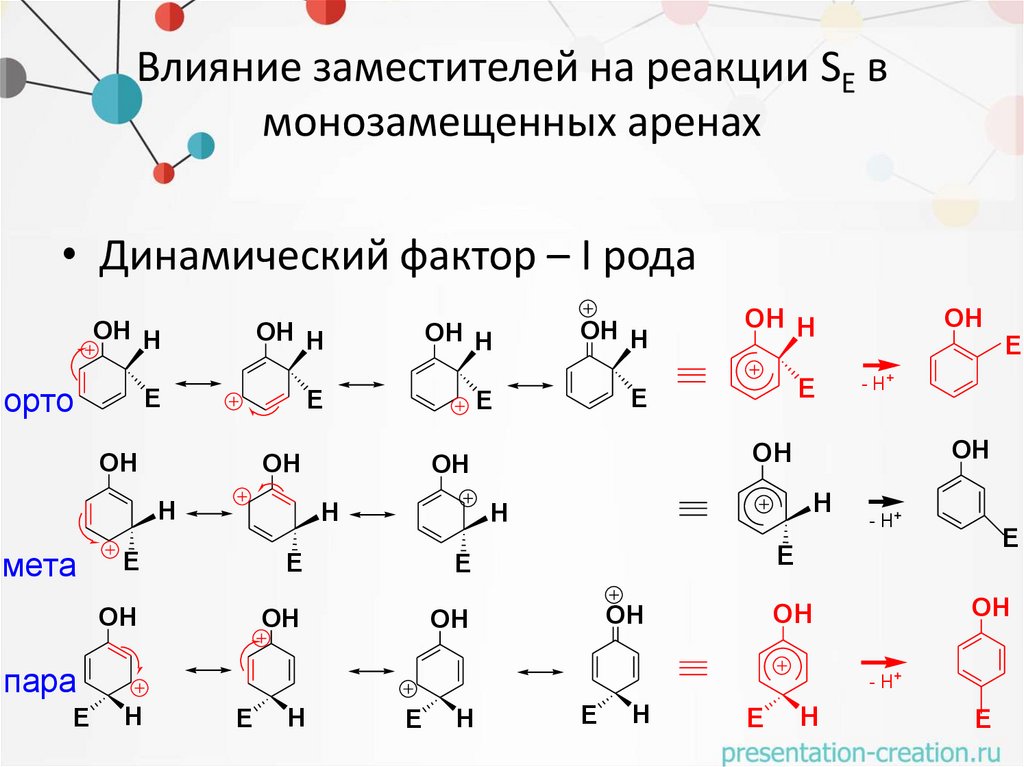
Влияние заместителей на реакции SE вмонозамещенных аренах
• Динамический фактор – I рода
OH H
орто
OH H
E
E
OH
OH H
OH H
E
E
E
OH
H
мета
OH H
E
E
OH
OH
OH
H
- H+
E
E
OH
OH
OH
пара
E
- H+
OH
H
E
E
OH
OH
H
OH
- H+
H
E
H
E
H
E
H
E
H
E
19.
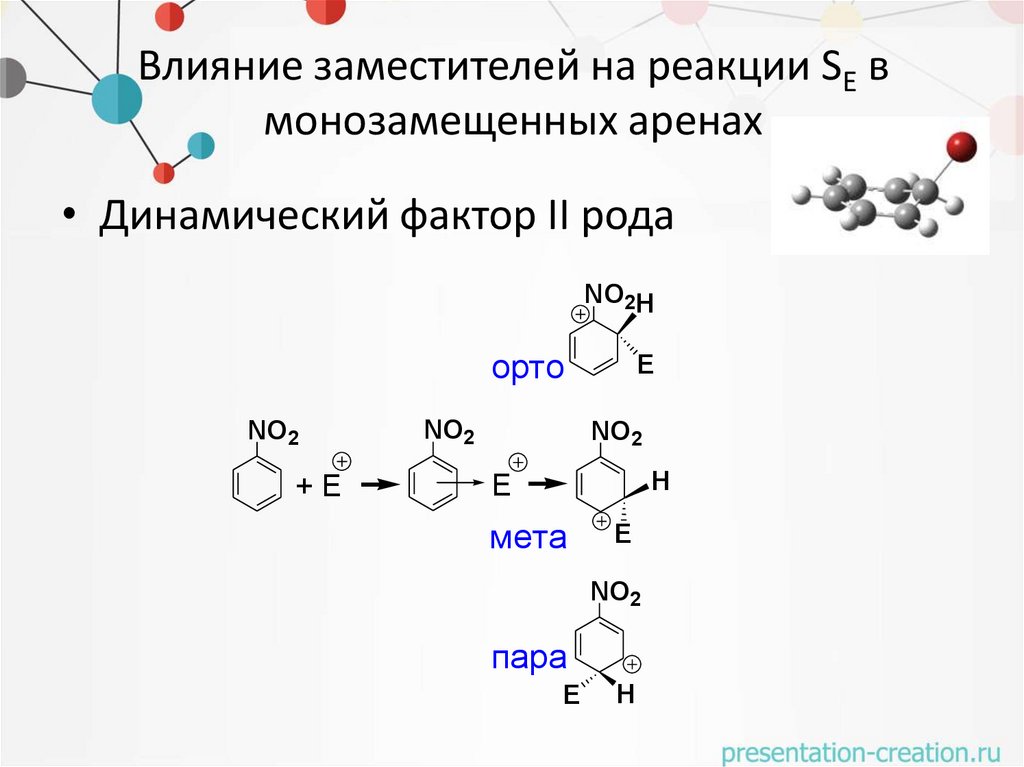
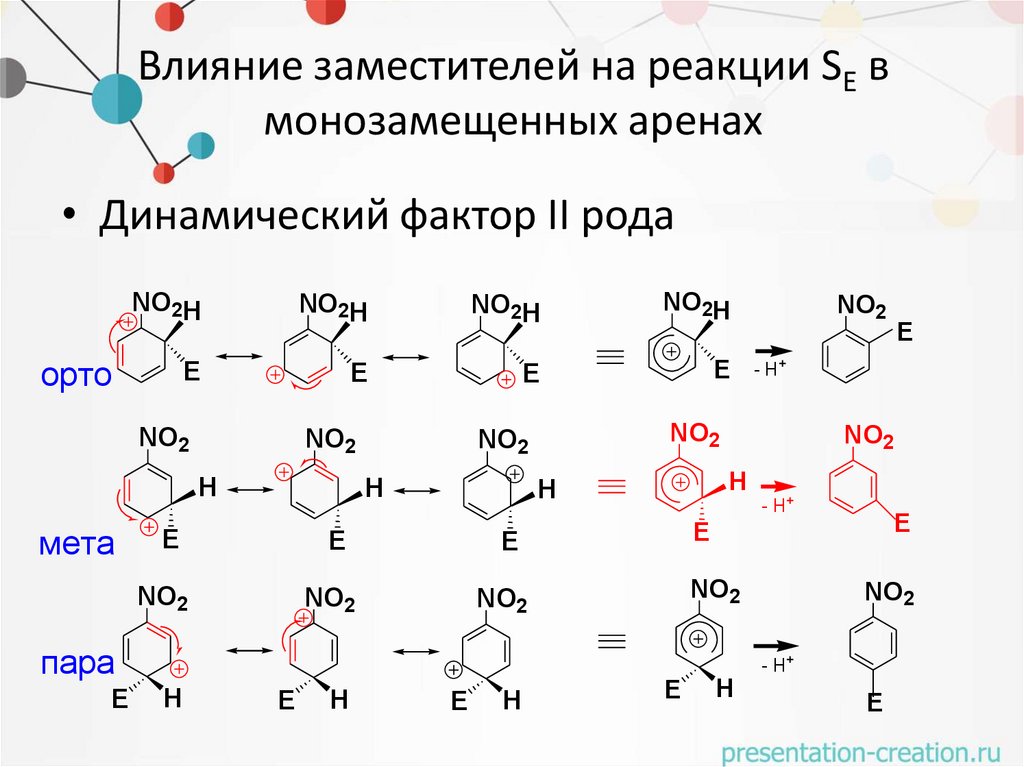
Влияние заместителей на реакции SE вмонозамещенных аренах
• Динамический фактор II рода
NO2H
орто
NO2
+E
NO2
E
NO2
H
E
мета
E
NO2
пара
E
H
20.
Влияние заместителей на реакции SE вмонозамещенных аренах
• Динамический фактор II рода
NO2H
NO2H
NO2H
NO2H
E
E
E
E
NO2
NO2
NO2
NO2
орто
H
мета
H
- H+
- H+
E
E
E
E
E
NO2
NO2
NO2
NO2
NO2
пара
E
E
NO2
H
H
NO2
- H+
H
E
H
E
H
E
H
E
21.
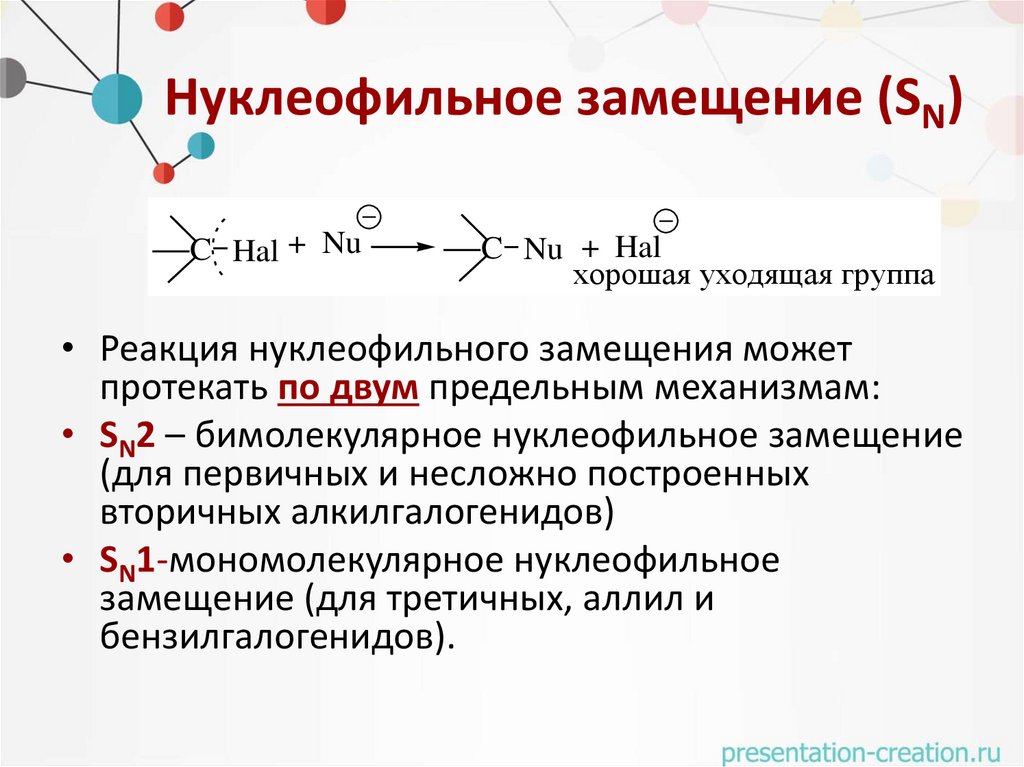
Нуклеофильное замещение (SN)C Hal + Nu
C Nu + Hal
хорошая уходящая группа
• Реакция нуклеофильного замещения может
протекать по двум предельным механизмам:
• SN2 – бимолекулярное нуклеофильное замещение
(для первичных и несложно построенных
вторичных алкилгалогенидов)
• SN1-мономолекулярное нуклеофильное
замещение (для третичных, аллил и
бензилгалогенидов).
22.
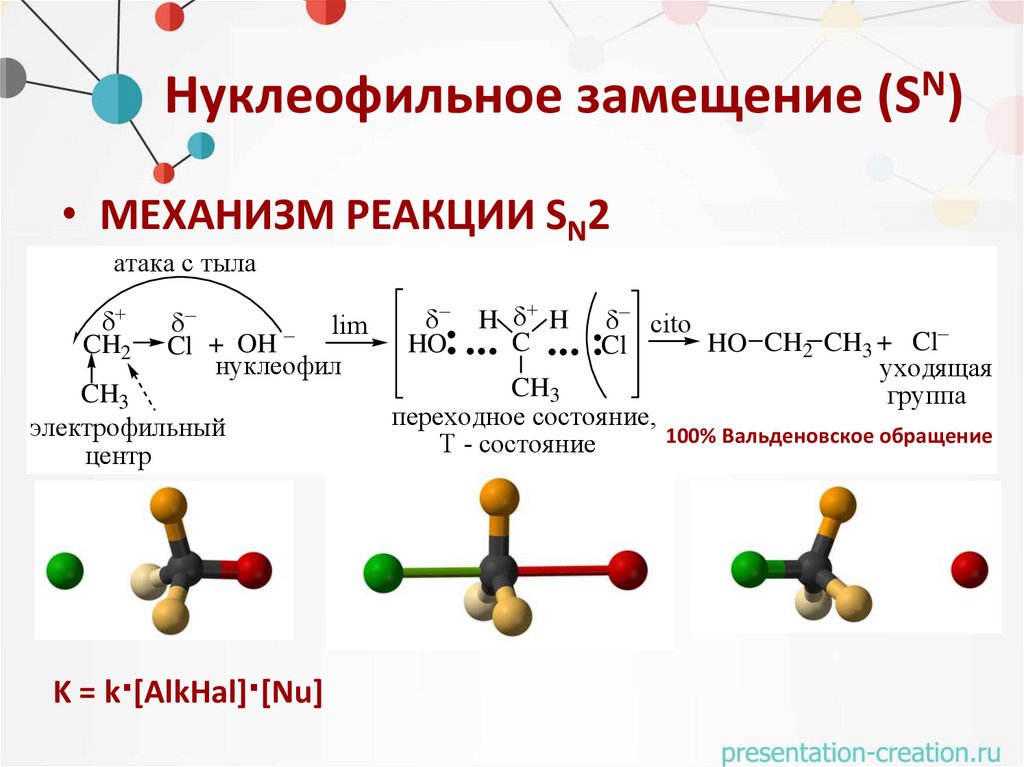
Нуклеофильное замещение (SN)• МЕХАНИЗМ РЕАКЦИИ SN2
атака с тыла
CH2
lim
Cl + OH
нуклеофил
CH3
электрофильный
центр
K = k·[AlkHal]·[Nu]
HO
H H
C
cito
HO CH2 CH3 + Cl
Cl
уходящая
CH3
группа
переходное состояние,
100% Вальденовское обращение
Т - состояние
23.
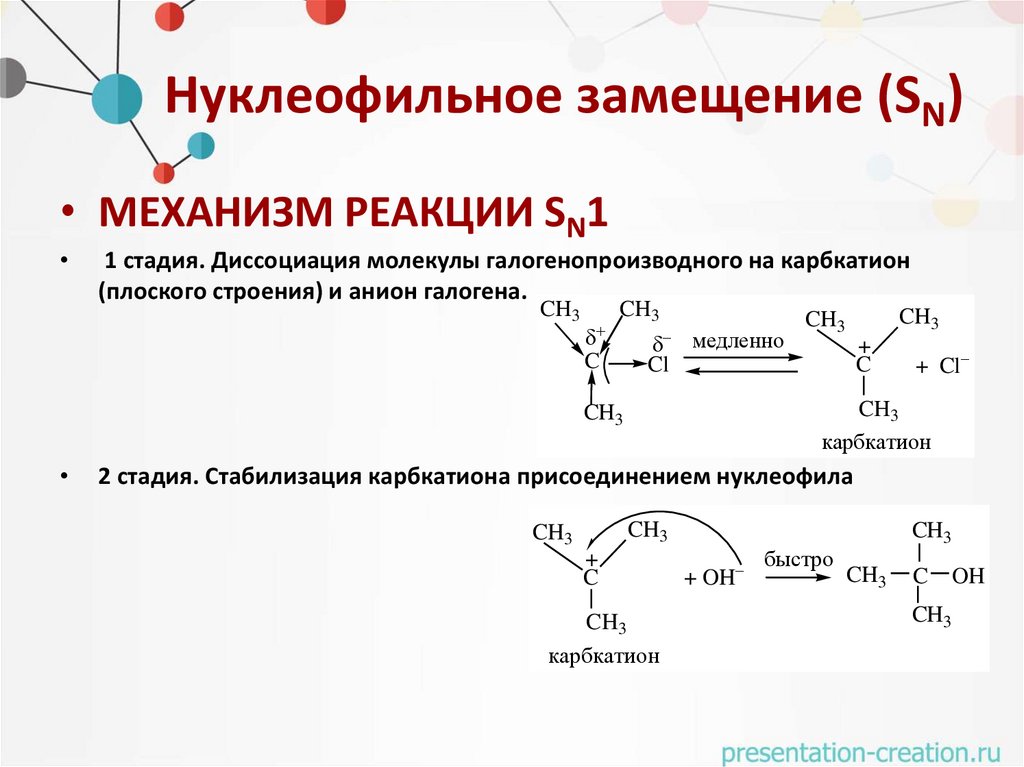
Нуклеофильное замещение (SN)• МЕХАНИЗМ РЕАКЦИИ SN1
1 стадия. Диссоциация молекулы галогенопроизводного на карбкатион
(плоского строения) и анион галогена.
CH3
C
CH3
Cl
медленно
+
C
+ Cl
CH3
карбкатион
CH3
CH3
CH3
2 стадия. Стабилизация карбкатиона присоединением нуклеофила
CH3
CH3
+
C
CH3
карбкатион
+ OH
быстро
CH3
CH3
C
CH3
OH
24.
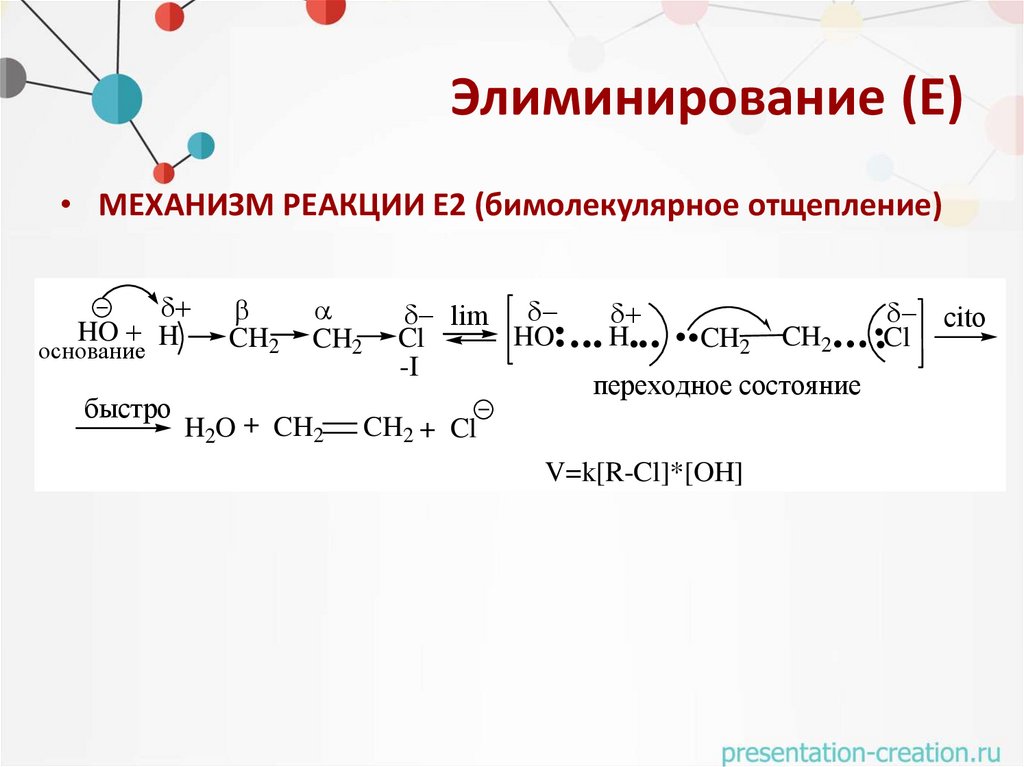
Элиминирование (Е)• МЕХАНИЗМ РЕАКЦИИ Е2 (бимолекулярное отщепление)
HO H
основание
быстро
CH2
CH2
H2O + CH2
lim
HO
Cl
-I
H
CH2
CH2
переходное состояние
CH2 + Cl
V=k[R-Cl]*[OH]
cito
Cl
25.
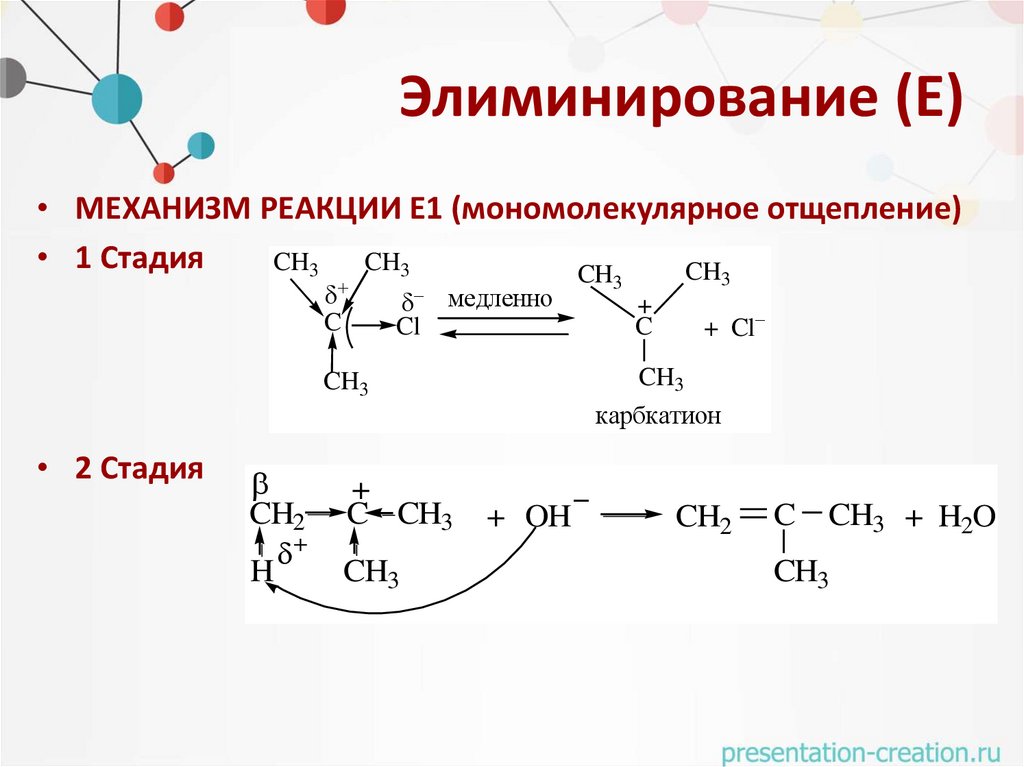
Элиминирование (Е)• МЕХАНИЗМ РЕАКЦИИ Е1 (мономолекулярное отщепление)
• 1 Стадия
CH3
CH3
CH
CH
C
Cl
медленно
CH2
H
+
C CH3
CH3
+
C
+ Cl
CH3
карбкатион
CH3
• 2 Стадия
3
3
+ OH
CH2
C
CH3 + H2O
CH3
26.
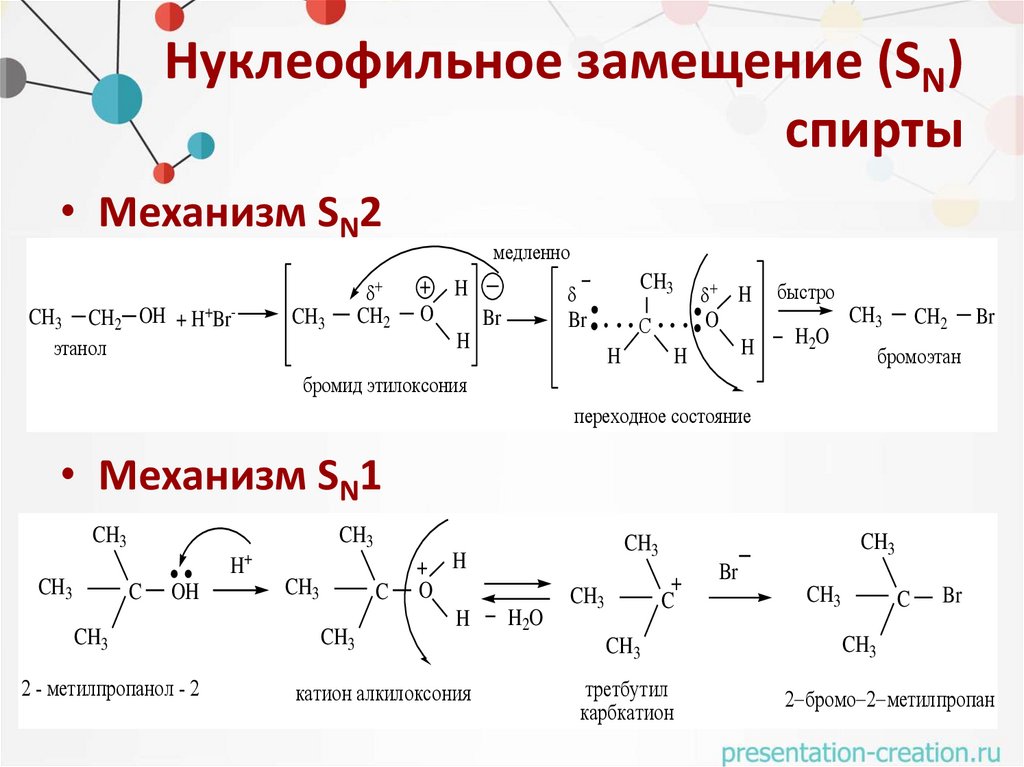
Нуклеофильное замещение (SN)спирты
• Механизм SN2
+
CH3 CH2 OH + H Br
этанол
-
CH2
CH3
медленно
Br
H
O
Br
H
CH3
H
O
С
H
H
H
быстро
H2O
CH3
CH2
Br
бромоэтан
бромид этилоксония
переходное состояние
• Механизм SN1
CH3
CH3
+
H
CH3
C
OH
CH3
2 - метилпропанол - 2
CH3
C
CH3
+
O
H
катион алкилоксония
CH3
CH3
H
H2O
+
C
CH3
CH3
третбутил
карбкатион
Br
CH3
C
Br
CH3
2 бромо 2 метилпропан
27.
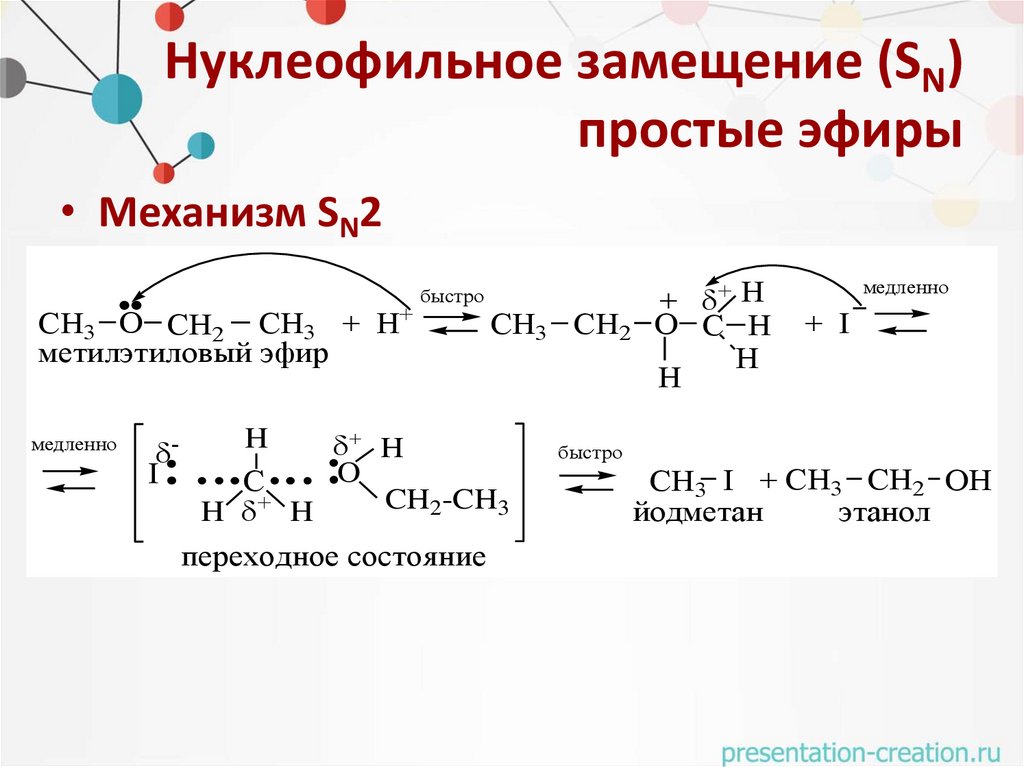
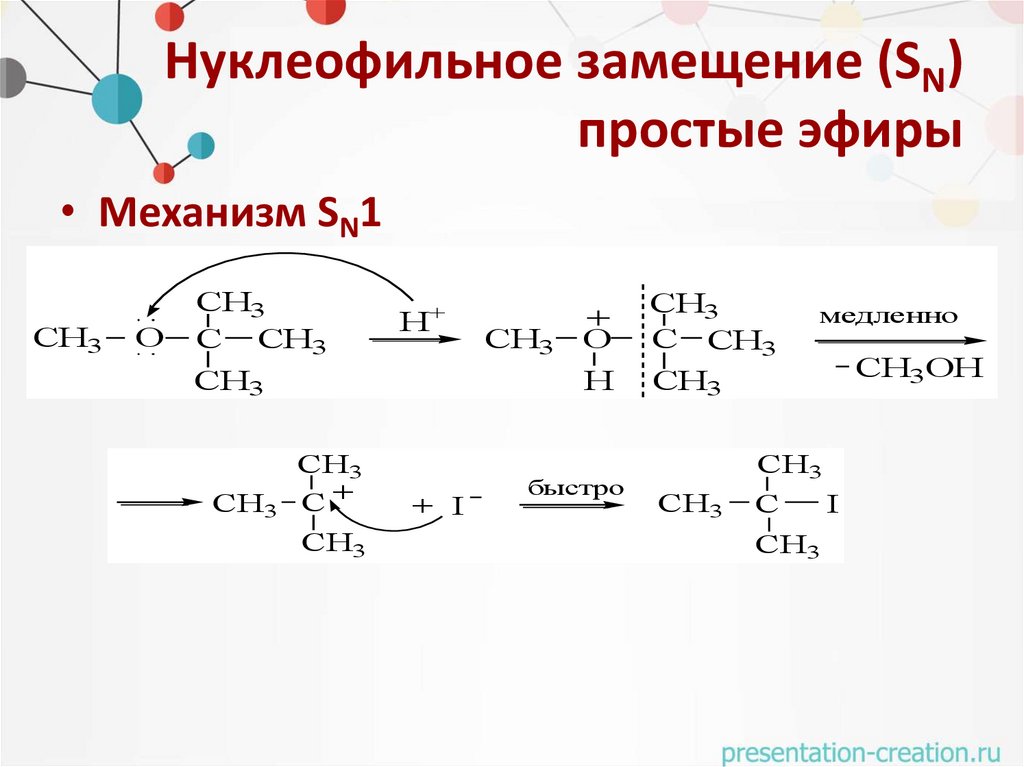
Нуклеофильное замещение (SN)простые эфиры
• Механизм SN2
СH3 O СH2 СH3 + H+
метилэтиловый эфир
медленно
I
быстро
СH3 СH2
H
H
O
С
CH2-CH3
H + H
переходное состояние
+ + H
O C H
H
H
медленно
+ I
быстро
СH3 I + СH3 СH2 OH
йодметан
этанол
28.
Нуклеофильное замещение (SN)простые эфиры
• Механизм SN1
СH3
O
СH3
C СH3
СH3
СH3
СH3
C+
СH3
H+
+ I
СH3
+
O
H
быстро
СH3
C СH3
СH3
медленно
CH3OH
СH3
СH3
C
СH3
I
29.
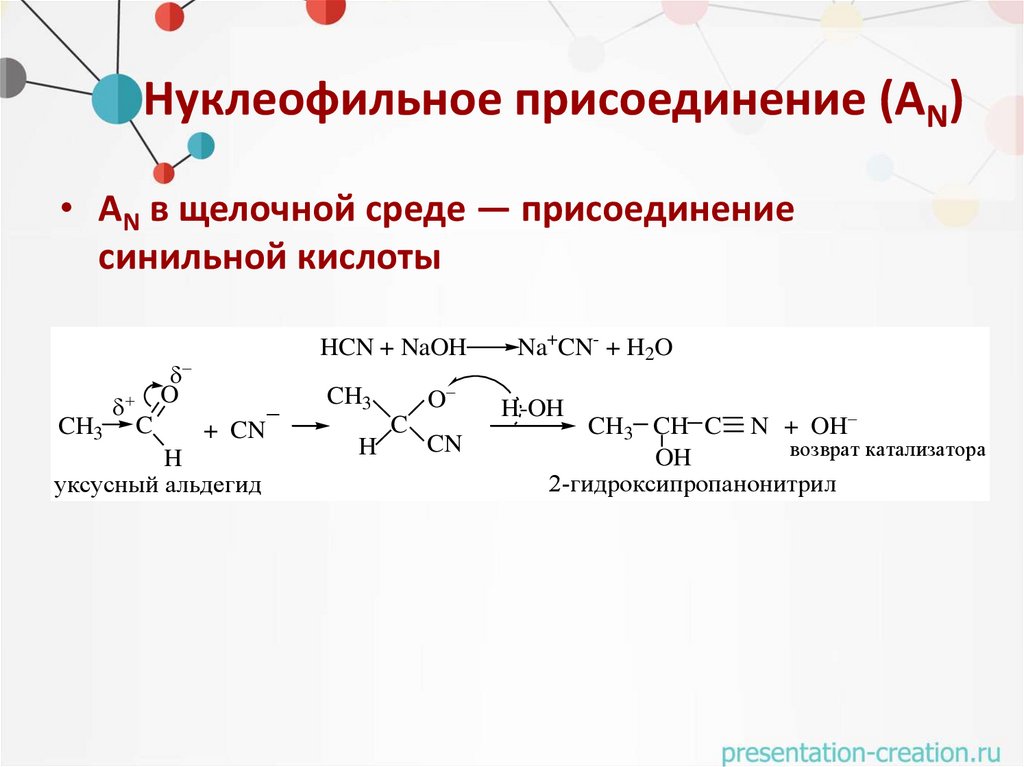
Нуклеофильное присоединение (АN)• АN в щелочной среде — присоединение
синильной кислоты
CH3
C
HCN + NaOH
O
+ CN
H
уксусный альдегид
O
CH3
H
C
CN
Na+CN- + H2O
H-OH
CH3 CH C N + OH
возврат катализатора
OH
2-гидроксипропанонитрил
30.
Нуклеофильное присоединение (АN)• АN в кислой среде — присоединение спиртов
(реакция ацетализации)
O
CH3 С
+ H+
этаналь H
(слабый электрофил)
CH3
+ OH
C
+ O СH3
H
H
+
CH3 СН O СH3
карбкатион
метанол
(сильный электрофил) (слабый нуклеофил)
OH H
выброс
катализатора
оксониевое соединение
хорошая
H уходящая
группа
CH3 СН O CH3 + H+
OH
H +
O
CH3 СН O CH3
+
CH3 СН OCH3 + O CH3
H2O
H
карбкатион
оксониевое соединение
(сильный электрофил)
полуацеталь,
1-метоксиэтанол-1
OCH3
+
CH3 СН O CH3
H
выброс
катализатора
оксониевое соединение
OCH3
+ H+
CH3 СН
OCH3
ацеталь,
1,1-диметоксиэтан
31.
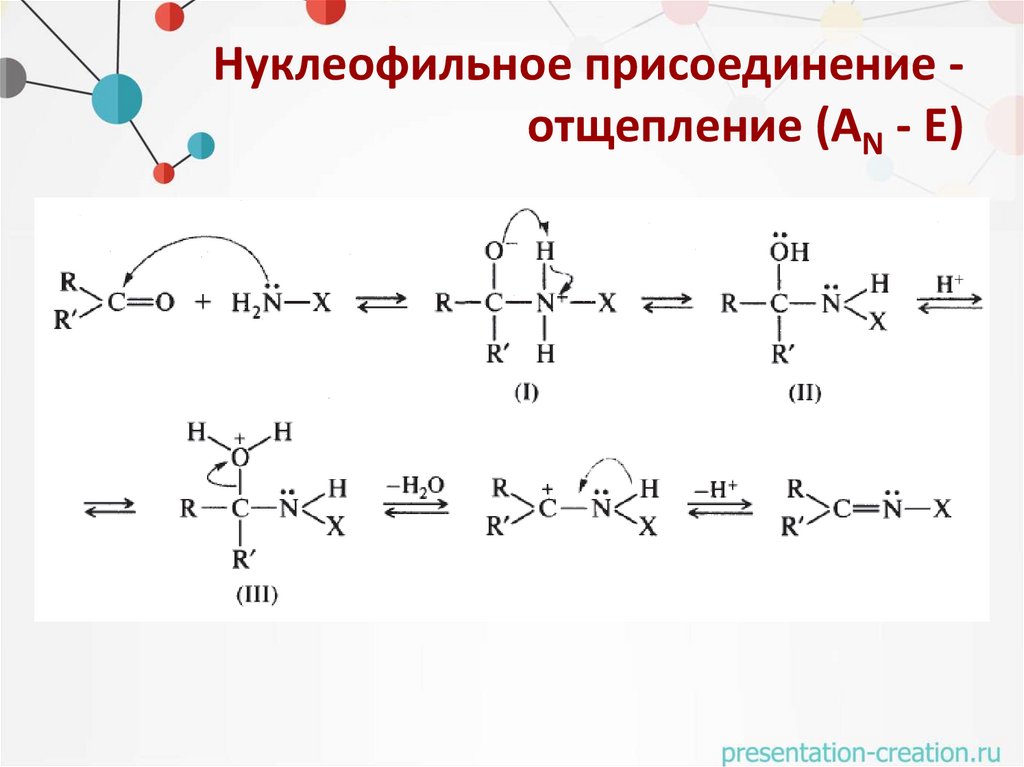
Нуклеофильное присоединение отщепление (АN - Е)32.
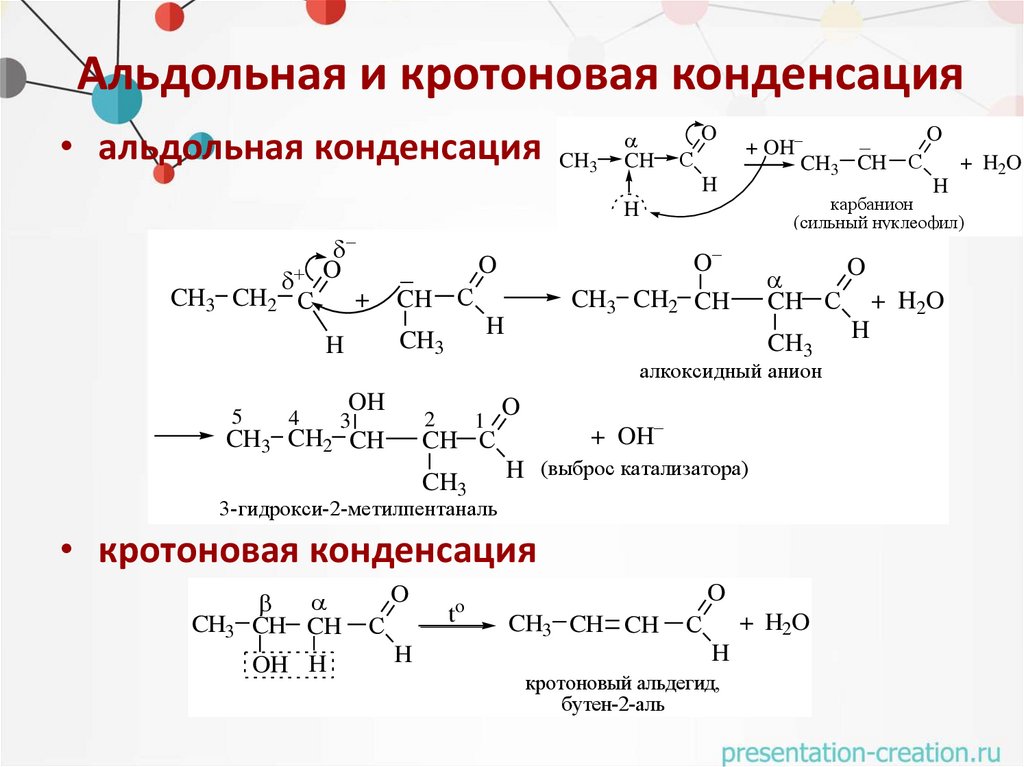
Альдольная и кротоновая конденсация• альдольная конденсация CH3
CH
O
С
H
+ OH
CH3 CH
4
CH С
CH3 CH2 CH
H
CH3
H
5
CH С
O
O
CH3
алкоксидный анион
OH
2
3
1
O
+ OH
CH С
CH3 CH2 CH
CH3
H (выброс катализатора)
3-гидрокси-2-метилпентаналь
• кротоновая конденсация
CH3
CH CH
OH H
O
С
H
o
t
O
CH3 CH CH
С
+ H2O
H
кротоновый альдегид,
бутен-2-аль
С
+ H2O
H
карбанион
(сильный нуклеофил)
H
O
CH3 CH2 С
+
O
O
+ H2O
H
33.
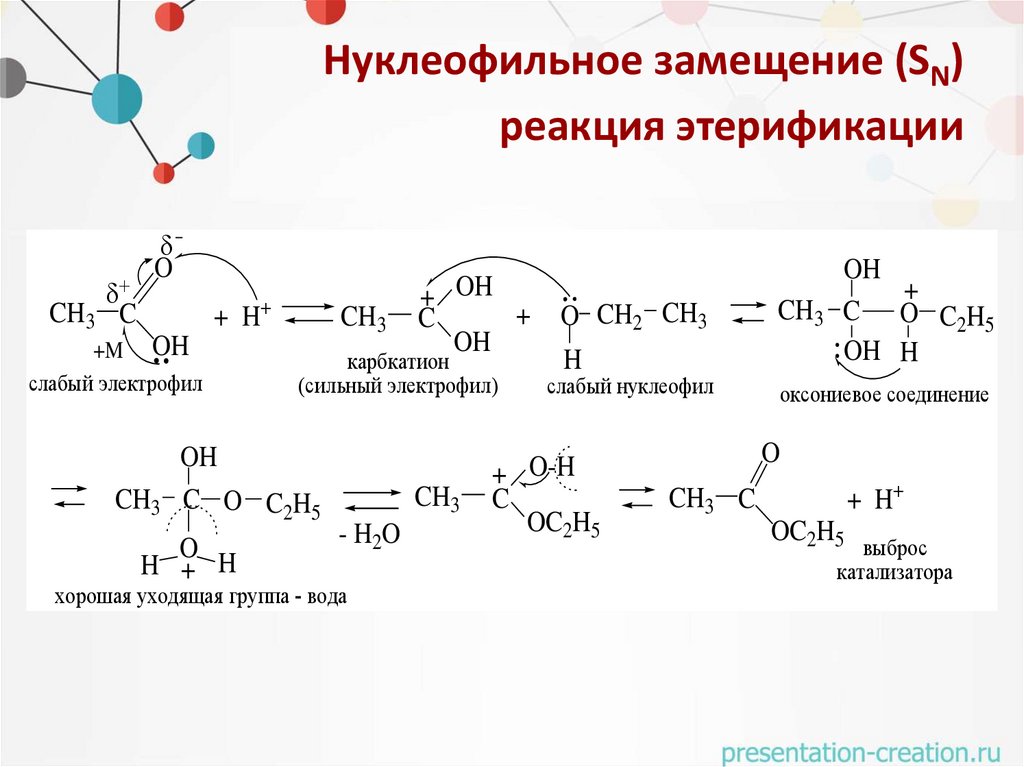
Нуклеофильное замещение (SN)реакция этерификации
CH3 C
O
+ H+
+M OH
слабый электрофил
CH3
карбкатион
(сильный электрофил)
OH
CH3 C O C2H5
O
H + H
+ OH
+
C
OH
CH3
- H2O
хорошая уходящая группа - вода
O CH2 CH3
H
OH
+
CH3 C O C2H5
OH H
слабый нуклеофил
+ O-H
C
OC2H5
оксониевое соединение
O
+ H+
CH3 C
OC2H5
выброс
катализатора
34.
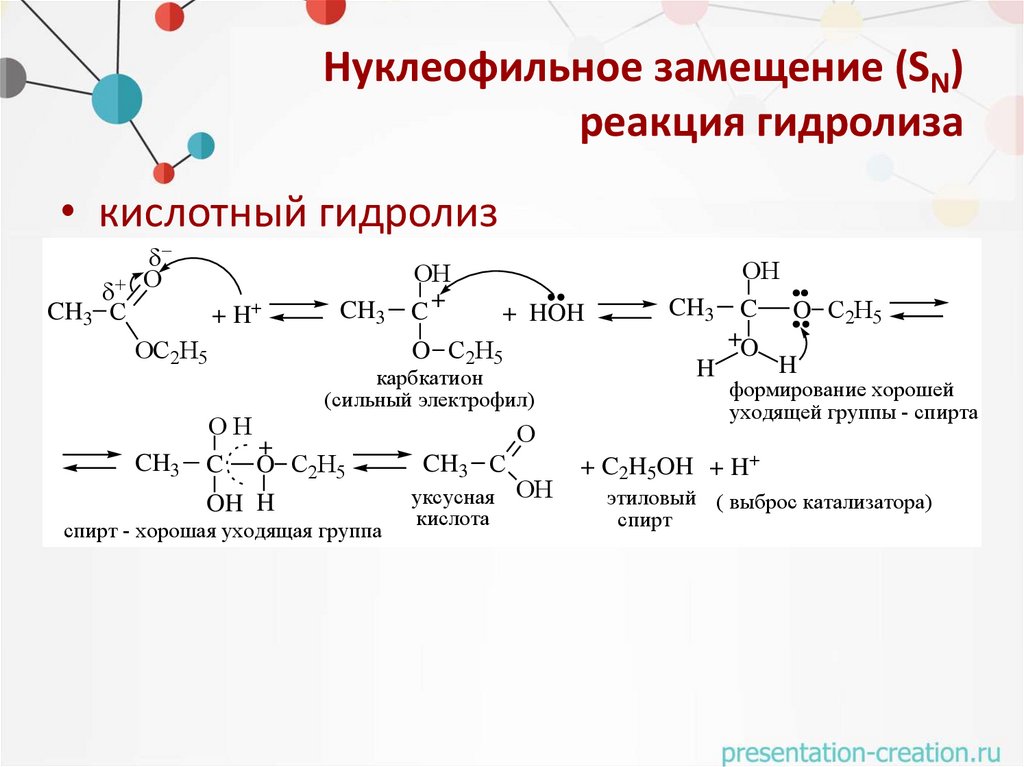
Нуклеофильное замещение (SN)реакция гидролиза
• кислотный гидролиз
O
CH3 С
+ H+
ОС2Н5
CH3
CH3
ОH
C+
+ HOH
O C2H5
карбкатион
(сильный электрофил)
ОH
+
C O C2H5
OH H
спирт - хорошая уходящая группа
O
CH3 С
уксусная ОН
кислота
ОH
CH3 C O C2H5
+O
H
H
формирование хорошей
уходящей группы - спирта
+ C2H5OH + H+
этиловый ( выброс катализатора)
спирт
35.
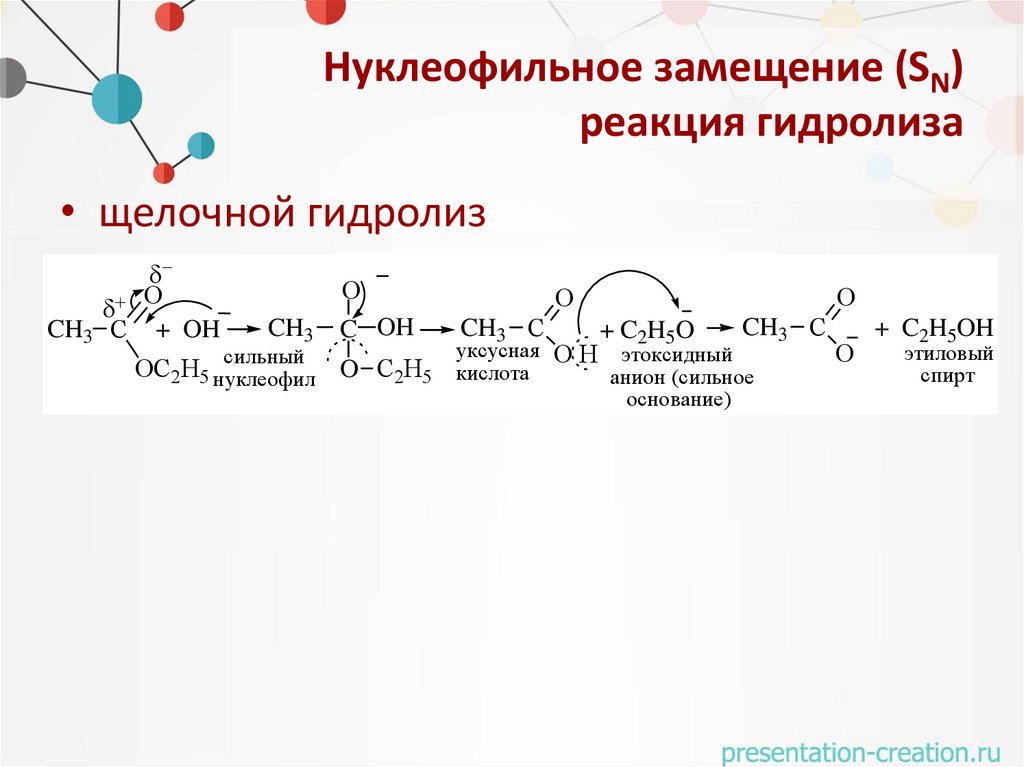
Нуклеофильное замещение (SN)реакция гидролиза
• щелочной гидролиз
O
CH3 С + OH
CH3
сильный
О
C OH
ОС2Н5 нуклеофил O C2H5
O
O
CH3 С
+ C2H5O
CH3 С
уксусная О Н этоксидный
кислота
анион (сильное
основание)
О
+ C2H5OH
этиловый
спирт
36.
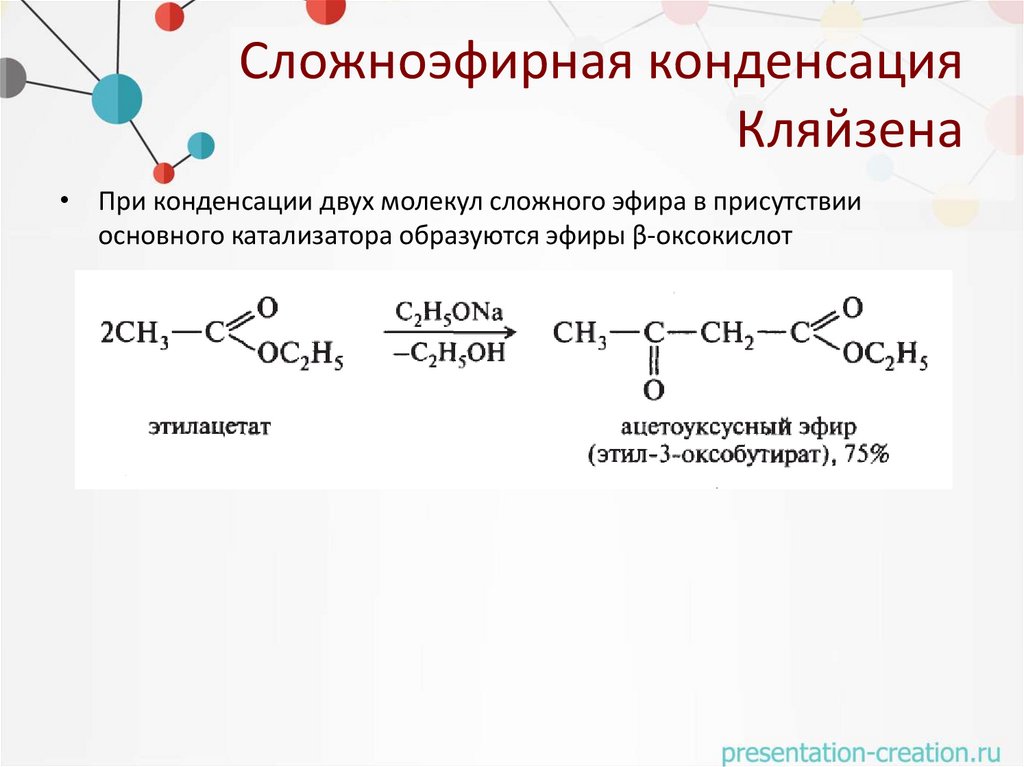
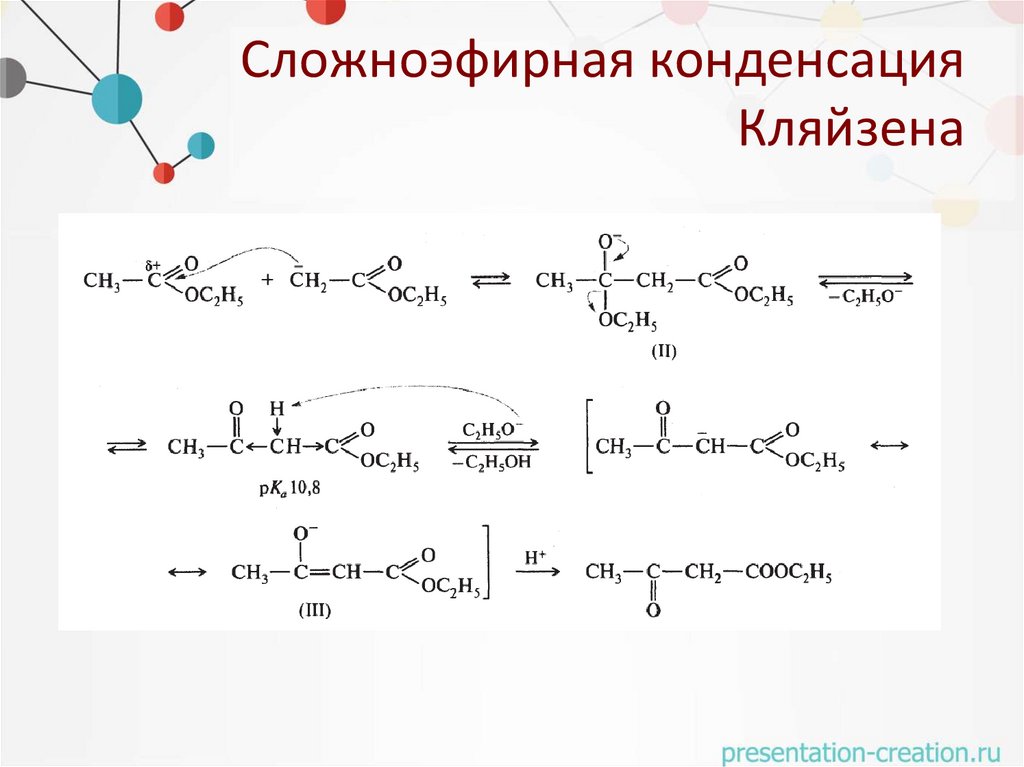
Сложноэфирная конденсацияКляйзена
• При конденсации двух молекул сложного эфира в присутствии
основного катализатора образуются эфиры β-оксокислот
37.
Сложноэфирная конденсацияКляйзена
• Молекула этилацетата обладает слабыми СН-кислотными свойствами
за счет индуктивного эффекта сложноэфирной группы
38.
Сложноэфирная конденсацияКляйзена
39.
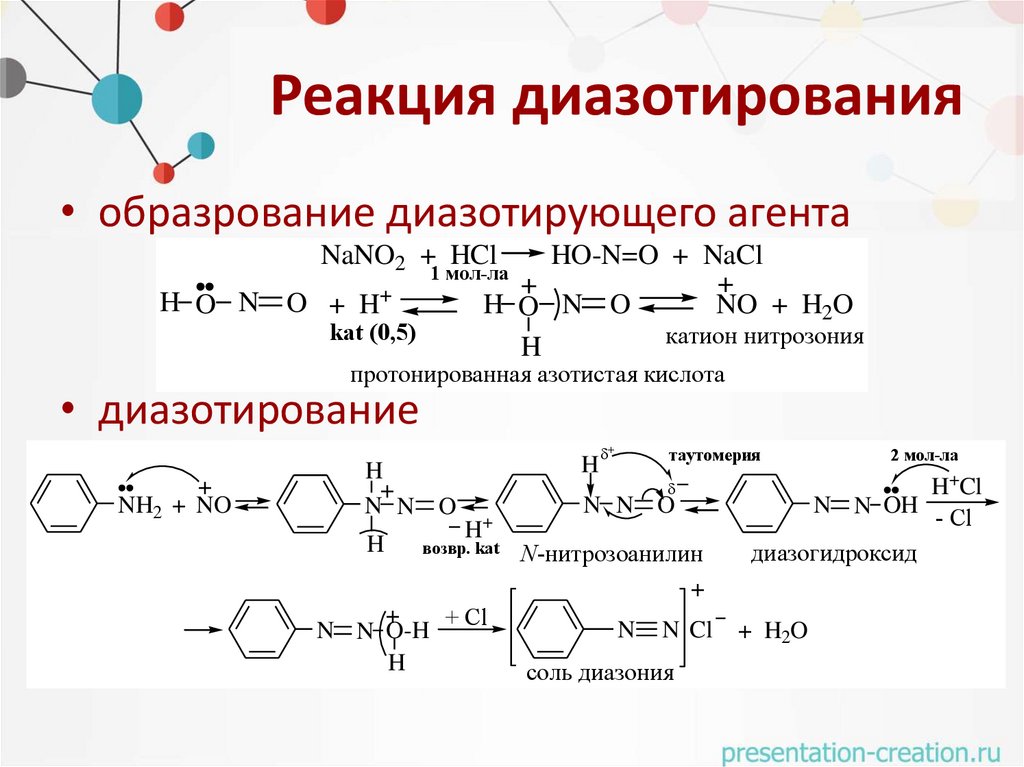
Реакция диазотирования• образрование диазотирующего агента
NaNO2 + HCl
HO-N=O + NaCl
+
+
H O N O
NO + H2O
катион нитрозония
H
1 мол-ла
H O N O + H+
kat (0,5)
протонированная азотистая кислота
• диазотирование
+
NH2 + NO
H
+
N N O
H
H+
возвр. kat
+
+ Cl
N N O-H
H
H
таутомерия
N N O
N-нитрозоанилин
+
N
N Cl
соль диазония
2 мол-ла
+
H Cl
N N OH
- Cl
диазогидроксид
+ H2O
40.
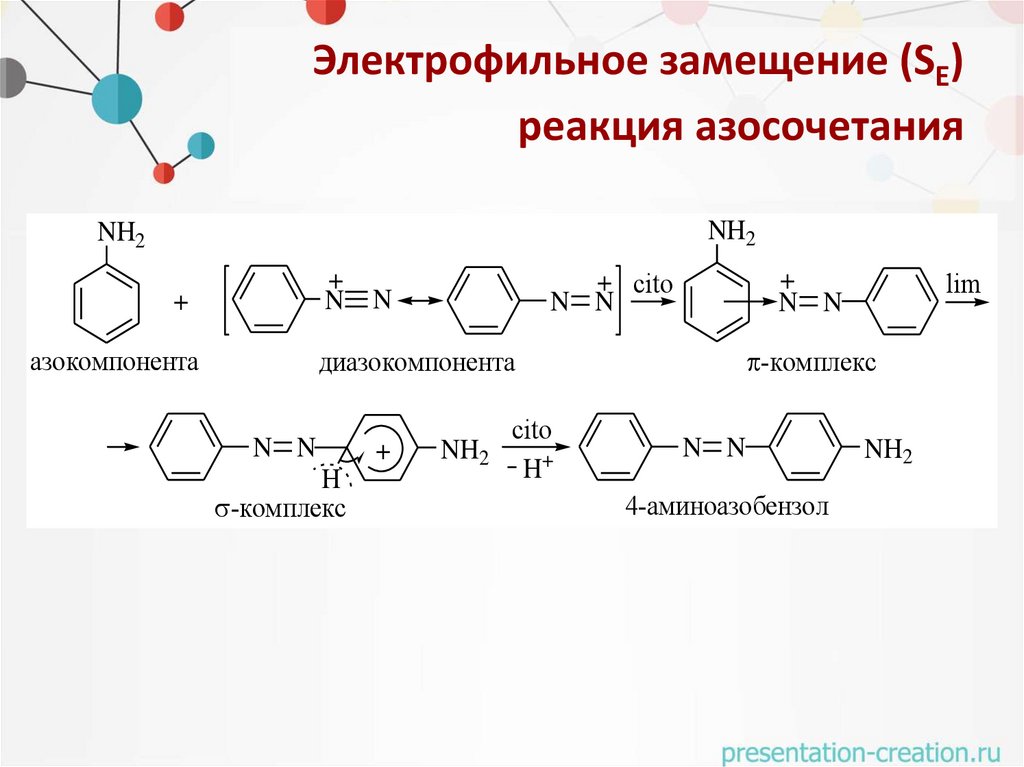
Электрофильное замещение (SE)реакция азосочетания
NH2
NH2
+
N
+
азокомпонента
+ cito
N N
N
-комплекс
диазокомпонента
N N
H
-комплекс
+
NH2
cito
H+
lim
+
N N
N N
4-аминоазобензол
NH2














 Химия
Химия








