Похожие презентации:
Азотсодержащие органические соединения. Амины
1.
АЗОТСОДЕРЖАЩИЕОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
2. АМИНЫ
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
2.
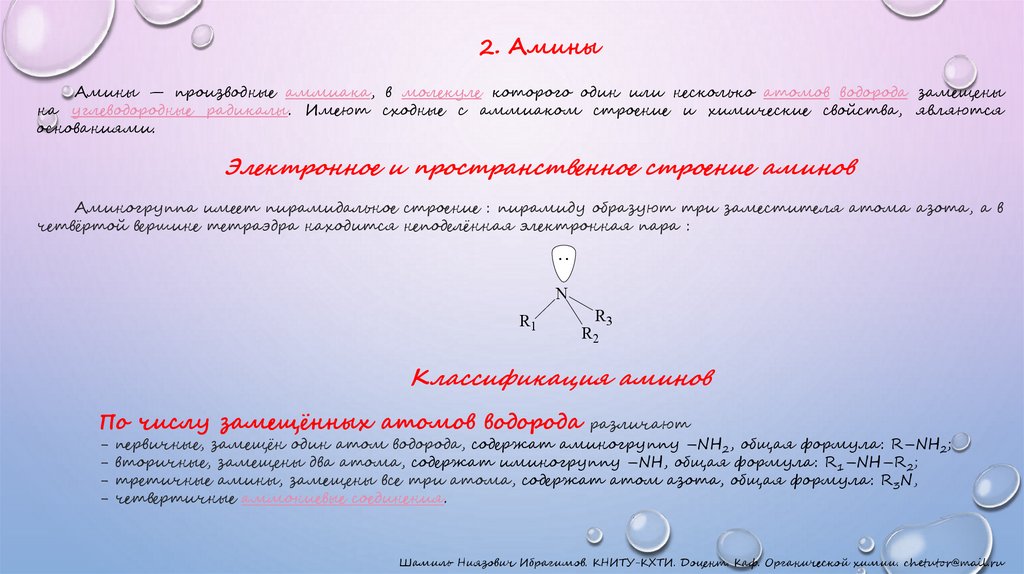
2. АминыАмины — производные аммиака, в молекуле которого один или несколько атомов водорода замещены
на углеводородные радикалы. Имеют сходные с аммиаком строение и химические свойства, являются
основаниями.
Электронное и пространственное строение аминов
Аминогруппа имеет пирамидальное строение : пирамиду образуют три заместителя атома азота, а в
четвёртой вершине тетраэдра находится неподелённая электронная пара :
..
N
R1
R3
R2
Классификация аминов
По числу замещённых атомов водорода различают
- первичные, замещён один атом водорода, содержат аминогруппу –NH2, общая формула: R–NH2;
- вторичные, замещены два атома, содержат иминогруппу –NH, общая формула: R1–NH–R2;
- третичные амины, замещены все три атома, содержат атом азота, общая формула: R3N,
- четвертичные аммониевые соединения.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
3.
Номенклатура, изомерия аминовНазвания аминов по рациональной номенклатуре обычно производят от названий входящих в них
углеводородных радикалов с присоединением окончания –амин: метиламин СН3–NН2, диметиламин
СН3–NН–СН3, триметиламин (СН3)3N, пропиламин СН3СН2СН2–NН2, фениламин С6Н5– NН2 и т. д.
По номенклатуре ИЮПАК аминогруппу рассматривают как функциональную группу и ее название
амино- ставят перед названием основной цепи:
CH3
CH3 CH CH2OH
NH2
2-аминопропанол-1
Для
названия:
ароматических
CH3 C CH2
CH2 COOH
NH2
4-амино-4-метилпентановая кислота
аминов
часто
используют
тривиальные
анилин PhNH2, толуидины (орто-, мета-, пара-) CH3C6H4NH2.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
4.
2.2. Способы получения аминов2.2.1. Получение аминов из спиртов
Стандартным промышленным способом получения низших аминов является реакция
соответствующего спирта с аммиаком. Т.к. получаемый первичный амин тоже может реагировать со
спиртом, продуктом всегда является смесь первичного, вторичного и третичного аминов. Синтез
осуществляют пропусканием паров спирта и аммиака при 450 ºС над катализатором:
Al2O3, 450oC
R NH2
-H2O
Al2O3, 450oC R
NH
R NH2 + R OH
-H2O
R
R
R
Al2O3, 450oC
R N
NH + R OH
-H2O
R
R
R OH + NH3
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
5.
2.2.2. Получение аминов из амидов кислотАмины получают из амидов карбоновых кислот, причём не только первичные, но из N-алкиламидов –
вторичные и из N,N-диалкиламидов – третичные амины.
Сначала из карбоновых кислот действием аммиака получают аммонийные соли, которые при
нагревании превращаются в амиды. Гидрирование амидов приводит к получению аминов и воды:
O
CH3CH2 C
пропионовая
кислота
OH
+ NH3
CH3CH2 C
пропионат
аммония
O
CH3CH2 C
NH2
+ 2H2
Pd, t
O-NH4+
NH2
CH3 C
OH
этановая
кислота
O -N +
этаноат
N-метиламмония
O
CH3 C
N
CH3 + 2H2
H
амид пропионовой
кислоты
NH2
+ H2O
CH3CH2CH2 NH2 + H2O
O
+ CH3
O
CH3CH2 C
пропиламин
O
CH3 C
> 100oC
O
Pd, t
CH3
> 100oC
H
CH3CH2 N
метилэтиламин
O
CH3 C
N
CH3 + H2O
H
N-метиламид этановой
кислоты
CH3
H
+ H2O
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
6.
2.2.3. Получение первичных аминов из нитриловНитрилы восстанавливаются водородом с образованием первичных аминов. Сами нитрилы могут быть
получены дегидратацией амидов кислот или из галоидных алкилов и цианидов металлов:
O
CH3CH2 C
t
NH2
амид пропионовой
кислоты
CH3CH2 Br + KCN
CH3CH2 C N + 2H2
CH3CH2 C N + H2O
нитрил пропионовой
кислоты
CH3CH2 C N + KBr
Pd, t
CH3CH2CH2 NH2
пропиламин
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении
волокна - нейлон.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
7.
2.2.4. Получение аминов по реакции галогенопроизводных и аммиака илиаминов (реакция Гофмана)
Амины
получают
замещением
галогена
в
углеводородном
радикале
(реакцию
можно
назвать
алкилированием аммиака). Реакция начинается с образования аммиаком (или амином) аммонийной соли с
галоидными алкилами, которые расщепляются с образованием новых аминов. На каждой стадии можно
использовать разные галоидные алкилы.
Недостатком способа является то, что степень алкилирования трудно контролировать, так как
образующийся амин содержит на одну алкильную группу больше, следовательно более основен (см. ниже) и более
активен по сравнению с исходным амином. Поэтому всегда образуется смесь аминов:
NH3 + RHal
аммиак галоидный
алкил
RNH2 + RHal
первичный
амин
R2NH + RHal
вторичный
амин
+
-
RNH3 Hal
соль первичного
амина
(алкиламмоний
галогенид)
R2NH2+ Hal-
соль вторичного
амина
(диалкиламмоний
галогенид)
R3NH2Hal
+ NaOH
RNH2 ,
-HHal первичный
амин
(алкиламин)
+ NaOH
-HHal
R2NH ,
вторичный
амин
(диалкиламин)
+ NaOH
R3N ,
соль третичного -HHal третичный
амин
амина
(триалкиламмоний
(триалкиламин)
галогенид)
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
8.
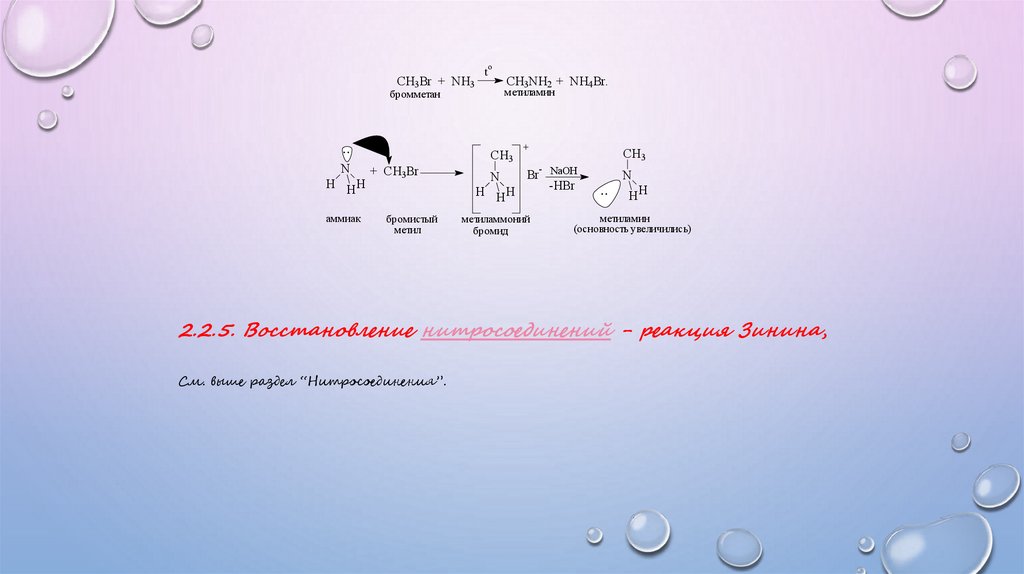
CH3Br + NH3t
o
CH3NH2 + NH4Br.
метиламин
бромметан
..
N
H HH
аммиак
+ CH3Br
CH3
N
+
H HH
бромистый
метил
CH3
Br- NaOH
метиламмоний
бромид
-HBr
..
N
HH
метиламин
(основность увеличились)
2.2.5. Восстановление нитросоединений - реакция Зинина,
См. выше раздел “Нитросоединения”.
9.
2.3. Химические свойства аминов2.3.1. Основность аминов
Атом азота аминов содержит неподелённую электронную пару, поэтому амины как и аммиак,
проявляют основные свойства, образуют гидроксиды, соли аммония и являются основаниями Льюиса. Амины
являются более сильными основаниями, чем вода. Также, амины являются более сильными основаниями,
чем аммиак, за счёт электроно-донорного влияния алкильных групп (+Jэфф алкильных групп). В газовой фазе,
где эффекты сольватации отсутствуют, основность аминов уменьшается в ряду: третичные > вторичные >
первичные
>
аммиак.
Ароматические
амины
являются
более
слабыми
основаниями,
что
связано
с
делокализацией неподелённой пары атома азота по ароматическому ядру вследствие сопряжения.
При взаимодействии с кислотами амины образуют соли аммония :
CH3 N
+ HCl
N
H
H
метилэтиламин
Амины вступают с водой в реакции гидролиза :
H
CH3
N
H
метиламмония гидроксид
..
C2H5
N
H
H
хлорид метилэтиламмония
N H OH ,
CH3
H
метиламин
Амины образуют соли с галоидными алкилами :
CH3
C2H5
CH3
Cl .
+
H
+ H2O
+
H
C2H5
+ C2H5J
CH3 NH2 + C2H5J
N
H
+
H
J-
CH3
CH3(C2H5)N+H2J-
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
10.
2.3.2. Кислотные свойства аминовАмины являются очень слабыми кислотами: pKa для них имеет порядок близкий к 40 (т.е. концентрация
протонов имеет порядок около 10-40 моль/л). Соответственно, анионы, получаемые из аминов, являются очень
сильными основаниями (нуклеофилами) и находят применение в органическом синтезе.
2.3.3. Окисление аминов
Амины горят на воздухе с образованием диоксида углерода, воды и азота, например, метиламин:
4CH3NH2 + 9 O2
4CO2 + 10H2O + 2N2 .
2.3.4. Алкилирование аминов
Соли, образуемые аминами с галоидными алкилами разлагаются основаниями с образованием новых аминов.
Это реакция алкилирования аминов, см. выше реакцию Гофмана.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
11.
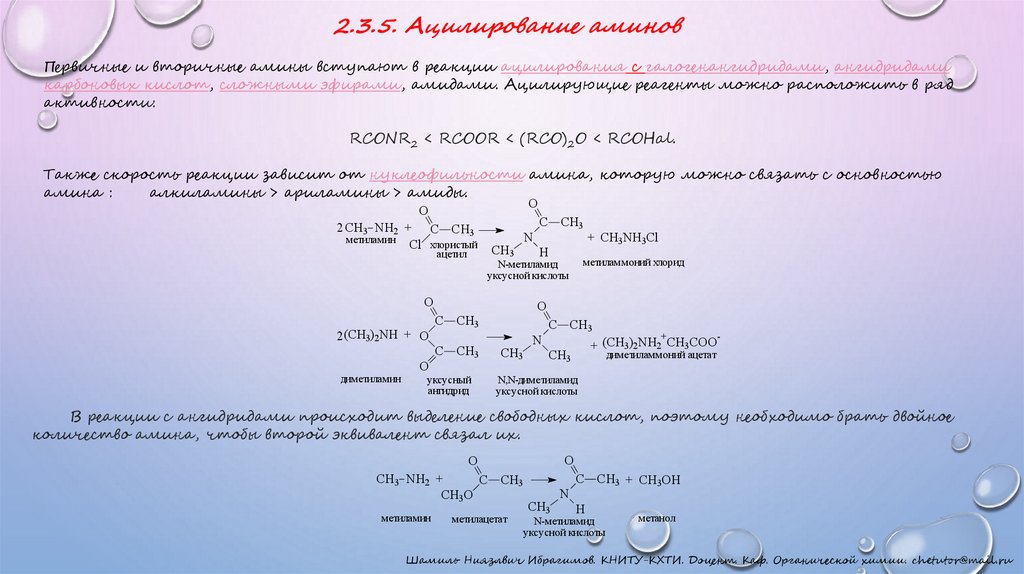
2.3.5. Ацилирование аминовПервичные и вторичные амины вступают в реакции ацилирования с галогенангидридами, ангидридами
карбоновых кислот, сложными эфирами, амидами. Ацилирующие реагенты можно расположить в ряд
активности:
RCONR2 < RCOOR < (RCO)2O < RCOHal.
Также скорость реакции зависит от нуклеофильности амина, которую можно связать с основностью
амина :
алкиламины > ариламины > амиды.
O
O
2 CH3 NH2 + C CH3
метиламин
Cl хлористый
ацетил
CH3
диметиламин
O
C CH3
H
+ CH3NH3Cl
метиламмоний хлорид
N-метиламид
уксусной кислоты
O
2 (CH3)2NH + O
N
O
C CH3
C CH3
уксусный
ангидрид
CH3
N
C CH3
+
+ (CH3)2NH2 CH3COO
CH3
-
диметиламмоний ацетат
N,N-диметиламид
уксусной кислоты
В реакции с ангидридами происходит выделение свободных кислот, поэтому необходимо брать двойное
количество амина, чтобы второй эквивалент связал их.
O
O
CH3 NH2 +
C CH3
CH3O
метиламин
метилацетат
CH3
N
C CH3 + CH3OH
H
N-метиламид
уксусной кислоты
метанол
Шамиль Ниязлвич Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
12.
2.3.6. Реакция аминов с альдегидами и кетонамиПри реакции с альдегидами и кетонами первичные амины образуют имины (основания Шиффа), а
O
вторичные амины дают енамины:
CH3
CH3 NH2 +
C
CH3
C2H5 NH2 + CH3 C
CH3
H
O
CH3 N C
+ H2O
H
CH3
C2H5 N C
+ H2O
CH3
2.3.7. Реакции аминов с азотистой кислотой
Подобно соединениям с подвижным водородом при α-углеродном атоме амины реагируют с азотистой
кислотой. При действии азотистой кислоты на первичные амины (кроме ароматических аминов) образуются
диазосоединения. Диазосоединения окрашены в красный цвет.
CH3 N
H
H
+ O N OH
[CH3 N
N OH]
[CH3 N
N OH] + H2O
метилдиазогидроксид
CH3 OH + N2
Вторичные амины (алифатические и ароматические) при действии азотистой кислоты нитрозируются
по атому азота, давая N-нитрозоамины, имеющие характерный жёлтый цвет:
CH3
CH3
N-H + HO
диметиламин
N O
CH3
CH3
N N O + H2O
нитрозодиметиламин
Третичные амины на холоду устойчивы к действию разбавленной азотистой кислоты.
Эта реакция имеет аналитическое значение, так как позволяет различать первичные, вторичные и
третичные амины неароматического характера.
Шамиль Ниязлвич Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
13.
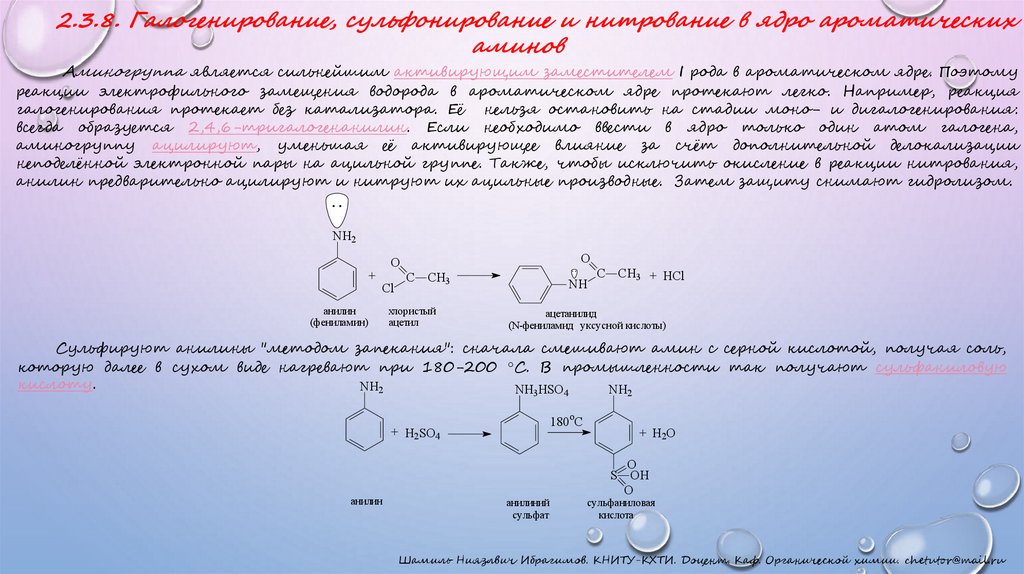
2.3.8. Галогенирование, сульфонирование и нитрование в ядро ароматическихаминов
Аминогруппа является сильнейшим активирующим заместителем I рода в ароматическом ядре. Поэтому
реакции электрофильного замещения водорода в ароматическом ядре протекают легко. Например, реакция
галогенирования протекает без катализатора. Её нельзя остановить на стадии моно- и дигалогенирования:
всегда образуется 2,4,6-тригалогенанилин. Если необходимо ввести в ядро только один атом галогена,
аминогруппу ацилируют, уменьшая её активирующее влияние за счёт дополнительной делокализации
неподелённой электронной пары на ацильной группе. Также, чтобы исключить окисление в реакции нитрования,
анилин предварительно ацилируют и нитруют их ацильные производные. Затем защиту снимают гидролизом.
..
NH2
+
O
..
C
NH
O
Cl
анилин
(фениламин)
C
CH3
хлористый
ацетил
CH3 + HCl
ацетанилид
(N-фениламид уксусной кислоты)
Сульфируют анилины "методом запекания": сначала смешивают амин с серной кислотой, получая соль,
которую далее в сухом виде нагревают при 180-200 °С. В промышленности так получают сульфаниловую
кислоту.
NH2
NH3HSO4
NH2
180oC
+ H2SO4
+ H2O
S
анилин
анилиний
сульфат
O
OH
O
сульфаниловая
кислота
Шамиль Ниязлвич Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru









 Химия
Химия








