Похожие презентации:
Аминокислоты. Классификация, номенклатура, изомерия
1.
АМИНОКИСЛОТЫАК– это такие производные
углеводородов, которые содержат
одновременно аминогруппу и
карбоксильную группу.
NH2
COOH
2.
Классификация, номенклатура, изомерия.В зависимости от кол-ва функциональных
групп различают:
моноаминокарбоновые кислоты,
моноаминодикарбоновые кислоты,
диаминокарбоновые кислоты и т. п.
В зависимости от взаимного расположения
–СООН и –NH2 –групп различают
, , - и т.д. -АК.
В зависимости от строения
углеводородного радикала АК делятся на
алифатические,
ароматические ,
гетероциклические.
3.
Для наименования АК широкоиспользуют тривиальные названия.
По рациональной номенклатуре АК
рассматривают как замещенные
соответствующих кислот, положение
NH2-групп обозначают префиксами ,
, .
В номенклатуре ИЮПАК NH2-группу
называют амино и указывают номер Сатома, с которым она связана, затем
следует название кислоты.
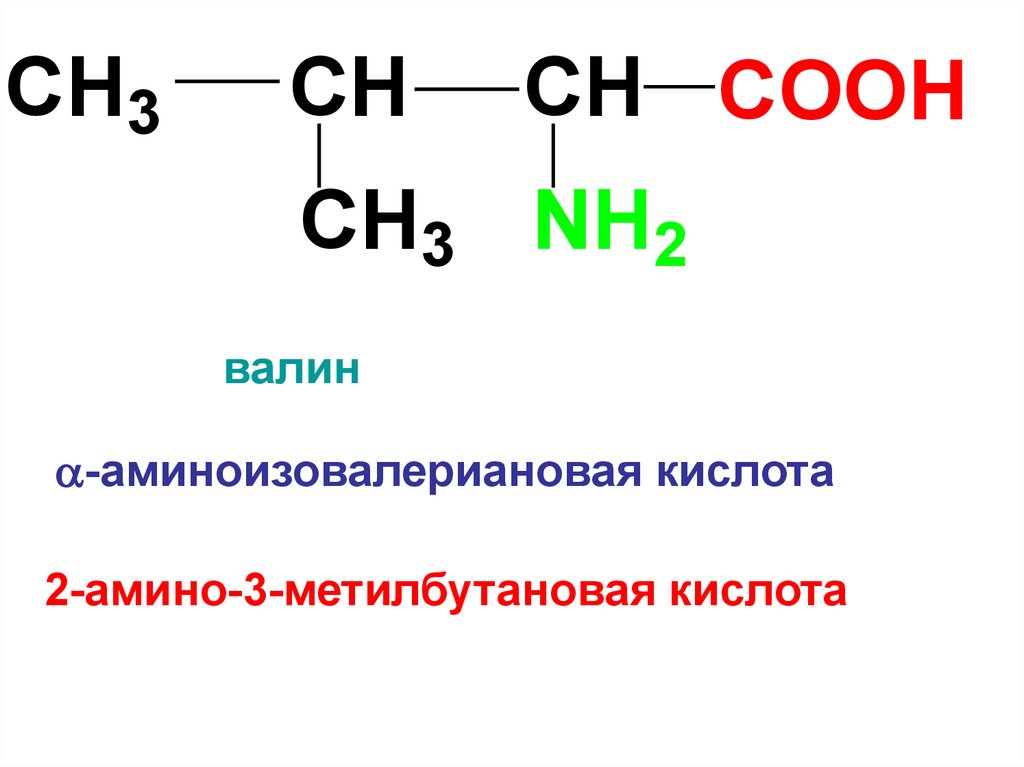
4.
CH3CH
CH COOH
CH3 NH2
валин
-аминоизовалериановая кислота
2-амино-3-метилбутановая кислота
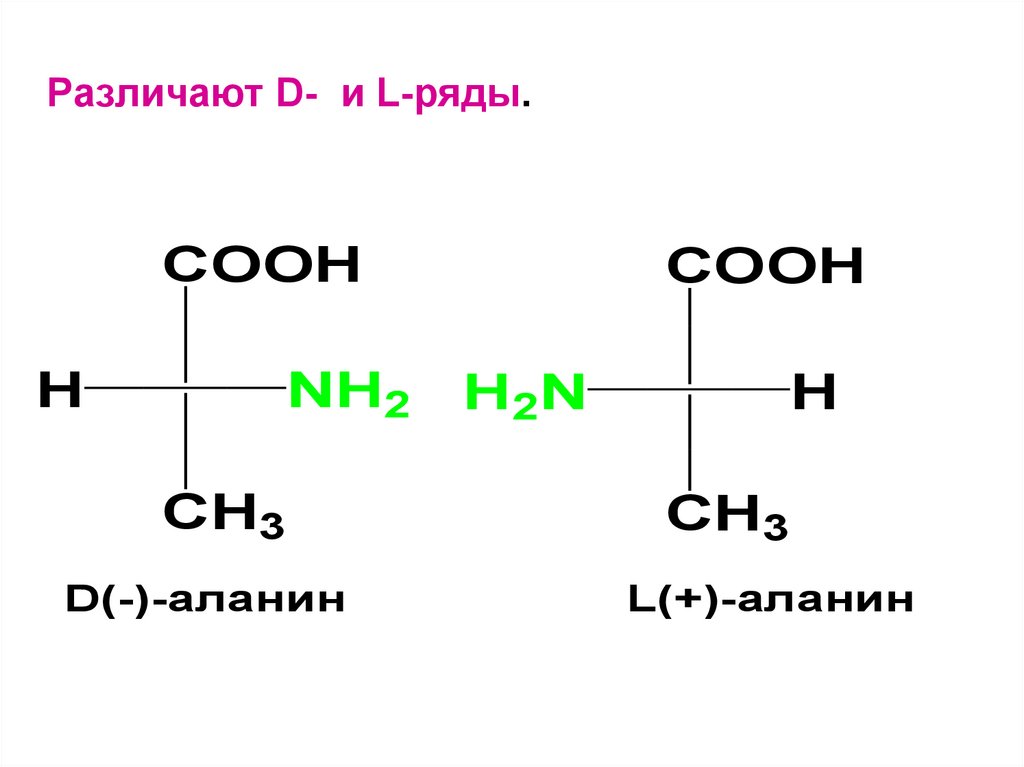
5.
Различают D- и L-ряды.COOH
NH2
H
CH3
D(-)-аланин
COOH
H
H2N
CH3
L(+)-аланин
6.
ФИЗИЧЕСКИЕ СВОЙСТВА,СТРОЕНИЕ• АК представляют собой бесц. кр.в-ва с
высокой Тпл. (150 – 330оС). Плавятся как
правило с разложением, нелетучи, х. р. в
воде, плохо в орг. растворителях
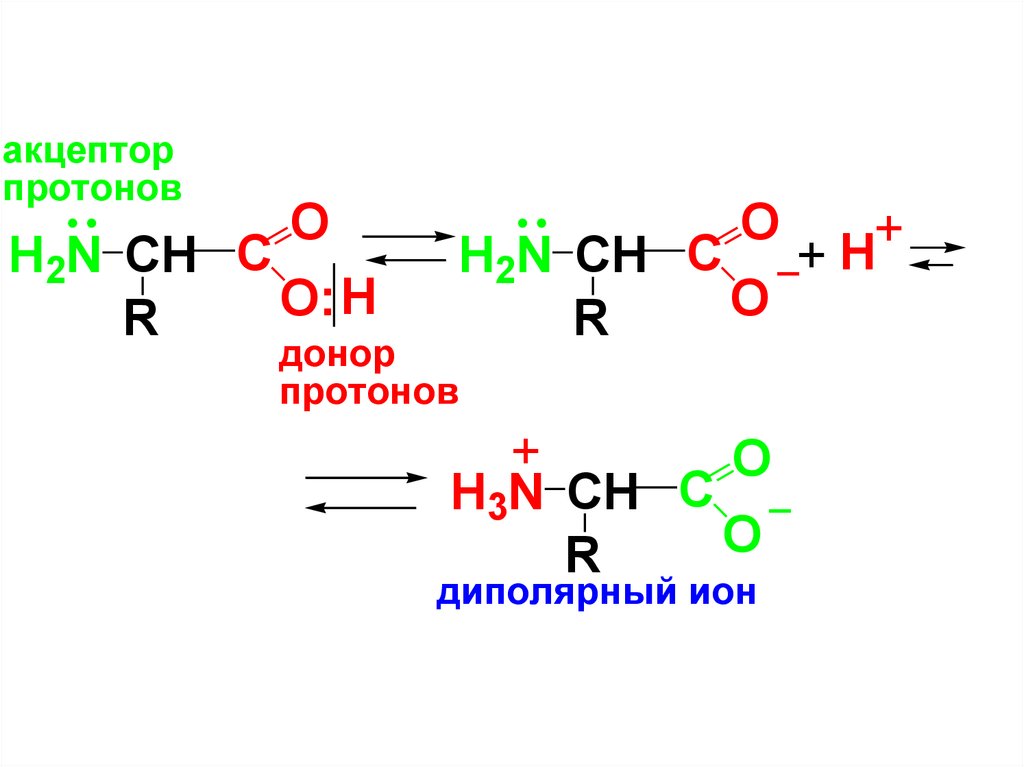
• В состав молекулы АК входит аминогруппа,
обладающая основными св-вами и
карбоксильная гр., обладающая кислотными
св-вами, которые вступают во внутримолекулярное взаимодействие, образуя
внутреннюю соль или диполярный ион
(цвиттер-ион).
7.
акцепторпротонов
O
H2N CH C
H
O:
R
O
H2N CH C
O
R
+
_+ H
донор
протонов
+
O
H3N CH C _
O
R
диполярный ион
8.
9.
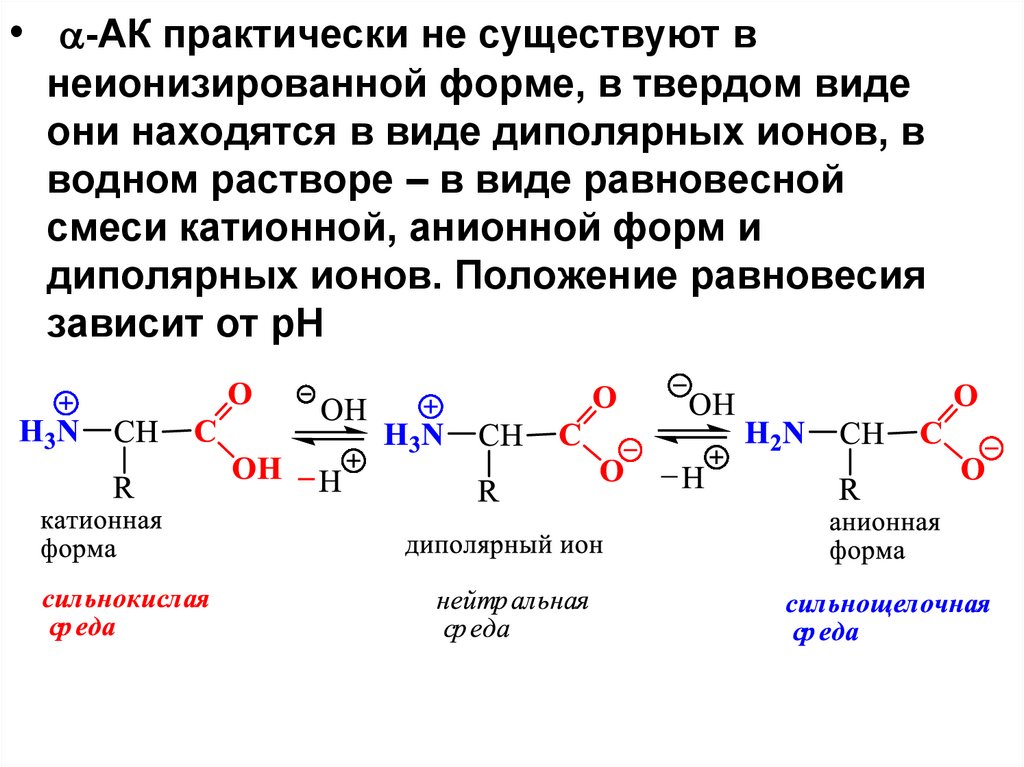
• -АК практически не существуют внеионизированной форме, в твердом виде
они находятся в виде диполярных ионов, в
водном растворе – в виде равновесной
смеси катионной, анионной форм и
диполярных ионов. Положение равновесия
зависит от рН
10.
• Большинство природных АК, участвующихв биохим.процессах содержат первичную
аминогр., находящуюся в -положении.
Практически все, входящие в состав белков
АК, относятся к L-ряду.
• В настоящее время в природных объектах
обнаружено около 100 -АК.
• Известно 20 наиболее важных -АК, 10 из
которых незаменимые. К ним относят такие
АК, которые не могут синтезироваться в
организме человека.
11.
-АК в твердом виде находятся в видедиполярных ионов, в водном р-ре в виде
равновесной смеси катионной, анионной
форм и диполярных ионов. Равновесие
зависит от рН среды.
• Значение рН, при котором р-ры АК
электронейтральны и не проводят
электрический ток, называют
изоэлектрической точкой.
12.
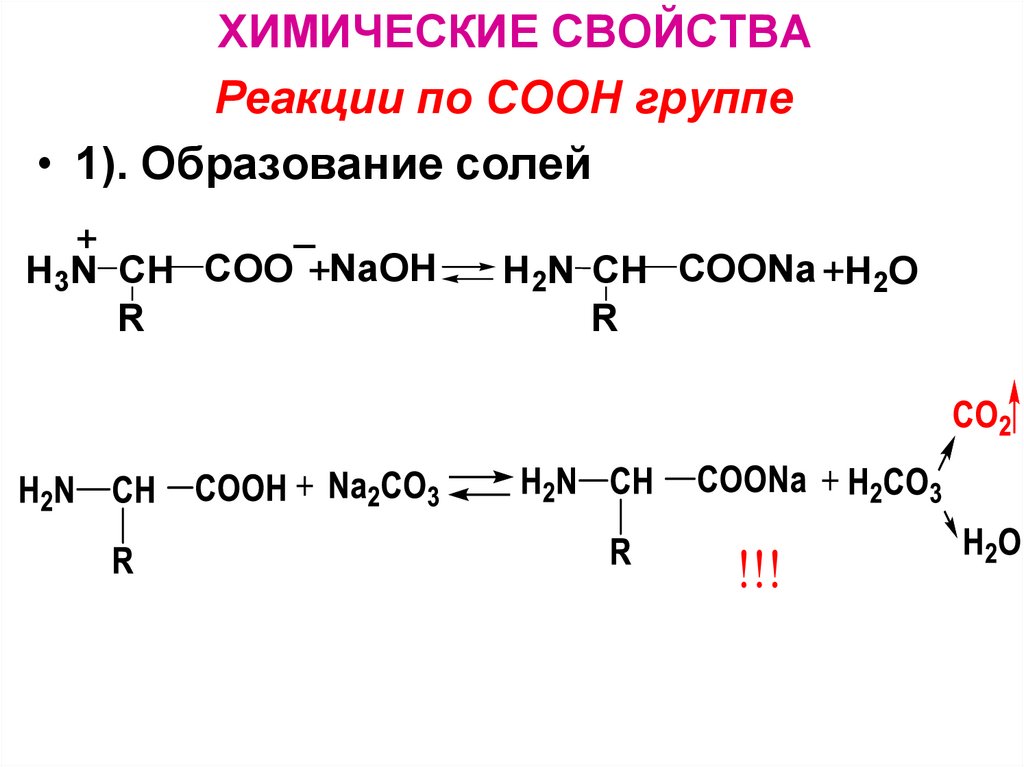
ХИМИЧЕСКИЕ СВОЙСТВАРеакции по СООН группе
• 1). Образование солей
_
+
H3N CH COO +NaOH
R
H2N CH COONa +H2O
R
13.
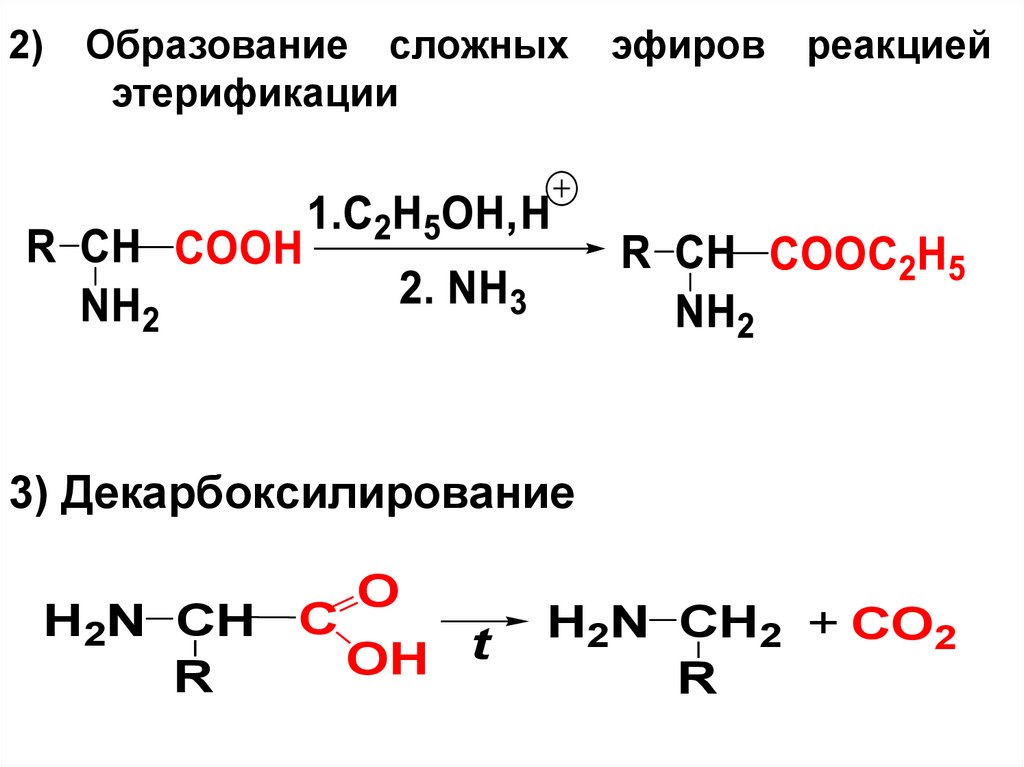
2)Образование сложных
этерификации
эфиров
реакцией
3) Декарбоксилирование
O
H2N CH C
t
OH
R
H2N CH2 + CO2
R
14.
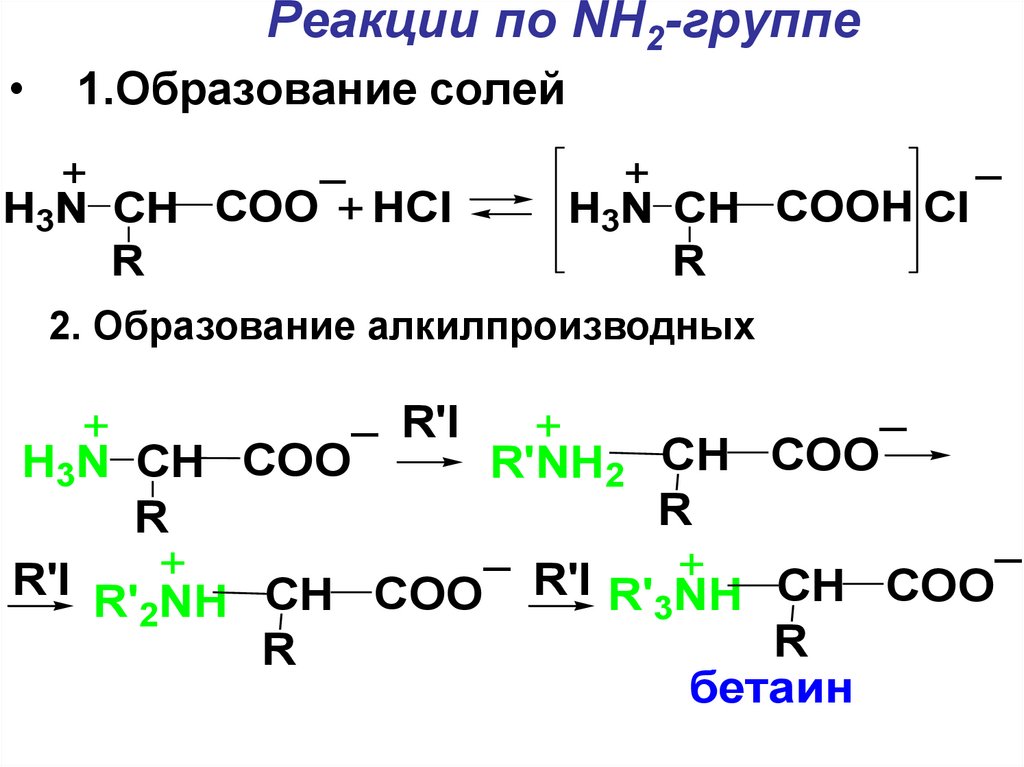
Реакции по NH2-группе1.Образование солей
_
+
H3N CH COO + HCl
R
_
+
H3N CH COOH Cl
R
2. Образование алкилпроизводных
_
_ R'I
+
+
H3N CH COO
R'NH2 CH COO
R
R
_
_
+
+
R'I R' NH
R'I
CH COO
COO
CH
R'
NH
3
2
R
R
бетаин
15.
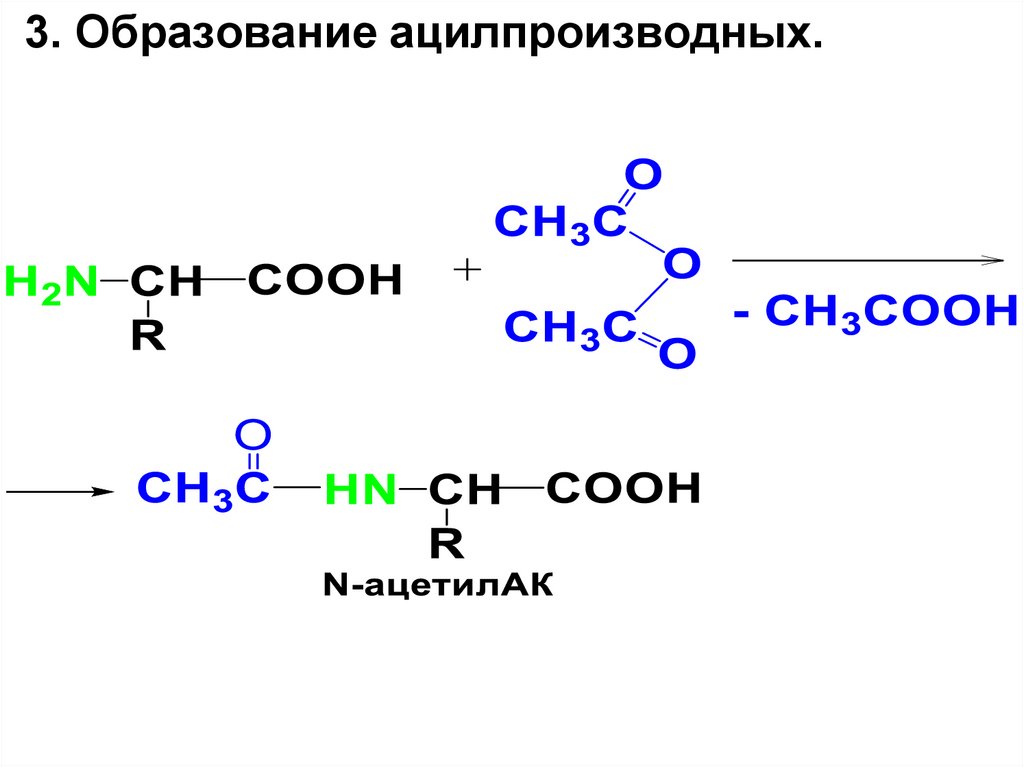
3. Образование ацилпроизводных.16.
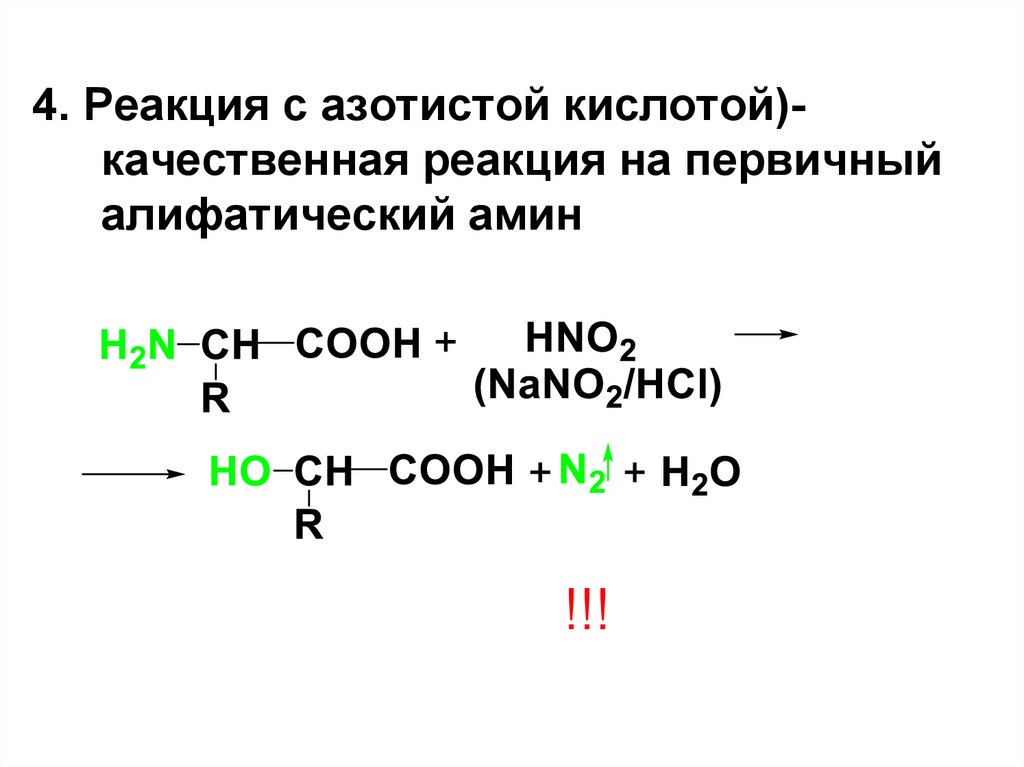
4. Реакция с азотистой кислотой)качественная реакция на первичныйалифатический амин
!!!
17.
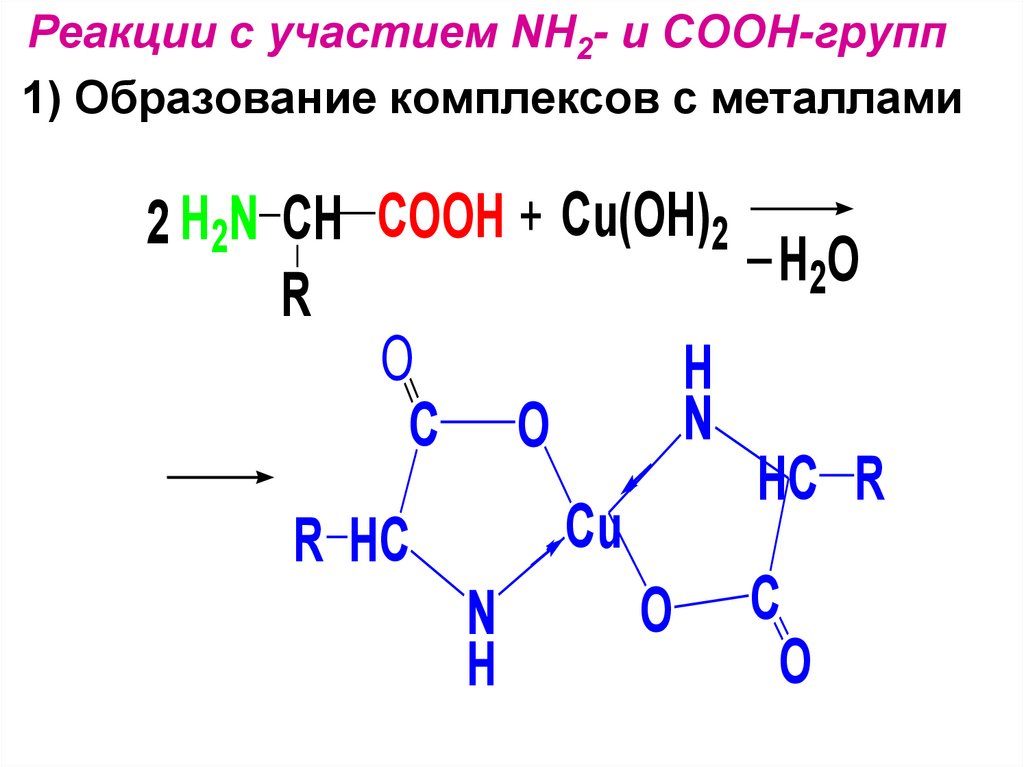
Реакции с участием NH2- и COOH-групп1) Образование комплексов с металлами
2 H2N CH COOH + Cu(OH)2 _
H2O
R
O
H
N
C O
HC R
Cu
R HC
O C
N
O
H
18.
ПЕПТИДЫ, БЕЛКИВысокомолекулярные органические
соединения белки явл-ся основным
компонентом живого организма.
Белки играют исключительную роль в
жизни живого организма, выполняя
разнообразные функции.
Кирпичиками, из которых строятся
белковые молекулы, явл-ся -АК.
19.
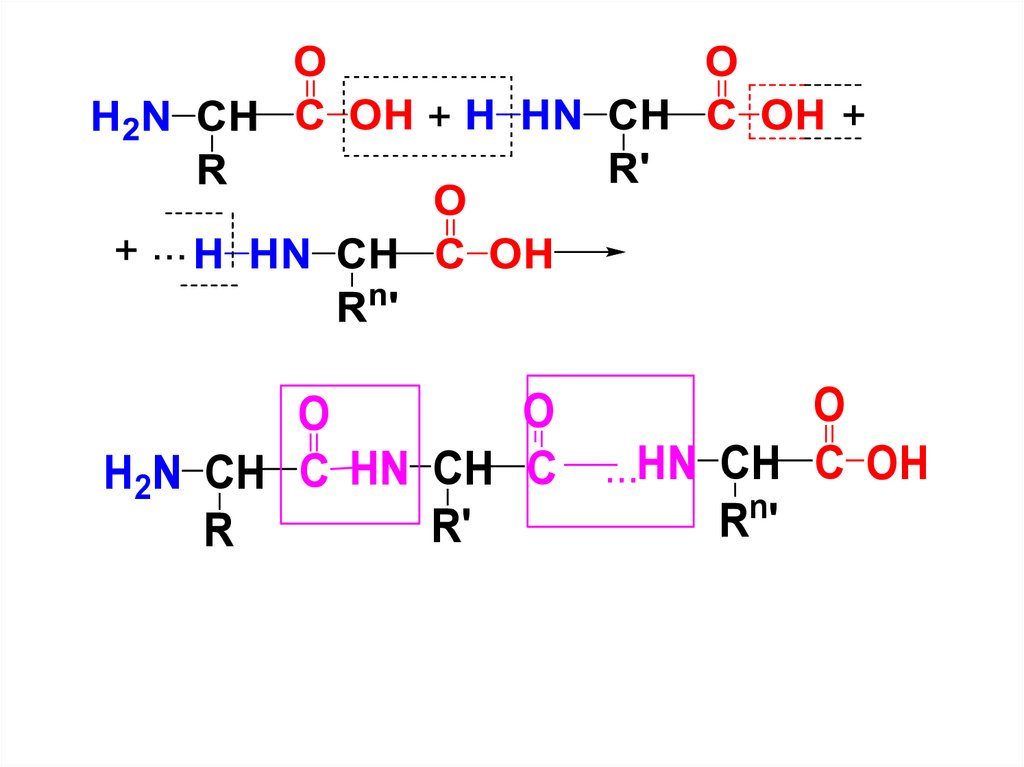
СТРОЕНИЕПервичная структура
Пептиды и белки построены из
остатков -АК, связанных между
собой амидной (пептидной) связью.
Молекулу пептида или белка можно рассматривать
как продукт поликонденсации -АК, протекающей с
образованием амидной связи между фрагментами
АК.
20.
OO
H2N CH C HN CH C
R'
R
O
...HN CH C OH
Rn'
21.
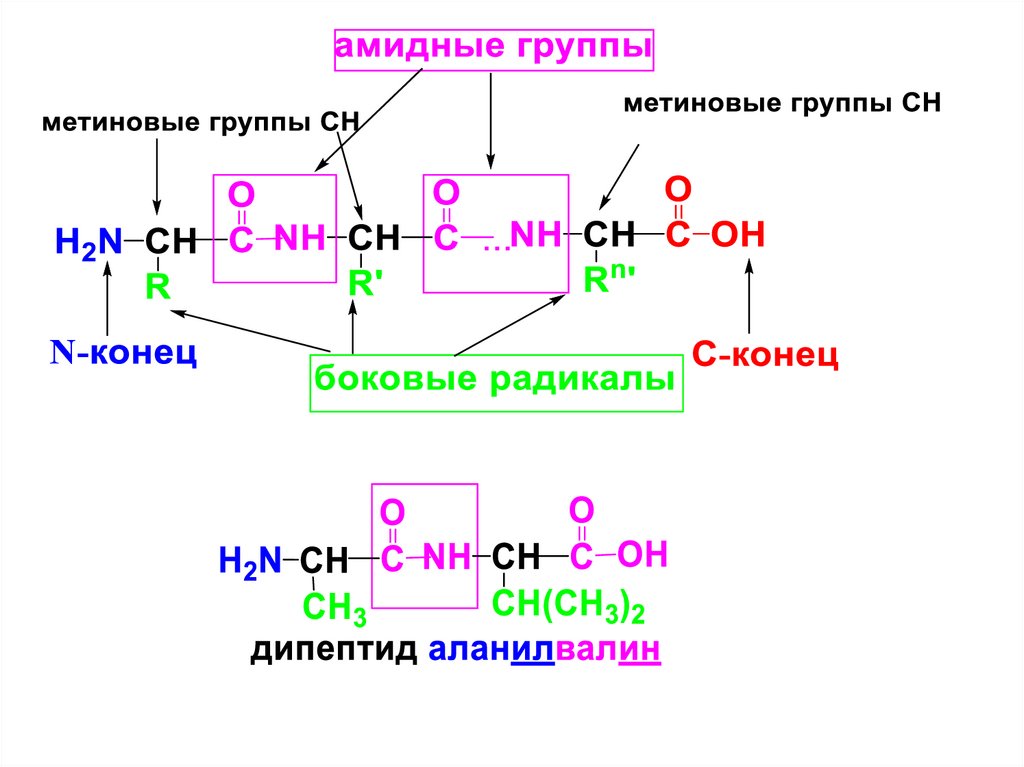
Полипептидная цепь пептидов ибелков имеет неразветвленное строение и
состоит из чередующихся амидных и
метиновых групп.
Конец цепи, на к-ром находится АК со
свободной NH2-группой, называется
N-концом;
второй
конец,
на
к-ром
находится АК со свободной СООН-гр. –
С-концом.
Пептидные и белковые молекулы
записывают с N-конца.
22.
23.
Первичная структура пептидов ибелков – это аминокислотная
последовательность, т.е. порядок
чередования -аминокислотных
остатков.
24.
Пространственное строениеВторичная структура описывает
пространственное строение одной
полипептидной цепи.
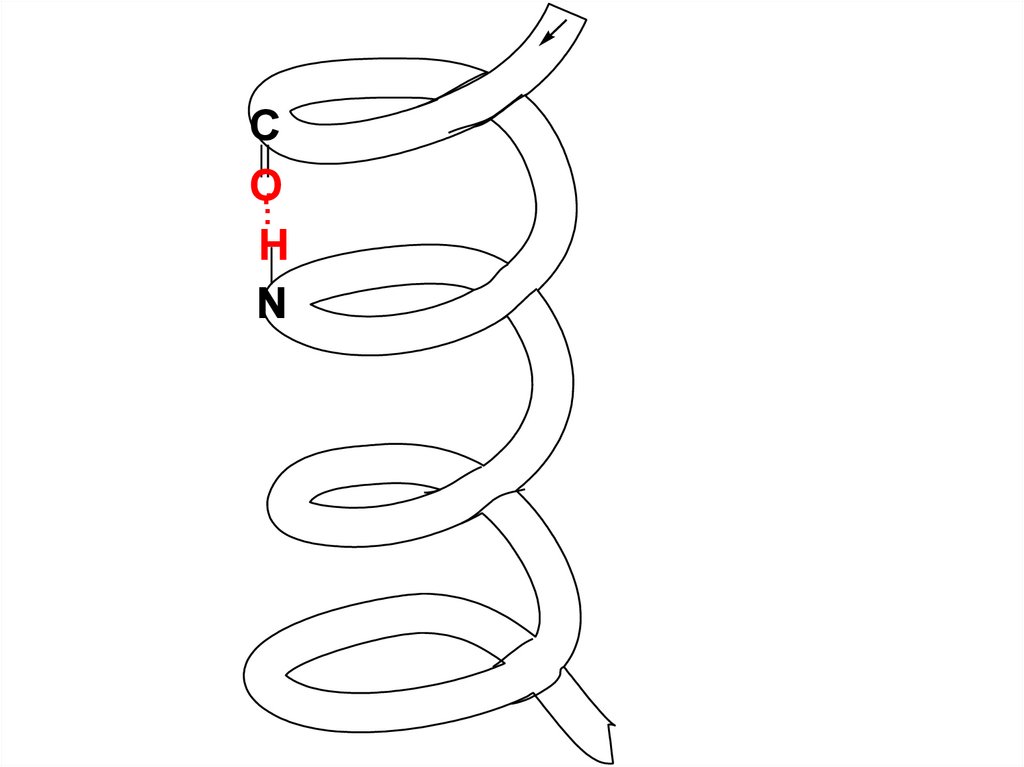
Наиболее энергетически устойчивая
пространственная структура полипептидной
цепи – -спираль (правозакрученная спираль)
Основное значение в закреплении этой
структуры имеют Н-связи, которые
направлены практически параллельно оси
спирали.
Н–связи образуются между О-атомом C=O
гр. каждого первого АК-ого остатка и Н-атомом
NН2-гр. каждого пятого АК-ого остатка.
25.
CO
...
H
N
26.
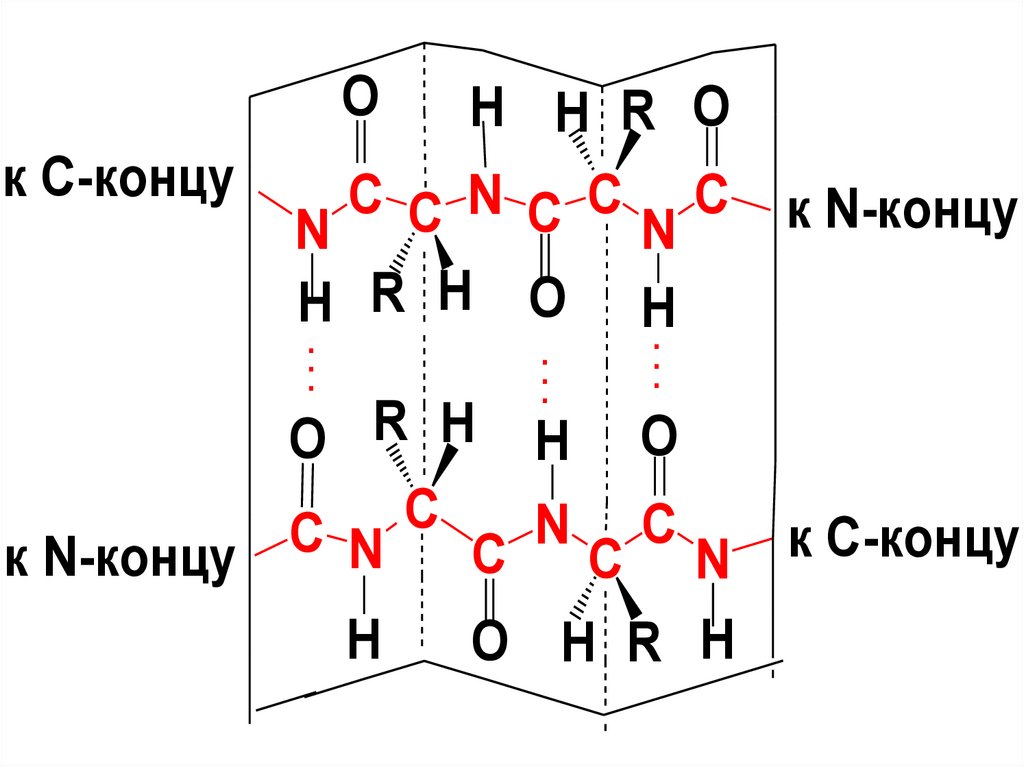
Второй вид втор. структуры:-структура (структура складчатого
листа) - представляет собой
зигзагообразную конформацию,
которую образуют вытянутые
параллельные полипептидные цепи,
закрепленные Н-связями между
пептидными гр.
Н-связи направлены перпендикулярно
длине полипептидных цепей
27.
OH H R O
к С-концу
C C N C C C к N-концу
N
N
H R H O H.
..
.
.
.
.
.
.
O R H H O
C
N
C
C
к
С-концу
N
C
к N-концу
C N
H
O H R H
28.
Третичная структура –формируется в результате укладки в
пространстве отдельных или
нескольких полипептидных цепей
вторичной структуры.
В стабилизации трет. структуры
принимают участие боковые
радикалы АК-ых остатков,
содержащие свободные СООН,
амино-гр., спиртовые и фенольные
ОН,тиольные и амидные гр.
29.
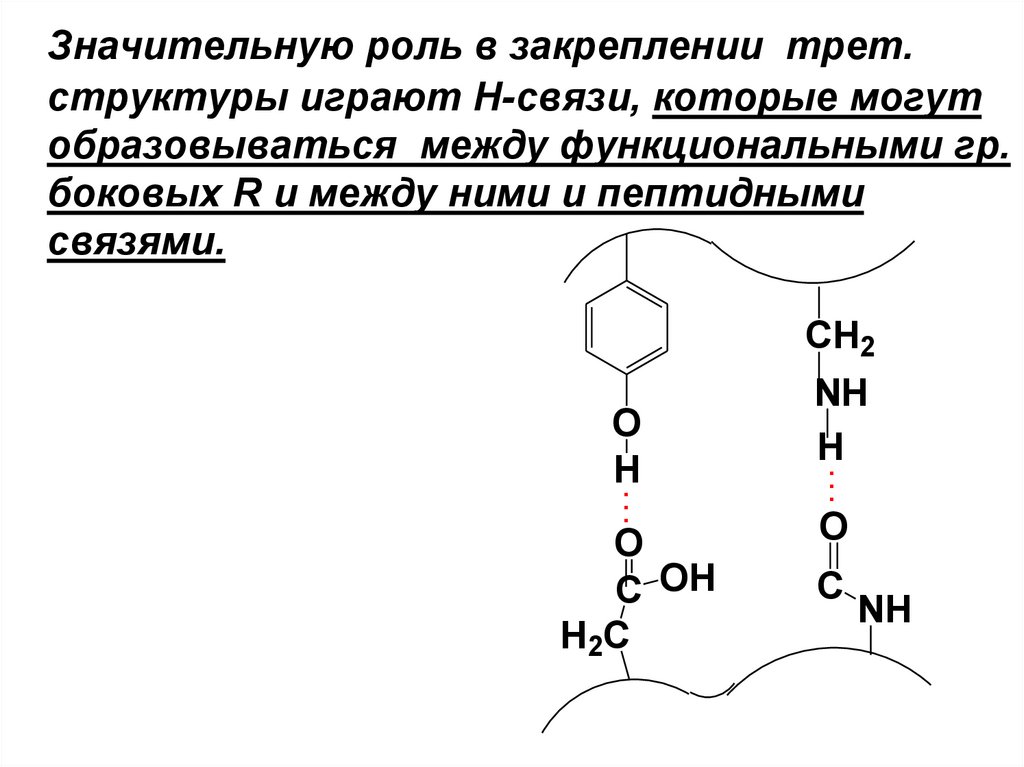
Значительную роль в закреплении трет.структуры играют Н-связи, которые могут
образовываться между функциональными гр.
боковых R и между ними и пептидными
связями.
CH2
O
H
..
.
O
C OH
H2C
NH
H.
..
O
C
NH
30.
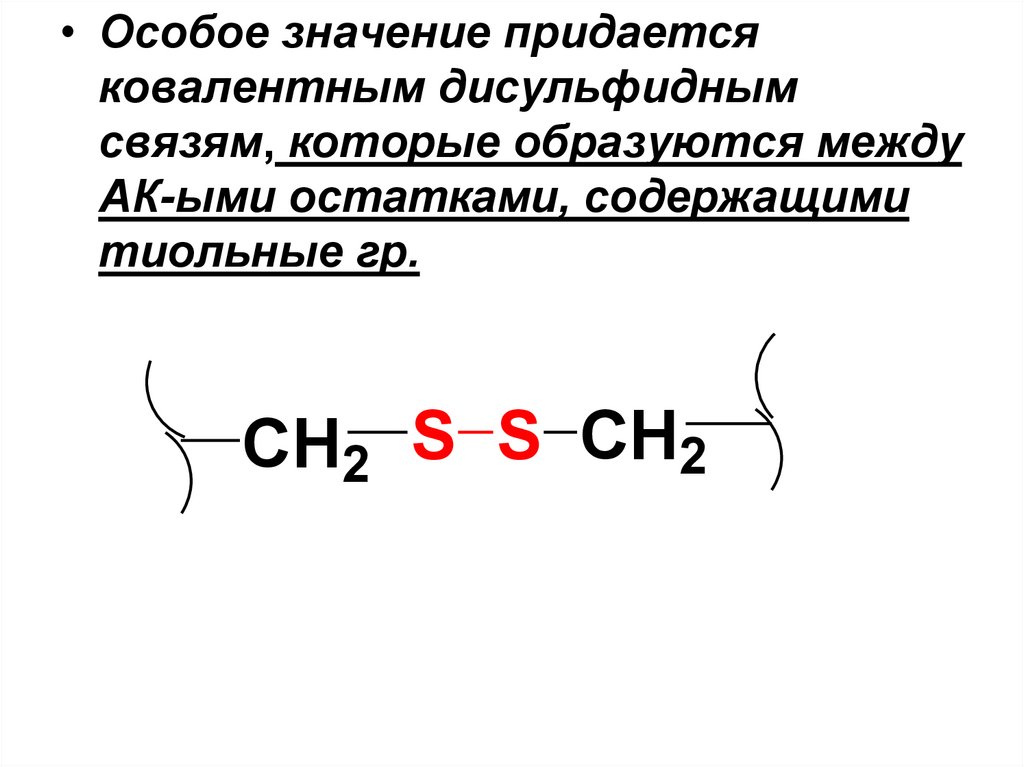
• Особое значение придаетсяковалентным дисульфидным
связям, которые образуются между
АК-ыми остатками, содержащими
тиольные гр.
CH2 S S CH2
31.
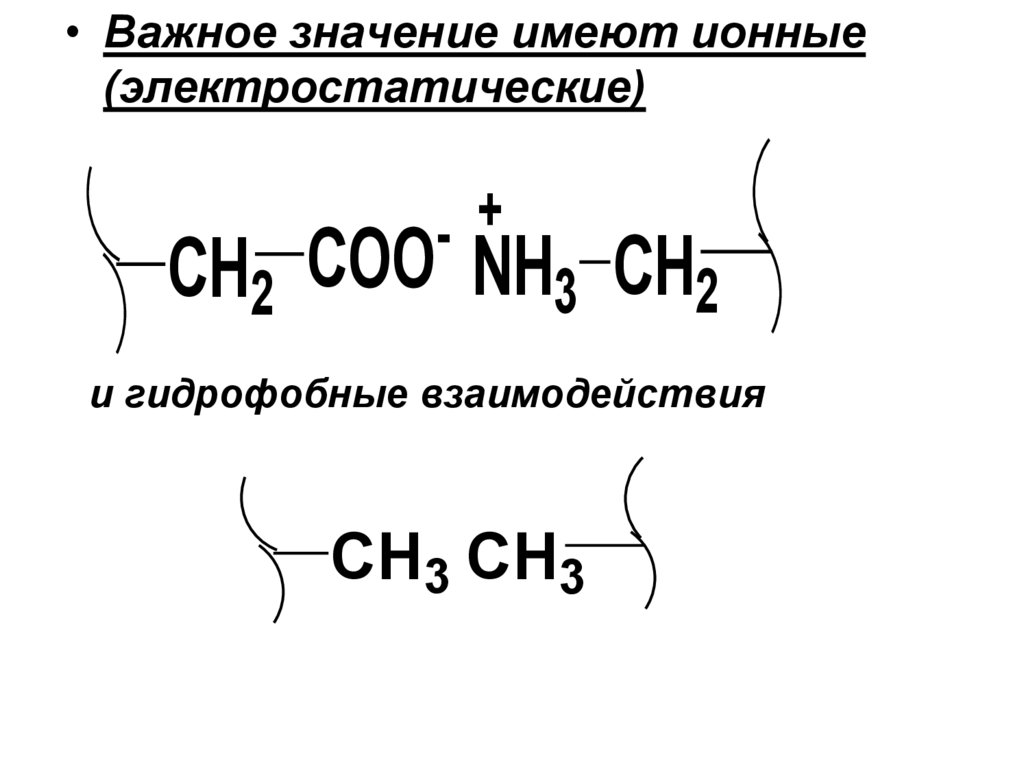
• Важное значение имеют ионные(электростатические)
+
-
CH2 COO NH3 CH2
и гидрофобные взаимодействия
CH3 CH3
32.
По типу упаковки различают:
Глобулярные белки – спиральные
полипептидные цепи свернуты
причудливым образом – чаще всего
образуется сферическая форма
(глобула).
Фибриллярные белки –
полипептидные цепи упаковываются
плотно между собой, располагаясь
рядом образуют нитевидные
структуры (фибриллы).
33.
Четвертичная структура –формируется при объединении
нескольких частиц с трет. структурой
в одну более крупную частицу.
Образующийся ассоциат существует
как единое целое и его распад, как
правило, обуславливает изменение
биологической активности белка.
34.
Пример:Гемоглобин: полипептидная цепь
(первичная структура) закручена в спираль (вторичная структура),
спираль свернута в клубок
(третичная структура) и наконец,
четыре таких клубка объединены в
одну крупную частицу (четвертичная
структура).

















 Химия
Химия








