Похожие презентации:
Альдегиды, свойства, получение, применение
1. ПРЕЗЕНТАЦИЯ урока химии «Альдегиды, свойства, получение, применение»
2.
Продолжить знакомить учащихся с кислородсодержащими
органическими соединениями на примере альдегидов.
Познакомить учащихся с применением формальдегида и
ацетальдегида на основе их свойств.
Продолжить развивать умения характеризовать строение и
химические свойства изученных органических соединений, объяснять
зависимость свойств веществ от их состава и строения, выполнять
химический эксперимент, соблюдая правила безопасного обращения с
веществами и лабораторным оборудованием, проводить наблюдения,
делать выводы.
Продолжить формирование ключевых компетентностей учащихся
Воспитывать бережное отношение к своему здоровью, здоровью
окружающих.
3.
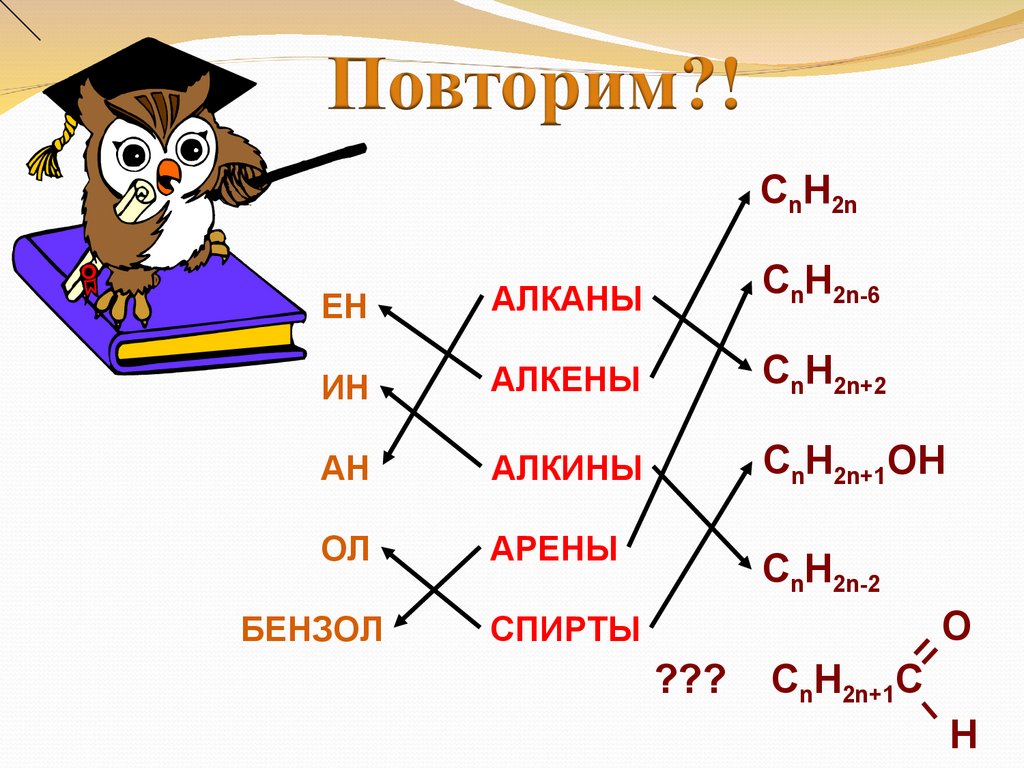
CnH2nЕН
АЛКАНЫ
CnH2n-6
ИН
АЛКЕНЫ
CnH2n+2
АН
АЛКИНЫ
CnH2n+1OH
ОЛ
АРЕНЫ
CnH2n-2
БЕНЗОЛ
СПИРТЫ
O
???
CnH2n+1C
H
4.
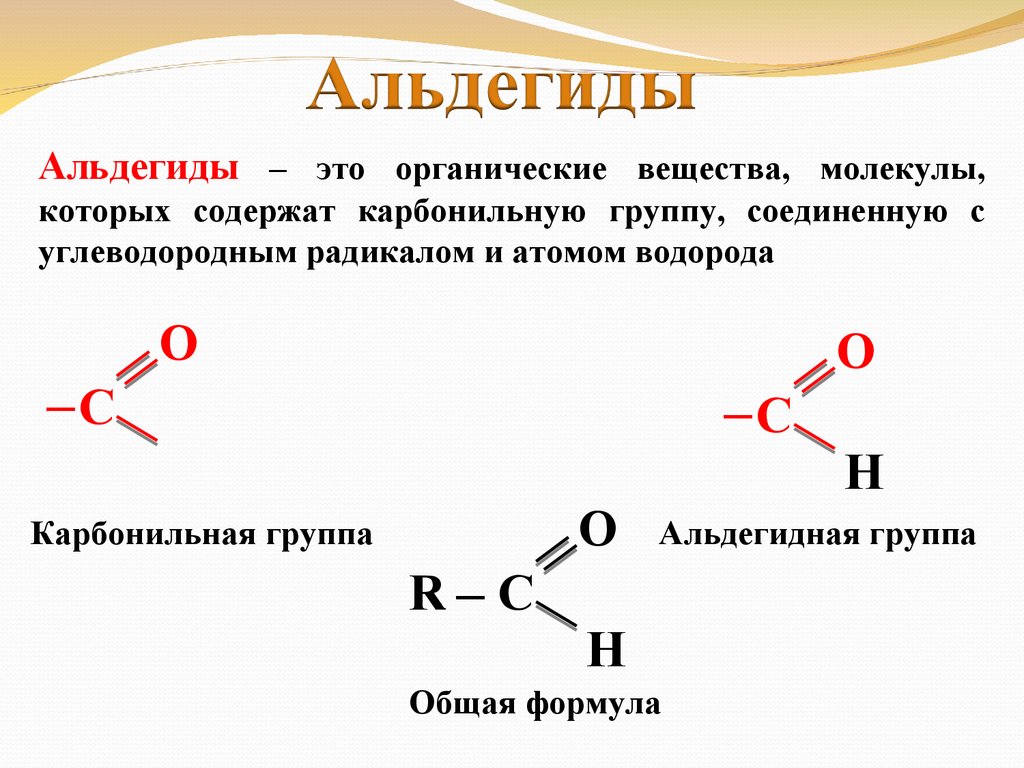
Альдегиды – это органические вещества, молекулы,которых содержат карбонильную группу, соединенную с
углеводородным радикалом и атомом водорода
О
О
─С
─С
О
Карбонильная группа
R─ С
Н
Альдегидная группа
Н
Общая формула
5.
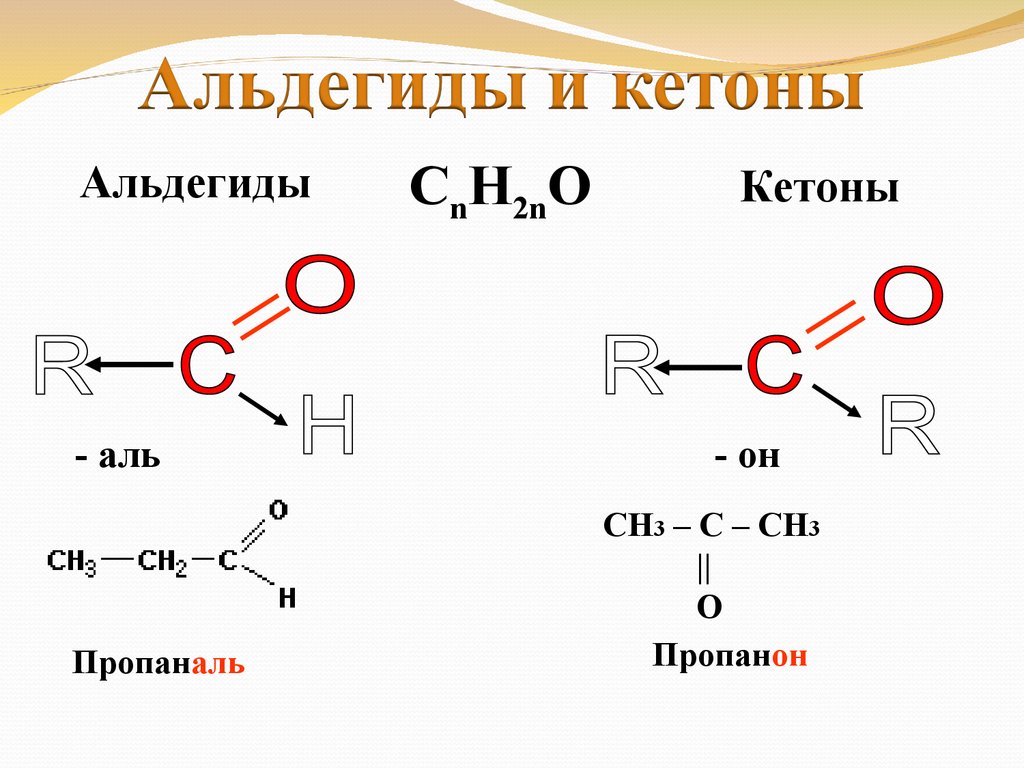
Альдегиды- аль
Пропаналь
CnH2nO
Кетоны
- он
СН3 – С – СН3
||
O
Пропанон
6.
Метаналь (формальдегид)Этаналь (ацетальдегид)
Пропаналь
Бутаналь
Пентаналь
7.
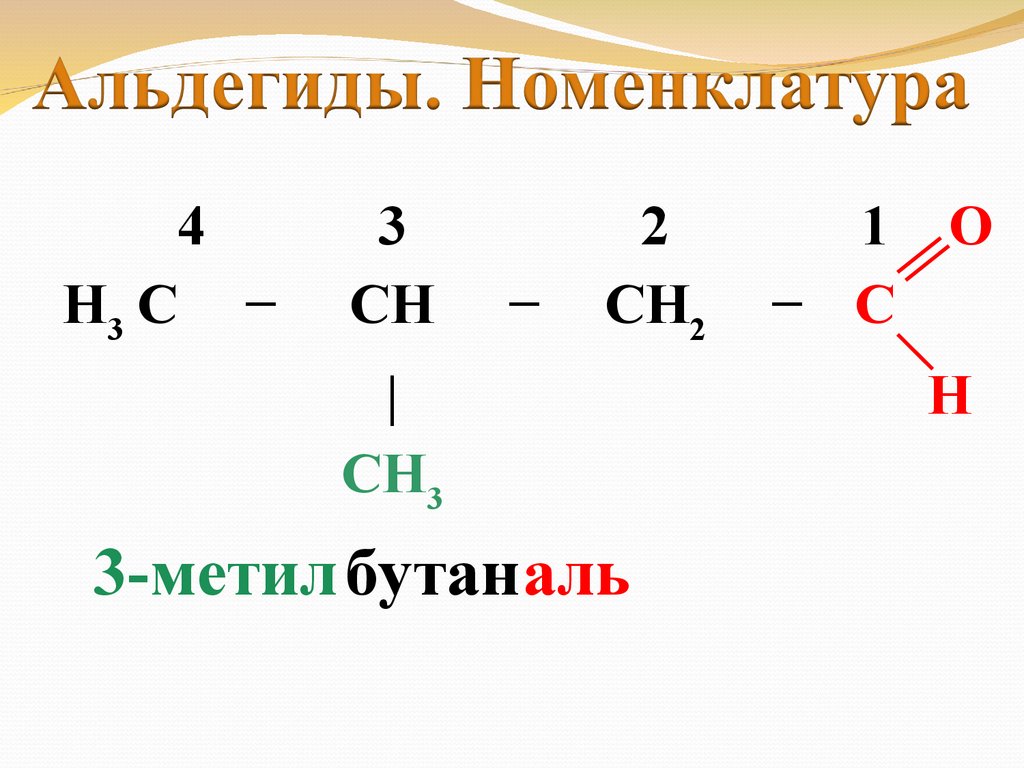
4H3 C −
3
CH
−
2
CH2
|
CH3
3-метил бутаналь
1 O
− C
H
8.
1. ВЫБОР ГЛАВНОЙ ЦЕПИ2. НУМЕРАЦИЯ ГЛАВНОЙ ЦЕПИ (НАЧИНАЕТСЯ
С АТОМА УГЛЕРОДА ФУНКЦИОНАЛЬНОЙ ГРУПП
3. НАЗЫВАЮТСЯ ЗАМЕСТИТЕЛИ И ИХ ПОЛОЖЕНИЕ
В АЛФАВИТНОМ ПОРЯДКЕ
4. НАЗЫВАЕТСЯ УГЛЕВОДОРОД ПО ЧИСЛУ
АТОМОВ УГЛЕРОДА В ЦЕПИ С СУФФИКСОМ -АЛЬ
9.
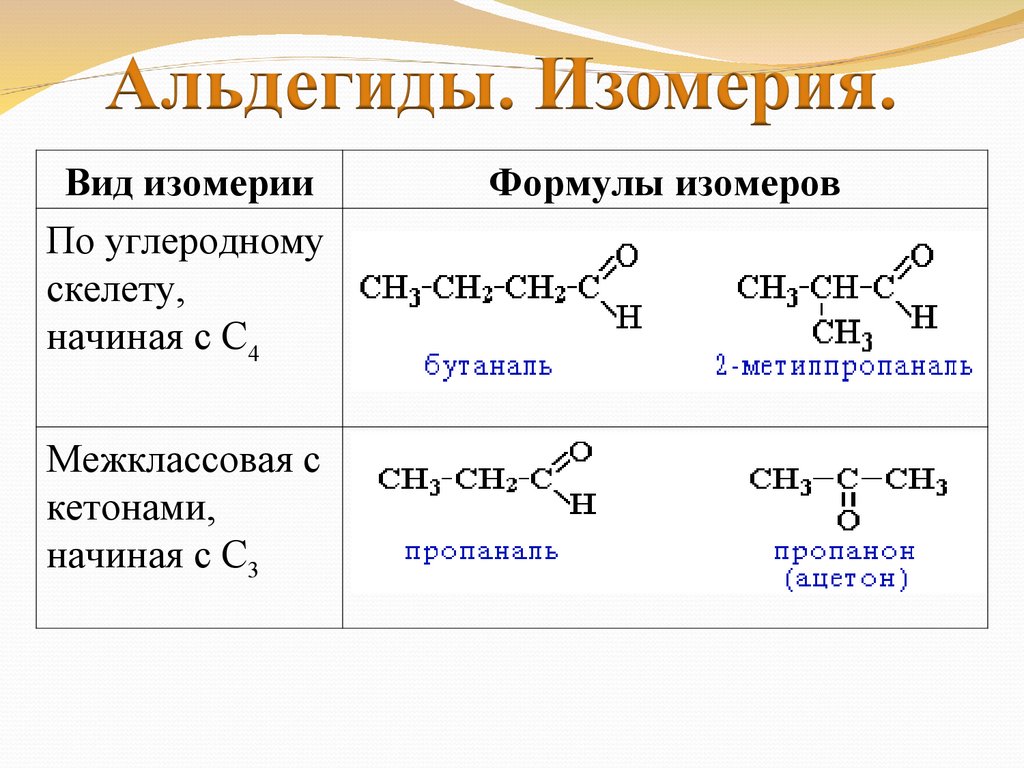
Вид изомерииПо углеродному
скелету,
начиная с С4
Межклассовая с
кетонами,
начиная с С3
Формулы изомеров
10.
1.Окислением (дегидрированием) первичныхспиртов:
в промышленности
Cu,t
СН3СН2ОН
→
CH3COH + H2↑
этанол
этаналь
в лаборатории
t
СН3СН2ОН + CuO → CH3COH + H2O+ Cu
этанол черный
этаналь
красный
запах зеленого
11.
Ot0
CH3 – CH2 – OH + CuO →CH3 – C + Cu + H2O
H
12.
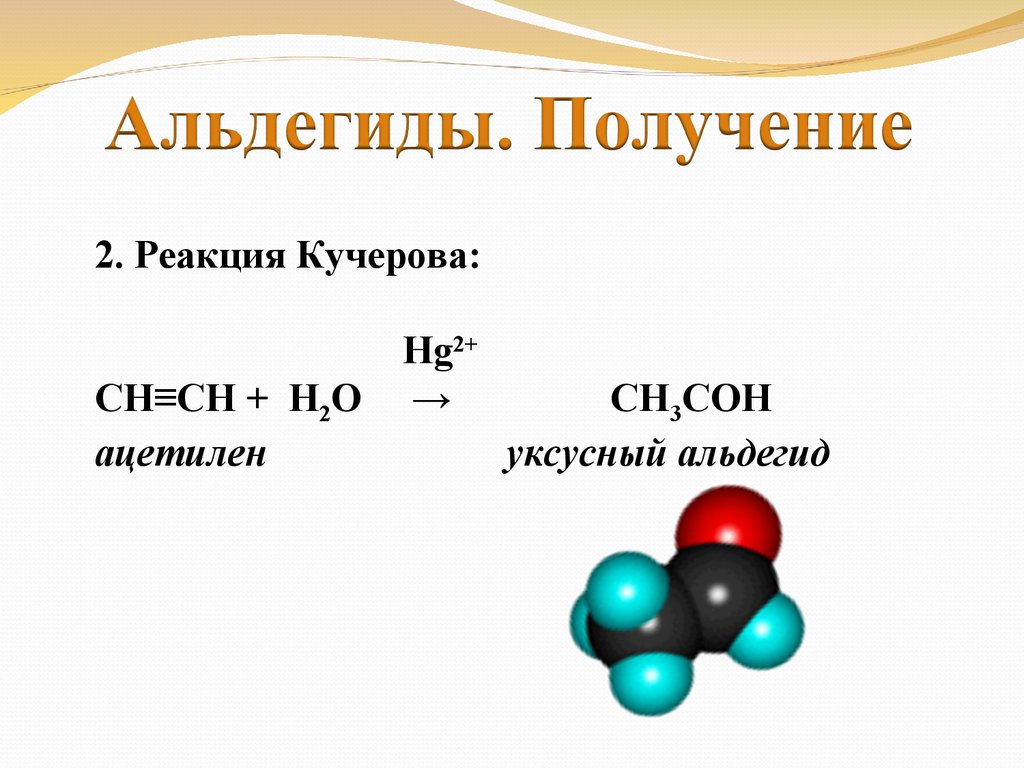
2. Реакция Кучерова:СН≡СН + Н2О
ацетилен
Hg2+
→
СН3СОН
уксусный альдегид
13.
С1– газ с резким запахом;
С2 – С3 – жидкости с резким запахом;
С4 – С6 – жидкости с неприятным запахом;
>С6
– твердые, нерастворимые в воде с цветочным
запахом (применяются в парфюмерии).
НСОН, СН3СОН – растворимы в воде неограниченно,
температуры кипения ниже, чем у
соответствующих спиртов.
14.
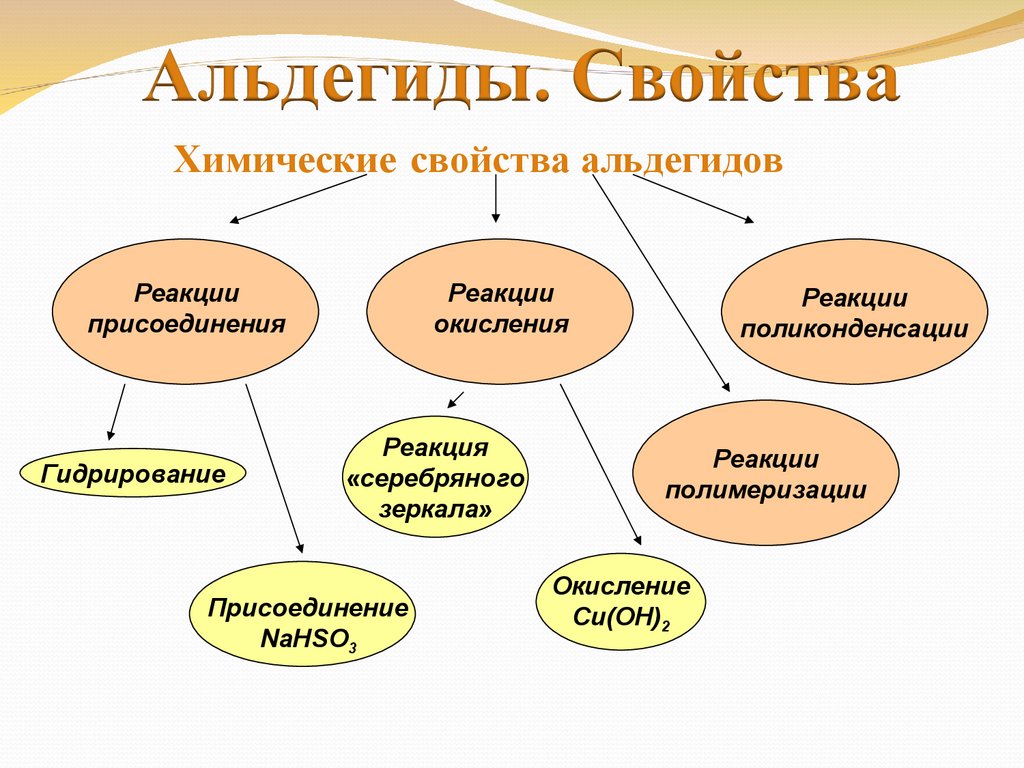
Химические свойства альдегидовРеакции
присоединения
Гидрирование
Реакции
окисления
Реакция
«серебряного
зеркала»
Присоединение
NaHSO3
Реакции
поликонденсации
Реакции
полимеризации
Окисление
Cu(OH)2
15.
Реакции окисленияR – C = O + [O]
Ι
H
альдегид
НСООН
СН3СООН -
→
R–C=O
Ι
OH
карбоновая
кислота
метановая (муравьиная) кислота
этановая (уксусная) кислота
16.
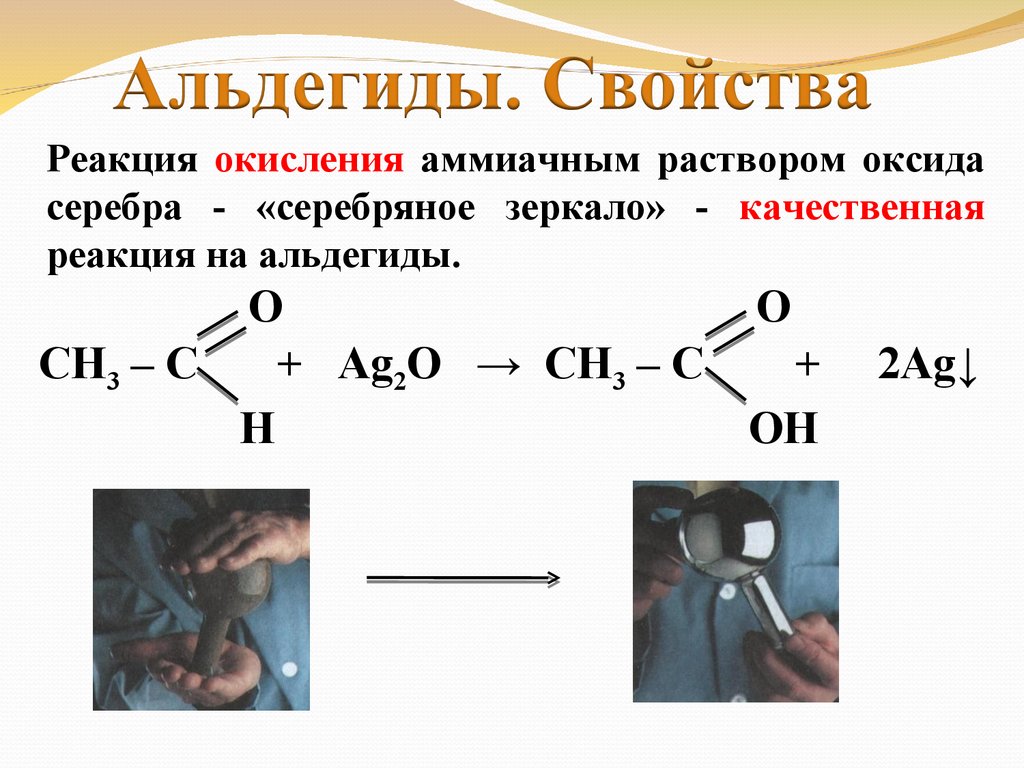
Реакция окисления аммиачным раствором оксидасеребра - «серебряное зеркало» - качественная
реакция на альдегиды.
O
O
СН3 – С
+ Ag2O → СН3 – С
+
H
OH
2Ag↓
17.
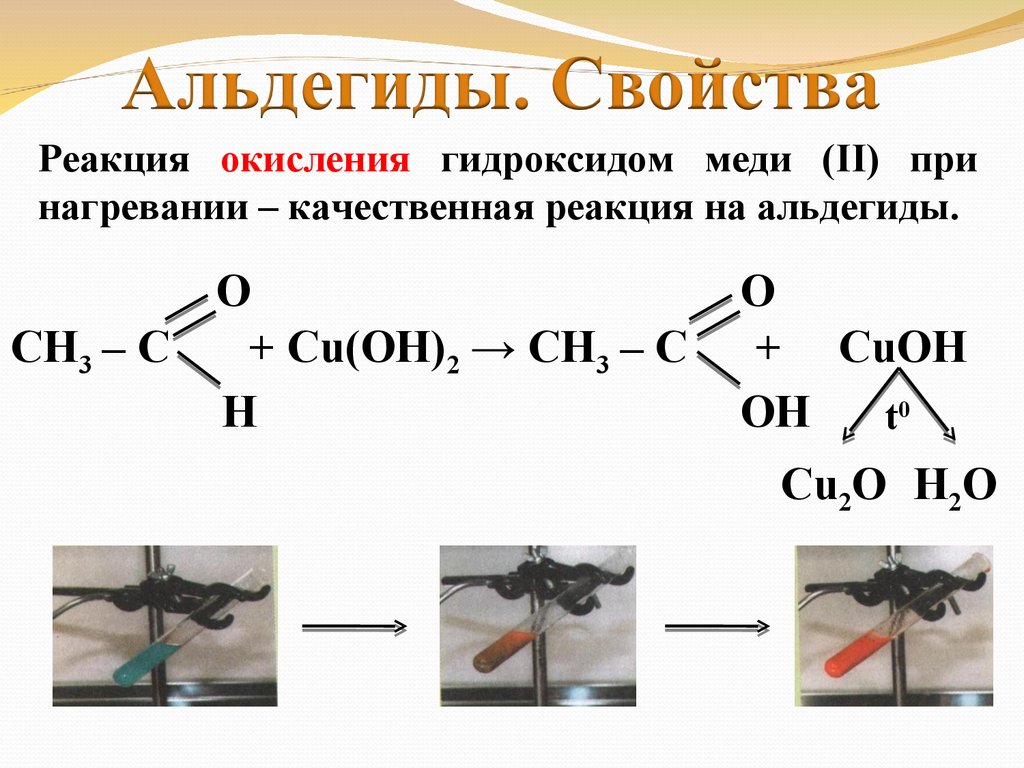
Реакция окисления гидроксидом меди (II) принагревании – качественная реакция на альдегиды.
СН3 – С
O
+ Cu(OH)2 → СН3 – С
H
O
+ CuOH
OH
t0
Cu2O H2O
18.
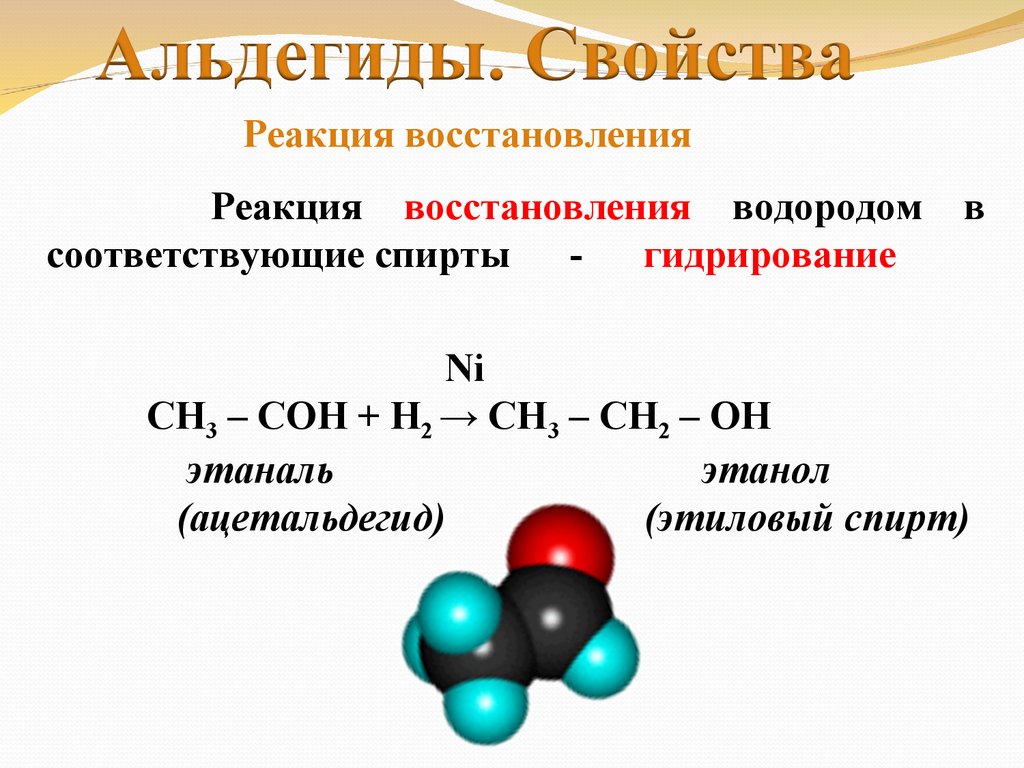
Реакция восстановленияРеакция восстановления водородом
соответствующие спирты гидрирование
в
Ni
СН3 – СОH + Н2 → CH3 – CH2 – OH
этаналь
этанол
(ацетальдегид)
(этиловый спирт)
19.
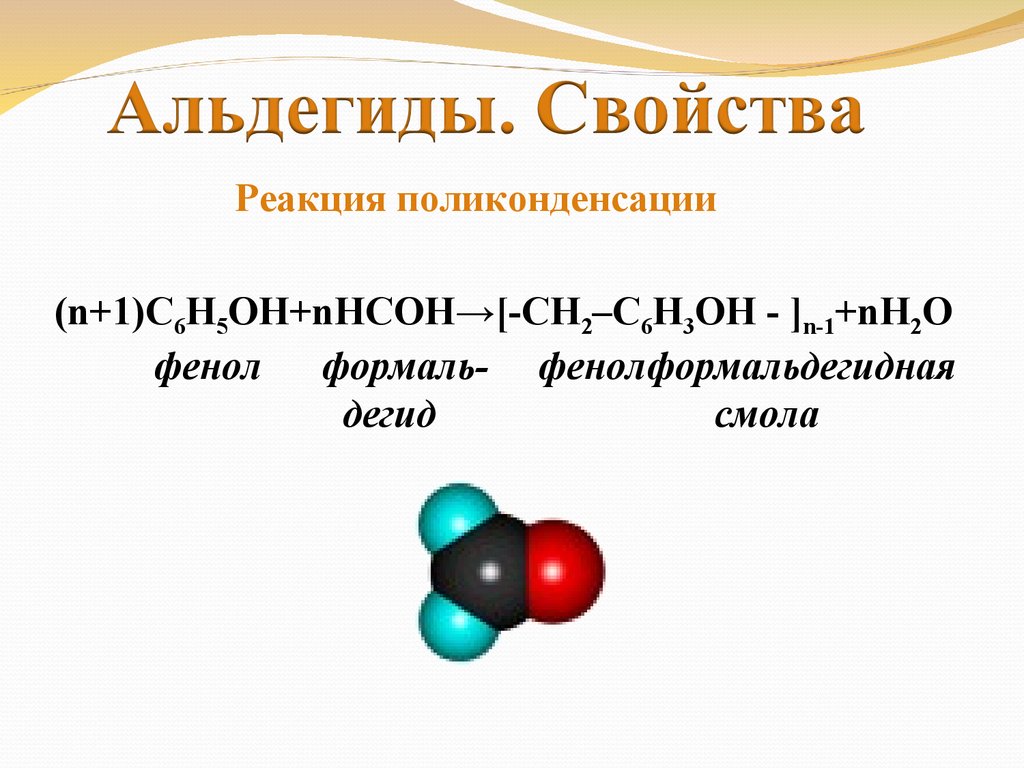
Реакция поликонденсации(n+1)С6Н5ОН+nНСОН→[-CH2–C6H3OH - ]n-1+nH2O
фенол формаль- фенолформальдегидная
дегид
смола
20.
Фенолформальдегидныесмолы
Сельское
хозяйство
Формальдегид
Кожевенная
промышленность
Медицина
21.
Формальдегид22.
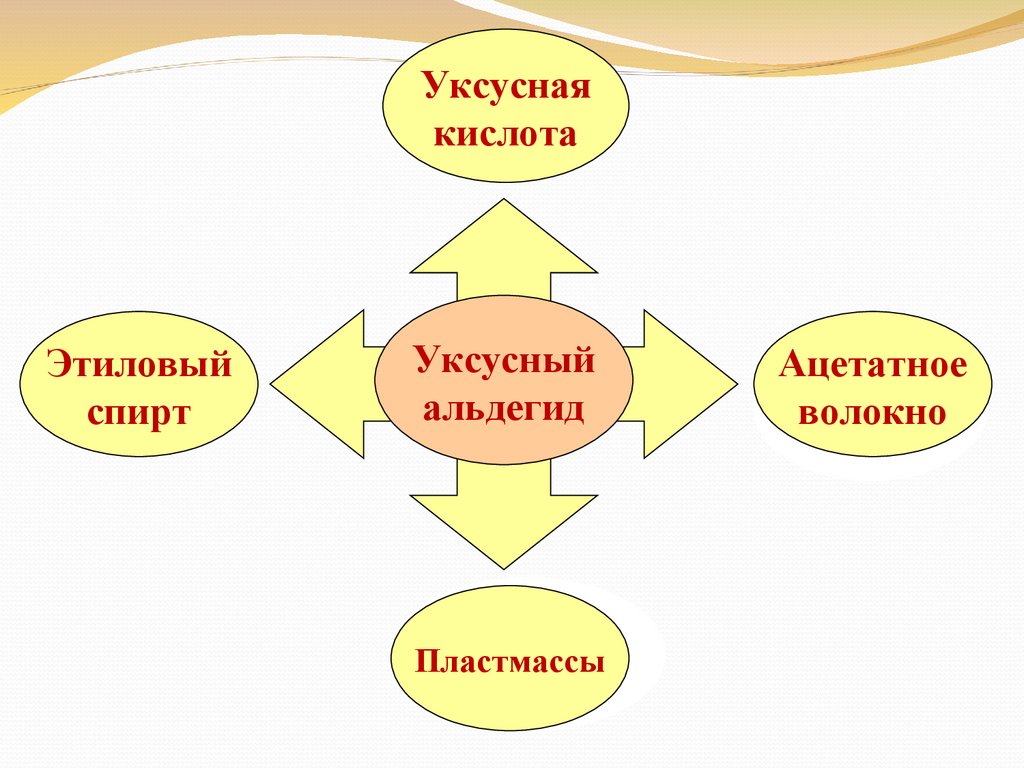
Уксуснаякислота
Этиловый
спирт
Уксусный
альдегид
Пластмассы
Ацетатное
волокно
23.
Ацетальдегид24.
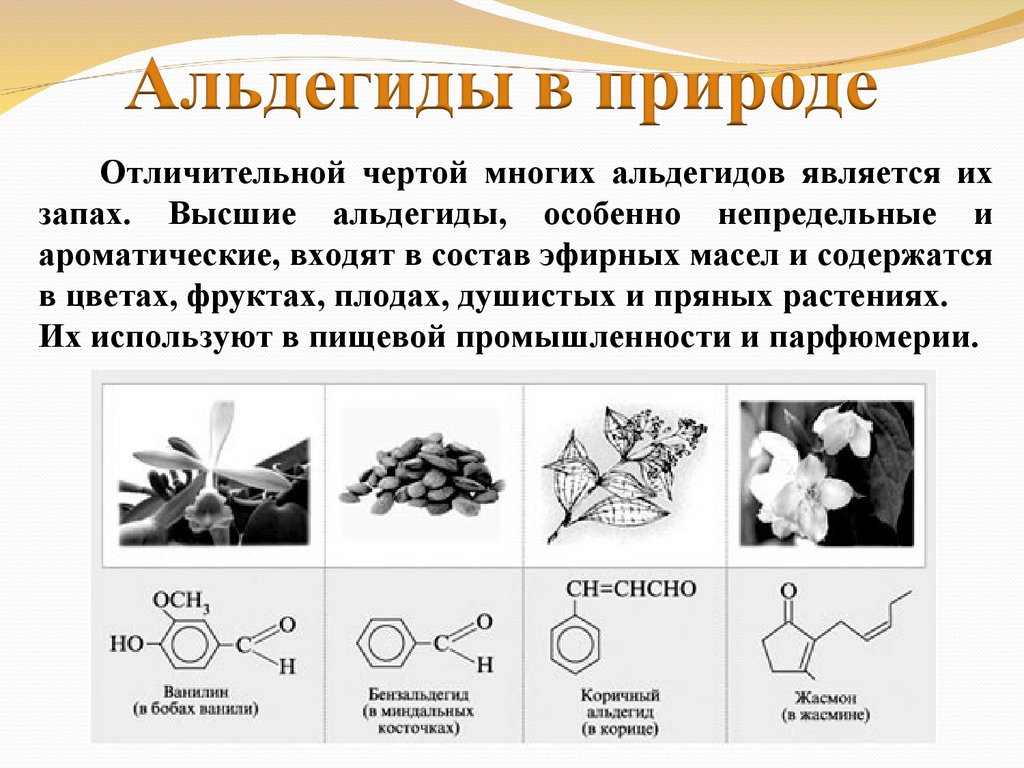
Отличительной чертой многих альдегидов является ихзапах. Высшие альдегиды, особенно непредельные и
ароматические, входят в состав эфирных масел и содержатся
в цветах, фруктах, плодах, душистых и пряных растениях.
Их используют в пищевой промышленности и парфюмерии.
25.
Булочки ванильные, корицы аромат,Амаретто, шоколад
Альдегидов вкус таят.
В землянике и кокосе,
И в жасмине, и в малине,
И в духах, и в еде
Альдегидов след везде.
Что за запах, что за прелесть,
И откуда эта свежесть?!
Это высший альдегид
Аромат вам свой дарит!
26.
ВанилинВ плодах ванили содержится
ароматический
альдегид,
который
придает
им
характерный запах.
Ванилин применяется в
парфюмерии,
кондитерской
промышленности,
для
маскирования
запахов
некоторых продуктов.
27.
ЦитральЗапах цитрусовых обусловлен данным диеновым
альдегидом. Его применяют в качестве отдушки средств
бытовой химии, косметических и парфюмерных веществ.
28.
Коричный альдегидКоричный альдегид содержится в масле корицы, его
получают перегонкой коры дерева корицы .
Применяется в кулинарии в виде палочек или порошка.
29.
БензальдегидБензальдегид – жидкость с запахом
горького миндаля.
Встречается в косточках и семечках(абрикос,
персик)
30.
ФенилэтанальФенилэтаналь по сравнению с
бензальдегидом лучше соответствует
рецептору цветочного запаха.
Фенилэтаналь пахнет гиацинтом.
31.
Гептанон-2Это соединение представляет собой жидкость с
гвоздичным запахом.
Гептаноном-2 обусловлен запах многих плодов
и
молочных продуктов, например, сыра «Рокфор»
32.
n-Гидроксифенилбутанон-2Этот кетон обуславливает в основном
запах спелых ягод малины.
Его включают в состав синтетических
душистых композиций
33.
1. ( Общая формула альдегидов :А. RCOH
В. R1COR2
Б. RCOOH
Г. ROH
2. Функциональная группа альдегидов :
А. - ОН
В. – СОН
Б. - СО
Г. – СООН
3. Формула формальдегида :
А.НСООН
В.СН3СОН
Б.НСОН
Г.СН3СООН
4. Вещество состава СН3СОН называется:
А. Метаналь В. Уксусная кислота
Б. Этаналь
Г. Ацетальдегид
34.
5. Продуктами восстановления альдегидов водородом(катализатор Ni) являются :
А. Сложные эфиры
В. Одноатомные спирты
Б. Карбоновые кислоты Г. Кетоны
6. В реакцию «серебряного зеркала» могут вступать :
А. Фенол
В. Этанол
Б. Метаналь
Г. Этаналь
7. Продуктом окисления этанола является :
А. Ацетон
В. Уксусный альдегид
Б. Уксусная кислота Г. Диэтиловый эфир
8. Правой частью уравнения СН3СОН + 2Cu(ОН)2↓→ :
А. НСООН + Cu2O↓ + 2H2O
Б. CH3COOH + Cu2O↓ + 2H2O





















 Химия
Химия








