Похожие презентации:
Основы молекулярно-кинетической теории
1.
Основы молекулярно-кинетической теорииВсе тела состоят из молекул, находящихся в беспрерывном
хаотическом движении, скорость которого зависит от температуры.
Данное движение молекул и определяет свойства тел. Чтобы
найти движение всех молекул тела надо решить совместно систему
уравнений Ньютона для этих молекул.
Однако, число молекул огромно, поэтому для описания свойств
тел используется не динамический метод, требующий детального
знания о движении молекул, а статистический метод, в котором
свойства тел объясняются как усредненный результат действия всех
молекул.
Совокупность макротел, обменивающихся энергией между
собой и внешней средой, называется термодинамической системой.
Состояние системы характеризуется термодинамическими
параметрами – температурой, давлением, объемом и т.д.
Если эти параметры не меняются со временем, то говорят, что
система находятся в состоянии термодинамического равновесия.
2.
Основное уравнение молекулярно-кинетическойтеории идеальных газов
Получим уравнение состояния идеального газа, исходя из
молекулярно-кинетических представлений.
Рассмотрим газ, находящийся в некотором сосуде. Будем
считать, что соударения молекул газа со стенками сосуда абсолютно
упругие. Найдем давление, оказываемое газом на стенки сосуда.
Выделим на стенке сосуда площадку S.
Каждая молекула, движущаяся перпендикулярно
к площадке, при соударении передает ей
импульс, равный
где
r
r
r
r
Δp = m 0 v - (-m 0 v) = 2m 0 v
m0 – масса молекулы, v – ее скорость.
За время t площадку достигнут
молекулы,находящиеся внутри цилиндра с
основанием S и высотой v t.
S
v t
V
3.
n – концентрация молекул в газе, то число молекул вцилиндре равно n Sv t, а импульс, переданный ими площадке S
Если
за время t, равен
p = 2nm0 Sv2 t
В действительности, разные молекулы движутся с разными по
величине и направлениями скоростями к площадке S. Это
хаотическое
движение
можно
приближенно
заменить
равновероятным движением молекул вдоль положительных и
отрицательных направлений осей x, y, z.
В одну сторону – в сторону площадки движется 1/6 часть от
всех молекул. Переданный ими средний импульс площадке S равен
1
2
Δp = m 0 nΔSΔt v
3
4.
здесьv2
- средний квадрат модуля скорости, равный
1
v v i2
N i
2
где N – число молекул внутри сосуда, vi – скорости отдельных
молекул.
Разделив средний импульс p на время t , получим силу,
с которой газ давит на площадку S
Δp
F=
Δt
В свою очередь, разделив силу F на площадь S, получим
давление газа на стенки сосуда
F n
2
2
P=
= m 0пост
v =ε n
ΔS 3
3
(10.3.1)
основное уравнение молекулярно-кинетической теории
5.
Здесь1
2
ε пост m 0 v
2
- среднее значение кинетической
энергии поступательного движения молекул.
Формула (10.3.1) раскрывает физический смысл давления –
оно определяется средним значением кинетической энергии молекул.
Сравнивая формулу (10.3.1) с формулой (10.2.4), получаем
2
nkT =ε n пост
3
3
εпост = kT
2
(10.3.2)
Следовательно, температура является мерой средней
кинетической энергии молекул.
6.
Элементы теории вероятностейПри статистическом описании свойств термодинамических
систем используются понятия теории вероятностей. Рассмотрим
некоторые положения этой теории.
Случайными называются события, условия наступления
которых неизвестны, и которые поэтому нельзя с определенностью
предсказать.
Пусть случайная величина принимает дискретный набор
значений x1, x2, x3, …, xn. Выполним N измерений. Если из этого
числа
измерений
значение
xi было обнаружено Ni раз, то
вероятностью события xi называют величину
Ni
Pi = lim
N N
n
n
Поскольку
N
i=1
(10.4.1)
i
=N
то
n
Ni
Pi =
1
i=1
i=1 N
7.
Рассмотрим сложное событие, состоящее в том, что в немобнаруживаются два значения xi и xk в два разных момента.
Вероятность получить результат xi либо xk равна
P(i
или k)
Ni + Nk
= lim
Pi + Pk
N
N
(10.4.2)
Это равенство выражает собой теорему сложения вероятностей
– вероятности несовместимых событий складываются.
Если две случайные величины x и y могут быть определены
одновременно, так что измерение величины x не влияет на результат
измерения величины y, то вероятность обнаружения двух событий
равна
(10.4.3)
P(x, y) = P(x)
P(y)
Это теорема об умножении вероятностей – вероятность
появления двух независимых друг от друга событий равна
произведению вероятностей этих событий.
8.
Зная результаты измерений случайной величины можно найтиее среднее значение
1
x
N
n
n
N x = Px
i 1
i
i
i 1
i
i
(10.4.4)
Пусть теперь случайная величина x принимает непрерывный
ряд значений. Разобьем область ее изменения на малые интервалы
Δх. Выполним N измерений. Обозначим через ΔN(х) – число
попаданий величины x в некоторый интервал x ÷ x + Δх. Тогда
вероятность обнаружения случайной величины в данном интервале
равна
N(х)
Pх =
N
Составим отношение этой вероятности к ширине интервала
Pх
f(x) =
х
(10.4.5)
9.
Построим график функции f(x). Он представляет собой ступенчатуюкривую, называемую гистограммой. f ( x )
Величина площади некоторого
прямоугольника
Pх=
f(x)
х
равна вероятности обнаружения
случайной величины в интервале
x ÷ x+ Δх.
В пределе Δх 0 гистограмма
x
0
x x+ x
превращается в гладкую кривую f(x),
которая называется функцией распределения вероятностей.
Из определения (10.4.5) следует, что f(x) - есть вероятность
нахождения случайной величины в единичном интервале, поэтому
f(x) является плотностью вероятности.
10.
Полная вероятность нахождения случайной величины должнаравняться 1. Ей отвечает площадь под всей кривой f(x), отсюда
получаем условие нормировки
f(x)
dP
f
(
x
)
dx
1
x
Зная функцию распределения вероятностей f(x), можно найти
среднее значение непрерывной случайной величины
x xdPx xf ( x)dx
(10.4.6)
Аналогично находится среднее значение произвольной функции А(x)
от случайной величины
x
A( x) A( x) f ( x)dx
(10.4.7)
11.
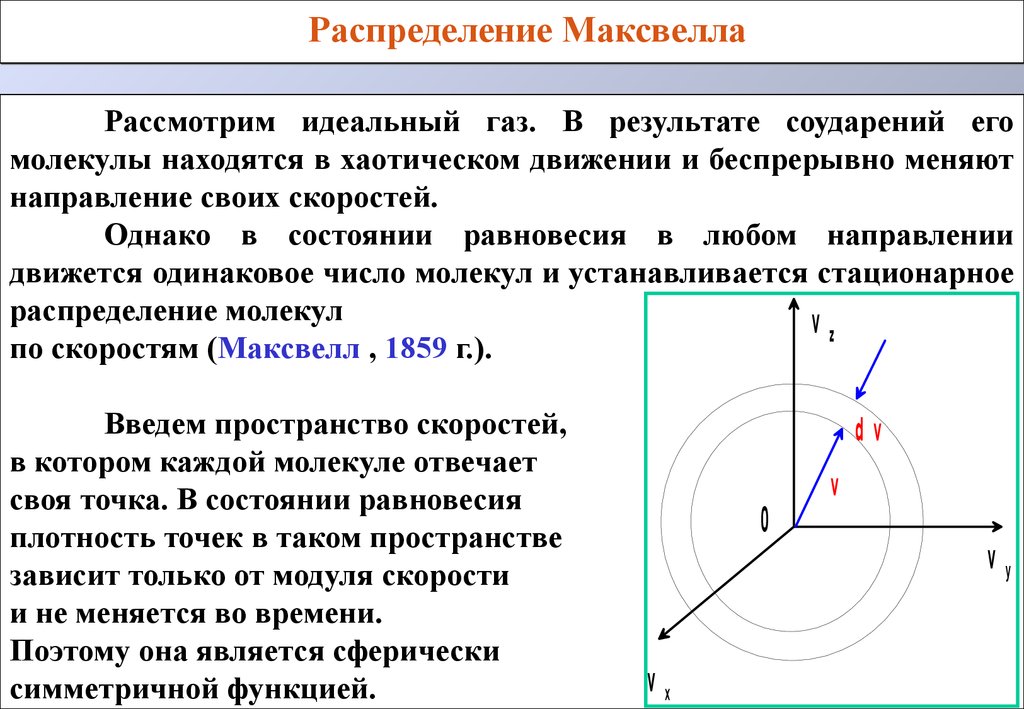
Распределение МаксвеллаРассмотрим идеальный газ. В результате соударений его
молекулы находятся в хаотическом движении и беспрерывно меняют
направление своих скоростей.
Однако в состоянии равновесия в любом направлении
движется одинаковое число молекул и устанавливается стационарное
распределение молекул
vz
по скоростям (Максвелл , 1859 г.).
Введем пространство скоростей,
в котором каждой молекуле отвечает
своя точка. В состоянии равновесия
плотность точек в таком пространстве
зависит только от модуля скорости
и не меняется во времени.
Поэтому она является сферически
симметричной функцией.
dv
0
vx
v
vy
12.
Обозначим плотность точек через f(v) - она равна вероятноститого, что модуль скорости молекулы равен значению v в единичном
объеме пространства скоростей около v.
Если N – полное число молекул в газе, то число молекул,
имеющих модуль скорости v в единичном объеме пространства
скоростей, равно Nf(v).
Выделим
малый объем
dvxdvydvz вблизи конца вектора
r
скорости v . Число молекул, скорости которых находятся внутри
этого объема, равно dN(vx,vy,vz ) = Nf(v)dvxdvydvz . Разделив его
на полное число молекул N, получим вероятность обнаружения
проекций скоростей молекул в интервалах vх ÷ vх + dvх;
vy ÷ vy + dvy; vz ÷ vz + dvz
dP(vх, vy, vz) = dN(vх, vy, vz)/N = f(v)dvxdvydvz
(10.5.1)
13.
Малый объем dvxdvydvz находится между сферами срадиусами v и v+dv.
Объем сферического слоя равен 4 v2dv, а число молекул
в нем равно
dN´(v) = Nf(v)4 v2dv
Разделив dN´(v) на полное число молекул газа N,
получим вероятность того, что модуль скорости молекулы
имеет значение в интервале v ÷ v + dv
dN´(v)/N = f(v)4 v2dv = dP(v)
14.
Разделив dP(v) на dv, находимdP(v)/dv = f(v)4 v2 = F(v)
(10.5.3)
Функция F(v) - дает вероятность того, что модуль скорости
молекулы равен v в единичном интервале скоростей около v.
Поэтому F(v) - и есть функция распределения молекул по скоростям.
Найдем ее конкретный вид.
Для этого введем в рассмотрение вероятности того, что
молекула имеет проекции скоростей в интервалах
vх ÷ vх + dvх
dP(vх) = (vх)dvх
vy ÷ vy + dvy
dP(vy) = (vy)dvy
vz ÷ vz + dvz
dP(vz) = (vz)dvz
В силу равноправности движения молекул во всех
направлениях вид трех функций (vх), (vy), (vz) должен быть
15.
Кроме того, проекции скоростей vх, vy, vz являютсястатистически независимыми друг от друга событиями. Поэтому по
теореме об умножении вероятностей получаем, что вероятность
нахождения проекций скоростей в интервалах
vх ÷ vх + dvх
vy ÷ vy + dvy
vz ÷ vz + dvz
равна
dP(vх, vy, vz) = dP(vх)dP(vy)dP(vz) = (vх) (vy) (vz)dvхdvydvz
Сравнивая с (10.5.1), находим
f(v) = (vх) (vy) (vz)
Логарифмируя, получаем
(10.5.4)
16.
Возьмем частные производные от последнего выражения.Сначала продифференцируем по vх
1
f
1
f
v
(lnf) =
=
f
vx
f
v
vx
'
vx
1
(ln ) =
vx
'
vx
поскольку
то
2
x
2
y
2
z
v= v + v + v
v vx
=
vx
v
f 1
1
=
v fv
vx vx
В последнем выражении слева и справа стоят функции от
разных независимых переменных v и vх. Поэтому их равенство может
быть лишь когда они обе равны одной и той же константе.
17.
Обозначая эту константу через- , получаем
1
vx vx
Данное соотношение является дифференциальным уравнением
первого порядка, интегрируем его
d
vx d vx
2
ln vx ln C
2
2
(vx ) C exp( vx )
2
18.
Аналогичные выкладки дают выражения для других функций2
(vy ) C exp( vy )
2
2
(vz ) C exp( vz )
2
Поэтому
2
2
2
2
3
f (v) C exp( (vx vy vz )) C exp( v )
2
2
3
19.
Константу интегрированияС
найдем из условия нормировки
2
(
v
)
d
v
C
exp(
v
)
d
v
1
x
x
x
x
2
C
2
3/ 2
2
f (v) exp( v )
2
2
20.
Константу найдем из расчета средних значений квадратовпроекций скорости
2
2
v
v (vx )d vx
vx exp( vx )d vx
2
2
2
x
2
x
2 1
3
2
Такие же значения имеют
2
y
v
и
2
z
, поэтому
v
3
v
v
v
v
2
2
x
2
y
2
z
21.
Но ранее, (10.3.2) было получено2
поэтому
m
v2 3
kT
2
2
m
v 3m 3
kT
2
2 2
Подставляя
в функцию f
m
kT
v , а последнюю в F v , получаем
функцию распределения молекул газа по скоростям, которая
называется распределением Максвелла
3/ 2
2
mv
m
F (v) 4 v
)
exp(
2kT
2 kT
2
(10.5.5)
22.
Построим график функции распределения Максвелладля разных температур. Максимум кривой F v отвечает
наиболее вероятной скорости молекул
T 2> T
F (v )
dF (v)
0
dv
2
2
mv
mv
exp(
)(2
) 0
2kT
kT
vвер
2kT
m
(10.5.6)
T
1
1
T
0
v вер
2
v
23.
Определим среднеквадратичную скорость молекулы1/ 2
vср.кв.
2
v
v F (v)d v
0
2
3kT
m
(10.5.7)
и среднюю скорость молекулы
8kT
v
vF (v)d v
πm
0
(10.5.8)
Между этими тремя скоростями имеет место пропорция
vвер :
v : vср.кв. 2 :
8
:
3 1 : 1.13 : 1.22
значит из них самая большая - среднеквадратичная скорость
молекулы.
24.
Закон распределения молекул по кинетическим энергиямСогласно (10.5.2) и (10.5.3) число молекул в сферическом слое
с радиусом v и толщиной dv равно
dN(v) = NF(v)dv
Обозначим кинетическую энергию молекулы
тогда
v
(10.6.1)
Т = mv2/2 = ,
2ε
m
Дифференциалы скорости и энергии связаны уравнением
d = d(mv2/2) = mvdv
Подставим эти выражения в исходную формулу (10.6.1).
25.
Получим3/ 2
2 m
dN ( ) N 4
exp( )
m 2 kT
kT
d
2
m
m
2N
3/ 2 1/ 2
kT exp( )d Nf ( )d
kT
где f( ) – функция распределения молекул по кинетическим
энергиям
2ε
-3/2 1/2
f(ε) =
kT ε exp(- )
kT
π
Она равна плотности вероятности того, что молекула имеет энергию
.
























 Физика
Физика








