Похожие презентации:
лекция 3 Хим связь
1. ПРЕЗЕНТАЦИЯ К ЛЕКЦИЯМ ПО ДИСЦИПЛИНЕ «Неорганическая химия»
КАФЕДРА ХИМИЯ И ЭКОТОКСИКОЛОГИЯПРЕЗЕНТАЦИЯ К ЛЕКЦИЯМ ПО
ДИСЦИПЛИНЕ
«Неорганическая химия»
Разработал:
Доцент кафедры , к.т.н.
Куликова Н.Е.
2. Лекция №3. Химическая связь и строение молекул
Химическая связь - сила, удерживающая вместе атомы,ионы, молекулы.
Химическая связь
формируется в результате
перекрывания электронных облаков связывающихся
частиц; сопровождается уменьшением полной энергии
системы (молекулы более стабильны, чем свободные
атомы).
При образовании химической связи атомы стремятся
приобрести устойчивую восьмиэлектронную (или
двухэлектронную для атома водорода) внешнюю
оболочку,
соответствующую
строению
атома
ближайшего инертного газа.
3.
Типы химической связи1. Ковалентная.
2. Ионная.
3. Металлическая.
4. Водородная.
Ковалентная связь образована общими парами
электронов взаимодействующих атомов. В результате
обобществления электронов каждый из атомов в
молекуле приобретает устойчивую восьмиэлектронную
(или двухэлектронную в случае атома водорода) внешнюю
оболочку.
4.
5. Свойства ковалентной связи
1) Насыщаемость ковалентной связи объяснятся наличиемв атоме определенного числа неспаренных электронов.
Два атома могут обобществлять несколько пар электронов.
В этом случае образуются кратные связи. Например, в
молекуле азота N2 реализуется тройная ковалентная связь
в результате обобществления трех пар электронов (по три
от каждого атома). При этом у каждого атома азота
возникает октет электронов.
Валентность, определяемая числом неспаренных электронов, называется
спинвалентностью.
6.
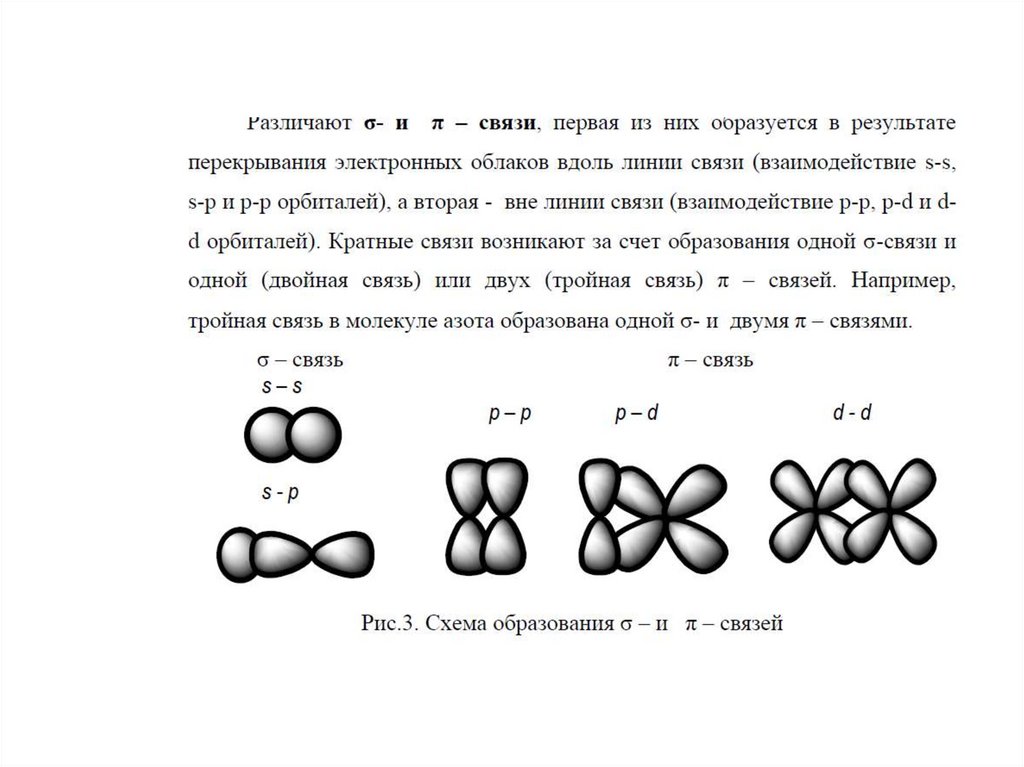
2) Направленность ковалентной связи в пространствеобусловлена тем, что атомные орбитали имеют
определенную форму и расположение в пространстве.
При образовании химической связи может происходить
смешивание (гибридизация) электронных орбиталей с
образованием новых гибридных облаков.
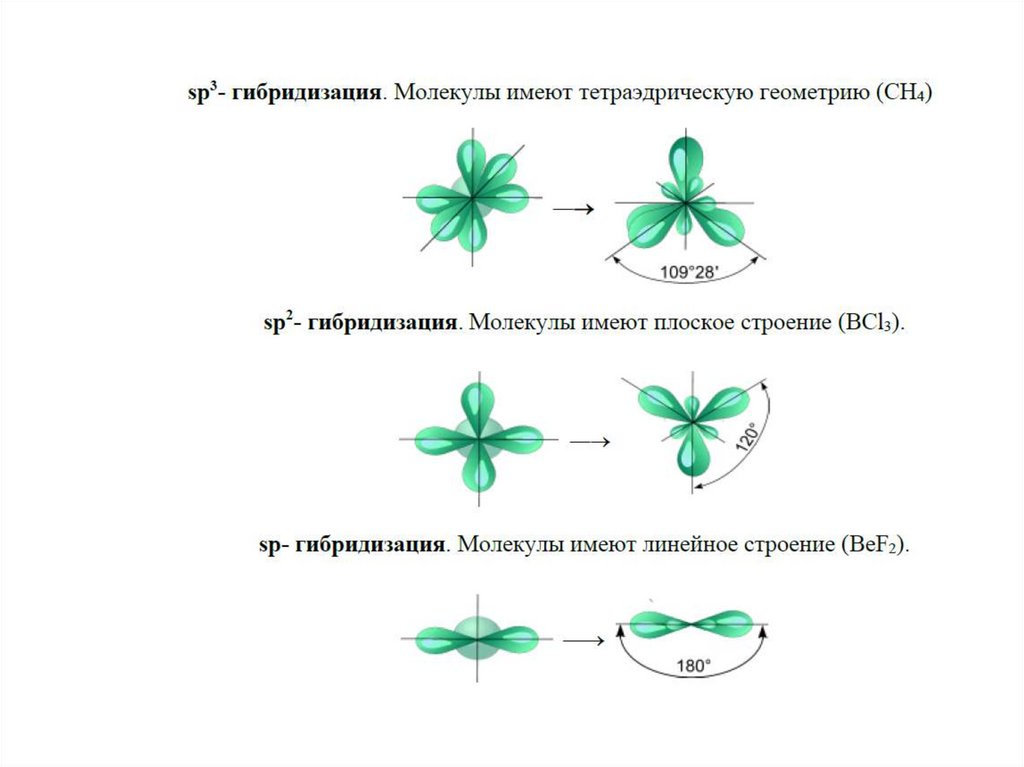
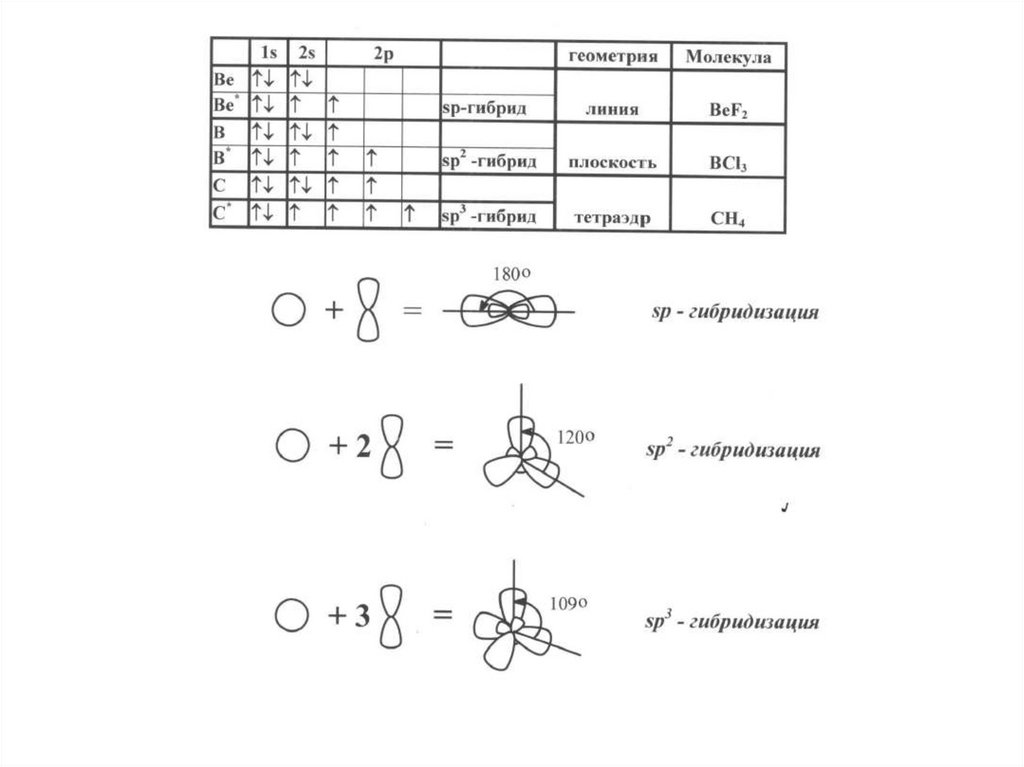
Гибридизация орбиталей – смешивание атомных
орбиталей с изменением их формы при образовании
ковалентной связи для достижения более эффективного
перекрывания орбиталей.
7.
8.
9.
10. 3) Поляризуемость
Явление смещения электронной плотности к болееэлектроотрицательному атому называется поляризацией. При этом более
электроотрицательный атом получает частичный отрицательный заряд (δ-),
а менее электроотрицательный - частичный положительный заряд (δ+)
Если электронная плотность расположена симметрично между
атомами, ковалентная связь называется неполярной. Если электронная
плотность смещена в сторону одного из атомов, то ковалентная связь
называется полярной. Полярность связи тем больше, чем больше
разность электроотрицательностей атомов.
11.
12.
13.
Водородная связьВодородная связь возникает между положительно
поляризованным атомом водорода молекулы или полярной
группой и отрицательно поляризованным атомом с большой
электроотрицательностью (F, O, N). Она может быть
внутримолекулярной (например, в салициловом альдегиде,
пептидах) и межмолекулярной.
Наличие водородных связей объясняет аномально высокую
температуру кипения воды, поскольку для перехода воды из
жидкого состояния в пар необходимо затратить
дополнительную энергию, чтобы разорвать эти связи.










 Химия
Химия








