Похожие презентации:
алканы строение
1.
лат.«parrum affinis»
имеющий мало сродства, малоактивный.
2.
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ(алканы, насыщенные или парафины)
Алканы – углеводороды с общей
формулой: СnH2n+2.
Термин предельные углеводороды означает, что
все атомы в молекуле связаны посредством
одинарных связей.
Термин насыщенные углеводороды означает,
что все четыре валентности углерода
максимально насыщены атомами водорода.
3.
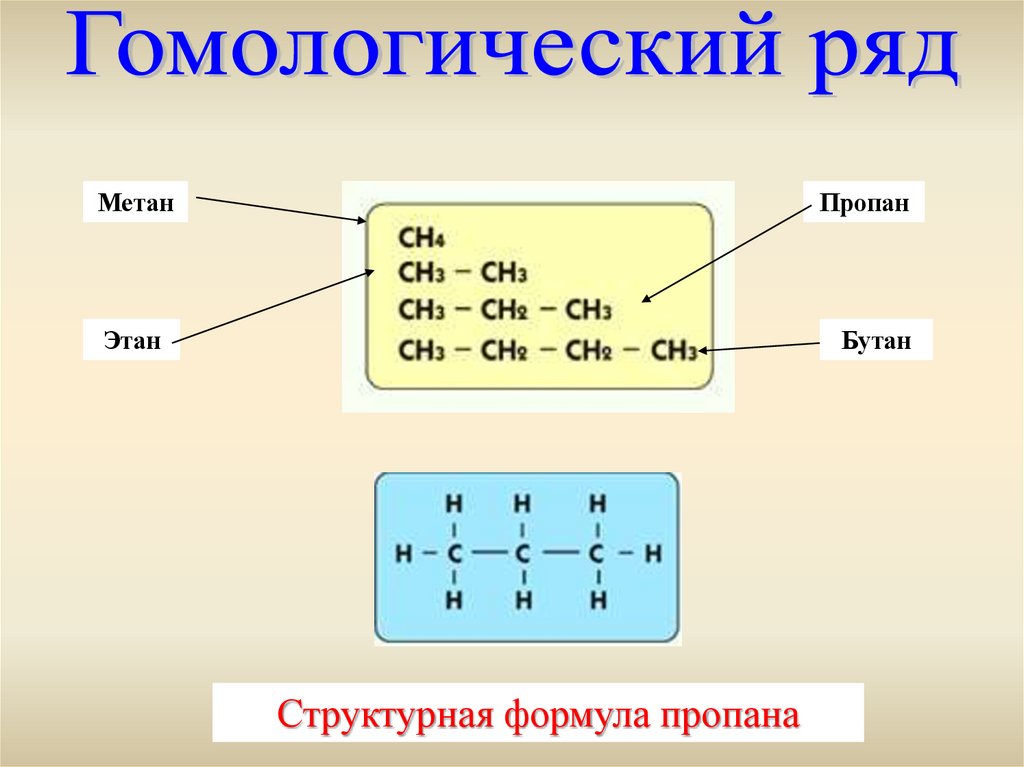
МетанПропан
Этан
Бутан
Структурная формула пропана
4.
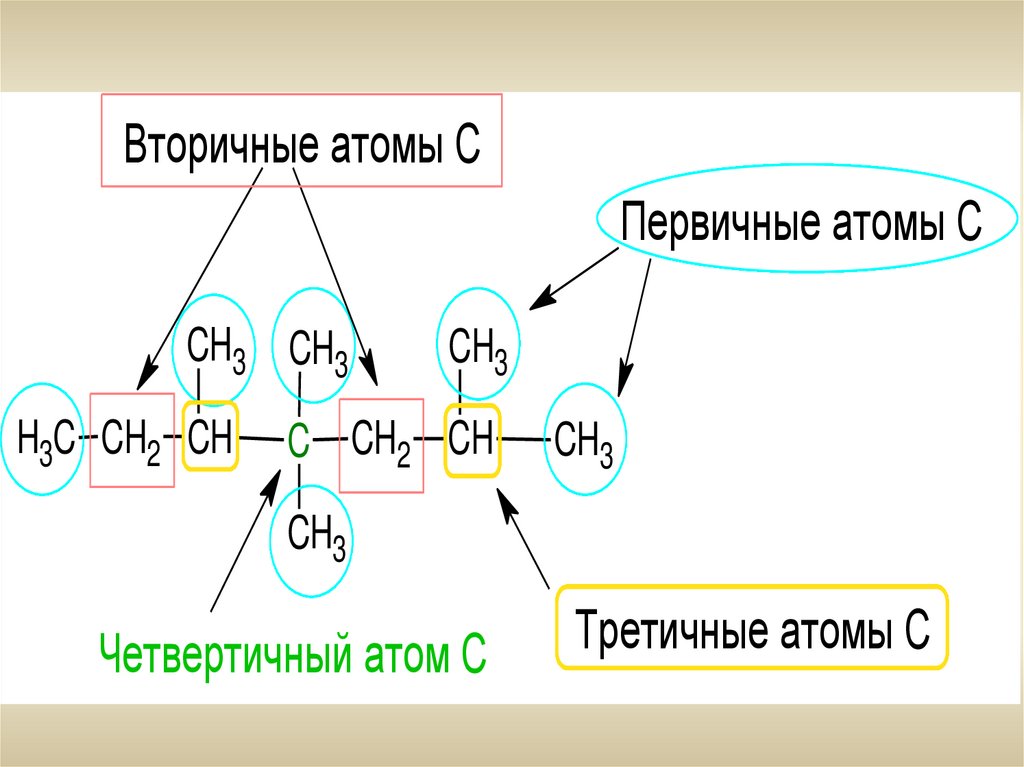
Вторичные атомы СПервичные атомы С
CH3 CH3
H3C CH2 CH
CH3
C CH2 CH
CH3
CH3
Четвертичный атом С
Третичные атомы С
5.
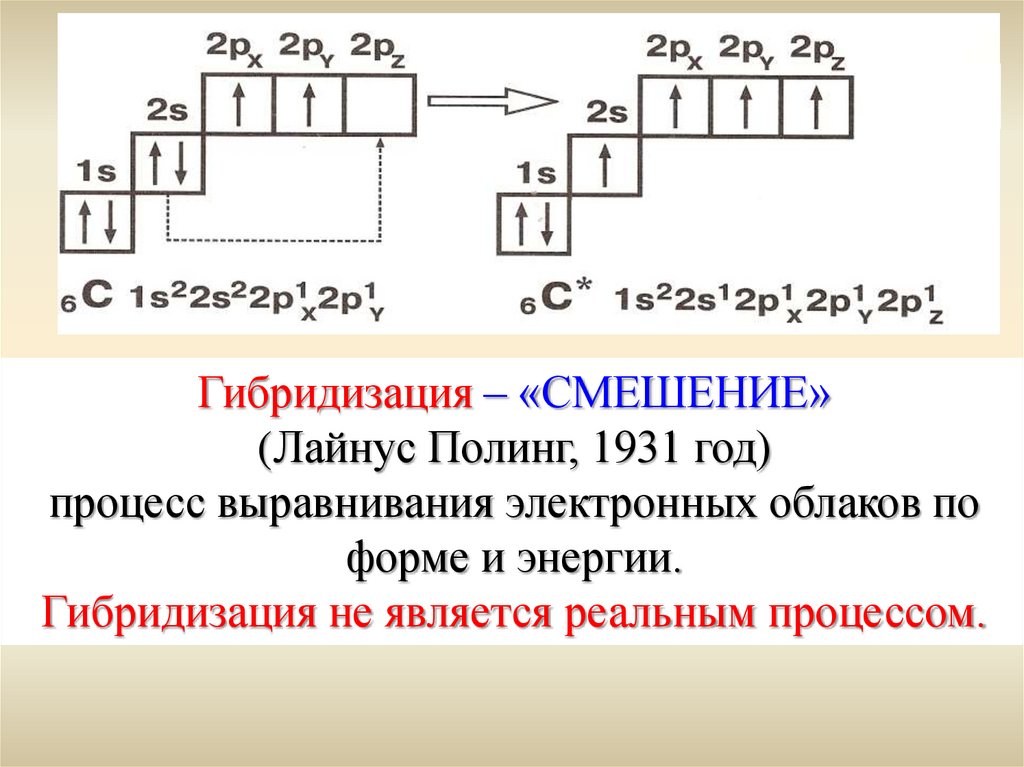
Гибридизация – «СМЕШЕНИЕ»(Лайнус Полинг, 1931 год)
процесс выравнивания электронных облаков по
форме и энергии.
Гибридизация не является реальным процессом.
6.
Основные положениягибридизации:
- В гидридизации участвуют АО с близкой
энергией.
- Число гибридных орбиталей равно суммарному
числу исходных орбиталей.
- Гибридизация сопровождается изменением
формы электронных облаков, химические связи с
участием гибридных орбиталей обладают
большей прочностью, чем связи с “чистыми” АО.
7.
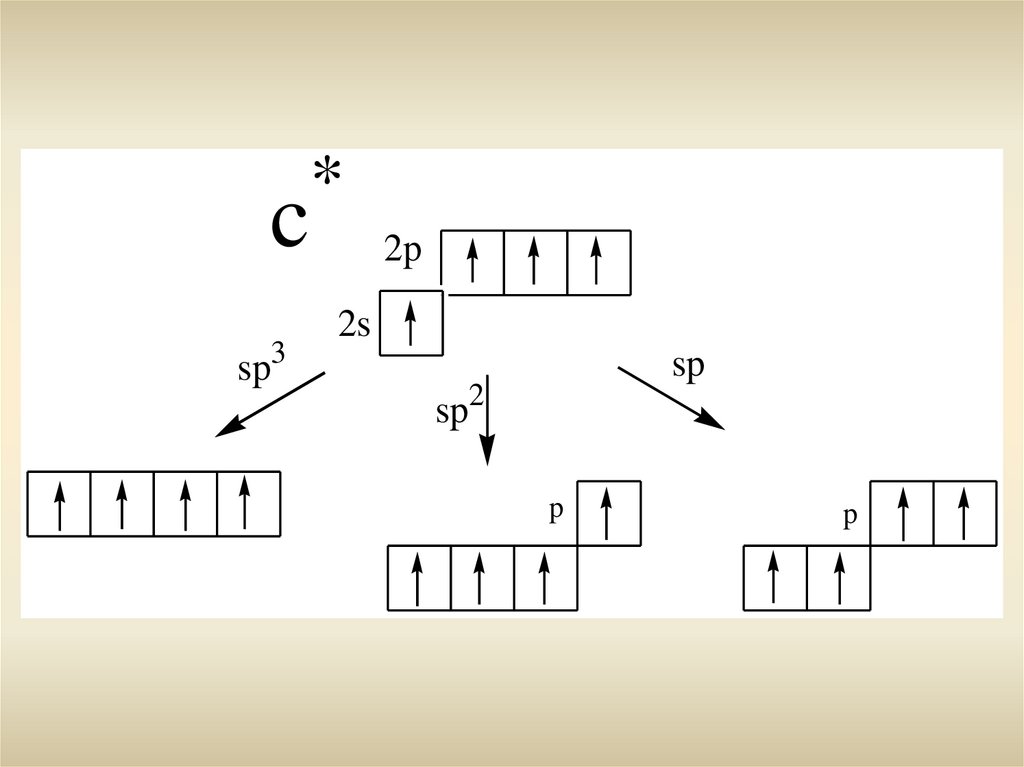
csp3
*
2p
2s
sp
sp2
p
p
8.
9.
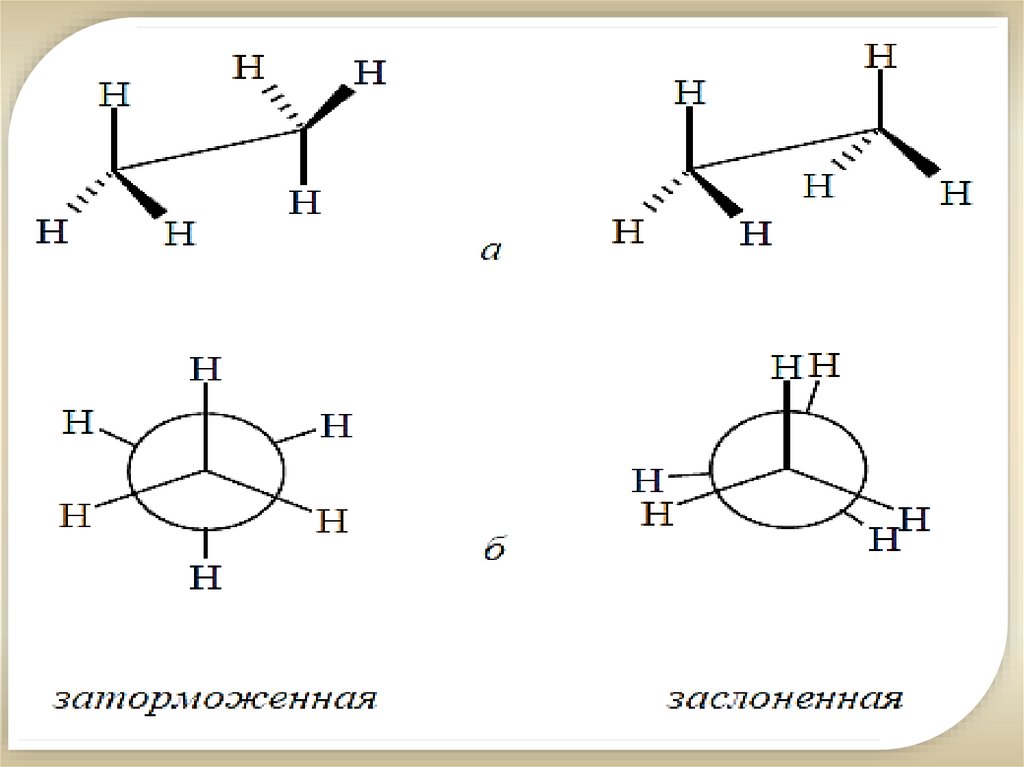
10.
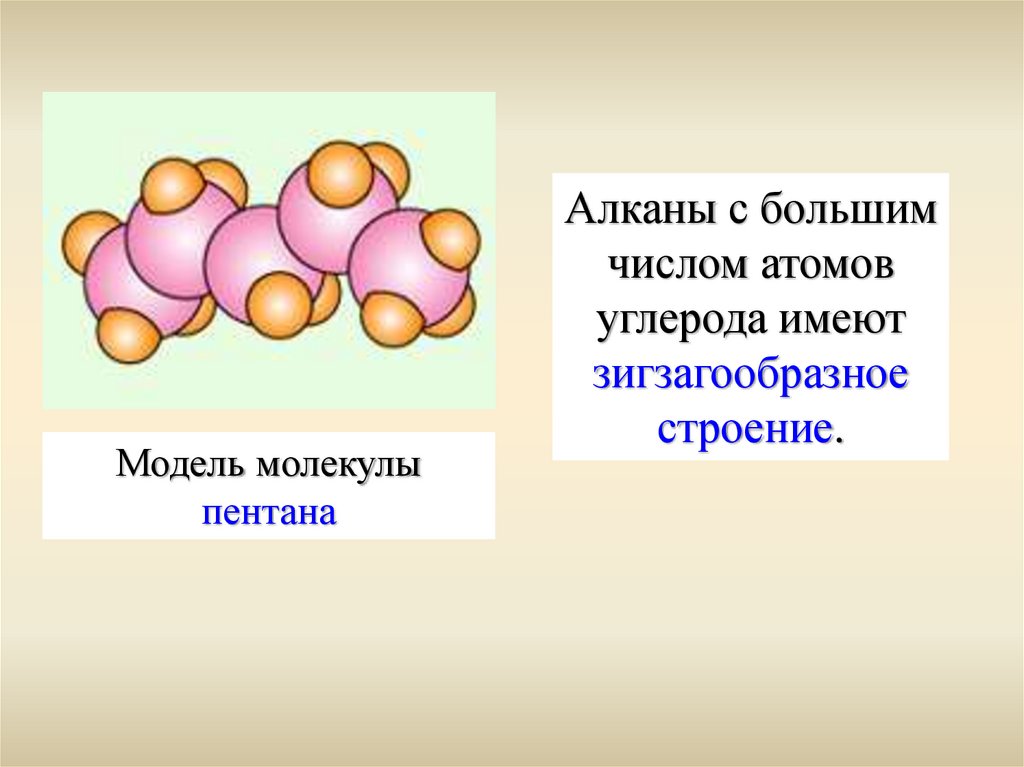
Модель молекулыпентана
Алканы с большим
числом атомов
углерода имеют
зигзагообразное
строение.
11.
12.
13.
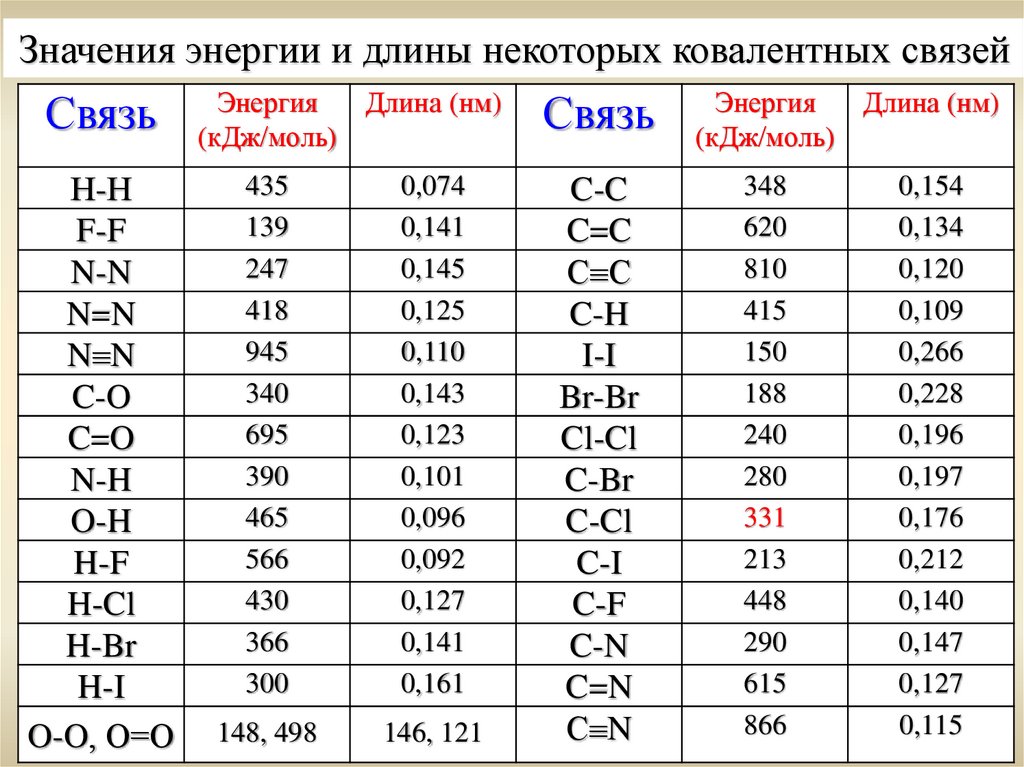
Значения энергии и длины некоторых ковалентных связейСвязь
Н-Н
F-F
N-N
N=N
N N
C-O
C=O
N-H
O-H
H-F
H-Cl
H-Br
H-I
O-O, О=О
Энергия
Длина (нм)
(кДж/моль)
435
139
247
418
945
340
695
390
465
566
430
366
300
0,074
0,141
0,145
0,125
0,110
0,143
0,123
0,101
0,096
0,092
0,127
0,141
0,161
148, 498
146, 121
Связь
C-C
C=C
С С
C-H
I-I
Br-Br
Cl-Cl
C-Br
C-Cl
C-I
C-F
C-N
C=N
С N
Энергия
Длина (нм)
(кДж/моль)
348
620
810
415
150
188
240
280
331
213
448
290
615
866
0,154
0,134
0,120
0,109
0,266
0,228
0,196
0,197
0,176
0,212
0,140
0,147
0,127
0,115
14.
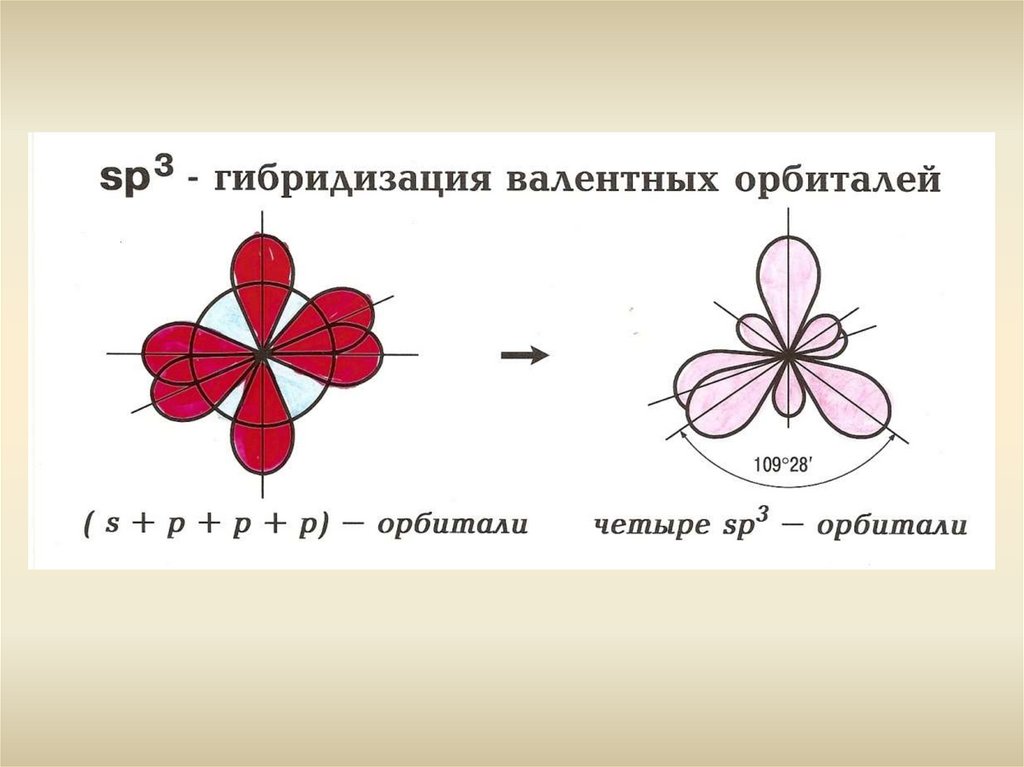
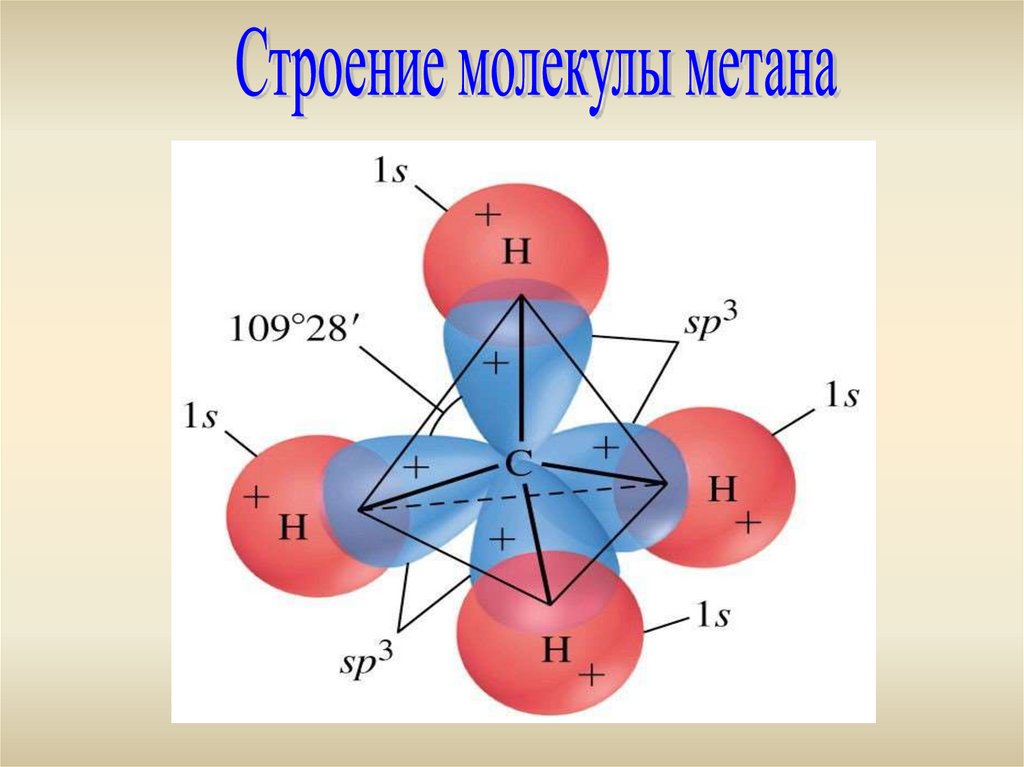
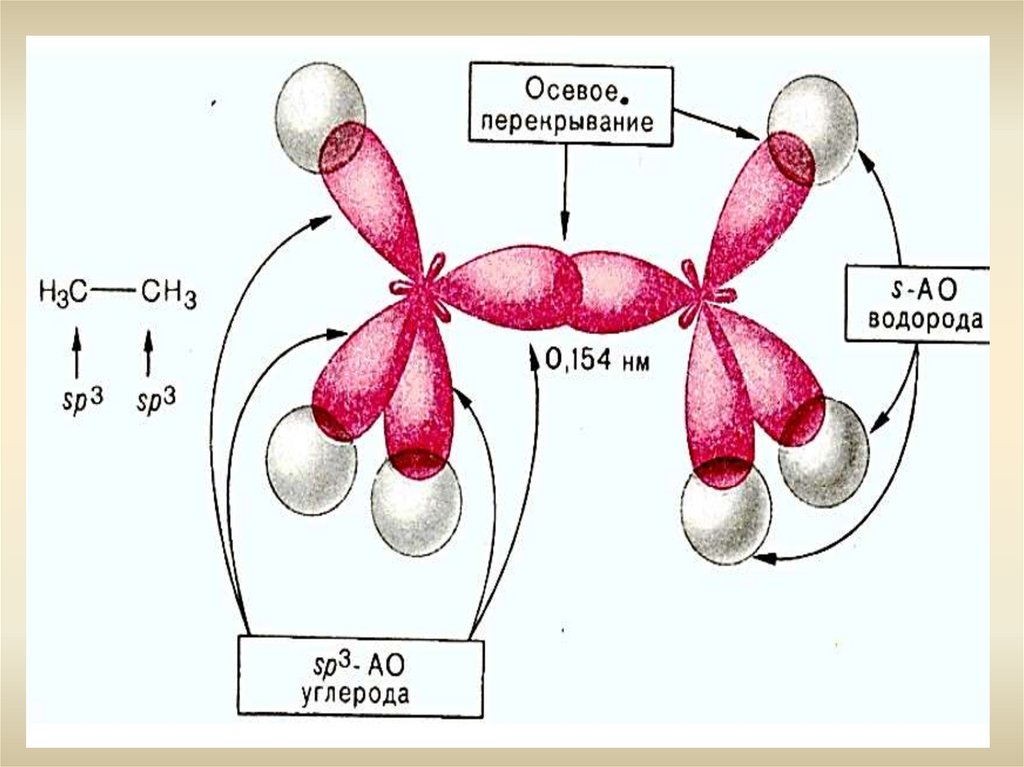
- Гибридизация - SР3- Валентный угол -109о28
- Тетраэдр
- Длина С-С связи: 0,154 нм
- Энергия С-С связи: 348 кДж/моль
- Энергия С-Н связи: 415 кДж/моль
15.
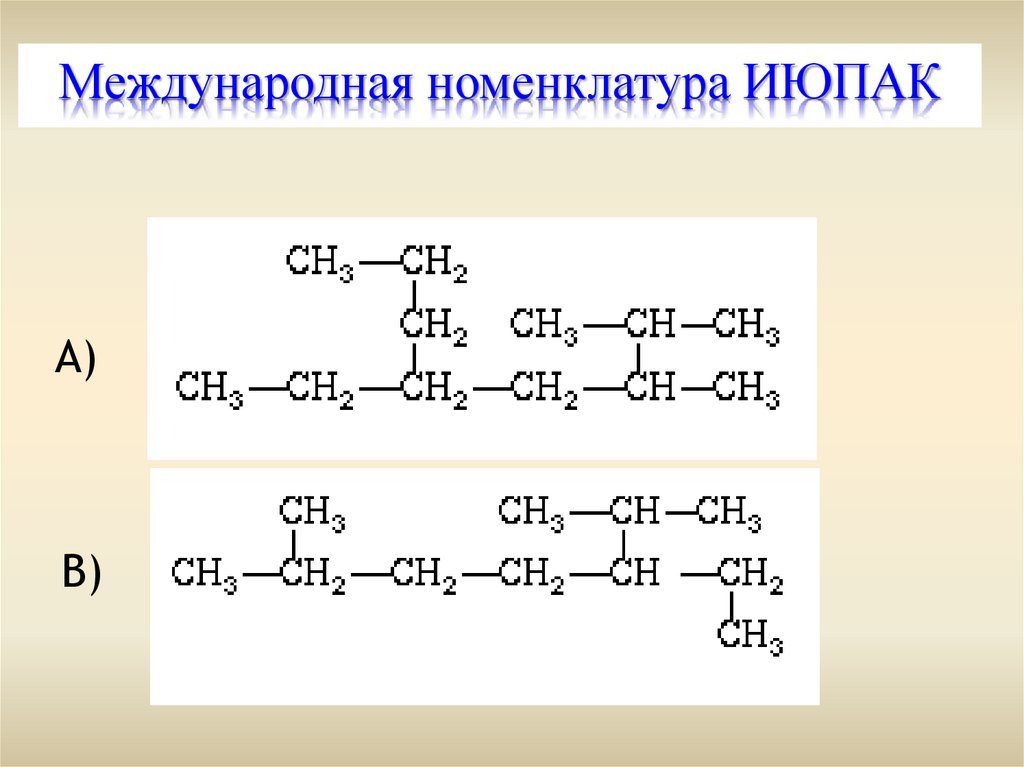
Международная номенклатура ИЮПАКА)
B)
16.
Структурная изомерия (УС) проявляется присодержании в цепи от 4-х и более атомов углерода,
т. е. начиная с бутана С4Н10.
17.
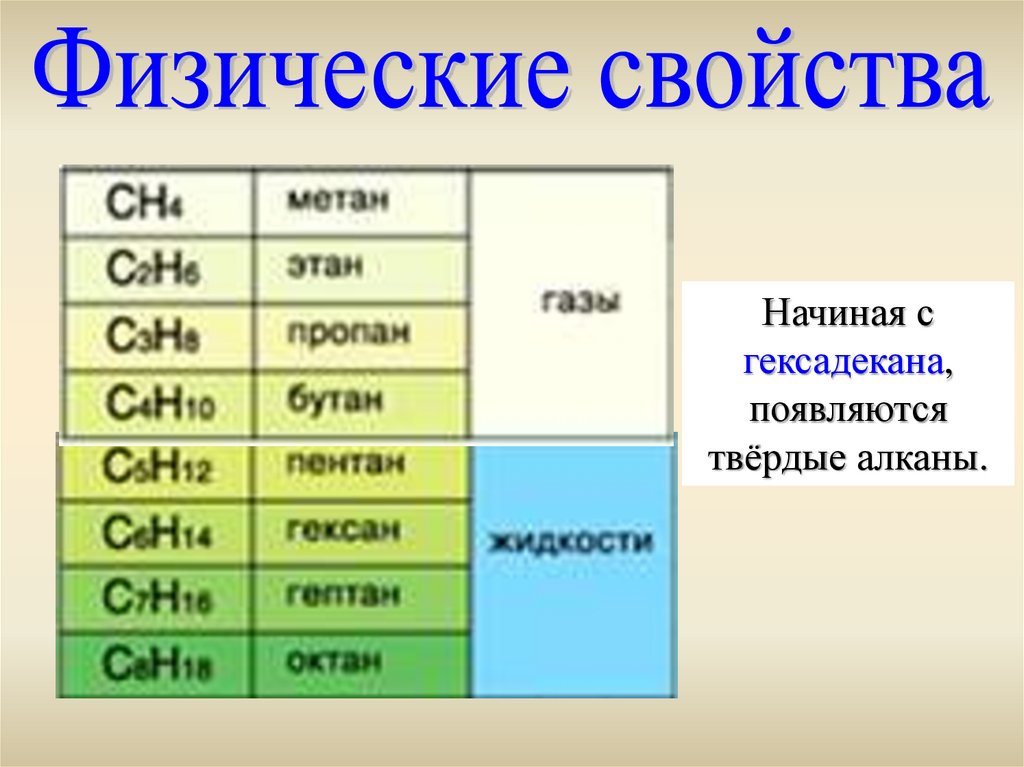
Начиная сгексадекана,
появляются
твёрдые алканы.
18.
В молекулах алканах присутствуют неполярныековалентные (С-С) связи и слабополярные (С-Н)
связи.
Молекула алкана всегда неполярна, поскольку
полярные связи в них симметричны.
Поэтому алканы растворяются в неполярных
растворителях и НЕ растворяются в воде (полярном
растворителе).
Основные неполярные (органические)
растворители: бензол - C6H6, тетрахлорметан CCl4, хлороформ СHCl3, гексан - C6H14,
диэтиловый эфир - C2H5-O-C2H5 и др.
19. Зависимость формы молекулы от наличия неподеленных электронных пар:
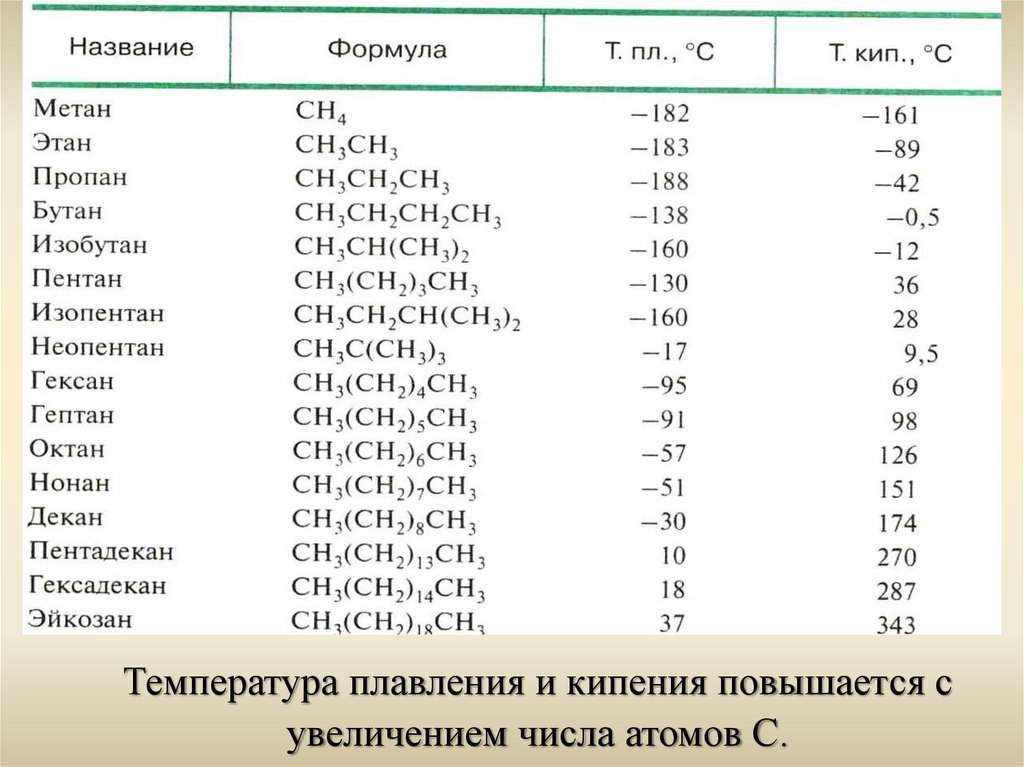
Температура плавления и кипения повышается сувеличением числа атомов С.
20.
ПОЛУЧЕНИЕ В ПРОМЫШЛЕННОСТИ ИЛАБОРАТОРИИ
В промышленности важно:
1) получение большого количества продукта;
2) дешевизна;
3) доступность исходных веществ.
В лаборатории важно:
1) синтез небольшого количества (1-100 г) супер-чистого
вещества;
2) цена имеет меньшее значение, чем время, затраченное
на синтез;
3) главное – максимальный выход нужного продукта без
примесей.
21.
Получение ПУВ реакцией гидрированияЦиклоалканов:
С5Н10 + Н2 = С5Н12
Катализаторы:
Ni/Pt/Pd/, to
Алкинов:
С2Н2 + 2Н2 = С2Н6
Алкенов:
С2Н4 + Н2 = С2Н6
Алкадиенов:
С4Н6 + 2Н2 = С4Н10
22.
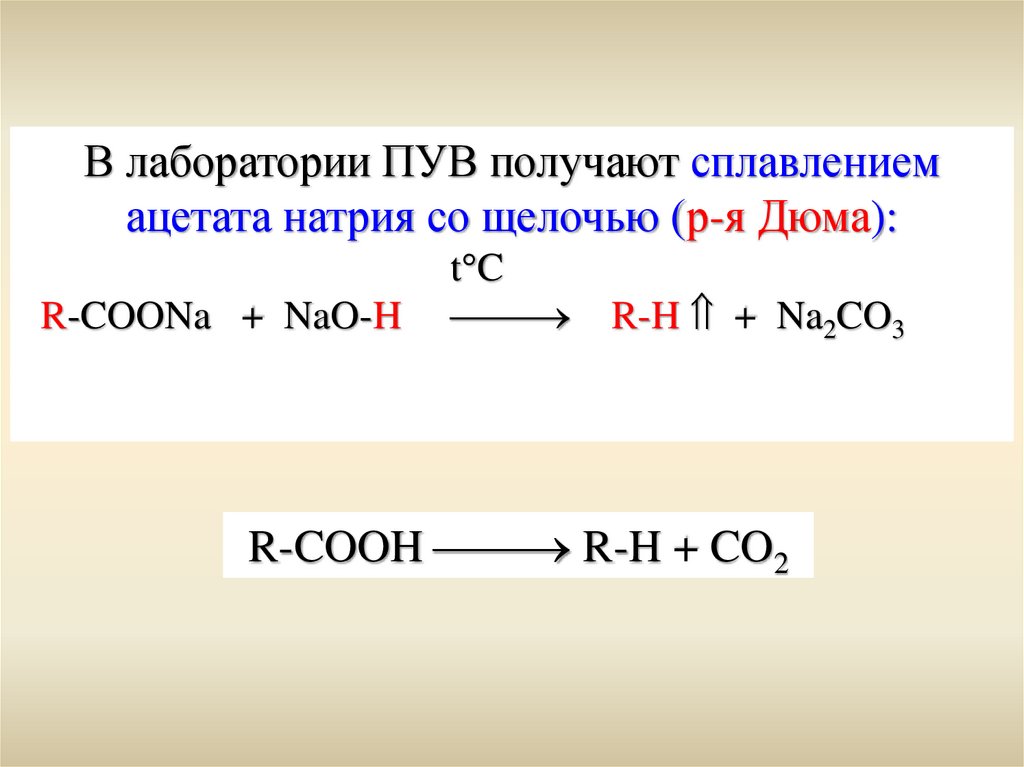
В лаборатории ПУВ получают сплавлениемацетата натрия со щелочью (р-я Дюма):
R-COONa + NaO-H
t C
R-H + Na2CO3
R-COOH R-H + CO2
23.
Синтез Вюрца 1855г.RHal + 2Na + R'Hal → R-R' + 2NaHal
проводится с целью получения алканов с более
длинной углеродной цепью. Hal = I2 или Br2
1 этап: Галогенирование исходного алкана.
СН4 + Br2 = CH3Br+ HBr
2 этап: Взаимодействие с натрием.
2CH3Br + 2Na = C2H6 + 2NaBr
24.
Реакция Вюрца-Фиттига, котораязаключается в сочетании алифатического
и ароматического галогенидов:
C6H5Cl + 2Na + CH3Cl = C6H5-CH3 + 2NaCl
25.
Адольф ВильгельмГерман Кольбе
Способ Кольбе (электролиз)
2RCOONa (р-в)→ R-R + 2CO2 + 2Na
2RCOONa + 2H2O → R-R + 2CO2 + H2 + 2NaOH
26.
При электролизе водного раствора солиактивного металла органической кислоты
на катоде выделяется водород, на аноде
углеводород и углекислый газ, а в растворе
образуется щелочь.
катод CH3COONa
анод +
← 2Na+
CH3COO- →
H 2O
2H2O + 2e- = H2↑ + 2OH-
2СH3COO- - 2e- = C2H6↑ + 2CO2↑
27.
Метан в лаборатории можно получитьгидролизом карбида алюминия:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
При пропускании смеси CO и Н2 при температуре
200-400оС и давлении над катализаторами железа,
никеля или кобальта образуется смесь алканов
(синтез Фишера-Тропша):
Ni
nCO + (2n + 1)H2
CnH2n+2 + nH2O













 Химия
Химия








