Похожие презентации:
Презентация_10_Теория_электролитической_диссоциации
1.
Общая и неорганическая химияРаздел: Ионные равновесия
Тема: Теория электролитической
диссоциации
2.
Истинный раствор — однородная гомогенная система,состоящая из двух и более веществ. В растворе
присутствует несколько типов частиц.
Истинный раствор — молекулярно-дисперсная система,
размеры частиц <10-9 м, частицы не обнаруживаются
оптическими методами. Между частицами вещества нет
границы раздела фаз.
Растворитель — вещество, агрегатное состояние
которого совпадает с агрегатным состоянием раствора.
В случае смеси двух жидкостей растворителем считают
то вещество, которого больше.
3.
Растворы - однородны;- характеризуются тепловыми движениями частиц;
- контракцией объема;
- не подчиняются закону постоянства состава;
- растворы могут быть разделены на составные части.
Растворы занимают промежуточное положение между
химическими соединениями постоянного состава и
механическими смесями.
Свойства растворов зависят от
-природы растворенного вещества и природы
растворителя
-количественного состава — концентраций растворов
В объеме раствора не происходит скачкообразного изменения
свойств.
Коллигативные (физико-химические) свойства растворов зависят
от суммарного числа частиц в растворе.
4.
Теория электролитической диссоциацииВодные растворы и расплавы солей, кислот и
оснований проводят электрический ток, так как эти
вещества диссоциируют на ионы и называются
электролитами.
Ионы, заряженные положительно, называются
катионами, а отрицательно заряженные – анионами.
Гипотезу ионизации выдвинул впервые в 1887г.
Аррениус.
Подтвердило
эту
гипотезу
явление
электропроводности расплавов и водных растворов
кислот, солей, оснований.
4
5.
Теория электролитической диссоциацииПредположения Аррениуса в дальнейшем были
развиты им в теорию, получившую название теории
электролитической диссоциации.
Процесс распада вещества на ионы называется
электролитической диссоциацией.
Теория электролитической диссоциации объясняет
то, что растворы электролитов
имеют гораздо
большие πосм, ∆Pпар, ∆tзам, ∆tкип..
По сравнению с растворами неэлектролитов
величины πосм,
∆Pпар, ∆tзам, ∆tкип для растворов
электролитов в i раз больше, где i - изотонический
5
коэффициент.
6.
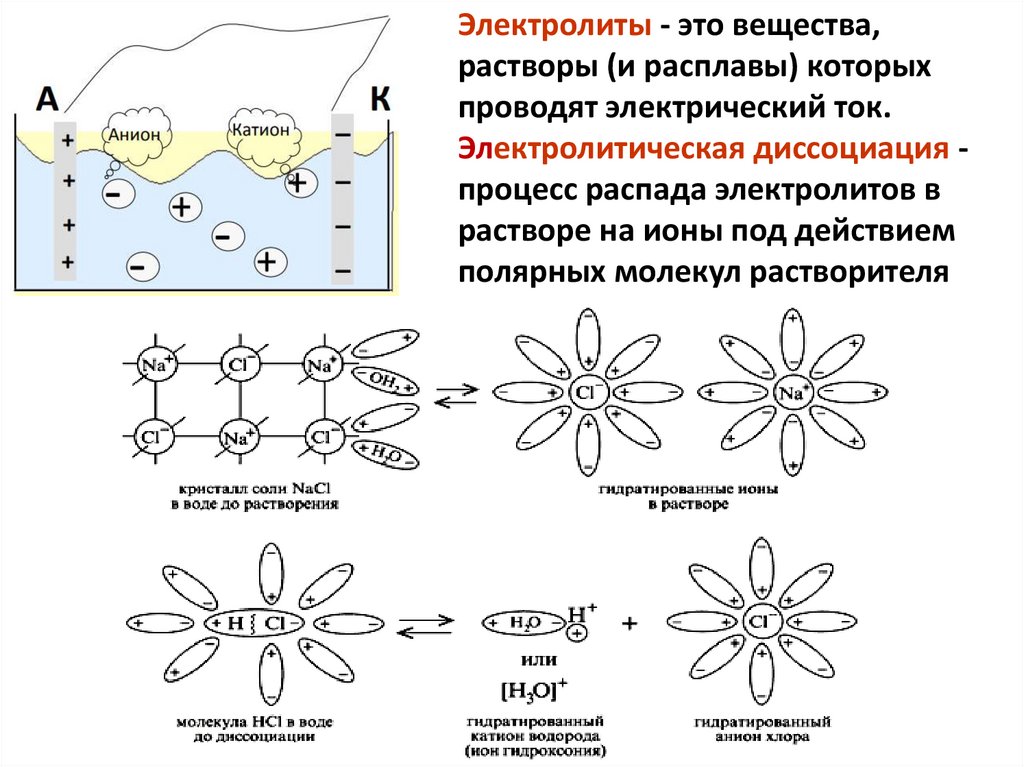
Электролиты - это вещества,растворы (и расплавы) которых
проводят электрический ток.
Электролитическая диссоциация процесс распада электролитов в
растворе на ионы под действием
полярных молекул растворителя
аще всего воды).
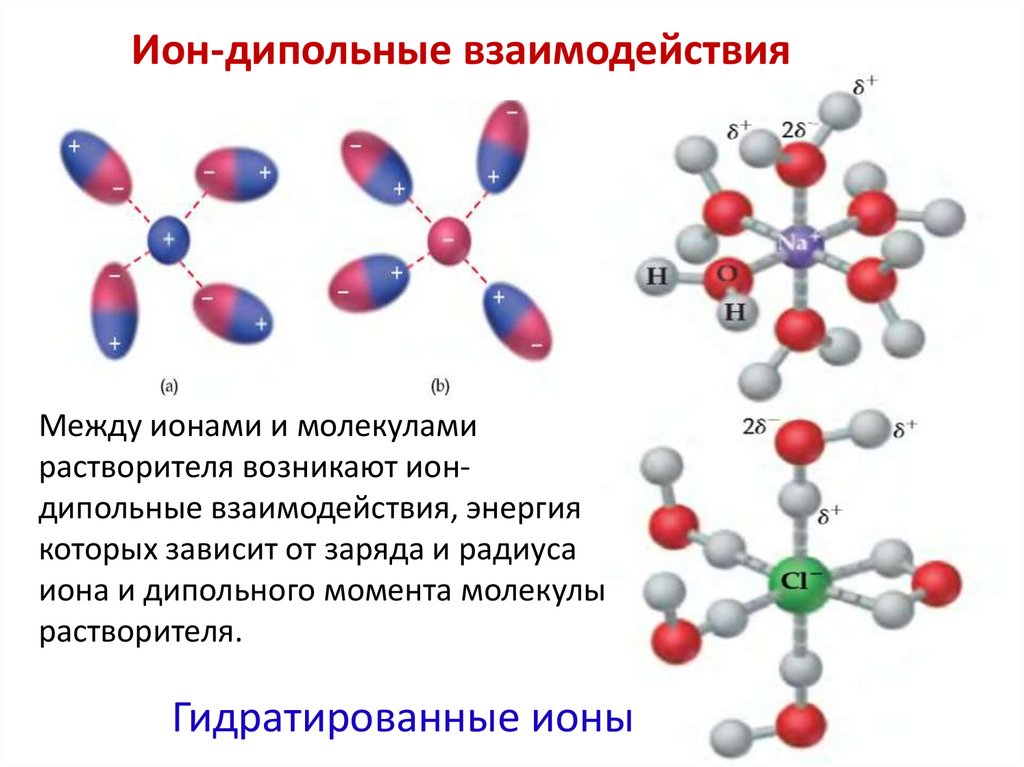
7. Ион-дипольные взаимодействия
Между ионами и молекуламирастворителя возникают иондипольные взаимодействия, энергия
которых зависит от заряда и радиуса
иона и дипольного момента молекулы
растворителя.
Гидратированные ионы
8.
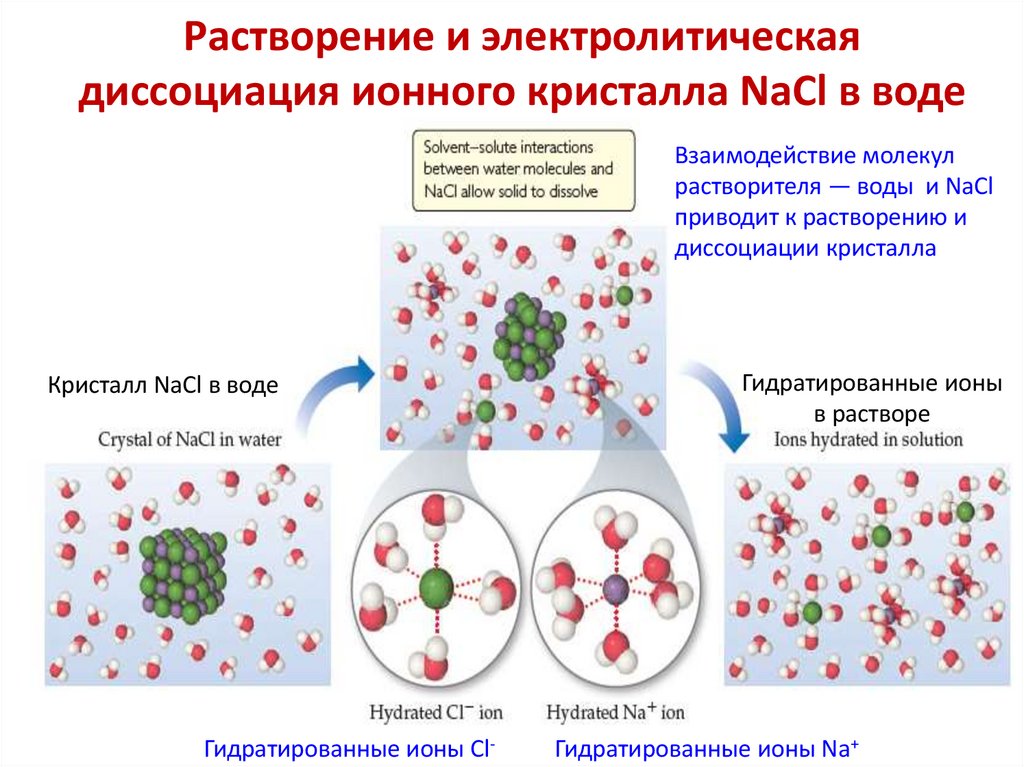
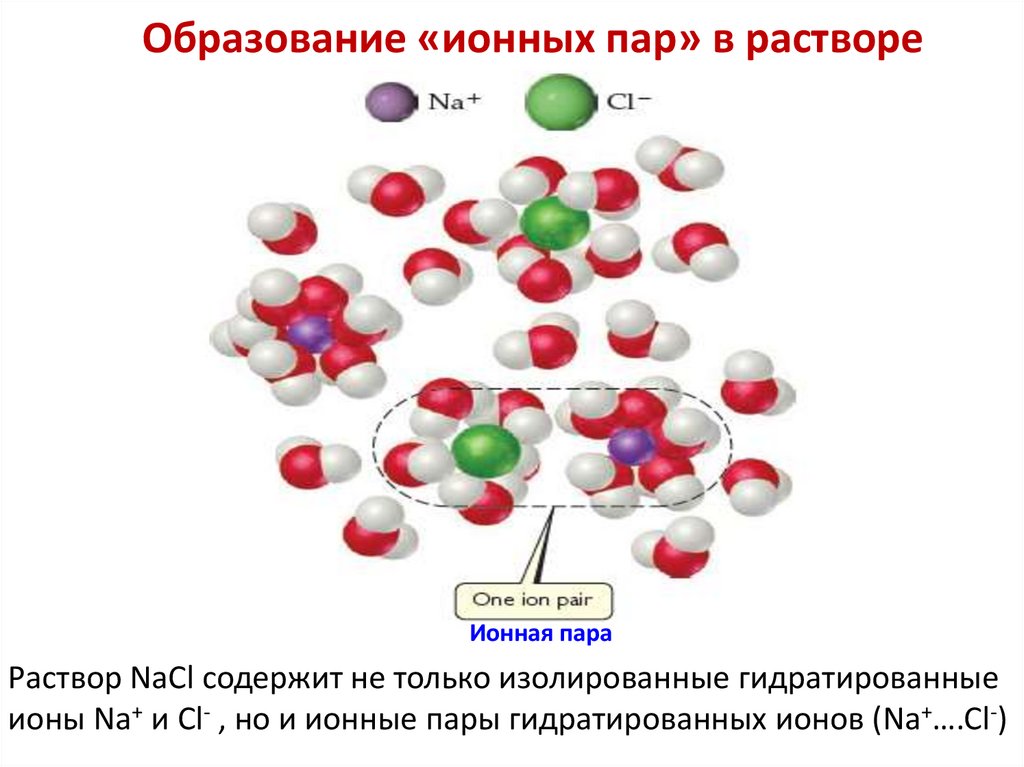
Растворение и электролитическаядиссоциация ионного кристалла NaCl в воде
Взаимодействие молекул
растворителя — воды и NaCl
приводит к растворению и
диссоциации кристалла
Кристалл NaCl в воде
Гидратированные ионы Cl-
Гидратированные ионы
в растворе
Гидратированные ионы Na+
9.
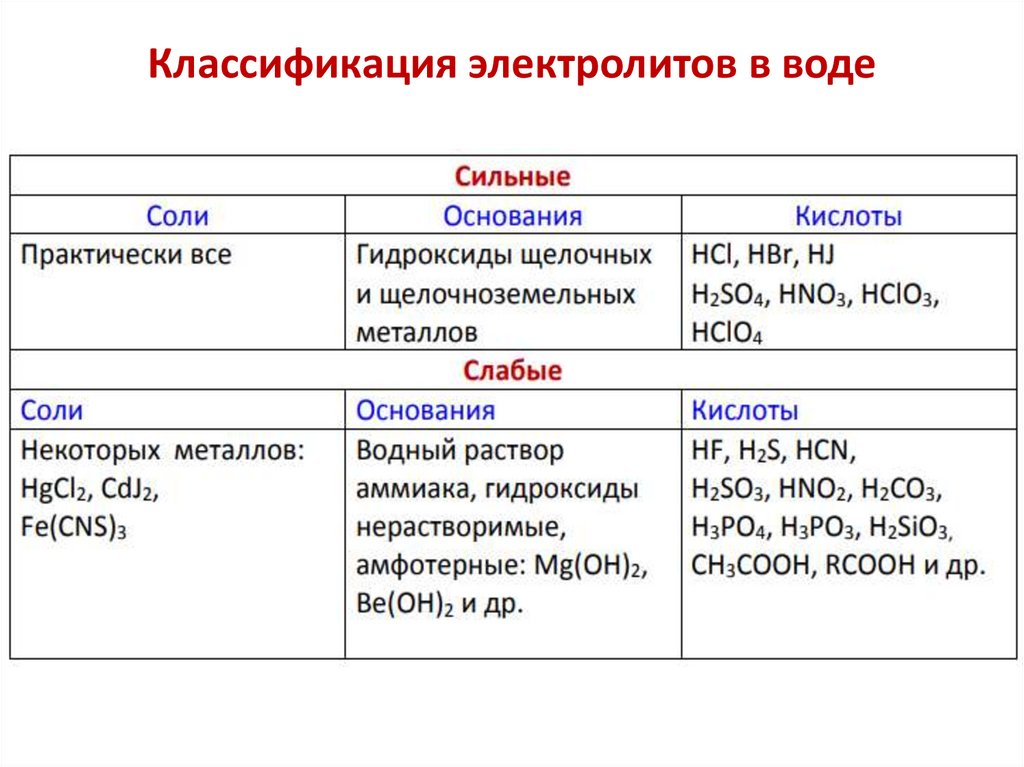
Классификация электролитов в воде10.
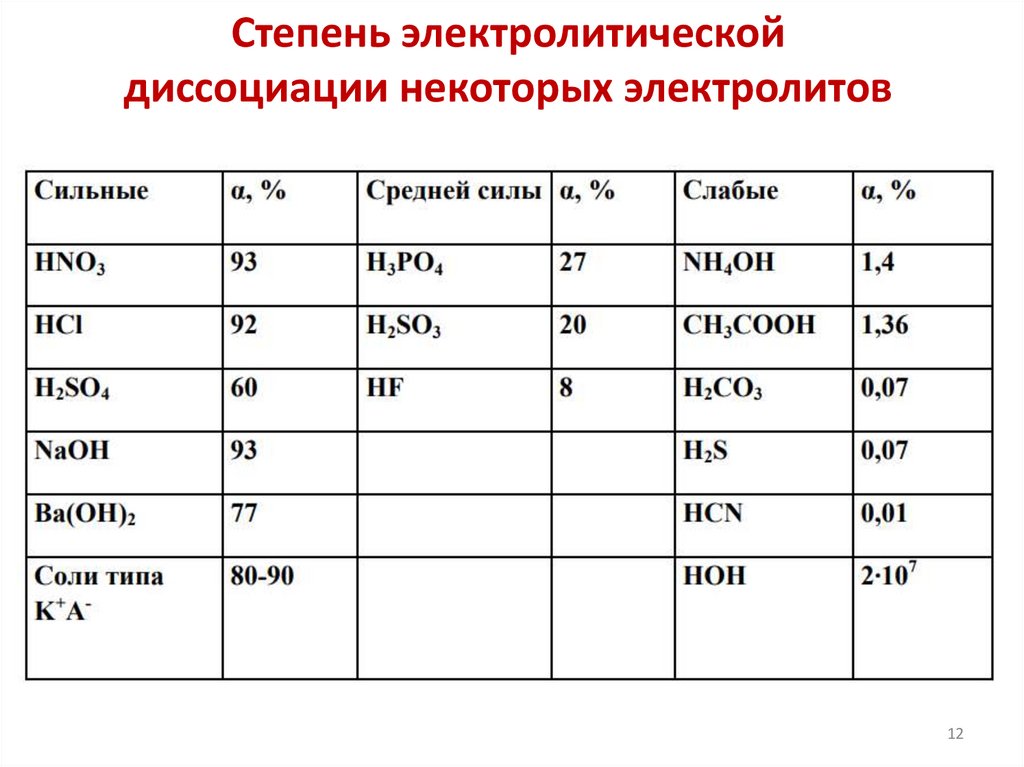
Степень электролитической диссоциацииСтепень электролитической диссоциации -








































 Химия
Химия








