Похожие презентации:
Презентация 8 хим равновесие
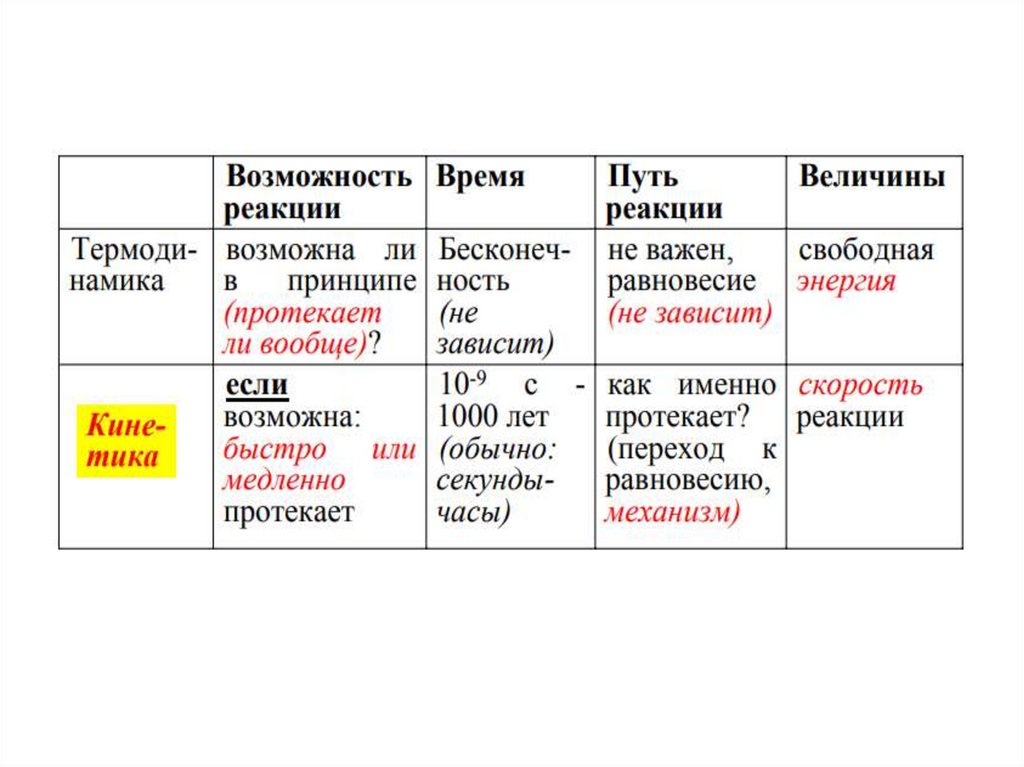
1.
Общая и неорганическая химияРаздел: Закономерности протекания
химических процессов
Тема: Химическая кинетика
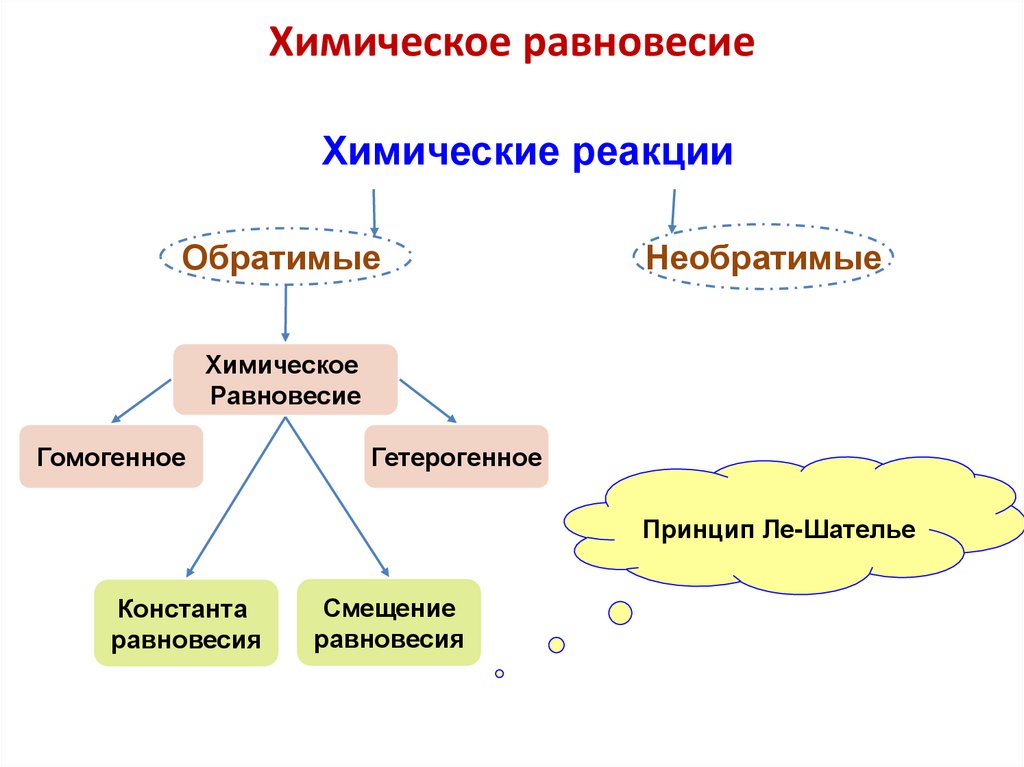
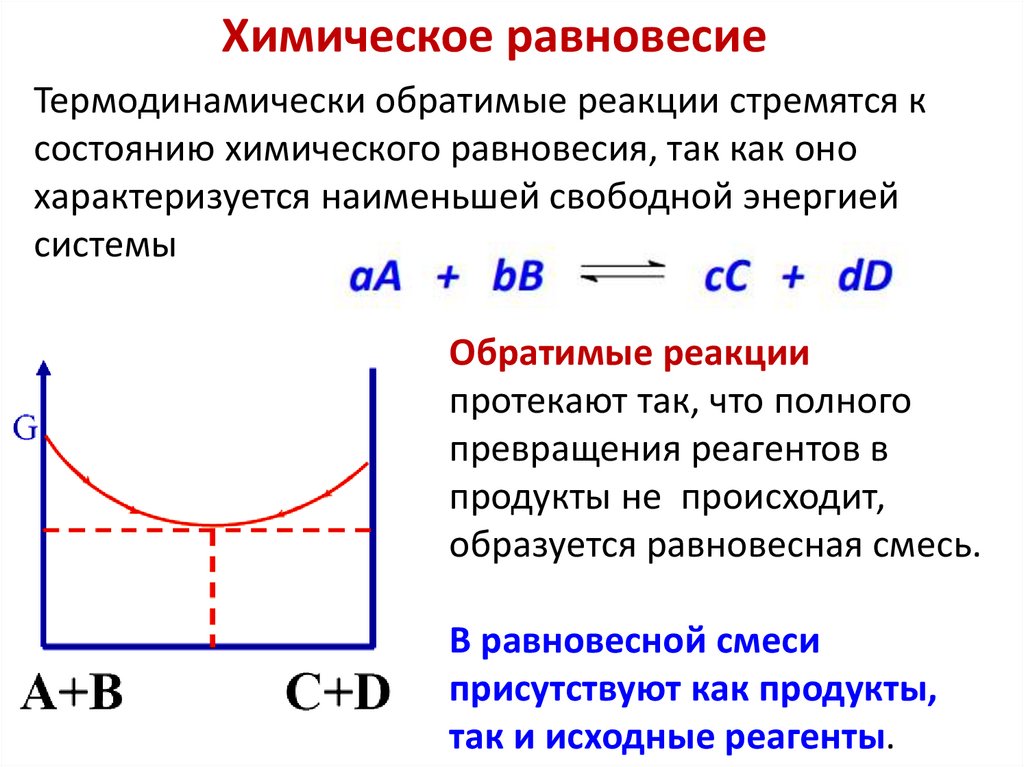
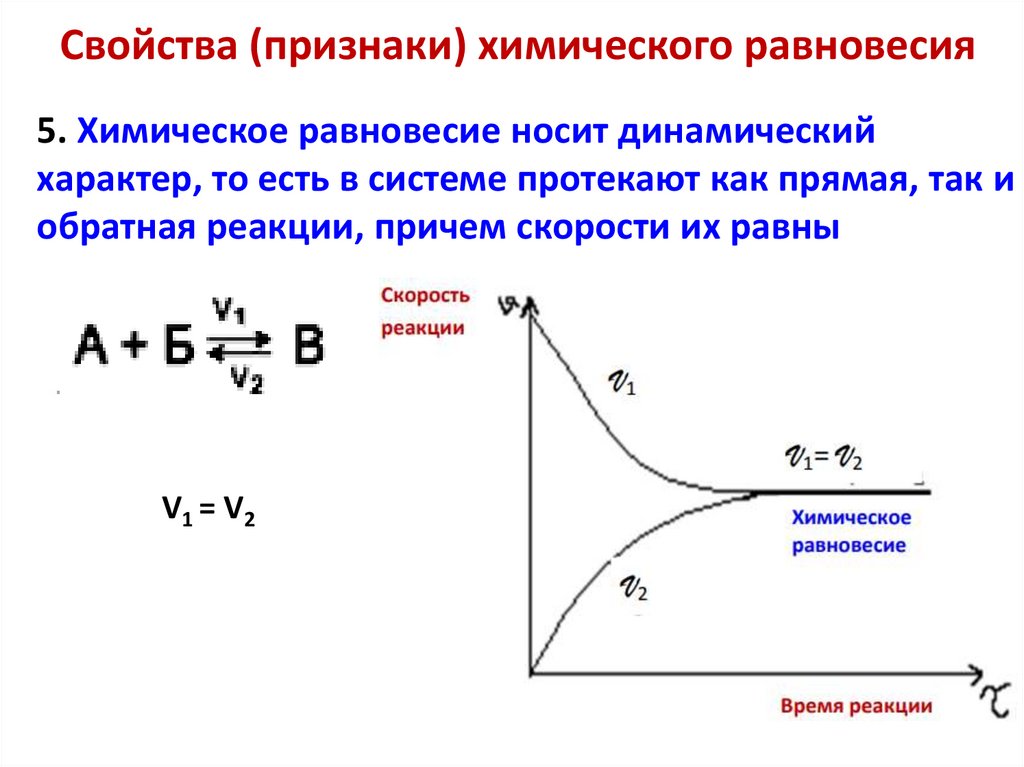
Химическое равновесие
2.
3.
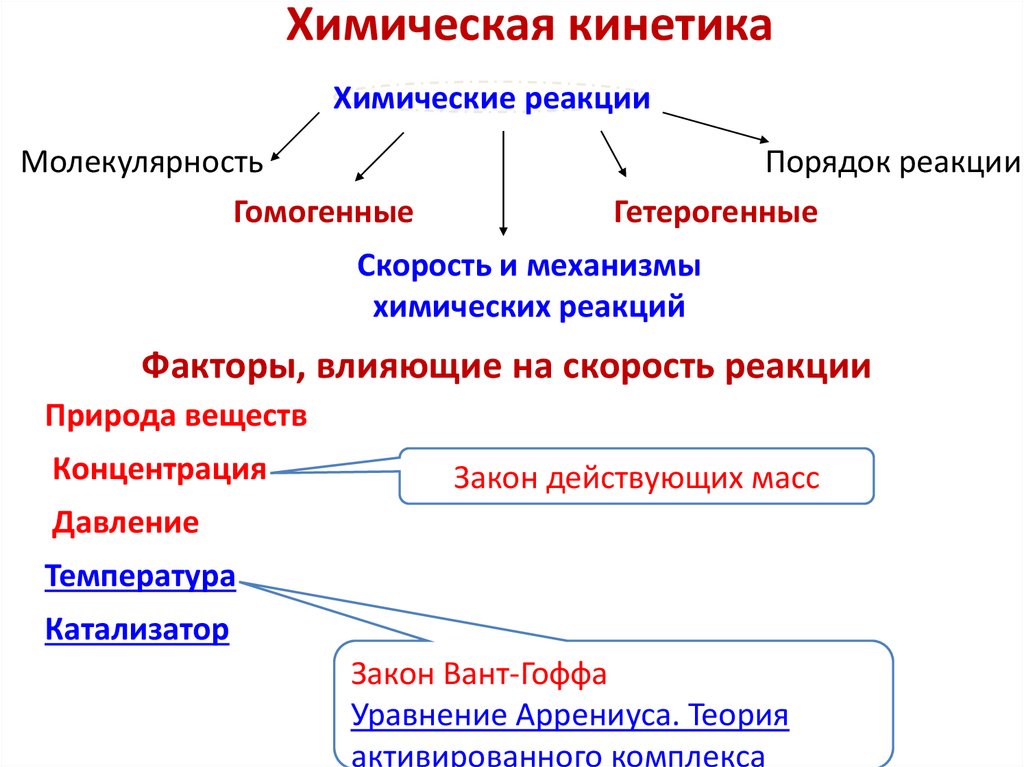
Химическая кинетикаХимические реакции
Молекулярность
Гомогенные
Порядок реакции
Гетерогенные
Скорость и механизмы
химических реакций
Факторы, влияющие на скорость реакции
Природа веществ
Концентрация
Закон действующих масс
Давление
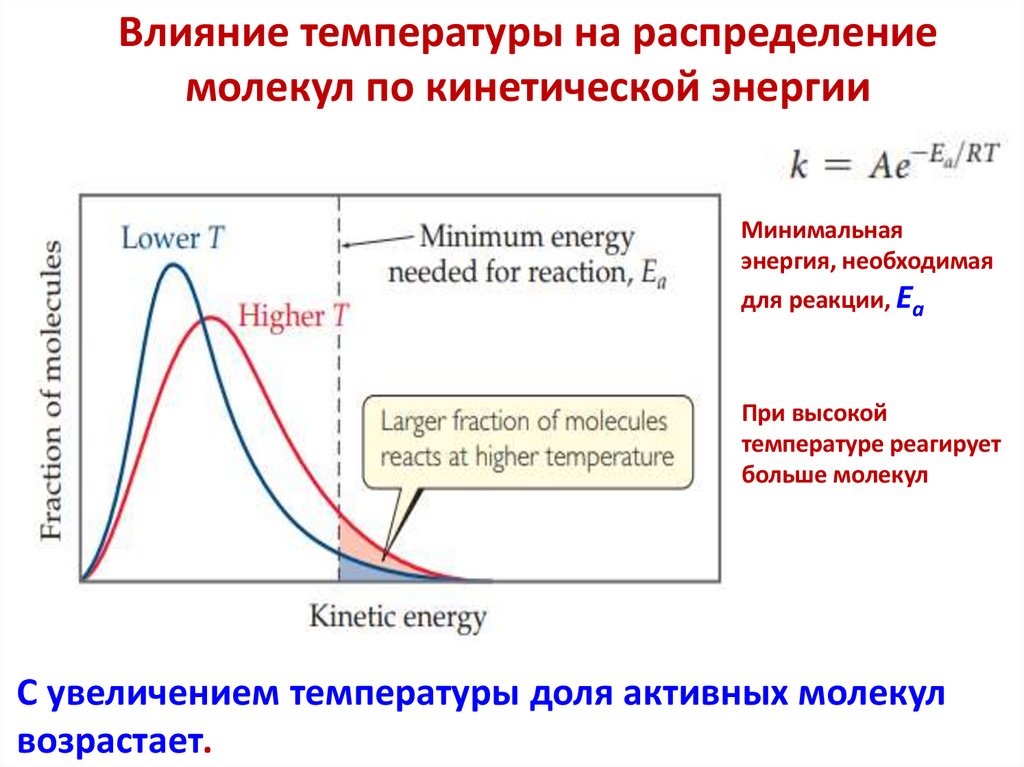
Температура
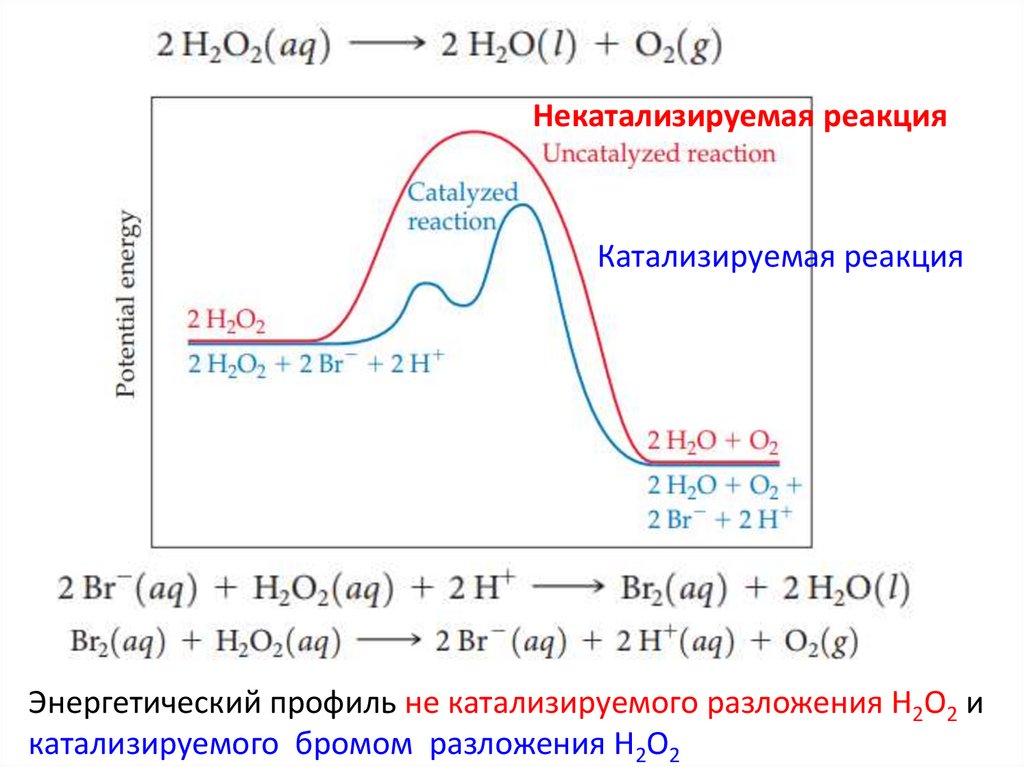
Катализатор
Закон Вант-Гоффа
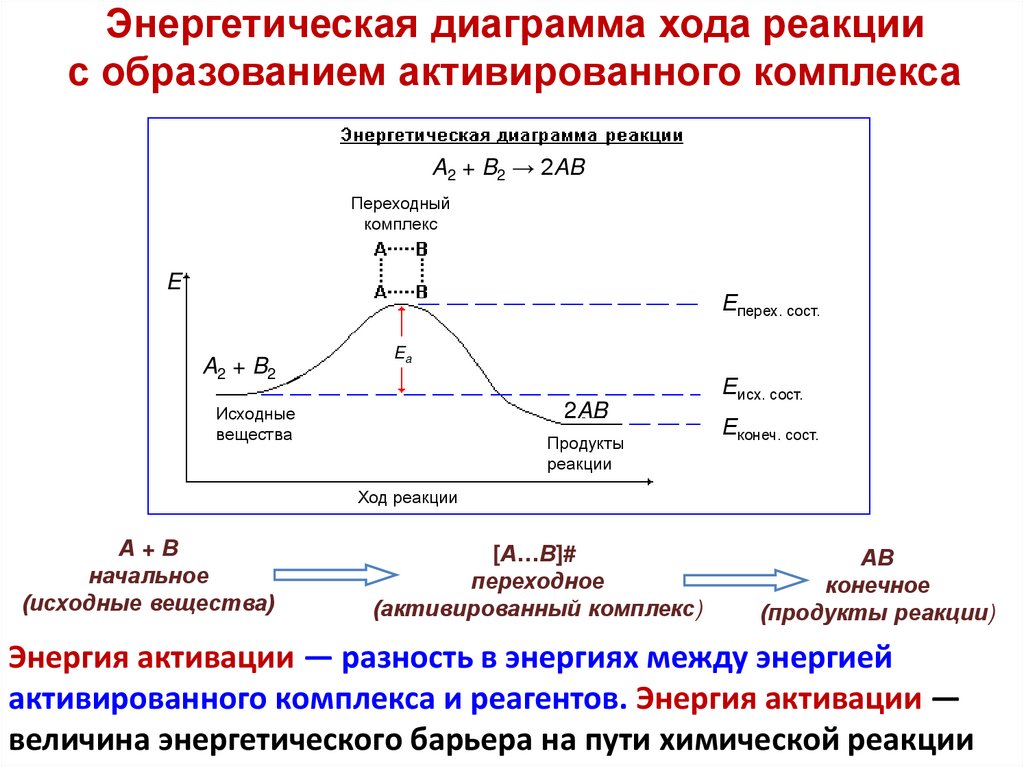
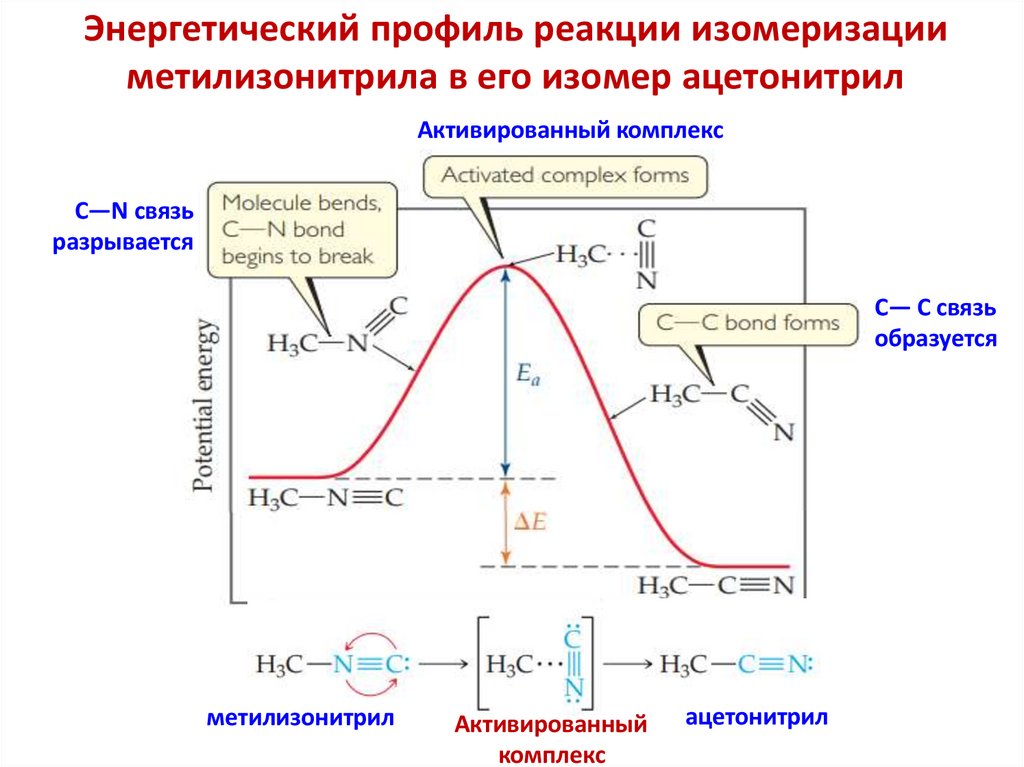
Уравнение Аррениуса. Теория
активированного комплекса
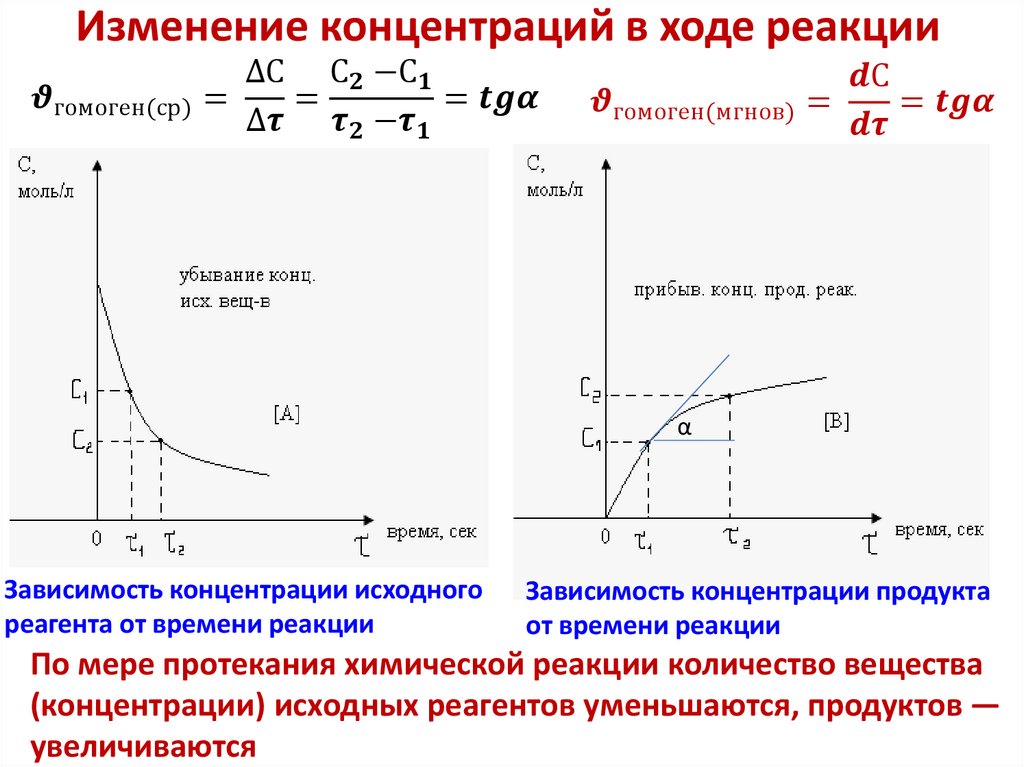
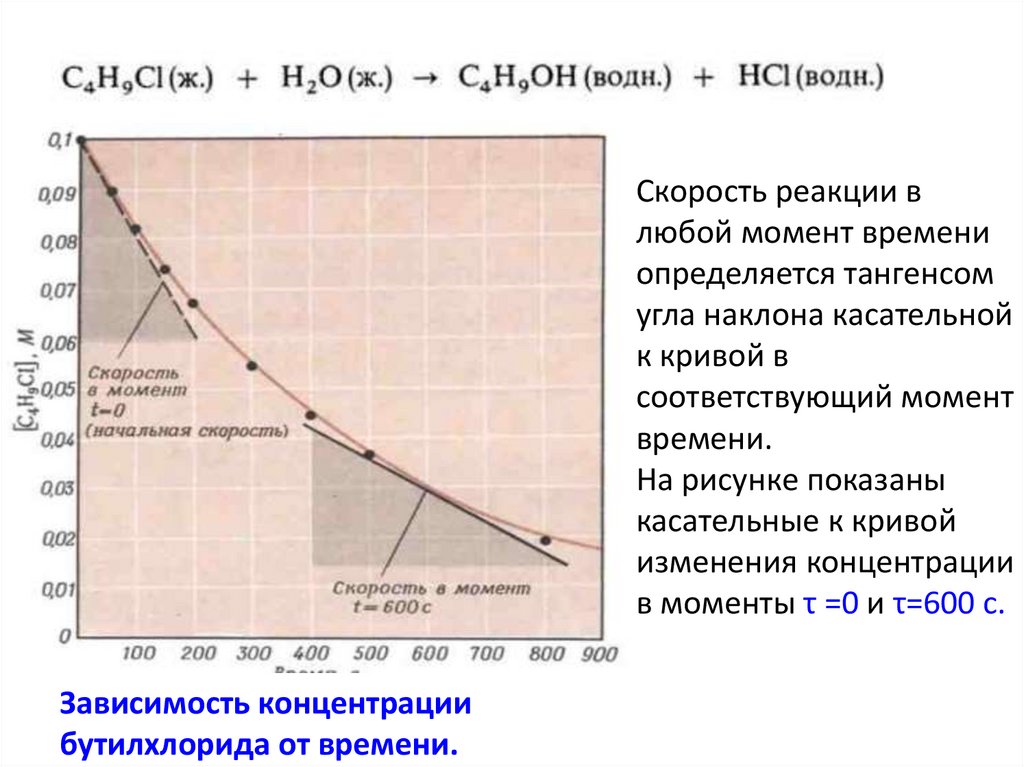
4. Скорость гомогенной реакции
• В химической кинетике различают:• 1. Гомогенные реакции – это процессы,
происходящие в одной фазе, т.е. смесь
однородная и реакция идет во всем объеме.
• СОгаз + 1/2О2газ → СО2газ
• NaOHр-р + HClр-р → NaClр-р + Н2О
• 2. Гетерогенные реакции – реагенты находятся в
разных фазах, между ними существует граница
раздела фаз: например: О2газ / Fe0тв
2Fe(тв) + O2(газ) = 2 FeO(тв)
5. Скорость гомогенной реакции
• Скорость гомогенной реакции определяетсяизменением количества вещества вступившего в
реакцию или образовавшегося в единице
объема в единицу времени:
∆