Похожие презентации:
Презентация по биологии, ариша
1.
H₂OУсловия проведения эксперимента
в естественных науках.
H₂S
2.
В химии и физике под нормальнымиусловиями (н.у.) чаще всего понимают:
· Температура: 0 °C или 273,15 К (Кельвин)
· Давление: 101 325 Па (Паскаль) или 760 мм рт. ст.
(миллиметров ртутного столба), что равно 1
атмосфере.
Почему при н.у. H_2O — жидкость,
а H_2S — газ?
Потому что в силе межмолекулярного взаимодействия,
а именно — в способности образовывать водородные
связи.
3.
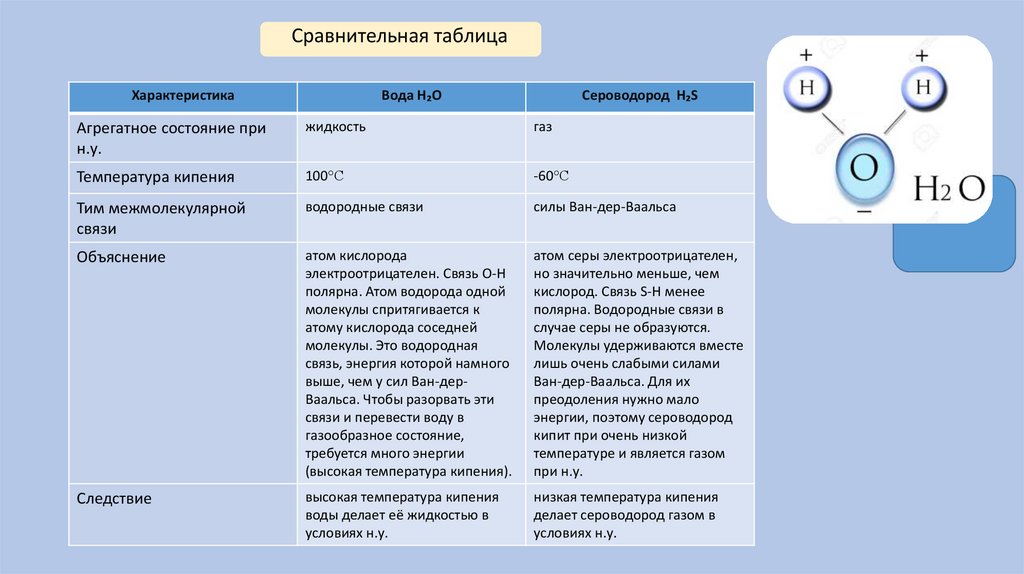
Сравнительная таблицаХарактеристика
Вода H₂O
Сероводород H₂S
Агрегатное состояние при
н.у.
жидкость
газ
Температура кипения
100°С
-60°С
Тим межмолекулярной
связи
водородные связи
силы Ван-дер-Ваальса
Объяснение
атом кислорода
электроотрицателен. Связь O-H
полярна. Атом водорода одной
молекулы спритягивается к
атому кислорода соседней
молекулы. Это водородная
связь, энергия которой намного
выше, чем у сил Ван-дерВаальса. Чтобы разорвать эти
связи и перевести воду в
газообразное состояние,
требуется много энергии
(высокая температура кипения).
атом серы электроотрицателен,
но значительно меньше, чем
кислород. Связь S-H менее
полярна. Водородные связи в
случае серы не образуются.
Молекулы удерживаются вместе
лишь очень слабыми силами
Ван-дер-Ваальса. Для их
преодоления нужно мало
энергии, поэтому сероводород
кипит при очень низкой
температуре и является газом
при н.у.
Следствие
высокая температура кипения
воды делает её жидкостью в
условиях н.у.
низкая температура кипения
делает сероводород газом в
условиях н.у.
4.
Дополнительный важный фактор:Размер молекулы
Молекула H₂S больше и тяжелее молекулы H₂O. Если бы
все определялось только массой, то H₂S должен был бы
кипеть выше, чем вода. Но мы видим обратную картину (60°C против +100°C). Это доказывает, что решающую роль
играет не масса, а именно тип межмолекулярных сил —
водородные связи у воды.
5.
Вывод:При нормальных условиях (0°C и 1 атм) вода является
жидкостью, а сероводород — газом, потому что молекулы
воды связаны между собой прочными водородными
связями, для разрыва которых нужна высокая температура.
Молекулы сероводорода взаимодействуют лишь слабыми
силами Ван-дер-Ваальса, которых недостаточно для
удержания вещества в жидком состоянии при нормальных
условиях.



 Химия
Химия








