Похожие презентации:
18. Общая характеристика галогенов. Химические свойства на примере хлора_0393d38f3571a237230f60d3a8042e4b
1. Галогены (солеобразующие)
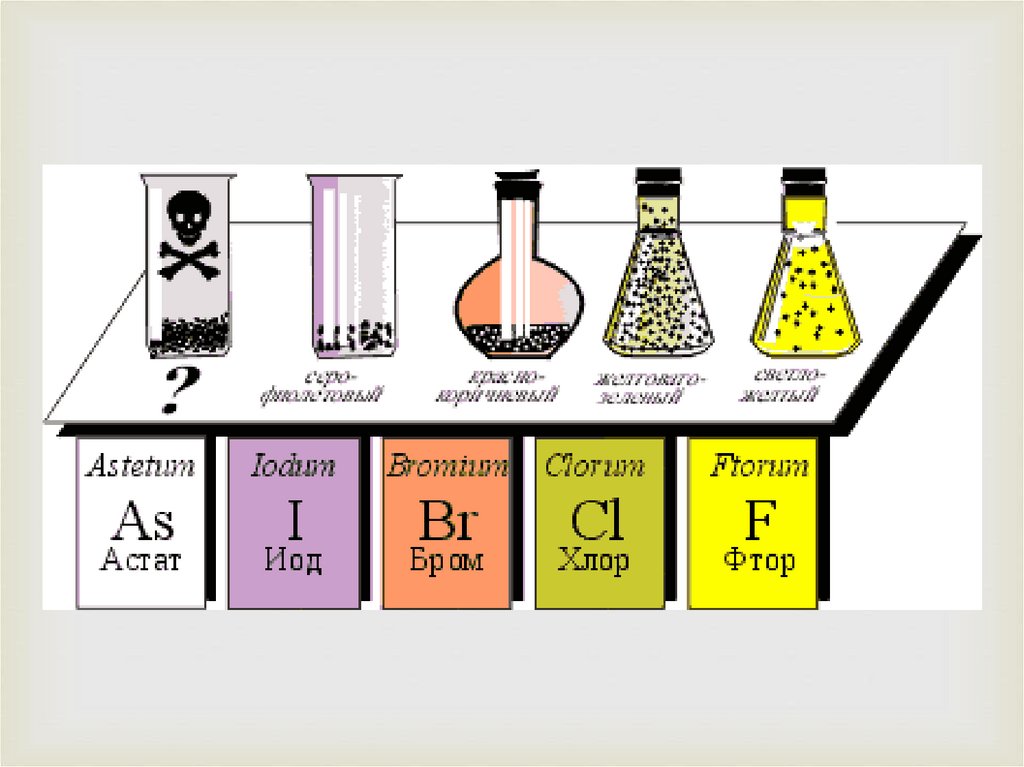
2. Открытие галогенов
Фтор в свободном виде получил впервые в 1866 г.французский химик Анри Муассан, лауреат
Нобелевской премии. Свое название элемент получил
от греч. фторос – разрушающий.
Хлор открыт шведским химиком Карлом Шееле в
1774 г. Элемент получил название за свой цвет ( от
греч. хлорос – желто - зеленый).
Бром открыт в 1826 г. французским химиком
Антуаном Баларом. Элемент назван так за свой запах
(греч. бромос – зловонный).
Йод получен в 1811 г. французским ученым
Бернаром Куртуа, а название получил за цвет своих
паров (греч. иодэс – фиолетовый).
3.
Нахождение в природеИз-за высокой химической активности галогены
в природе в свободном виде не встречаются.
CaF2 плавиковый шпат
Соединения
галогенов
NaCI•KCI сильвинит
NaCI каменная соль
KIO3 , KIO4 в залежах
селитры, в морских
растениях
4.
ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВГалогены – это естественная группа элементов ,
расположенных в главной подгруппе VII группы.
Фтор (F), хлор(Cl), бром (Br), йод (I), астат
(At)
Галогены имеют степень окисления
+1,+3,+5,+7, -1
У фтора только -1
В природе наиболее распространён - хлор.
Астат получен искусственным путём.
5.
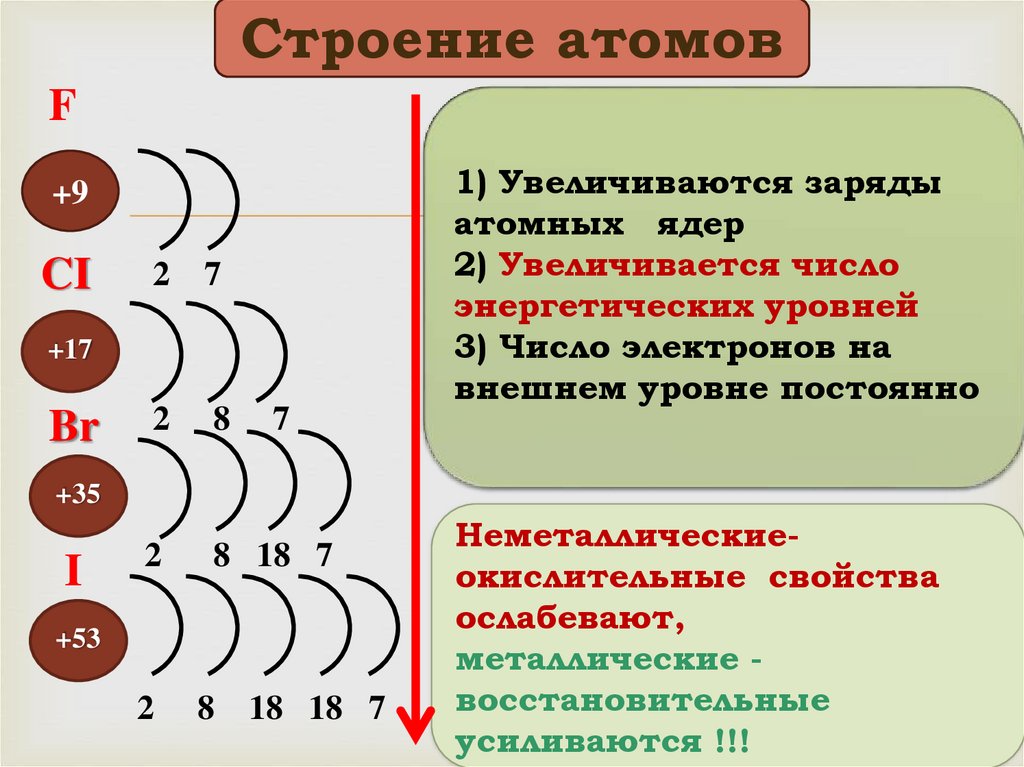
Строение атомовF
CI
2
7
2
8
2
8 18 7
2
8
+17
Br
1) Увеличиваются заряды
атомных ядер
2) Увеличивается число
энергетических уровней
3) Число электронов на
внешнем уровне постоянно
+9
7
+35
I
+53
18 18 7
Неметаллическиеокислительные свойства
ослабевают,
металлические восстановительные
усиливаются !!!
6.
Электронные формулыF 1S22S22P5
S
2
P
5
CI 1S22S22P63S23P5
Br
…4S24P5
I
…5S25P5
Вывод:
галогены - р - элементы
На внешнем энергетическом
уровне 7 электронов, один из
них неспаренный .
7.
?Химическая связь
.. ..
.. ..
.
.
:Г
+
Г:
→
:Г(:)
Г:
.. ..
.. ..
Ковалентная
неполярная
Кристаллическая
решетка
молекулярная
8.
9.
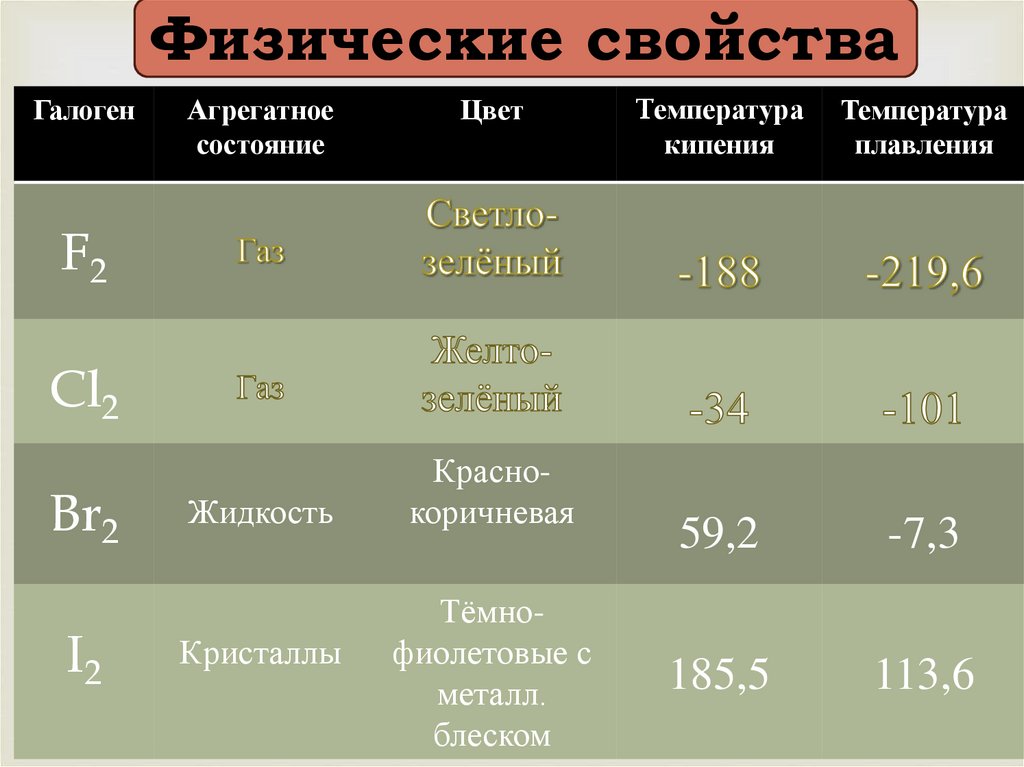
Физические свойстваГалоген
Агрегатное
состояние
Цвет
Tемпература
кипения
Температура
плавления
59,2
-7,3
185,5
113,6
F2
Cl2
Br2
I2
Жидкость
Кристаллы
Краснокоричневая
Тёмнофиолетовые с
металл.
блеском
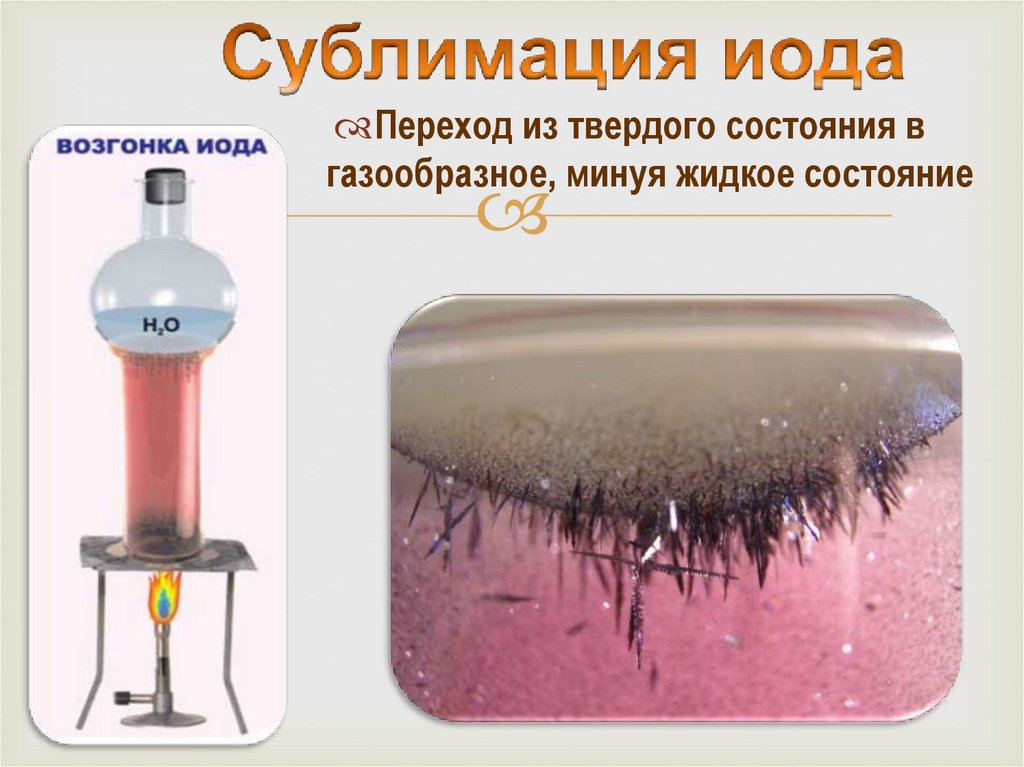
10.
Переход из твердого состояния вгазообразное, минуя жидкое состояние
11.
Химические свойства1.Взаимодействие с металлами
+1 -1
2 Na0 + CI20 = 2 NaCI
CI20 окислитель
Получаются соли: фториды, хлориды,
бромиды, йодиды.
12.
Что являетсяокислителем?
13.
2.Взаимодействие с водородомН20 + Г20 = 2Н+ Г-
Н20 + F20 = 2НF
Н20 + CI20 = 2НCI
Н20 + Br20 = 2НBr
Н20 + I20 = 2НI
14.
3.Взаимодействие с водойCI2 + H2O = HCI + HCIO
Соляная
кислота
Хлорноватистая
кислота
2F2 + 2Н2 О = 4НF + О2
Плавиковая кислота
15.
4.Взаимодействие с растворами солейгалогенов:
F2
CI2
Br2
I2
CI2 + 2NaI = 2 NaCl + I2
Br2 + 2NaI = 2 NaBr + I2
16.
Применение галогенов17.
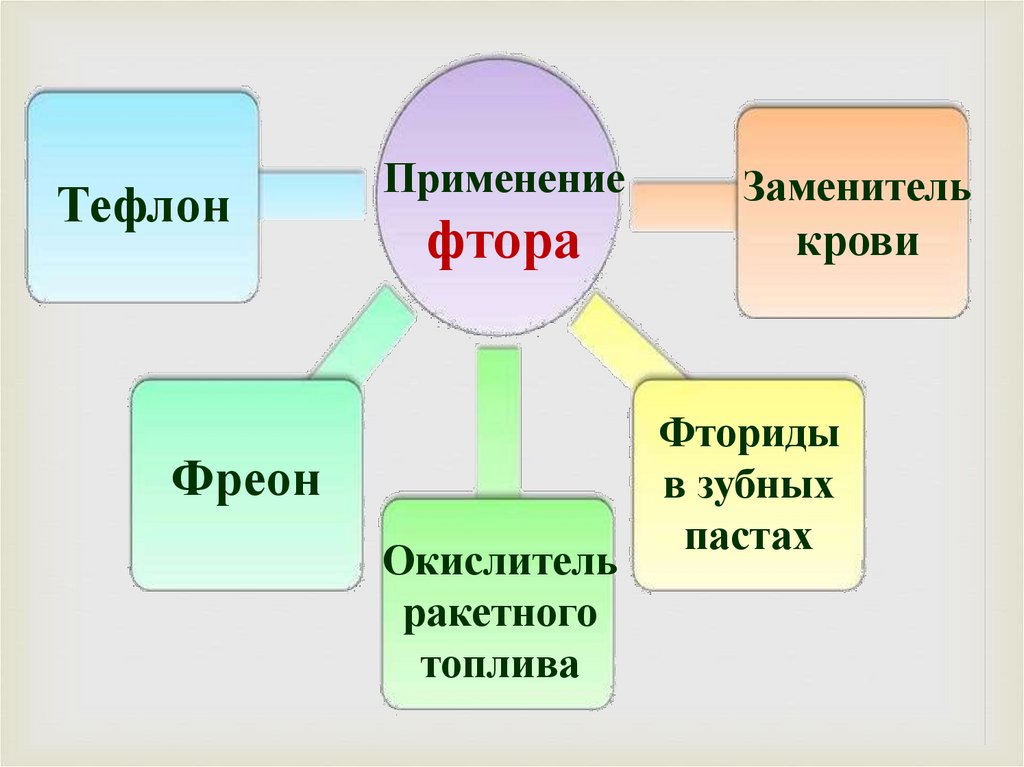
ТефлонПрименение
фтора
Фреон
Окислитель
ракетного
топлива
Заменитель
крови
Фториды
в зубных
пастах
18.
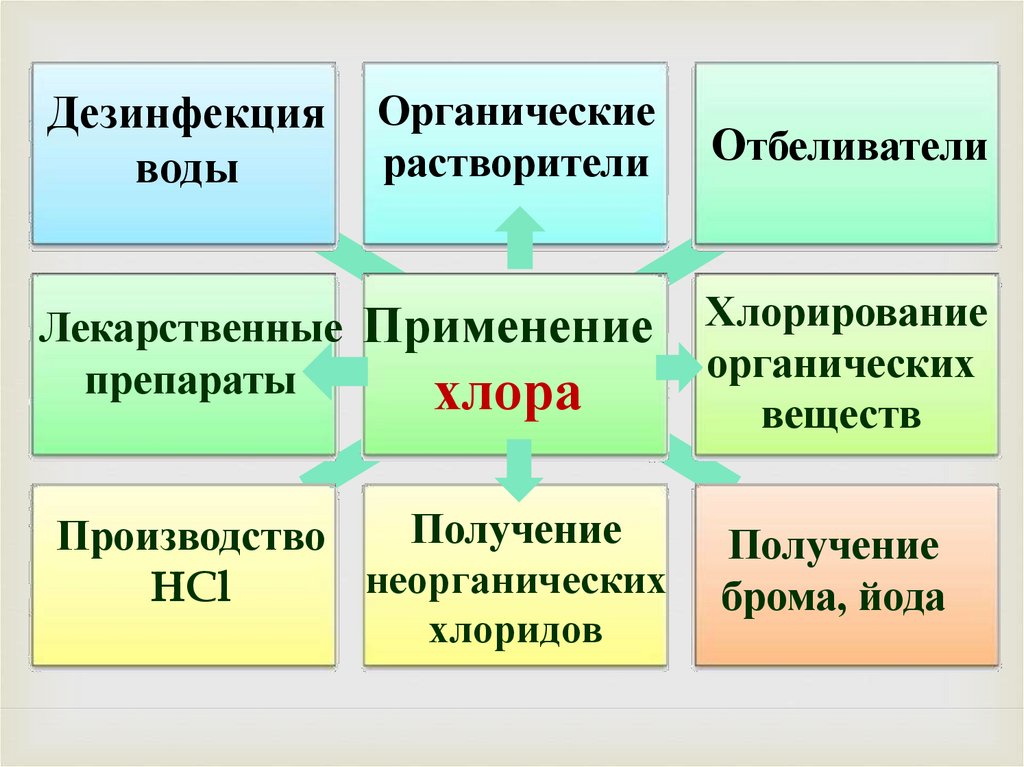
Органическиерастворители
Отбеливатели
Лекарственные Применение
препараты
хлора
Хлорирование
органических
веществ
Получение
Производство
неорганических
HCl
хлоридов
Получение
брома, йода
Дезинфекция
воды
19.
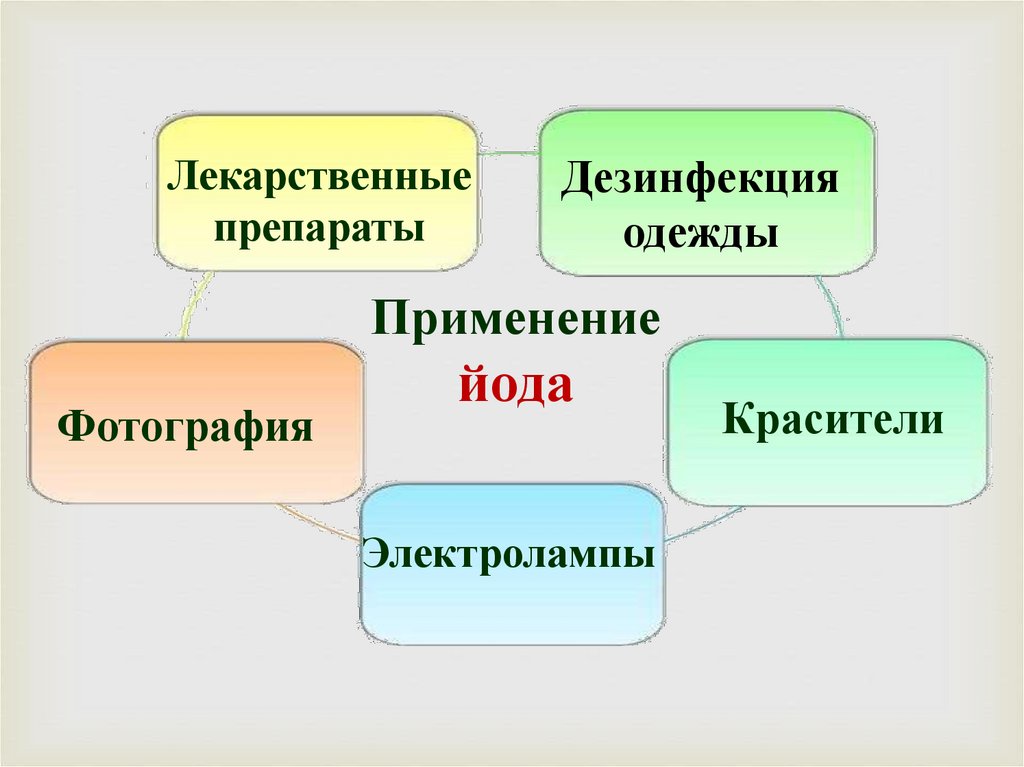
Лекарственныепрепараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
Красители







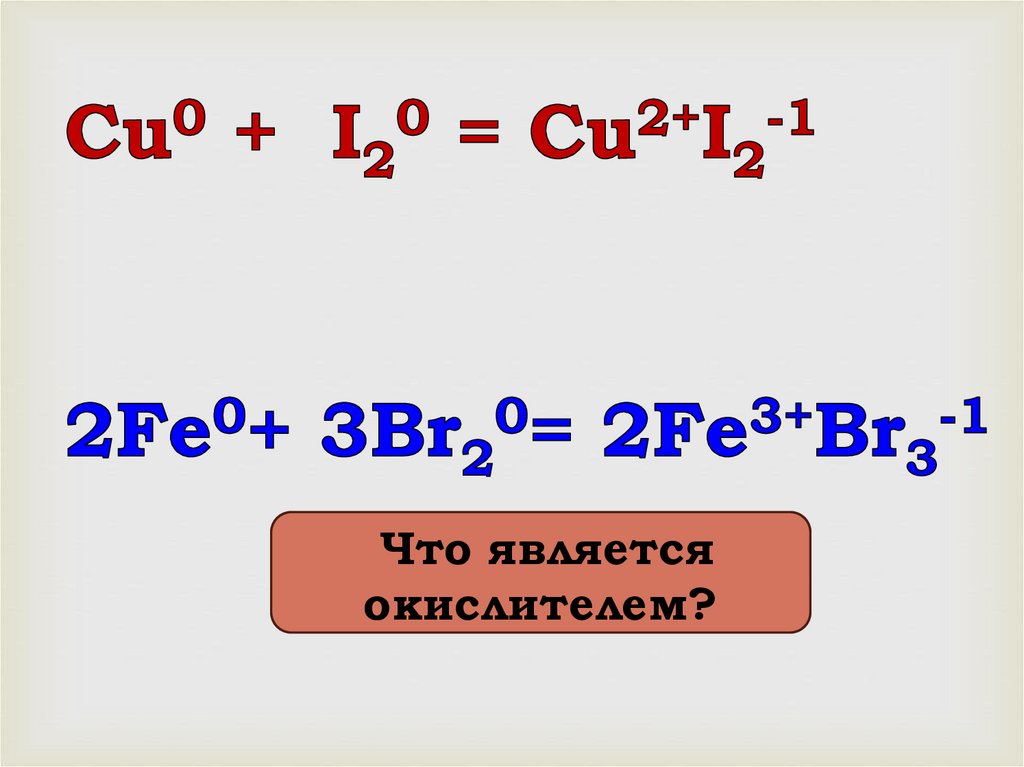




 Химия
Химия








