Похожие презентации:
АМИНОКИСЛОТЫ ИБЕЛКИ
1. СтГМУ кафедра общей и биологической химии
ЛЕКЦИЯАминокислоты и
белки
2. План лекции:
1. Классификация аминокислот2. Стереоизомерия аминокислот
3. Химические свойства аминокислот
4. Метаболические реакции
аминокислот
5. Пептиды и белки
3. Аминокислоты
- это органические гетерофункциональные соединения вещества,содержащие карбоксильную -СООН и амино -NН2 -группы.
Общая формула α-аминокислоты
H2N
α
СН СООН
R
В состав белков входят 20 разновидностей α, L-аминокислот.
4.
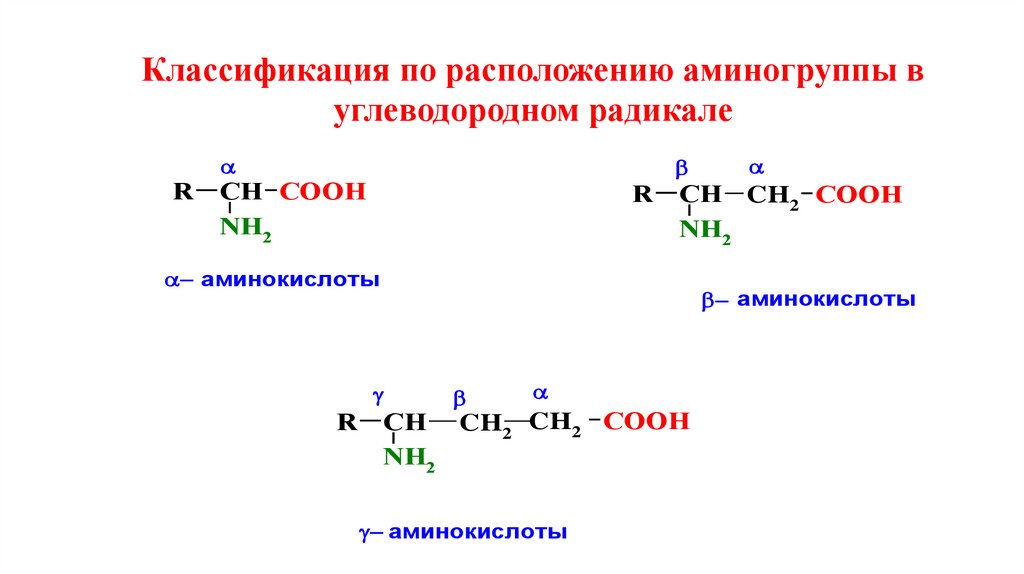
Классификация по расположению аминогруппы вуглеводородном радикале
R
СН CООН
NH2
R
СН CH2 CООН
NH2
аминокислоты
аминокислоты
R
СН CH2 CH2 CООН
NH2
аминокислоты
5.
Классификация α-аминокислот:1. По природе радикала:
● ациклические
● ароматические
● гетероциклические
2. По полярности радикала:
● полярные
● неполярные
4. По возможности биосинтеза в
организме человека:
● заменимые
● условно-заменимые (гистидин, аргинин,
тирозин)
● незаменимые (изолейцин, метионон,
фенилаланин,
триптофан, треонин, лизин, валин, лейцин)
3. По кислотно-оснóвным свойствам:
● нейтральные (моноаминомонокарбоновые,
диаминодикарбоновые)
● оснóвные (диаминомонокарбоновые)
● кислые (моноаминодикарбоновые)
5. По другим функциям:
● аминогидроксикислоты
● серусодержащие
аминокислоты
6.
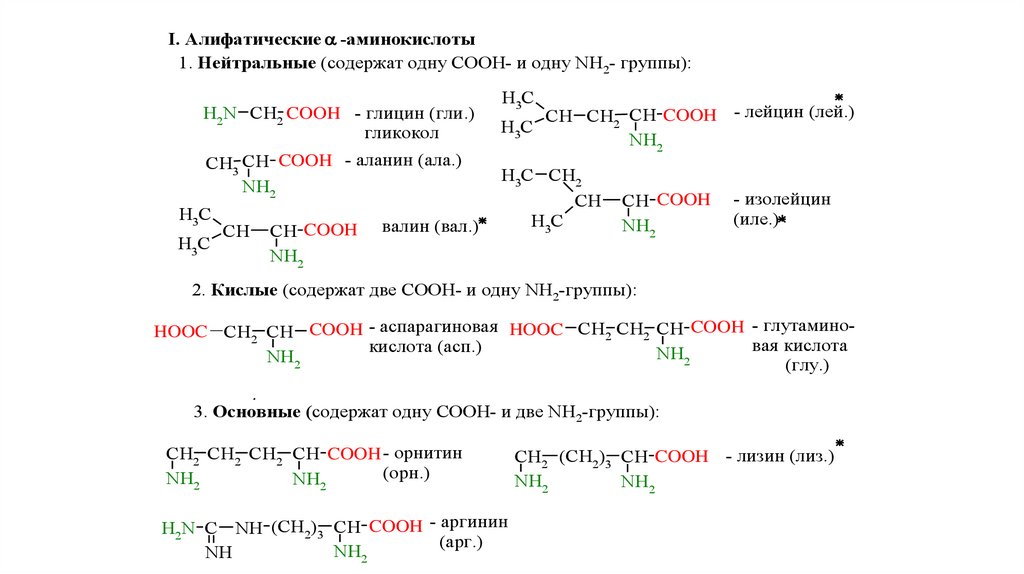
I. Алифатические -аминокислоты1. Нейтральные (содержат одну СООН- и одну NH2- группы):
H2N CH2 COOH - глицин (гли.)
гликокол
CH3 CH COOH - аланин (ала.)
NH2
H3C
H3C
CH
CH COOH
NH2
валин (вал.)
H3C
CH CH2 CH COOH - лейцин (лей.)
H3C
NH2
H3C CH2
CH
H3C
CH COOH
NH2
- изолейцин
(иле.)
2. Кислые (содержат две СООН- и одну NH2-группы):
HOOC CH2 CH COOH - аспарагиновая HOOC CH2 CH2 CH COOH - глутаминовая кислота
кислота (асп.)
NH2
NH2
(глу.)
3. Основные (содержат одну СООН- и две NH2-группы):
CH2 CH2 CH2 CH COOH - орнитин
(орн.)
NH2
NH2
H2N C NH (CH2)3 CH COOH - аргинин
(арг.)
NH2
NH
CH2 (CH2)3 CH COOH - лизин (лиз.)
NH2
NH2
7.
К группе алифатических α-аминокислот относятсягидроксиаминокислоты
(содержат дополнительно группу ОН-):
CH2 CH COOH
OH NH2 - серин (сер.)
H3C CH
OH
CH COOH
NH2 - треонин (тре.)
Серусодержащие аминокислоты
(содержат тиольную группу SH-, дисульфидную S-S):
CH2 CH COOH - цистеин (цис.)
SH NH2
CH2 CH2 CH COOH
NH2 - метионин (мет.)
SCH3
CH2 S S CH2
H2N CH
COOH
CH NH2
COOH
Цистин (цис.-S-S-цис.)
8.
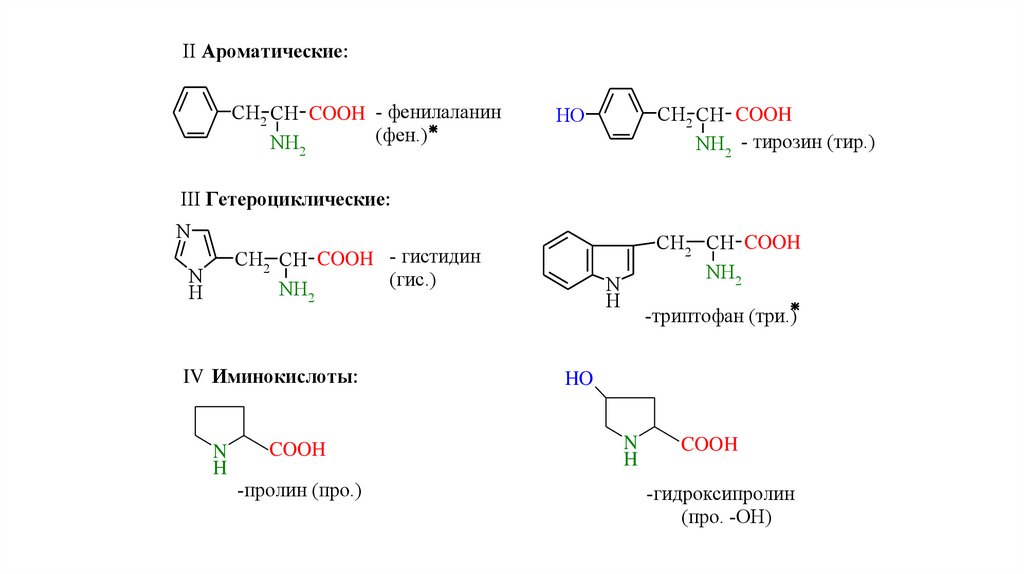
II Ароматические:CH2 CH COOH - фенилаланин
(фен.)
NH2
CH2 CH COOH
NH2 - тирозин (тир.)
HO
III Гетероциклические:
N
CH2 CH COOH - гистидин
(гис.)
NH2
N
H
IV Иминокислоты:
N
H
COOH
-пролин (про.)
CH2 CH COOH
NH2
N
H
-триптофан (три.)
HO
N
H
COOH
-гидроксипролин
(про. -ОН)
9.
Биологическая классификацияЗаменимые
1. Глицин
2. Аланин
3. Серин
4. Аспарагиновая кислота
5. Глутаминовая кислота
6. Аспарагин
7. Глутамин
8. Пролин
Условно заменимые
1. Цистеин
2. Тирозин
Абсолютно незаменимые
1. Валин
2. Лейцин
3. Изолейцин
4. Треонин
5. Метионин
6. Лизин
7. Триптофан
8. Фенилаланин
Условно незаменимые
1. Аргинин
2. Гистидин
10.
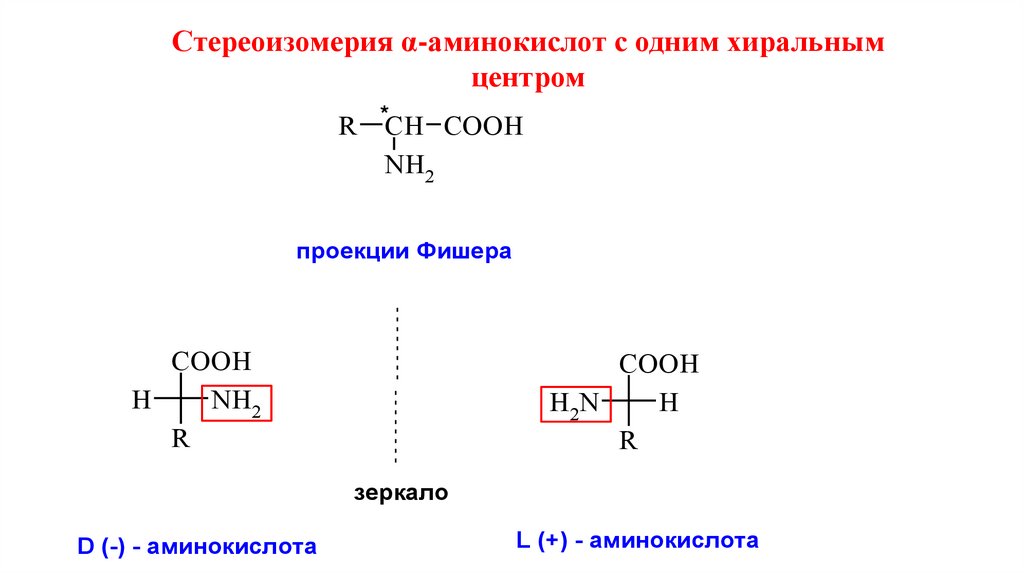
Стереоизомерия α-аминокислот с одним хиральнымцентром
R *СН CООН
NH2
проекции Фишера
COOH
H
NH2
R
COOH
H2N
H
R
зеркало
D (-) - аминокислота
L (+) - аминокислота
11.
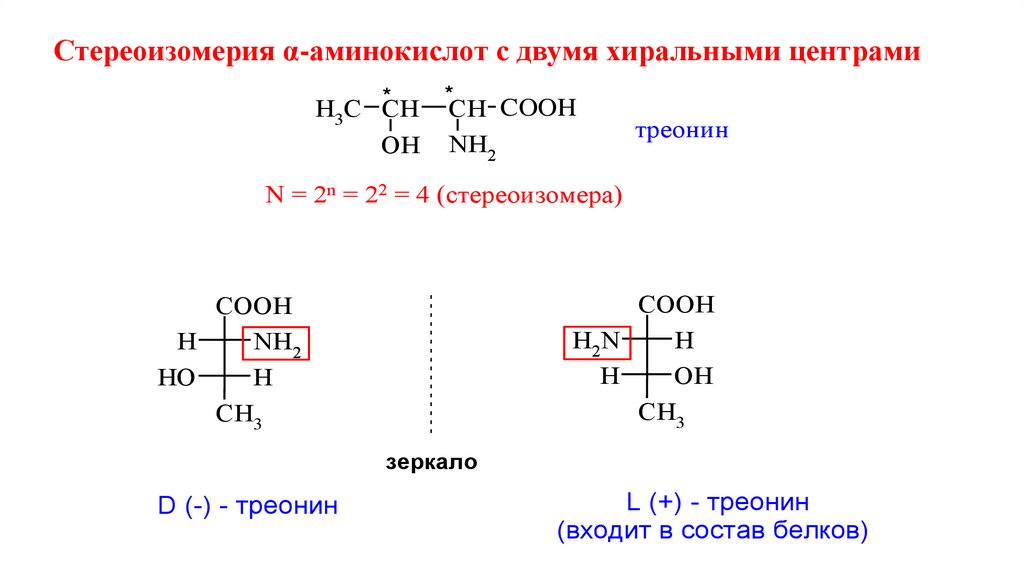
Стереоизомерия α-аминокислот с двумя хиральными центрами*
H3C CH
OH
*
CH COOH
NH2
треонин
N = 2n = 22 = 4 (стереоизомера)
COOH
H2N
H
H
OH
CH3
COOH
H
NH2
HO
H
CH3
зеркало
D (-) - треонин
L (+) - треонин
(входит в состав белков)
12.
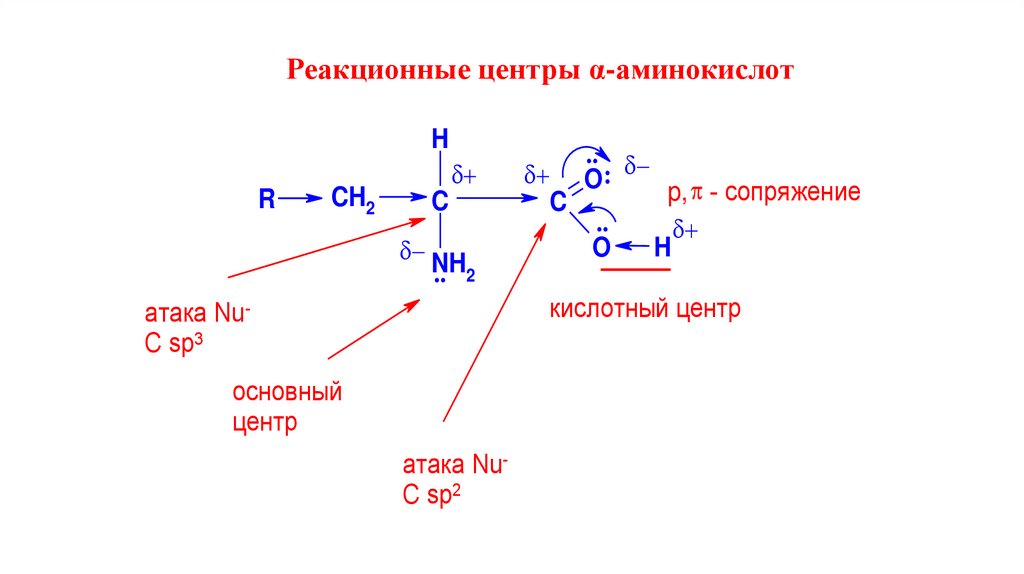
Реакционные центры α-аминокислотH
R
CH2
C
NH
.. 2
C
..
O:
p, - сопряжение
..
O
H
кислотный центр
атака NuC sp3
основный
центр
атака NuC sp2
13.
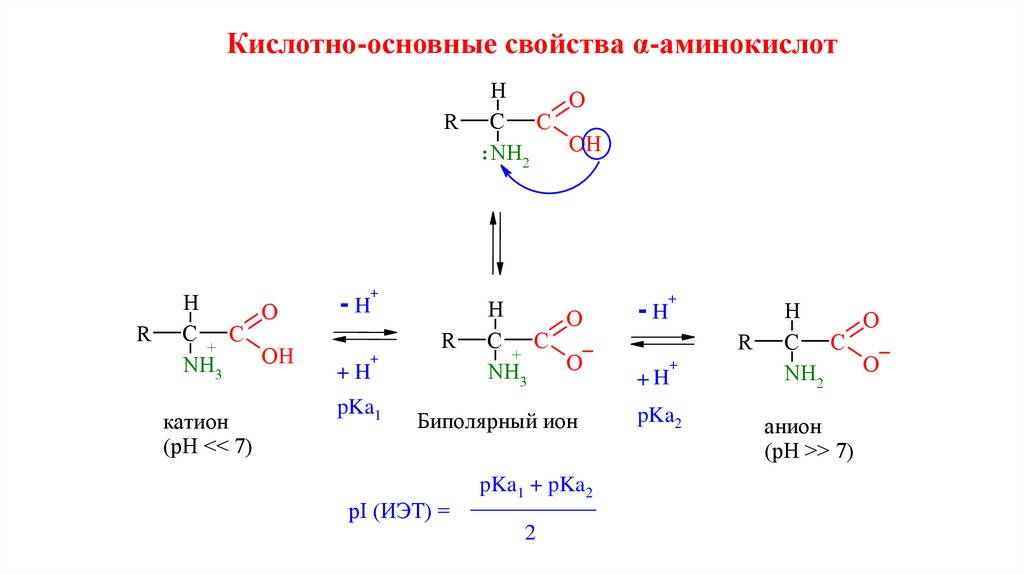
Кислотно-основные свойства α-аминокислотR
Н
O
С C
+
OH
NH3
катион
(pH << 7)
R
Н
O
С C
OH
: NH2
R
+H
Н
O
С C
+
O
NH3
+H
pKa1
Биполя рный ион
pKa2
+
-H
+
pI (ИЭТ) =
pKa1 + pKa2
2
+
-H
R
+
Н
O
С C
O
NH2
анион
(рН >> 7)
14.
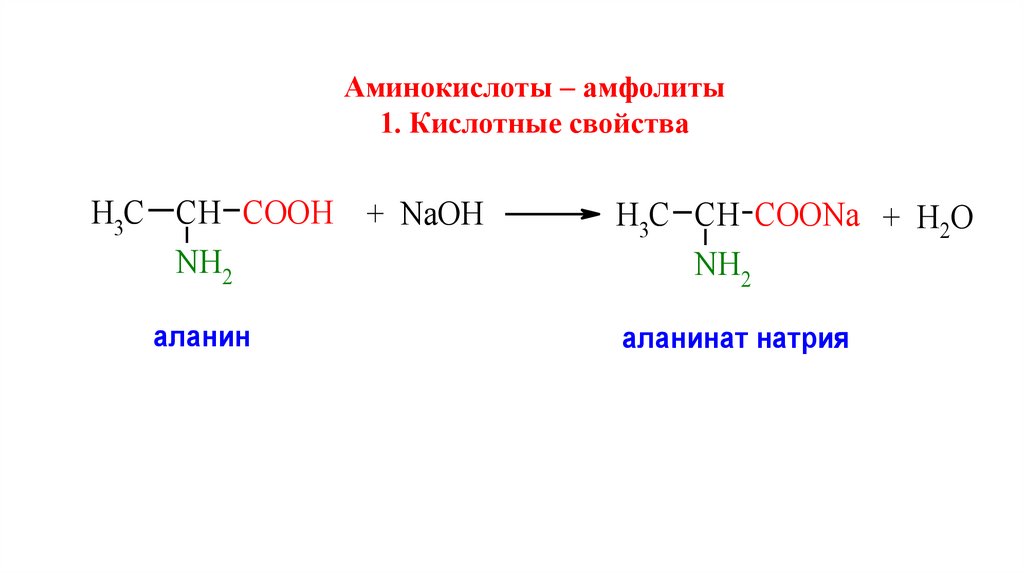
Аминокислоты – амфолиты1. Кислотные свойства
H3C СН CООН + NaOH
NH2
аланин
H3C СН CООNa + Н2О
NH2
аланинат натрия
я
15.
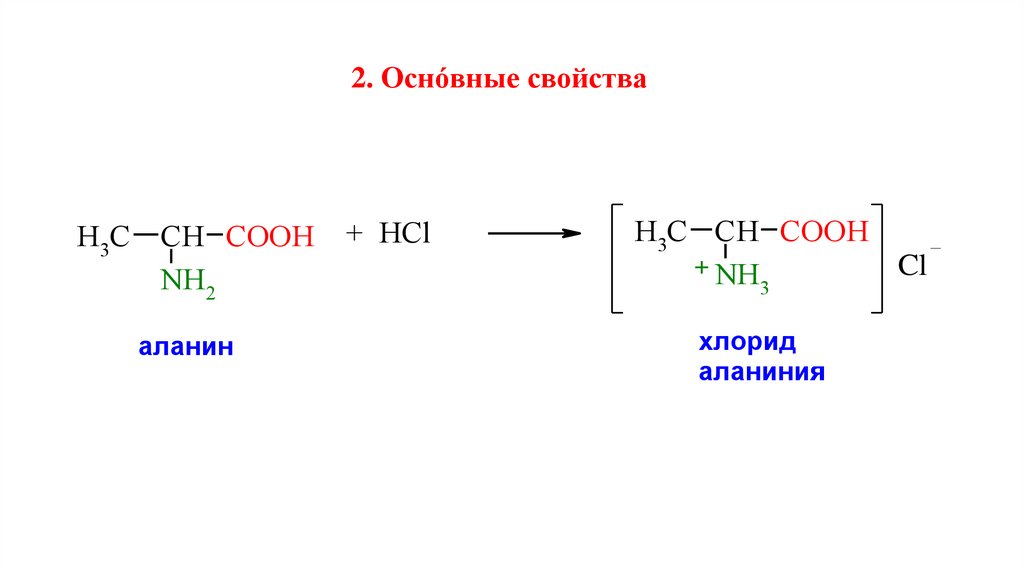
2. Оснóвные свойстваH3C СН CООН
NH2
аланин
+ HCl
H3C СН CООН
+ NH
Cl
3
хлорид
аланиния
я
16.
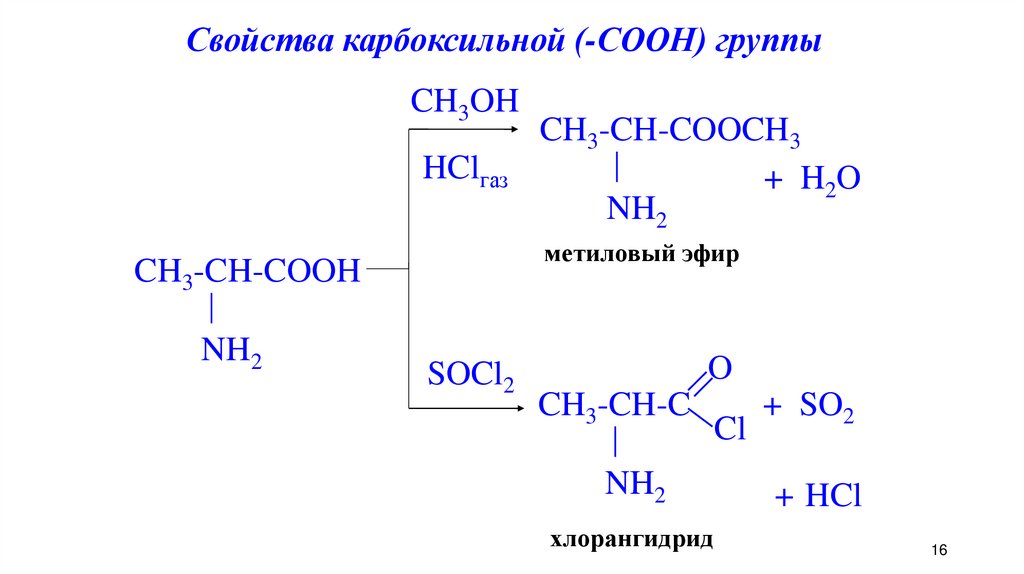
Свойства карбоксильной (-СООН) группыCH3OH
HClгаз
метиловый эфир
CH3-CH-COOH
NH2
CH3-CH-COOCH3
+ H 2O
NH2
SOCl2
O
CH3-CH-C
NH2
хлорангидрид
Cl
+ SO2
+ HCl
16
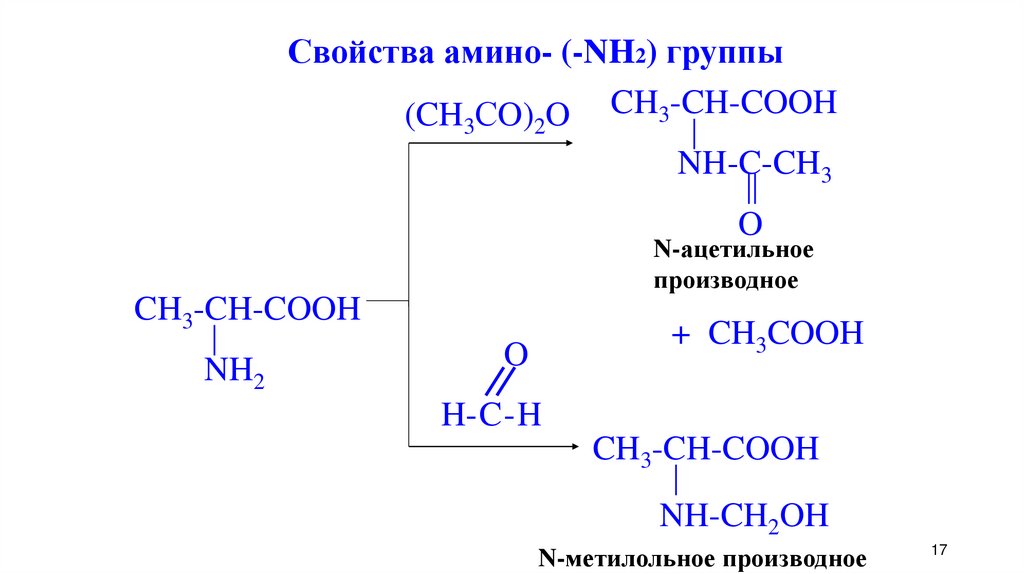
17.
Свойства амино- (-NH2) группы(CH СO) O CH3-CH-COOH
3
2
NH-C-CH3
O
N-ацетильное
производное
CH3-CH-COOH
NH2
+ CH3COOH
O
H-C-H
CH3-CH-COOH
NH-CH2OH
N-метилольное производное
17
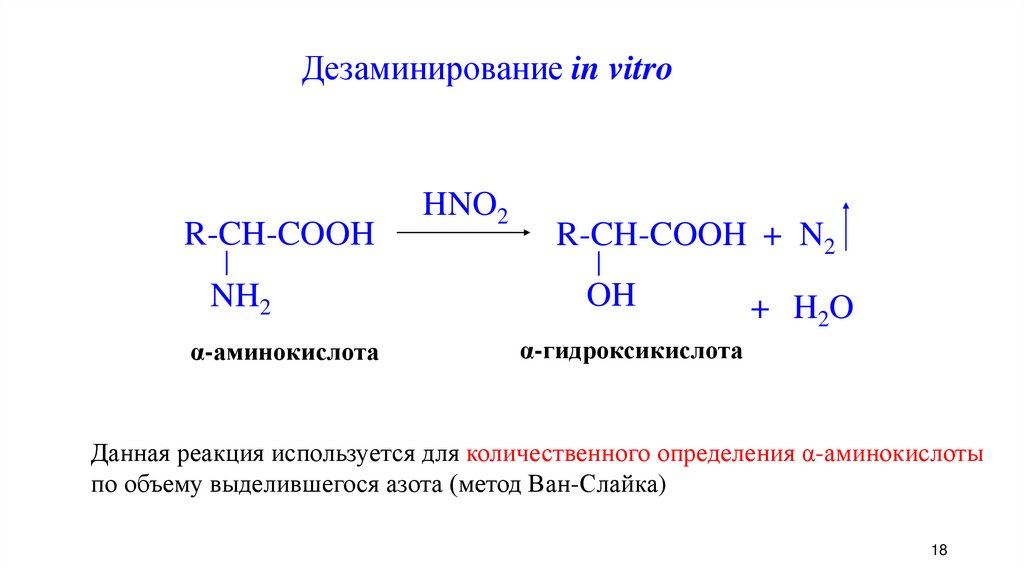
18.
Дезаминирование in vitroR-CH-COOH
NH2
α-аминокислота
HNO2
R-CH-COOH + N2
OH
+ H2O
α-гидроксикислота
Данная реакция используется для количественного определения α-аминокислоты
по объему выделившегося азота (метод Ван-Слайка)
18
19.
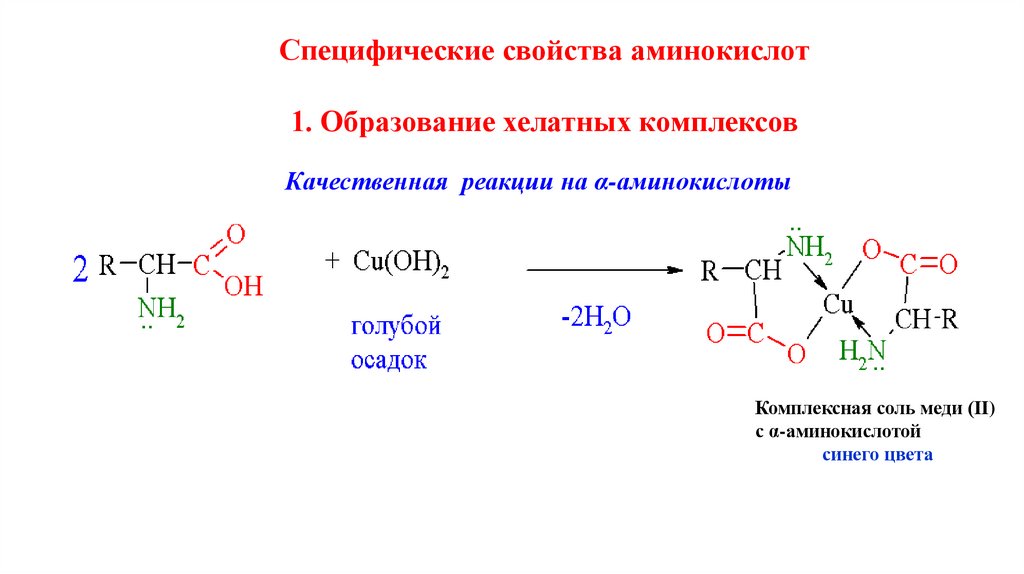
Специфические свойства аминокислот1. Образование хелатных комплексов
Качественная реакции на α-аминокислоты
Комплексная соль меди (II)
с α-аминокислотой
синего цвета
20.
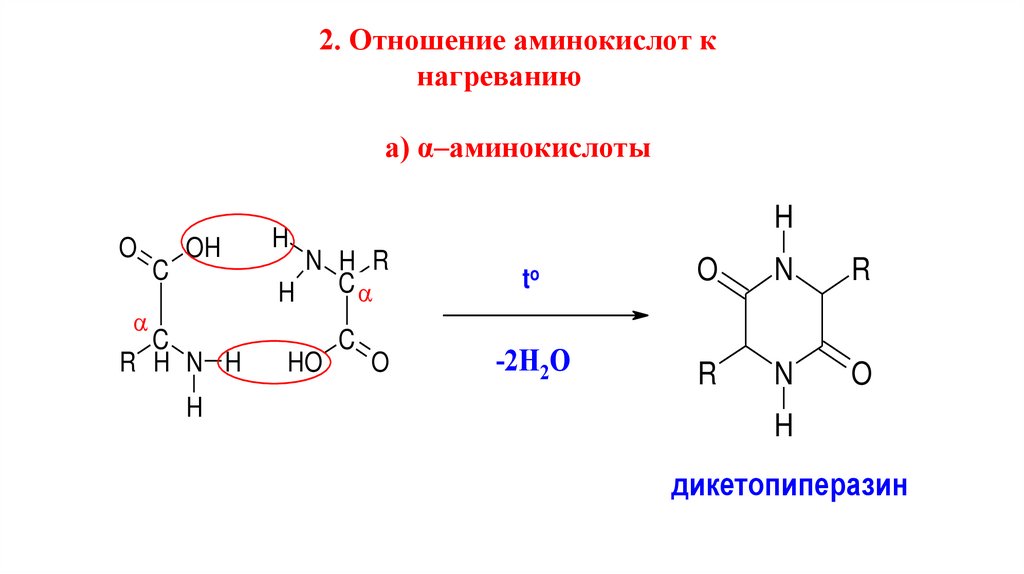
2. Отношение аминокислот кнагреванию
а) α–аминокислоты
O
C
OH
C
R H N H
H
H
H
N H R
C
H
HO
C
O
to
O
N
R
-2Н2О
R
N
O
H
дикетопиперазин
21.
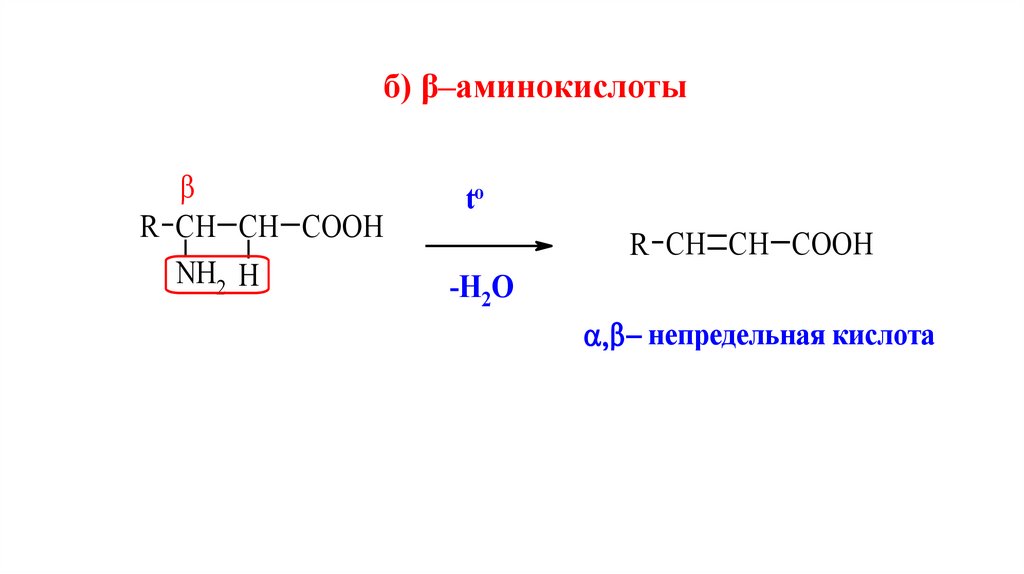
б) β–аминокислотыR СН СН СООН
NH2 Н
to
R СН СН СООН
-H2O
непредельная кислота
22.
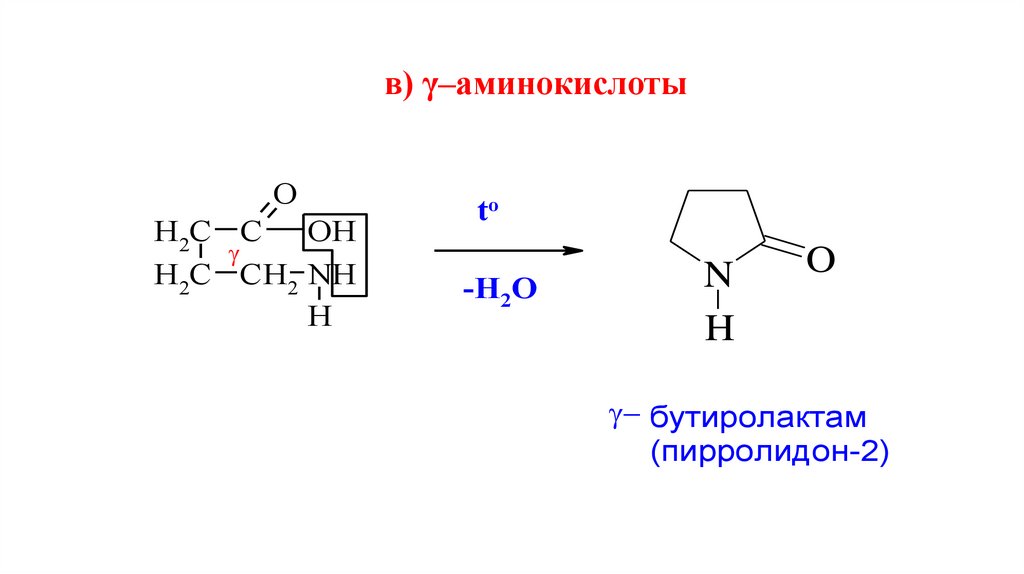
в) γ–аминокислотыO
H2C C OH
H2C CH2 NH
H
to
-H2O
N
H
O
бутиролактам
(пирролидон-2)
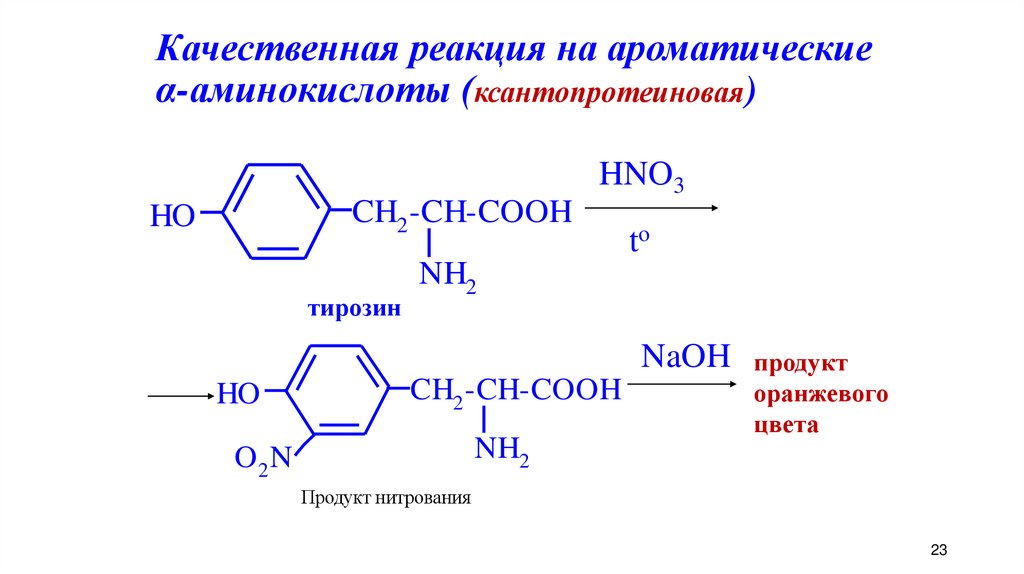
23. Качественная реакция на ароматические α-аминокислоты (ксантопротеиновая)
HNO3CH2 -CH-COOH
HO
тирозин
to
NH2
NaOH продукт
HO
CH2 -CH-COOH
NH2
O2 N
оранжевого
цвета
Продукт нитрования
23
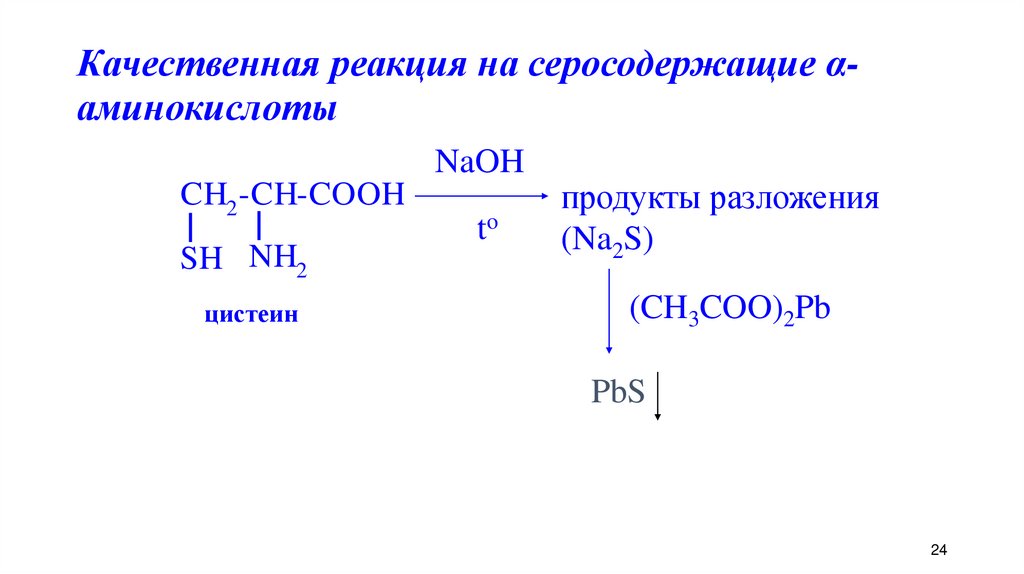
24. Качественная реакция на серосодержащие α-аминокислоты
Качественная реакция на серосодержащие αаминокислотыNaOH
CH2 -CH-COOH
SH NH2
цистеин
to
продукты разложения
(Na2S)
(CH3COO)2Pb
PbS
24
25.
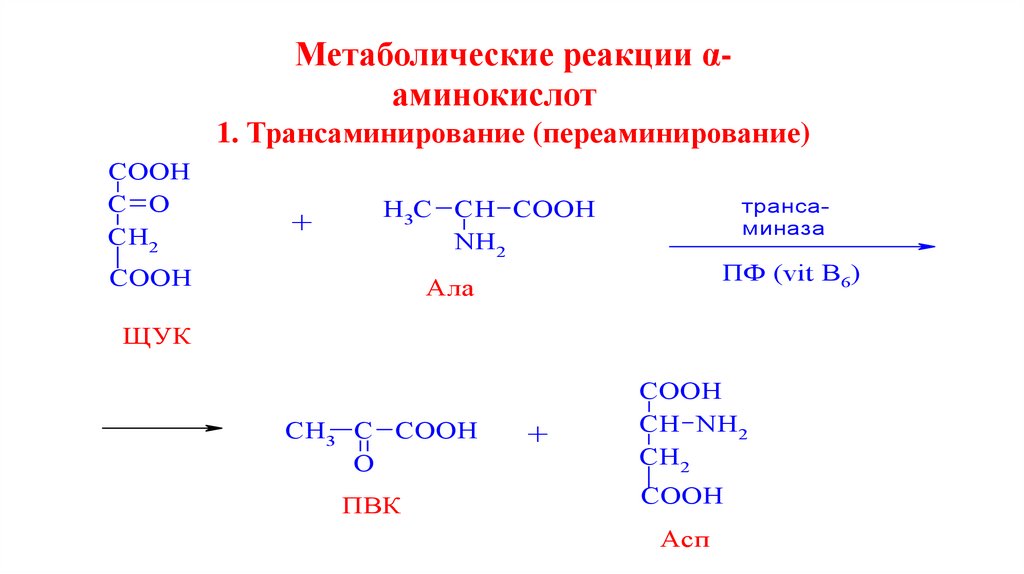
Метаболические реакции αаминокислот1. Трансаминирование (переаминирование)
COOH
C O
CH2
+
трансаминаза
H3C CH COOH
NH2
COOH
ПФ (vit B6)
Ала
ЩУК
СН3 С СООН
O
ПВК
+
COOH
CH NH2
CH2
COOH
Асп
26.
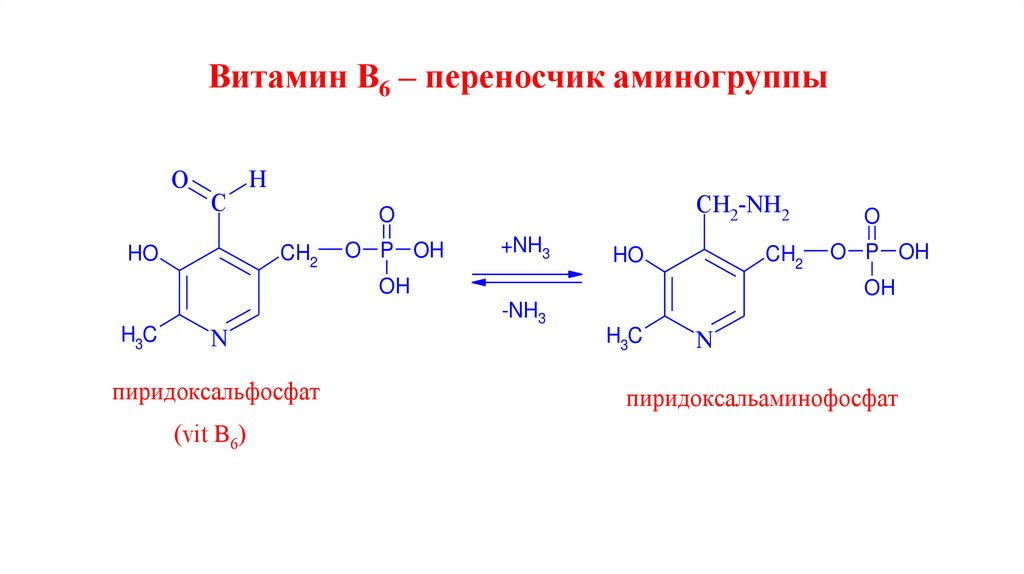
Витамин В6 – переносчик аминогруппыO
C
H
CH2
HO
CH2-NH2
O
O P OH
+NH3
CH2
HO
OH
H3C
N
пиридоксальфосфат
(vit B6)
O
O P OH
OH
-NH3
H3C
N
пиридоксальаминофосфат
27.
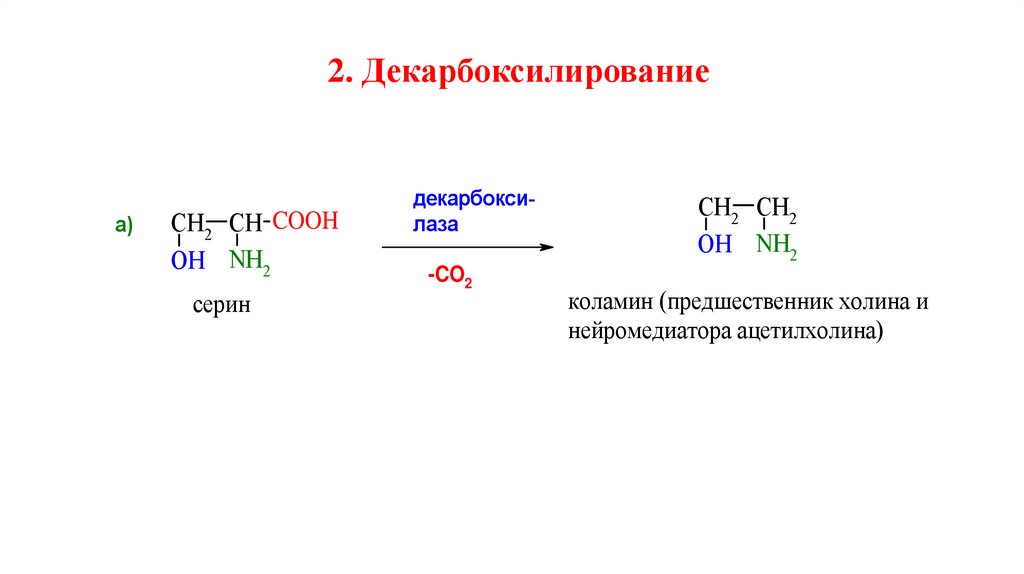
2. Декарбоксилированиеа)
CH2 CH COOH
OH NH2
серин
декарбоксилаза
-CO2
CH2 CH2
OH NH2
коламин (предшественник холина и
нейромедиатора ацетилхолина)
28.
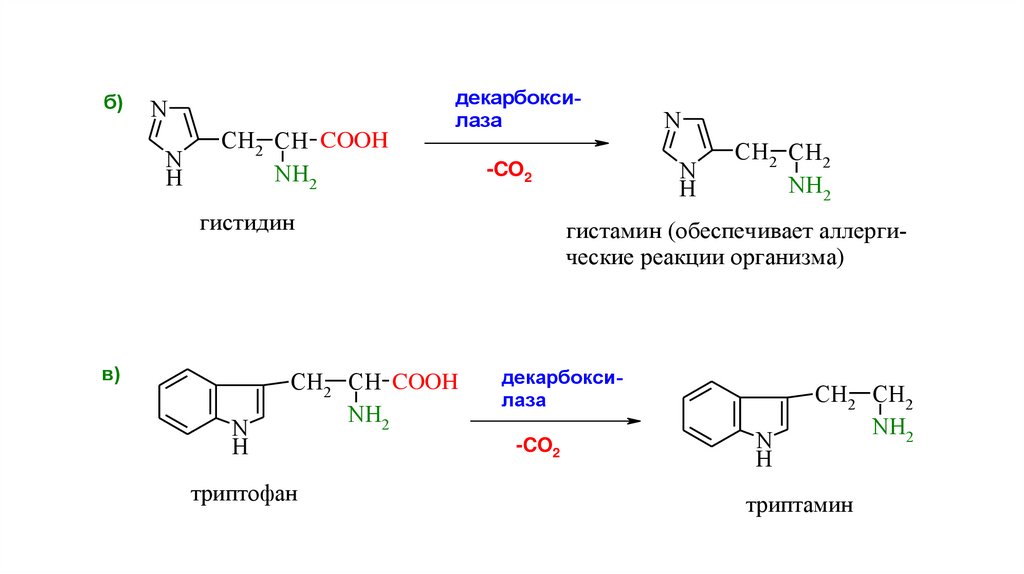
б)N
N
H
CH2 CH COOH
NH2
декарбоксилаза
в)
N
H
CH2 CH COOH
NH2
триптофан
N
H
-CO2
гистидин
N
CH2 CH2
NH2
гистамин (обеспечивает аллергические реакции организма)
декарбоксилаза
-CO2
N
H
CH2 CH2
NH2
триптамин
29.
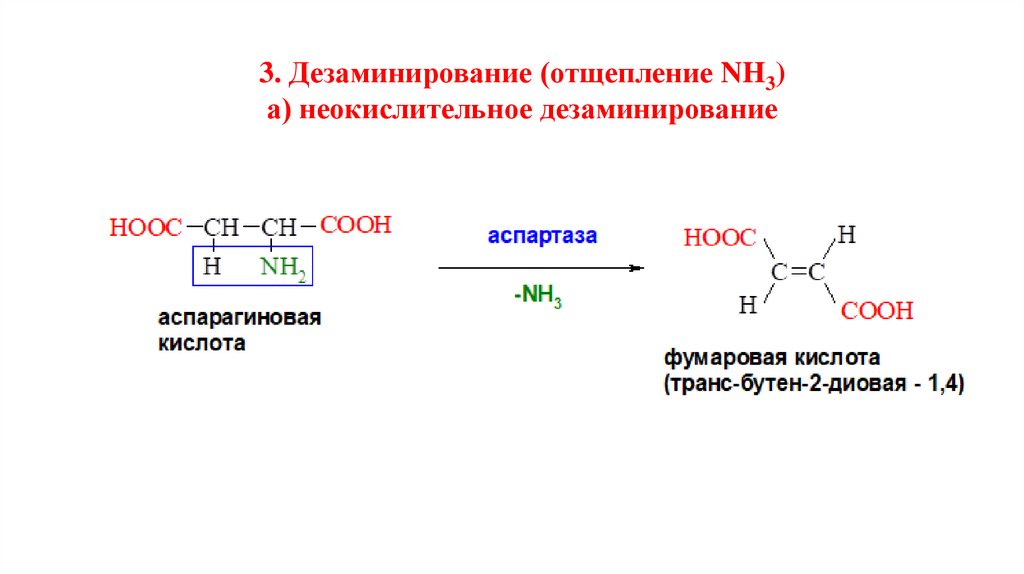
3. Дезаминирование (отщепление NH3)а) неокислительное дезаминирование
30.
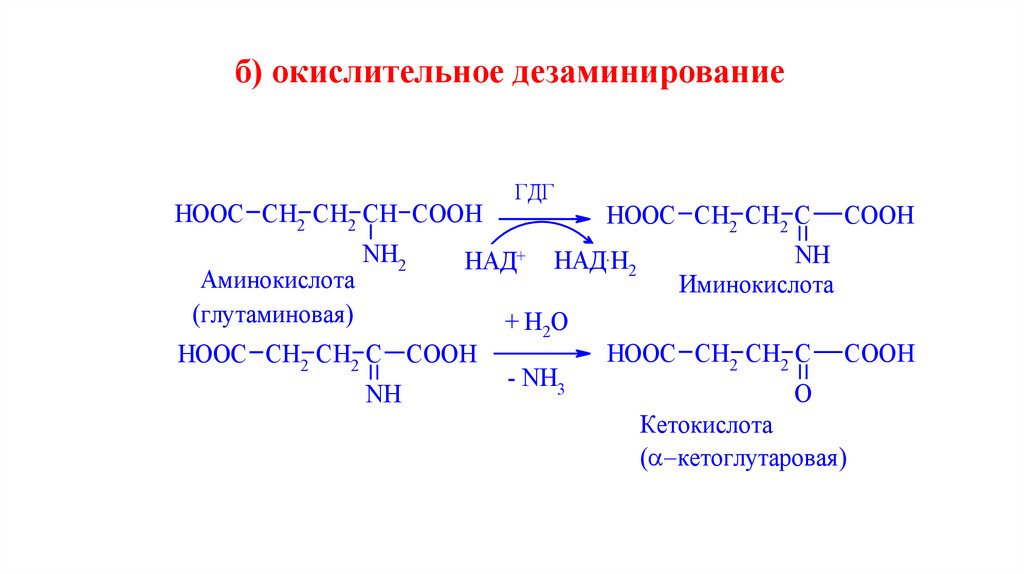
б) окислительное дезаминированиеHOOC СН2 СН2 СН COOH
Аминокислота
(глутаминовая )
NH2
НАД+
HOOC СН2 СН2 С COOH
NH
ГДГ
HOOC СН2 СН2 С
НАД.Н2
+ H2O
- NH3
COOH
NH
Иминокислота
HOOC СН2 СН2 С
COOH
O
Кетокислота
( кетоглутаровая )
31.
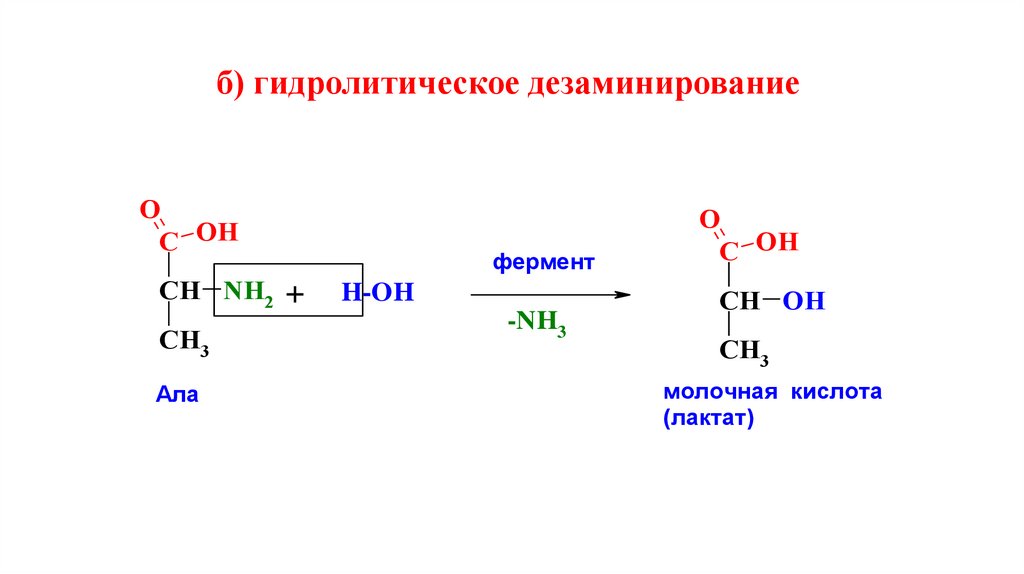
б) гидролитическое дезаминированиеO
C OH
CH NH2 +
CH3
Ала
фермент
H-OH
-NH3
O
C OH
CH OH
CH3
молочная кислота
(лактат)
32.
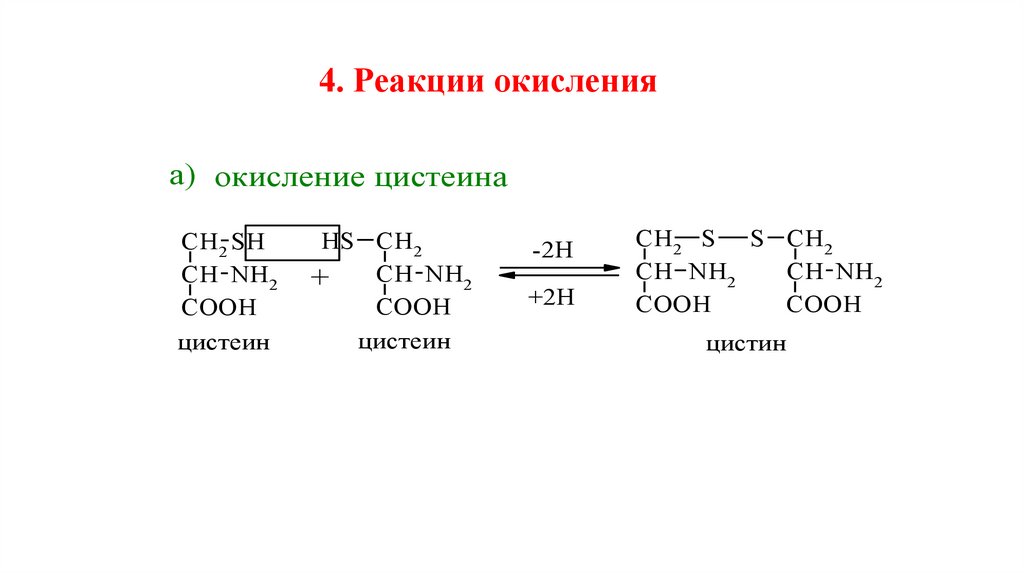
4. Реакции окисленияа) окисление цистеина
CH2 SH
CH NH2
COOH
цистеин
HS CH2
CH NH2
+
COOH
цистеин
-2Н
+2Н
CH2 S S CH2
CH NH2
CH NH2
COOH
COOH
цистин
33.
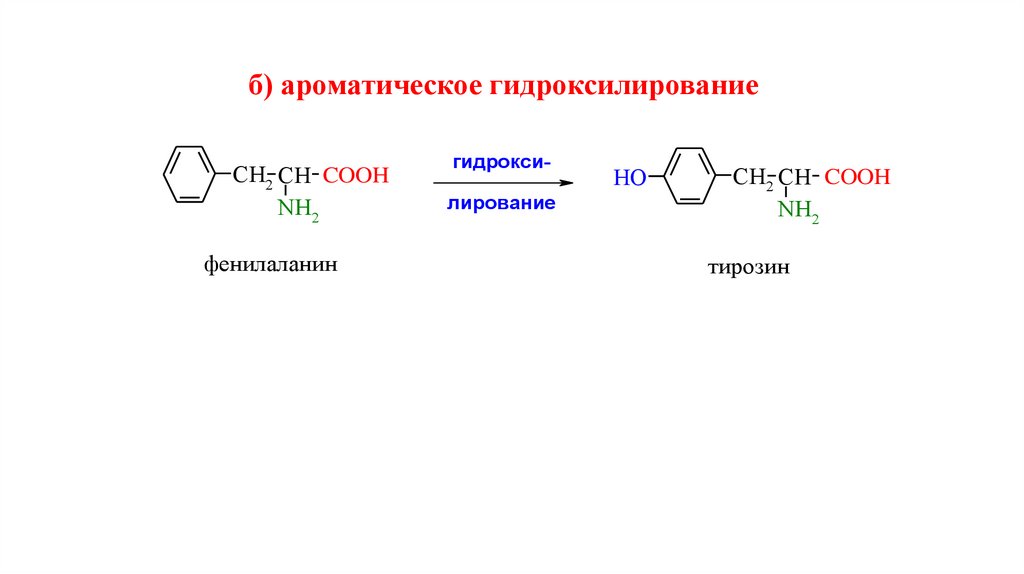
б) ароматическое гидроксилированиеCH2 CH COOH
NH2
фенилаланин
гидроксилирование
HO
CH2 CH COOH
NH2
тирозин
34.
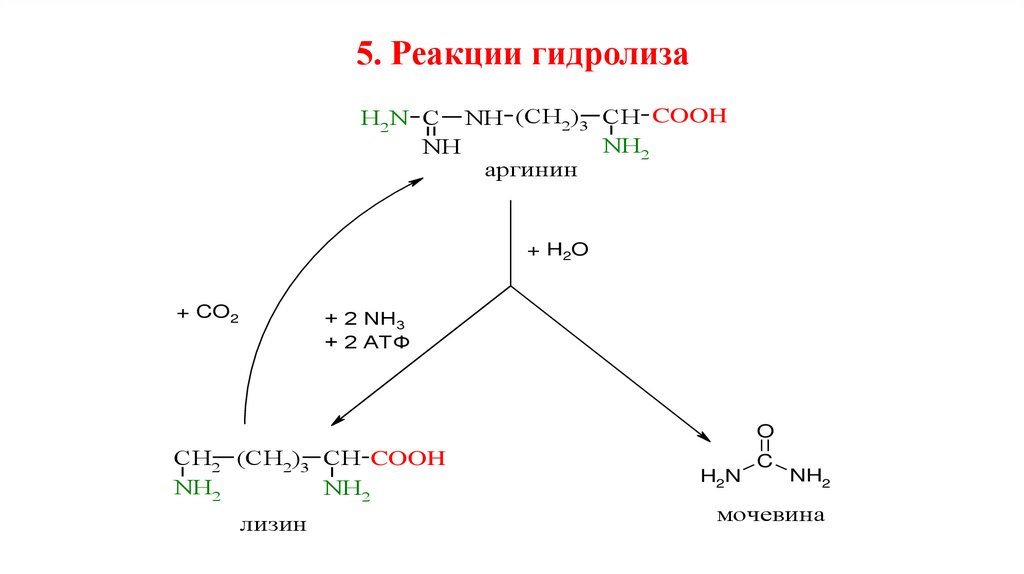
5. Реакции гидролизаH2N C NH (CH2)3 CH COOH
NH2
NH
аргинин
+ H2O
+ CO2
+ 2 NH3
+ 2 АТФ
O
CH2 (CH2)3 CH COOH
NH2
NH2
лизин
H2N
C
NH2
мочевина
35.
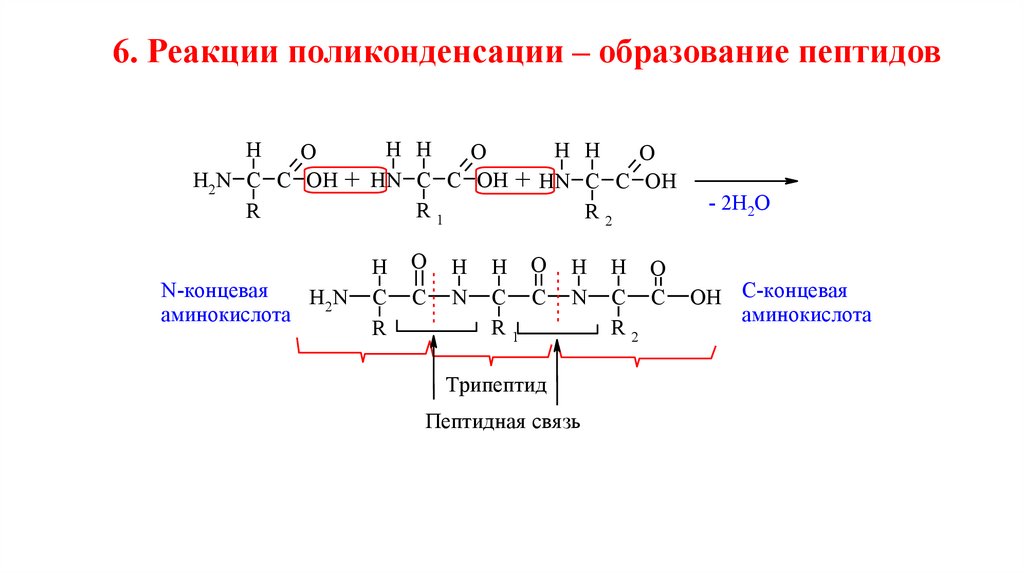
6. Реакции поликонденсации – образование пептидовH H
H
H H
O
O
O
H2N C C OH + HN C C OH + HN C C OH
R1
R
R2
N-концевая
H2N
аминокислота
H
C
R
O
C
H
N
H O
C C
R1
H
N
Трипептид
Пептидная свя зь
H O
C C
R2
- 2H2O
OH С-концевая
аминокислота
36.
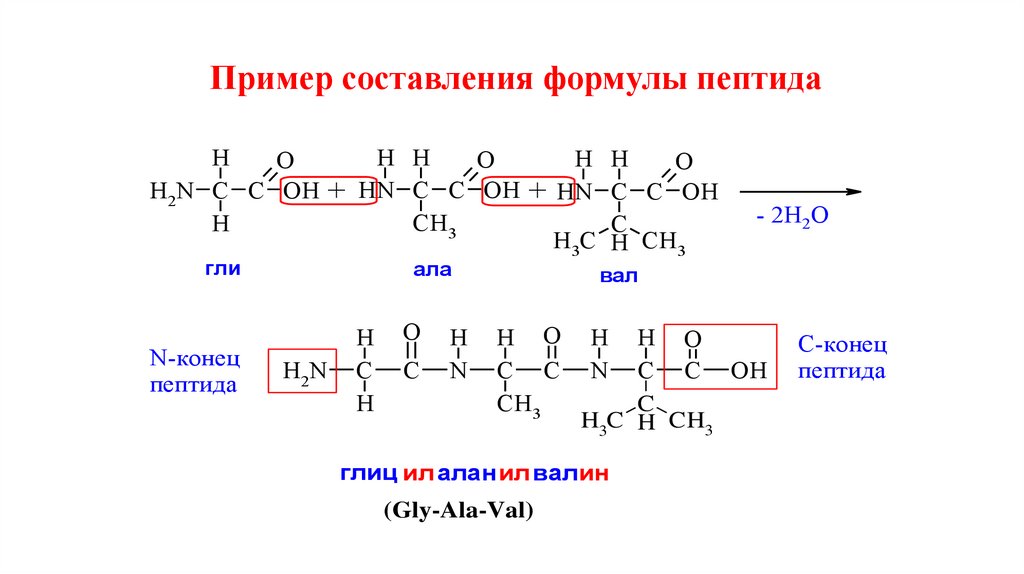
Пример составления формулы пептидаH H
H
H H
O
O
O
H2N C C OH + HN C C OH + HN C C OH
CH3
H
C
H3C H CH3
гли
N-конец
пептида
ала
H2N
H
C
H
O
C
H
N
- 2H2O
вал
H O
C C
CH3
H O
C C OH
C
H3C H CH3
H
N
глиц ил алан ил валин
(Gly-Ala-Val)
С-конец
пептида
37.
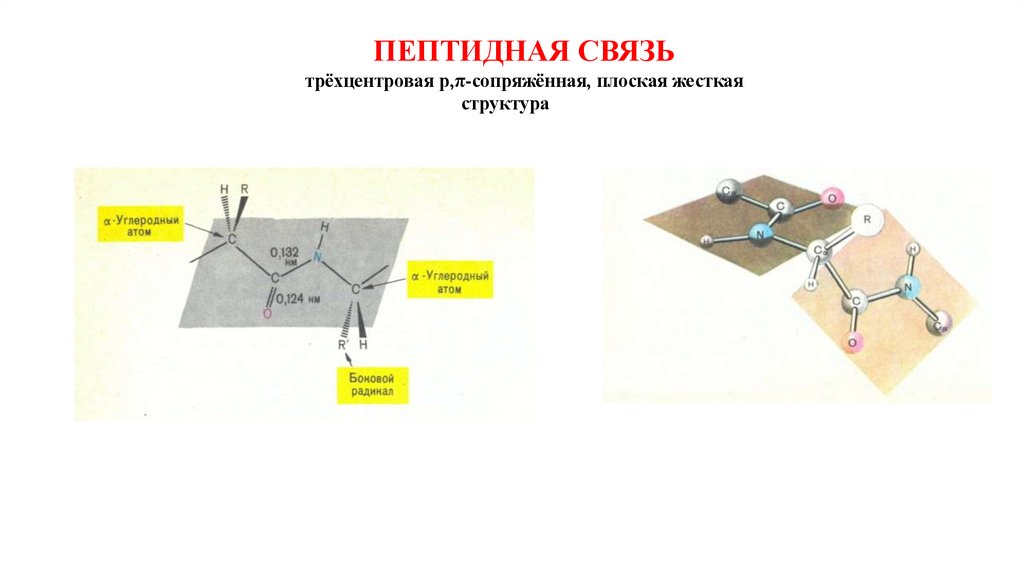
ПЕПТИДНАЯ СВЯЗЬтрёхцентровая р,π-сопряжённая, плоская жесткая
структура
38.
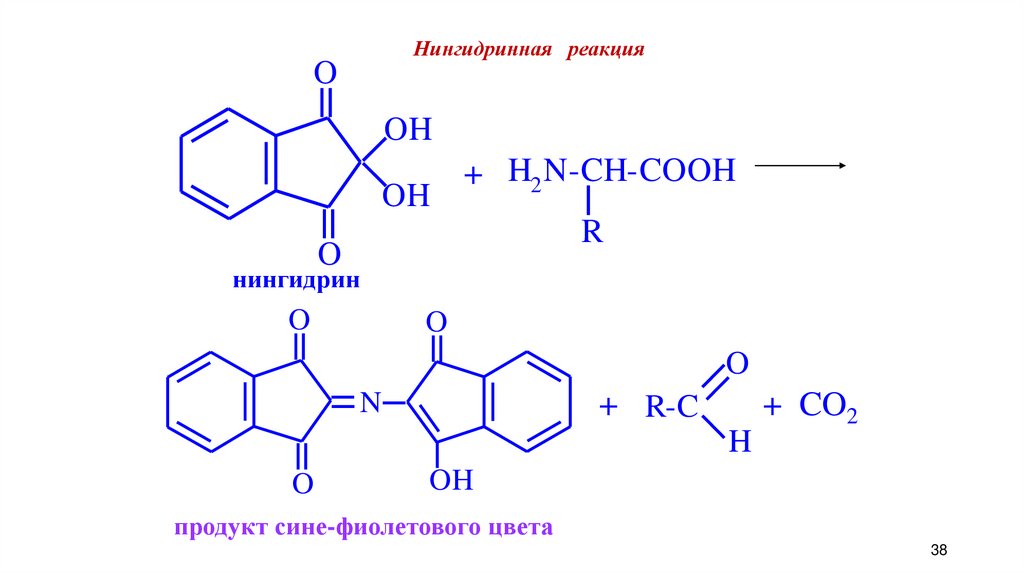
Нингидринная реакцияO
OH
OH
+ H2 N-CH-COOH
R
O
нингидрин
O
O
O
N
+ R-C
+ CO2
H
O
OH
продукт сине-фиолетового цвета
38
39. Пептиды и белки -
Пептиды и белки представляют собой высокомолекулярные азотсодержащие органическиесоединения, построенные из остатков α-L- аминокислот, соединенных
между собой пептидными (амидными) связям.
40. Пептиды
– это полиамиды, построенные из α –аминокислот (дипептиды,трипептиды, тетрапептиды и т.д.):
•до 10 аминокислотных остатков- олигопептиды
• более 10 аминокислотных остатков – полипептиды
• могут включать аминокислотные остатки D-ряда
•разнообразны в структурном отношении (содержат циклические
фрагменты, разветвленные цепи и т.д.)
(М < 10 000)
41. Белки-
Белкиприродные полипептиды, включающие более 100 аминокислотныхостатков (М>10000)
Классификация пептидов и белков:
По растворимости: водорастворимые, солерастворимые,
спирторастворимые, нерастворимые и пр.
По конформационной структуре: фибриллярные, глобулярные.
По химическому строению:
простые- протеины – состоят только из аминокислот,
сложные или коньюгированные - протеиды – помимо АК имеют в составе
небелковую часть (углеводы, липиды, металлы, нуклеиновые кислоты)
42. Функции белков
1.Каталитическая (ферменты > 50% всех белков);2.Защитная (иммуноглобулины, система комплемента лизоцим, лактоферрин и
др.);
3.Транспортная (сывороточный альбумина (транспорт ионов Na+ жирных кислот
и др.), трансферрин (транспорт ионов железа), гемоглобин (транспорт кислорода);
4.Регуляторная (инсулин, глюкагон, вазопрессин и др.);
5.Сократительная (актин, миозин мышц);
6.Структурная (белки нуклеосом (гистоны), белки соединительной ткани
(коллаген и эластин), фибрин тромбов, кератин волос и ногтей);
7.Резервная (белки мышц, альбумин плазмы)
8.Питательная
43. Уровни структурной организации белка
• первичная структура –аминокислотная последовательность
• вторичная структура – локальные
высокоупорядоченные конформации белковой цепи
α(-спираль, β -структура)
• третичная структура – форма белковой молекулы;
трёхмерная структура белка.
• четвертичная структура – агрегат из нескольких
молекул белка
44.
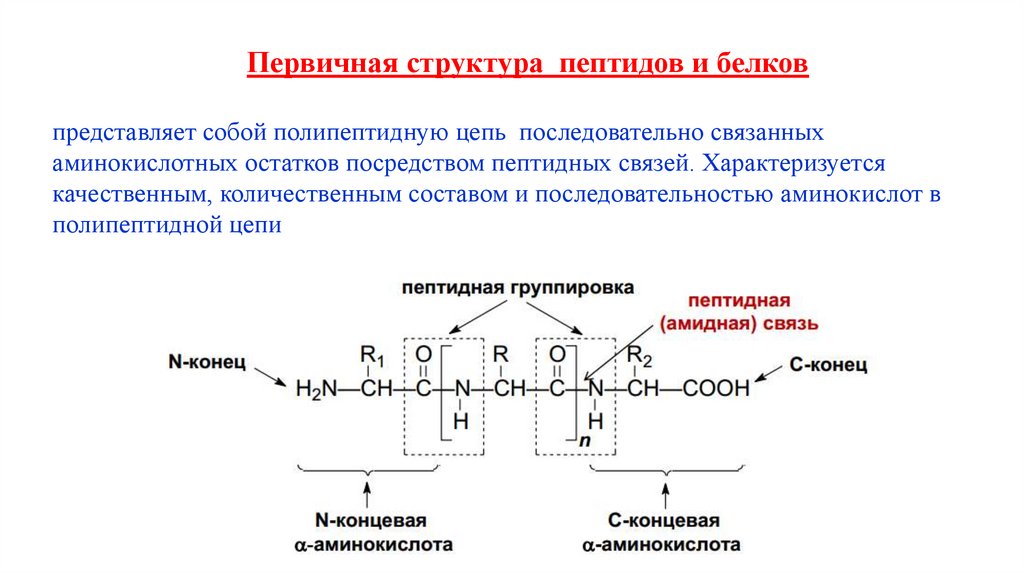
Первичная структура пептидов и белковпредставляет собой полипептидную цепь последовательно связанных
аминокислотных остатков посредством пептидных связей. Характеризуется
качественным, количественным составом и последовательностью аминокислот в
полипептидной цепи
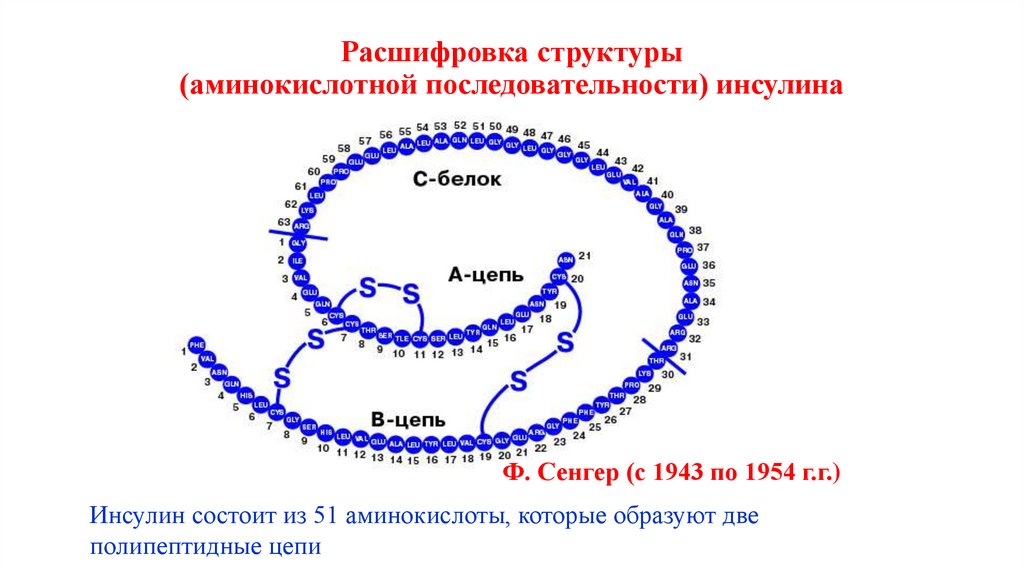
45. Расшифровка структуры (аминокислотной последовательности) инсулина
Ф. Сенгер (с 1943 по 1954 г.г.)Инсулин состоит из 51 аминокислоты, которые образуют две
полипептидные цепи
46.
20аминокислот
могут
дать
примерно
100000000000000000000000000000000000000000000000000
000000000000000000000000000000000000000000000000000
000000000000000000000000000000000000000000000000000
000000000000000000000000000000000000000000000000
белков, состоящих из 150 остатков аминокислот.
Это астрономическое число – число гугол умноженное
на число гугол (число гугол – это 10100)
В настоящее время большая часть работ по определению
аминокислотных последовательностей автоматизирована.
Прибор для автоматического определения первичной
структуры - секвенатор
47.
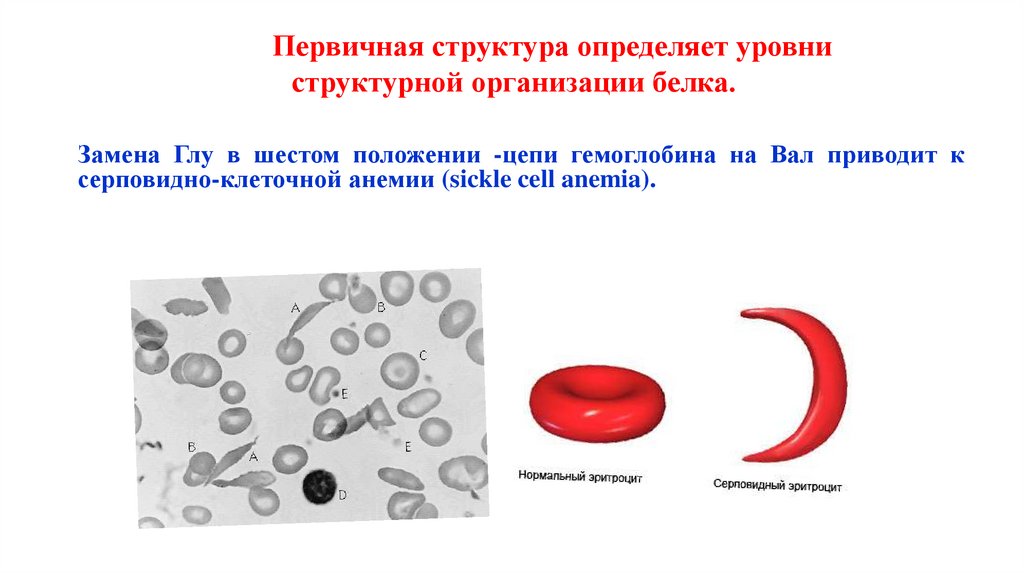
Первичная структура определяет уровниструктурной организации белка.
Замена Глу в шестом положении -цепи гемоглобина на Вал приводит к
серповидно-клеточной анемии (sickle cell anemia).
48.
Вторичная структура белкавозникает за счет водородных связей между пептидными связями, что
приводит к упорядоченному расположению полипептидных цепей в
виде α -спирали или складчатой структуры.
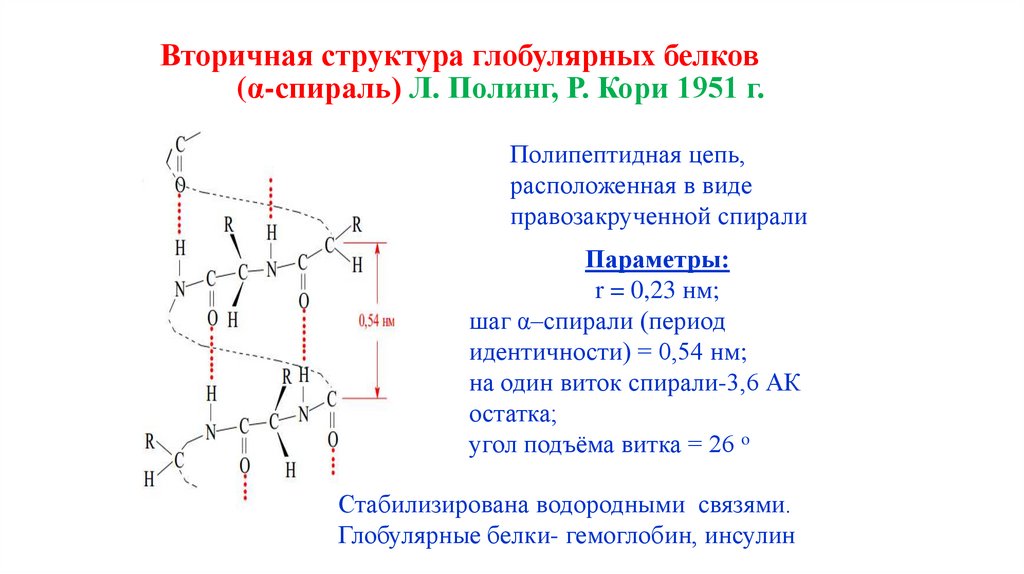
49. Вторичная структура глобулярных белков (α-спираль) Л. Полинг, Р. Кори 1951 г.
Полипептидная цепь,расположенная в виде
правозакрученной спирали
Параметры:
r = 0,23 нм;
шаг α–спирали (период
идентичности) = 0,54 нм;
на один виток спирали-3,6 АК
остатка;
угол подъёма витка = 26 o
Стабилизирована водородными связями.
Глобулярные белки- гемоглобин, инсулин
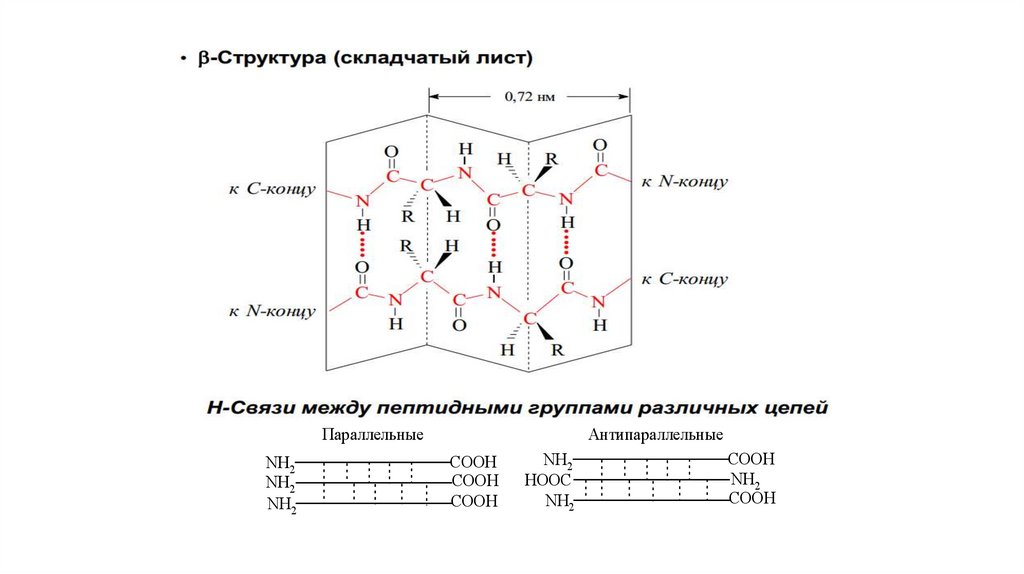
50. Вторичная структура фибриллярных белков (β-структура) – складчатый лист
Вытянутые полипептидные цепи, уложенные в "складчатые листы", связываемыемножеством водородных связей между пептидными группами этих цепей. В
большинстве случаев "складчатый лист" включает более 6 полипептидных цепей.
Характерна для фибриллярных белков: кератина, коллагена.
У. Астбери 1941 г.
51.
ПараллельныеNH2
NH2
NH2
Антипараллельные
СООН
СООН
СООН
NH2
HOOC
NH2
СООН
NH2
СООН
52.
Третичная структура белкавозникает в результате взаимодействия между радикалами
аминокислотных остатков полипептидных цепей.
К таким взаимодействиям относятся водородные связи, Ван-дерВаальсовы силы, менее характерными являются дисульфидные связи и
ионные связи.
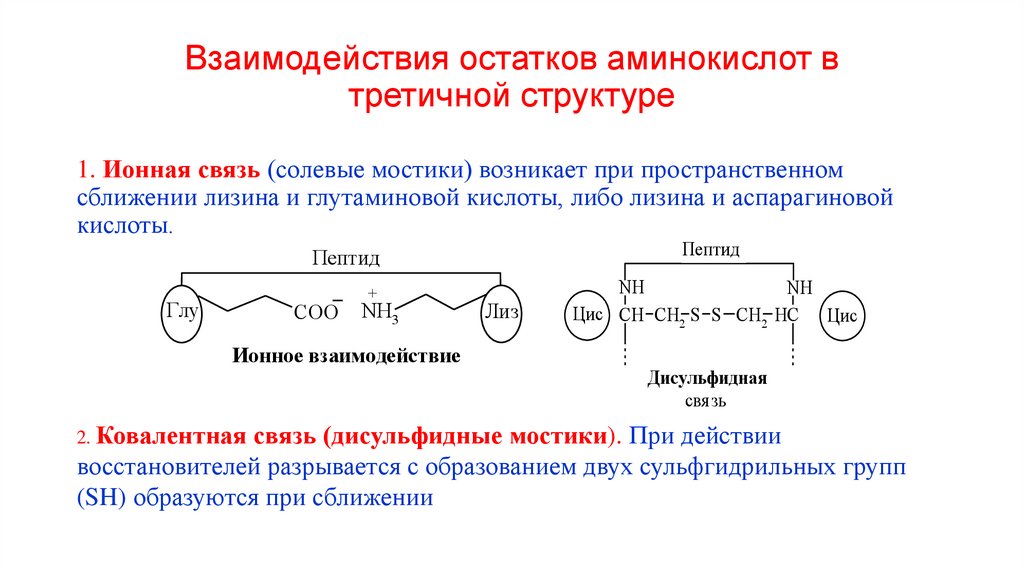
53. Взаимодействия остатков аминокислот в третичной структуре
1. Ионная связь (солевые мостики) возникает при пространственномсближении лизина и глутаминовой кислоты, либо лизина и аспарагиновой
кислоты.
Пептид
Пептид
Глу
СОО
+
NH3
Ионное взаимодействие
Лиз
NH
NH
Цис CH СН2 S S CH2 HC Цис
Дисульфидная
свя зь
2. Ковалентная связь (дисульфидные мостики). При действии
восстановителей разрывается с образованием двух сульфгидрильных групп
(SH) образуются при сближении двух остатков цистеина. Эта связь
54.
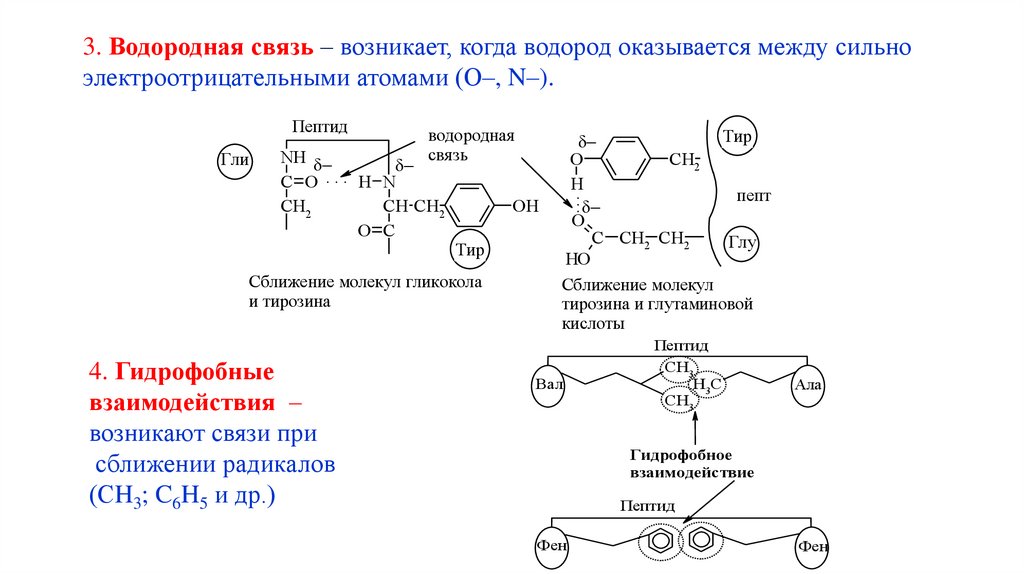
3. Водородная связь – возникает, когда водород оказывается между сильноэлектроотрицательными атомами (О–, N–).
Пептид
Гли
водородная
свя зь
NH
.
.
.
C O
H N
CH2
CH CH2
O C
OH
Тир
Сближение молекул гликокола
и тирозина
4. Гидрофобные
взаимодействия –
возникают связи при
сближении радикалов
(СH3; C6H5 и др.)
Тир
O
CH2
H
.
пепт
:
O
C CH2 CH2
Глу
HO
Сближение молекул
тирозина и глутаминовой
кислоты
Вал
Пептид
CH3
H3C
CH3
Ала
Гидрофобное
взаимодействие
Пептид
Фен
Фен
55. Выделяют два общих типа третичной структуры:
В фибриллярных белках (коллаген, эластин) третичная структура представленалибо тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми
структурами.
α1
α2
α3
ГЛИЦИН – ПРОЛИН - ГИДРОКСИПРОЛИН] –
ПОВТОРЯЮЩИЙСЯ ФРАГМЕНТ
В глобулярных белках встречается сочетание всех трех типов структур: всегда есть
нерегулярные участки, есть бета-складчатые структуры и альфа-спирали.
56.
Модель третичной структуры миоглобинаДж. Кендрью
1961 г.
Параметры:
4,5 х 3,5 х 2,5 нм
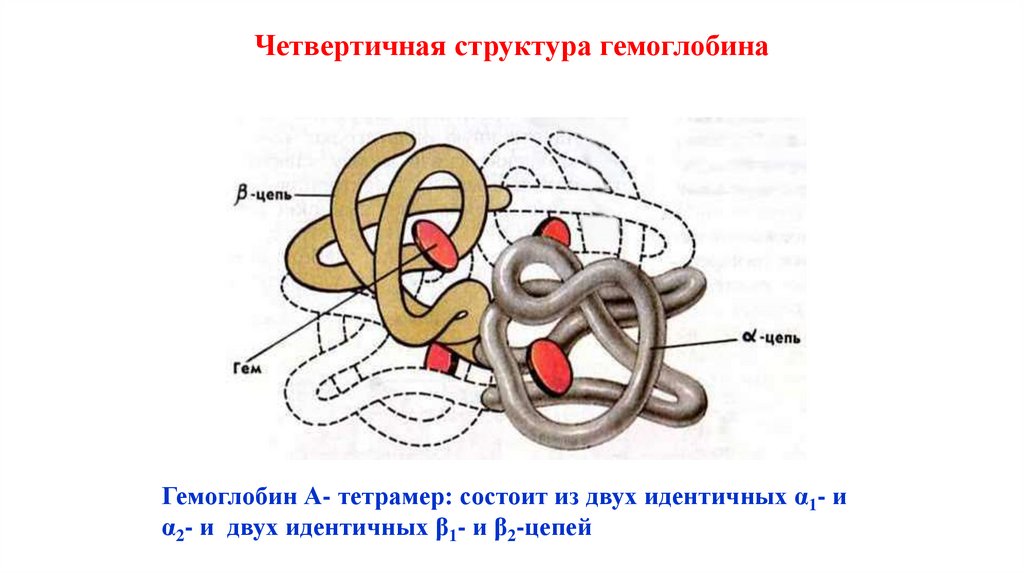
57. Четвертичная структура
Четвертичная структура - способ укладки в пространстве отдельныхполипептидных цепей, обладающих одинаковой первичной, вторичной, третичной
структурой и формирование единого макромолекулярного комплекса.
Встречается у олигомерных белков- состоят из двух или более полипептидных
цепей.
Каждая цепь - СУБЪЕДИНИЦА (ПРОТОМЕР).
В состав белковой молекулы могут входить одинаковые или разные
субъединицы.
Фиксируется всеми типами слабых связей, а иногда дисульфидными связями.
58. Четвертичная структура гемоглобина
Гемоглобин А- тетрамер: состоит из двух идентичных α1- иα2- и двух идентичных β1- и β2-цепей
59.
ДЕНАТУРАЦИЯ- это лишение белка eгo природных, нативных свойств,
сопровождающееся разрушением четвертичной (если она была),
третичной, а иногда и вторичной структуры белковой молекулы,
которое возникает при разрушении дисульфидных и слабых
типов связей, участвующих в образовании этих структур.
Первичная структура при этом сохраняется, потому что она
сформирована прочными ковалентными связями. Разрушение
первичной структуры может произойти только в результате гидролиза
белковой молекулы длительным кипячением в растворе кислоты или
щелочи.
60. Денатурирующие факторы
Физические Факторы1.Высокие температуры. Денатурация
при 40-50°С -белок термолабильный.
Денатурация при более
высоких температурах-белок
термостабильный.
2. Ультрафиолетовое облучение
З. Рентгеновское и радиоактивное
облучение
4. Ультразвук
5. Механическое воздействие (н-р,
вибрация).
Химические Факторы
1. Концентрированные кислоты и щелочи
(н-р,трихлоруксусная кислота
(органическая), азотная кислота
(неорганическая).
2. Соли тяжелых металлов
(н-р, CuS04).
З. Органические растворители (этиловый
спирт, ацетон)
4. Растительные алкалоиды.
5. Мочевина в высоких
концентрациях
61. Обратимость денатурации
Процесс обратный денатурации-ренатурация.In vivo, в организме, ренатурация связана с выработкой специфических
белков, которые «узнают» структуру денатурированного белка,
присоединяются к нему с помощью слабых типов связи и создают
оптимальные условия для ренатурации. Такие специфические белки
известны как «белки теплового шока» или «белки стресса».





















 Химия
Химия








