Похожие презентации:
№6_Қышқыл,_сілті_және_тұз_ерітінділерінің_рН_і (2)
1.
Қышқыл, сілті жәнетұз ерітінділерінің
рН-і. Тұздар
гидролизі.
Зертханалық тәжірибе
№2«Гидроксидтер,қышқыл және
тұздар қасиеттерін зерттеу.
Тұздар гидролизі»
2.
Сутектік көрсеткіш дегеніміз теріс таңбаменалынған сутегі иондарының
концентрациясының ондық логарифмін
айтады.
pH = - lg [ H+]
Сутектік көрсеткіш түсінігін 1909 жылы дат
химигі Серенсен енгізді.
рН арқылы ерітінділердің реакциясы былай
сипатталады:
Нейрал орта рН = 7
Қышқыл орта рН < 7
Сілтілі орта рН > 7
3.
Ерітіндінің рН білу химиялық зерттеу жұмыстарындада,әр түрлі өндірістік процестерде де,тірі органимдерде
де жүретін құбылыстарды түсіндіруде өте
керек.Көпшілік жағдайда рН дәл мәнін емес ,ерітіндінің
реакциясы қандай,қышқыл ма,немесе сілтілік пе-соны
сапалық турде білу жеткілікті болады, олүшін
индикатор деп аталатын арнаулы реактивтерді
пайдаланылады.Ол индикаторлар сутек иондарының
концентрациясына қарай өз түсін өзгертіп ,ерітінді –
қышқыл ,бейтарап не сілтілік екенін көрсетеді.Жиі
қолданатын индикаторлар : лакмус, фенол-фталейн,
метилоранж, солардың қандай ортада қандай түске
боялатындығы көрсетілген
4.
Кейбір ерітінділердің рН мәндері:Асқазан шырыны
қышқылдық реакция)
O
Шымтезек суы
қышқылдық реакция)
O
Жаңбыр суы
қышқылдық реакция)
O
Құбыр суы
реакция)
O
Қан
O
Сілекей
қышқылдық)
O
Көз жасы
реакция)
O
рН=1,7 (күшті
рН =4
(әлсіз
рН=6
(әлсіз
рН=7,5 (әлсіз сілтілік
рН=7,4 (әлсіз сілтілік)
рН=6,9 (әлсіз
рН =7 (бейтарап
5. Тұздар гидролизі
O Тұздар гидролизі – тұз иондарының суменәрекеттесу нәтижесінде тұз ыдырап, әлсіз
электролиттің (әлсіз қышқылдің не әлсіз негіздің)
түзілу реакциясы
O Сандық жағынан гидролизді гидролиздену
дәрежесі (h) арқылы өрнектейді
h=гидролизденген молекулар саны
O Температураны арттырып және ерітінді сұйылту
арқылы гидролиздену дәрежесін өсіруге болады.
6.
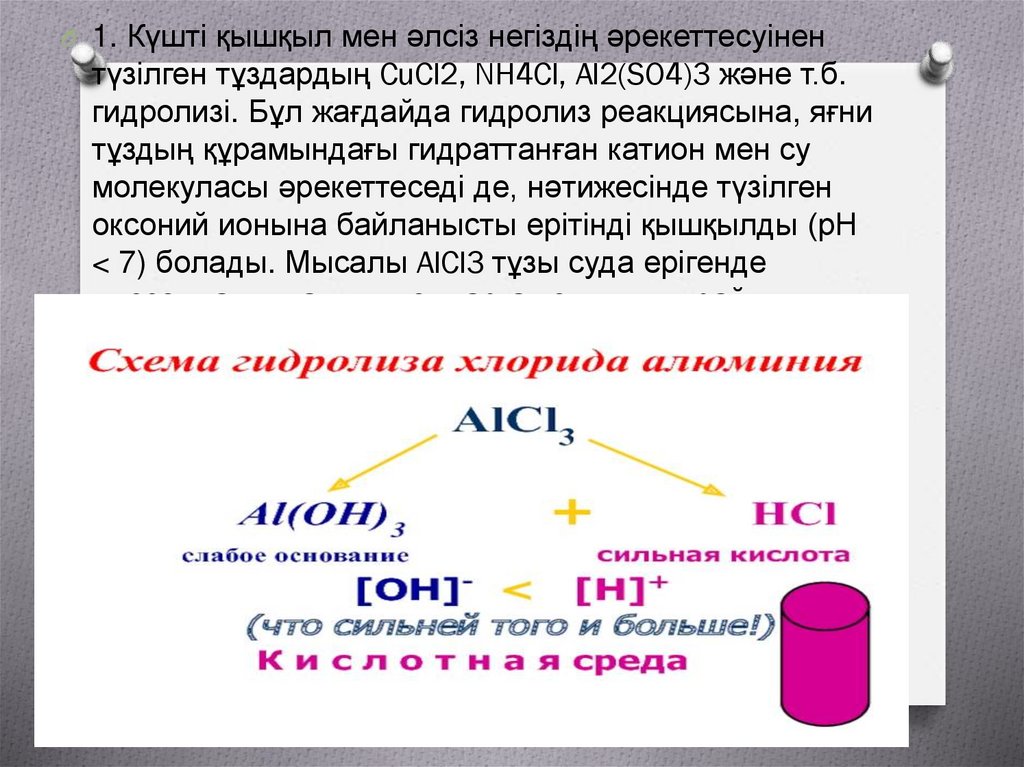
O 1. Күшті қышқыл мен әлсіз негіздің әрекеттесуінентүзілген тұздардың CuCl2, NH4Cl, Al2(SO4)3 және т.б.
гидролизі. Бұл жағдайда гидролиз реакциясына, яғни
тұздың құрамындағы гидраттанған катион мен су
молекуласы әрекеттеседі де, нәтижесінде түзілген
оксоний ионына байланысты ерітінді қышқылды (рН
< 7) болады. Мысалы AlCl3 тұзы суда ерігенде
диссоциацияланып, иондарға толық ыдырайды:
7.
O 3. Әлсіз негіз бен әлсіз қышқылдан түзілгентұздар да гидролизге ұшырайды. Бұл жағдайда
гидролиздену процесі соңына дейін жүріп,
қышқыл мен негіз түзіледі. Мысалы, алюминий
сульфиді Al2S3 сумен әрекеттескенде алюминий
гидроксиді Al(OH)3 мен күкіртсутек H2S түзіліп,
гидролиздену реакциясы қайтымсыз болады
8.
O 2. Әлсіз қышқыл мен күшті негіздердіңәрекеттесуінен түзілген тұздардың CH3COONa,
Na2CO3, KCN, Na2SO3, KNO2 және т.б. гидролизі.
Бұл жағдайда гидролиз реакциясына тұздың
құрамындағы әлсіз қышқылдың қалдығы болып
саналатын гидраттанған анион түседі де,
нәтижесінде ерітінді сілтілі (рН > 7) болады.
9.
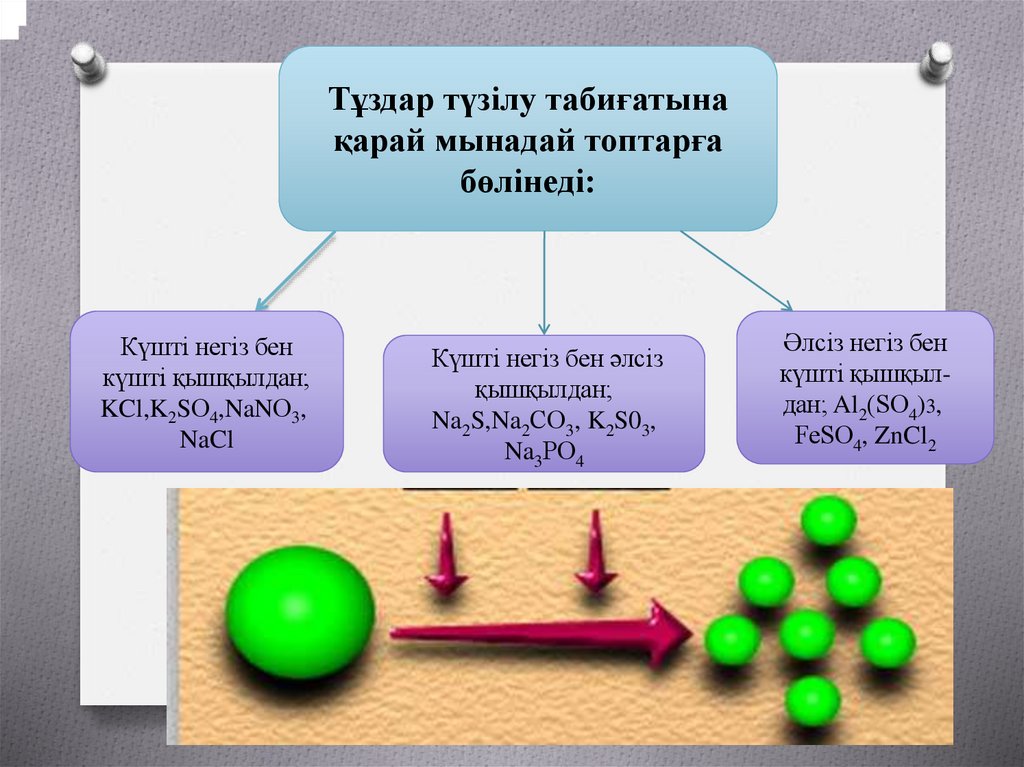
;Тұздар түзілу табиғатына
қарай мынадай топтарға
бөлінеді:
Күшті негіз бен
күшті қышқылдан;
KCl,K2SО4,NaNО3,
NaCl
Күшті негіз бен әлсіз
қышқылдан;
Na2S,Na2CО3, K2S03,
Na3PО4
Әлсіз негіз бен
күшті қышқылдан; Al2(SО4)3,
FeSО4, ZnCl2
10.
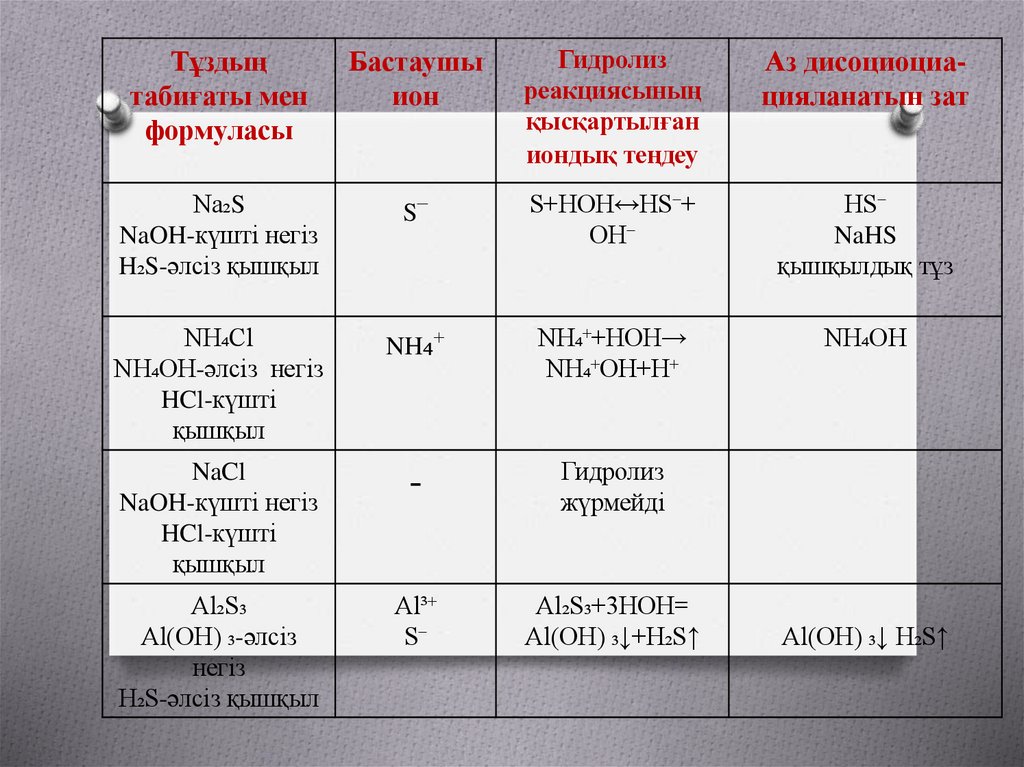
Тұздыңтабиғаты мен
формуласы
Бастаушы
ион
Гидролиз
реакциясының
қысқартылған
иондық теңдеу
Аз дисоциоциацияланатын зат
Na₂S
NaOH-күшті негіз
H₂S-әлсіз қышқыл
S⁻
S+HOH↔HS⁻+
OH⁻
HS⁻
NaHS
қышқылдық тұз
NH₄Cl
NH₄OH-әлсіз негіз
HCl-күшті
қышқыл
NH₄⁺
NH₄⁺+HOH→
NH₄⁺OH+H⁺
NH₄OH
NaCl
NaOH-күшті негіз
HCl-күшті
қышқыл
-
Гидролиз
жүрмейді
Al₂S₃
Al(OH) ₃-әлсіз
негіз
H₂S-әлсіз қышқыл
Al³⁺
S⁻
Al₂S₃+3HOH=
Al(OH) ₃↓+H₂S↑
Al(OH) ₃↓ H₂S↑
11.
1. Әлсіз негізбен күшті қышқылдан түзілген тұздаргидролизденеді.
NH4CI + HOH ↔ NH4OH + HCI қайтымды процесс.
NH4+ + CI- + HOH ↔ NH4OH + H+ + CINH4+ + HOH ↔ NH4OH + H+
орта қышқылдық
Ортаның өзгеруі тұз ионының сумен әрекеттесуінің нәтижесінде
пайда болады.
2. Күшті негізбен әлсіз қышқылдан түзілген тұздар
гидролизденеді
Na2 CO3 + HOH ↔ NaHCO3 + NaOH
2Na + + CO32- + HOH ↔ Na+ + HCO3- + Na + + OHCO32- + HOH ↔ HCO32- + OHОрта сілтілік
3. Әлсіз негізбен әлсіз қышқылдан түзілген тұздар
гидролизденеді.
Бұл жағдайда гидролиз реакциясы соңына дейін жүріп, қышқыл
мен негіз түзіледі. Яғни гидролиз реакциясы қайтымсыз болады:
AI2S3 + 6H2O → 2AI(OH)3↓ + 3H2S↑ орта бейтарап.
4. Күшті қышқылмен күшті негізден түзілген тұздар гидролизге
ұшырамайды.
12.
Кез келген ерітіндінің ортасының қышқылдығын,сілтілігін, нейтралдығын анықтайтын құрал қолданылады.
Сутектік көрсеткіш дегеніміз теріс таңбамен алынған
сутегі иондарының концентрациясының ондық
логарифмін айтады.
pH = - lg [ H+] Сутектік көрсеткіш түсінігін
1909 жылы дат химигі Серенсен енгізді.
рН арқылы ерітінділердің реакциясы былай
сипатталады:
нейрал рН = 7, қышқыл рН < 7, сілті рН > 7
13.
14.
ҚорытындыКүшті негіз бен күшті қышқылдан түзілген тұз сумен
әрекеттеспейді (гидролизге ұшырамайды). Орта
бейтарап қалпын сақтайды.
Әлсіз негіз және күшті қышқылдан түзілген тұз
құрамындағы металл катионы гидроксид ОН-ионымен
байланысатындықтан, ерітіндіге Н+ иондары жиналып
қышқылдық орта береді.
Күшті негіз бен әлсіз қышқылдан түзілген тұз
анионы сутек катионымен Н+ байланысатындықтан,
ерітіндіге ОН- иондары жиналып сілтілік орта береді.
Әлсіз негіз бен әлсіз қышқылдан түзілген тұз
құрамындағы иондар Н+ және ОН- иондарымен
байланысатындықтан, гидролиздену реакциясы соңына
дейін жүреді.
15.
ТапсырмаБерілген тұздардың:
Na2SO4, Cu(NO3)2, K2S, ZnSO4, Na2СO3
ортасын анықтап, гидролиз реакциясының
теңдеуін жаз
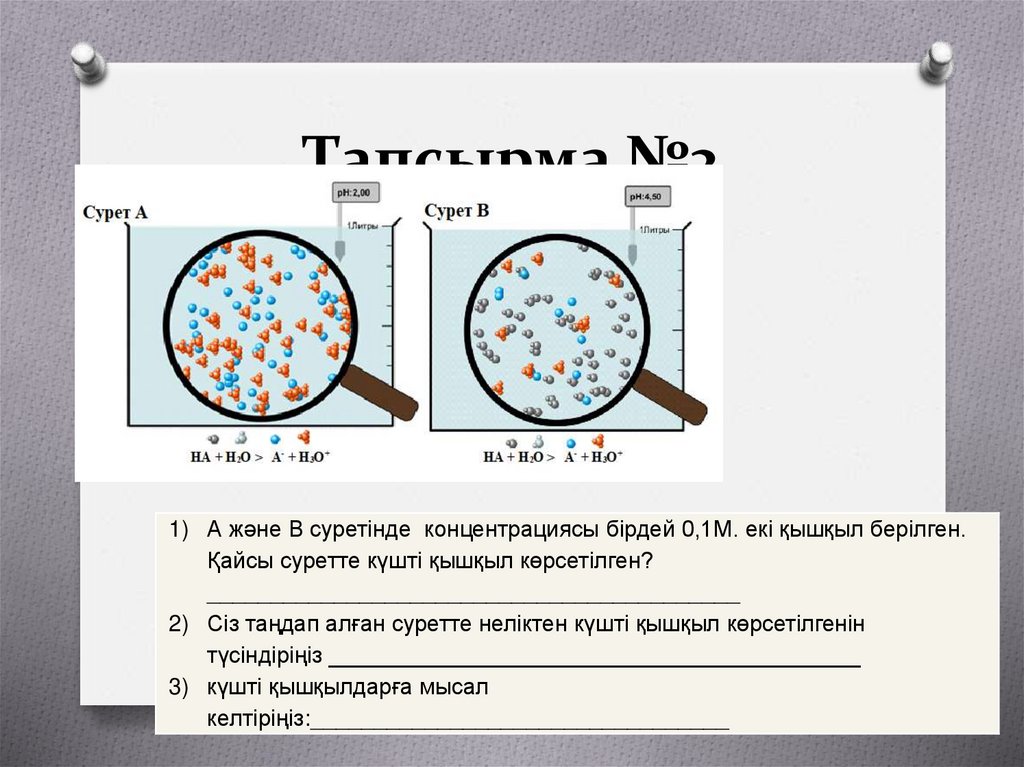
16. Тапсырма №2
1) А және В суретінде концентрациясы бірдей 0,1М. екі қышқыл берілген.Қайсы суретте күшті қышқыл көрсетілген?
__________________________________________
2) Сіз таңдап алған суретте неліктен күшті қышқыл көрсетілгенін
түсіндіріңіз __________________________________________
3) күшті қышқылдарға мысал
келтіріңіз:_________________________________
17. Тапсырма №3.
Екі сынауықта AlCl3 және Na2S тұздарының ерітінділері бар.(a) AlCl3ерітіндісінің ортасы
………………………………………………………………
реакцияның қысқартылған иондық теңдеуі
………………………………………………………………
(b) Na2S ерітіндісінің
ортасы…………………………………..............................
реакцияның қысқартылған иондық теңдеуі…...............
18.
Кім жылдам?1. Су молекулалары әсерінен әлсіз
электролит иондары не молекулалары түзіле
жүретін реакциялар
2. Гидролизге ұшырамайтын тұздар
3. Толығымен гидролизденетін тұздар
4. Гидролездену нәтижесінде қышқылдық
орта беретін тұздар
5. Гидролездену нәтижесінде негіздік орта
беретін тұздар
6. Күшті қышқыл және күшті негіз
арасындағы алмасу реакциясы
19.
Жауаптары1. Тұздар гидролизі
2. Күшті негіз және күшті қышқыл
тұздары
3. Әлсіз қышқыл мен әлсіз негіз
тұздары
4. Күшті қышқыл мен әлсіз негіз тұзы
5. Күшті негіз және әлсіз қышқыл тұзы
6. Бейтараптану реакциясы
















 Химия
Химия








