Похожие презентации:
Алкены (1)
1. Алкены
(олефины)Непредельные, ненасыщенные
углеводороды
Это непредельные алифатические углеводороды, в
молекулах которых содержится одна двойная связь.
Общая формула алкенов:
Сn H2n
2. Гомологический ряд алкенов
С2Н6 этенС3Н8
пропен
С4Н10 бутен
С5Н12
пентен
С6Н14 гексен
С7Н16
гептен
С8Н18 октен
С9Н20 нонен
С10Н22 декен
3. Физические свойства
• С1 – С4 – газы• С5 –С17 – жидкости
• С18 - ∞ -твердые вещества
• Жидкие алкены обладают очень своеобразным
запахом.
• Плохо растворимы в воде
4.
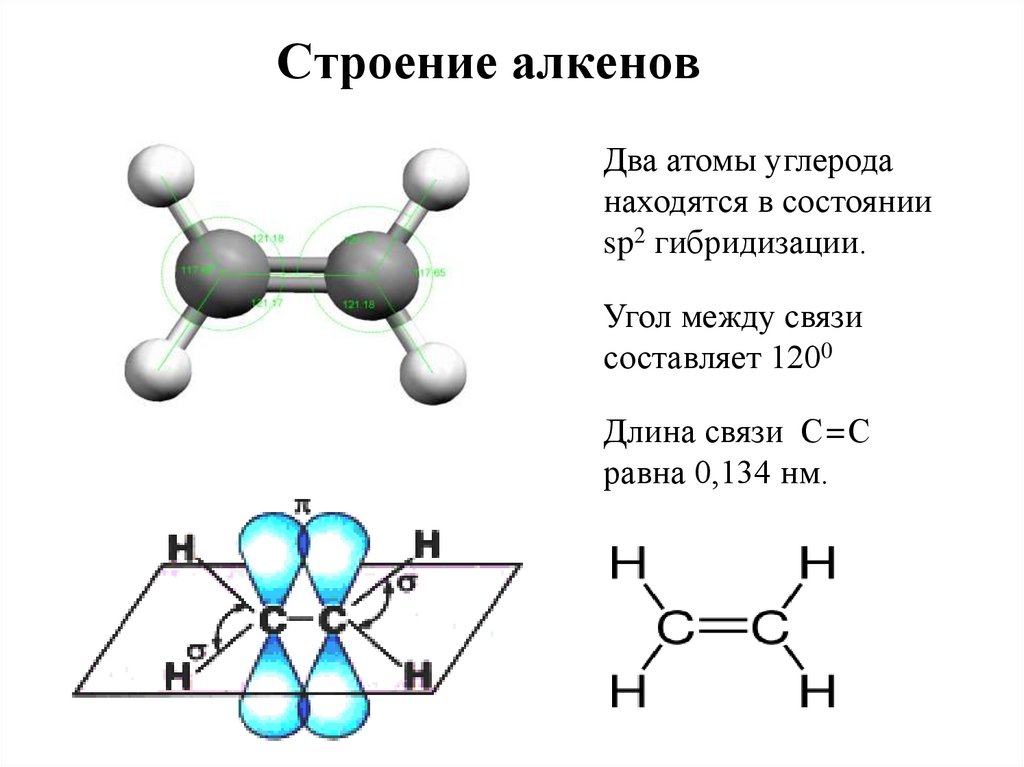
Строение алкеновДва атомы углерода
находятся в состоянии
sp2 гибридизации.
Угол между связи
составляет 1200
Длина связи С=С
равна 0,134 нм.
5.
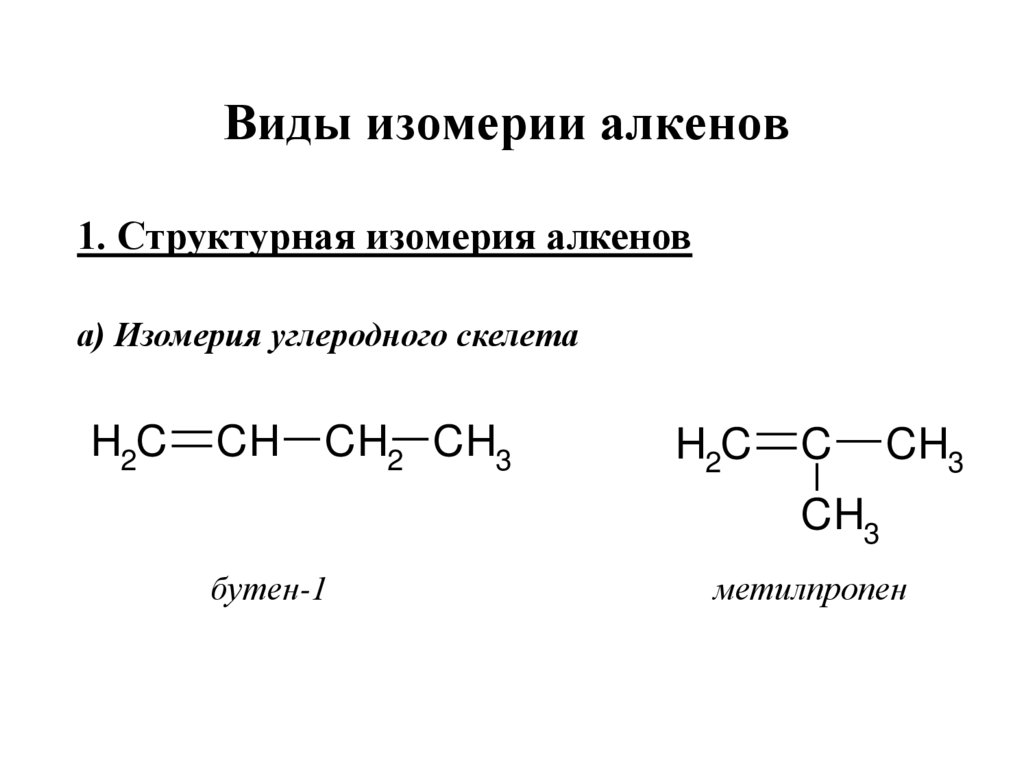
Виды изомерии алкенов1. Структурная изомерия алкенов
а) Изомерия углеродного скелета
H2C
CH
CH2 CH3
H2C
C
CH3
CH3
бутен-1
метилпропен
6.
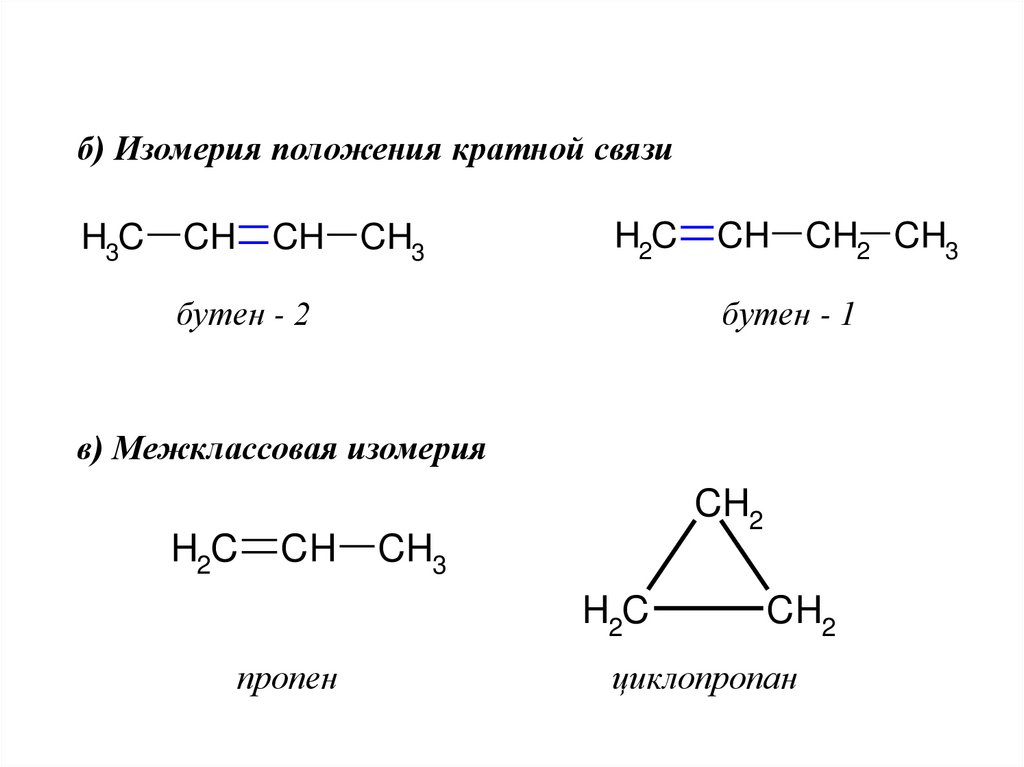
б) Изомерия положения кратной связиH3C
CH CH CH3
H2C
бутен - 2
CH CH2 CH3
бутен - 1
в) Межклассовая изомерия
H2C
CH
CH2
CH3
H2C
пропен
CH2
циклопропан
7.
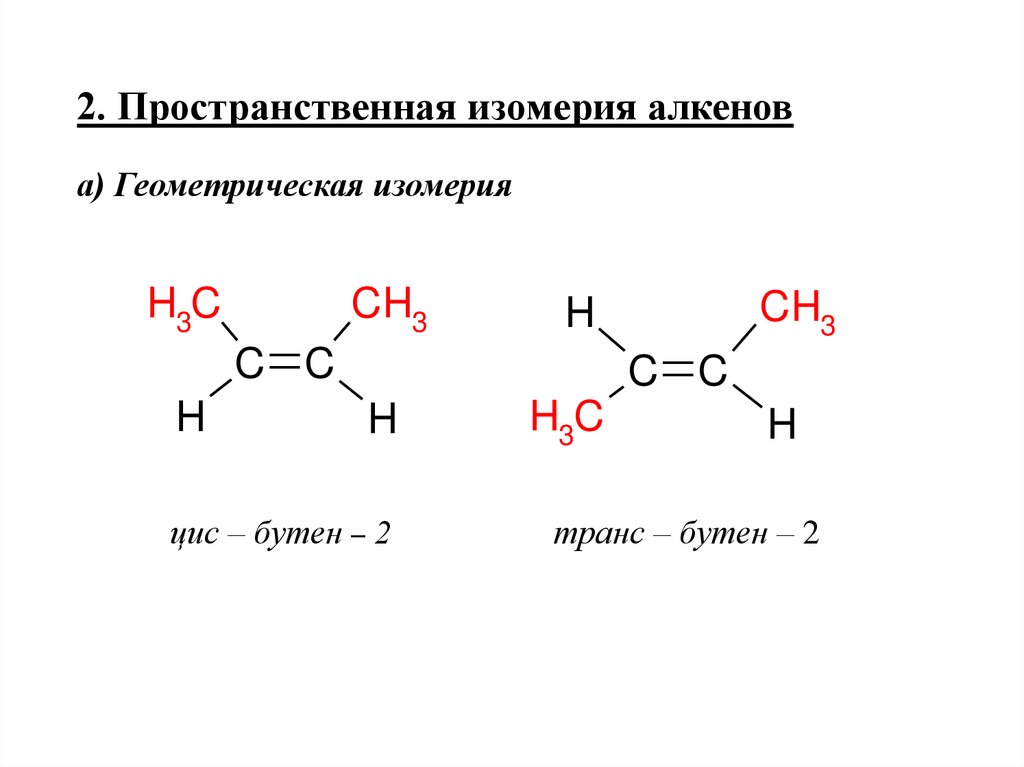
2. Пространственная изомерия алкенова) Геометрическая изомерия
H3C
CH3
C C
H
CH3
H
C C
H
цис – бутен – 2
H3C
H
транс – бутен – 2
8.
Химические свойства алкенов1. Алкены более реакционноспособны, чем алканы.
2. Реакционная способность алкенов обусловлена наличием двойной
С = С связи, а именно не прочной π-связи. электроны π-связи более
доступны действию реагентов извне, так как в отличие от σэлектронов расположены на некотором удалении от ядер. В связи с
этим, π-элекгроны легко поляризуются, поэтому алкены могут
выступать как основания (по классификации Льюиса), т.е. являться
донорами электронов или нуклеофилами. Следовательно, алкены
легко взаимодействуют с электрофильными реагентами —
акцепторами электронов (кислоты по Льюису).
3. Учитывая ненасыщенный характер алкенов, для них наиболее
характерными являются реакции присоединения, протекающие
преимущественно по электрофильному механизму (АЕ). Однако, при
определенных условиях возможно так же протекание реакций
присоединения по радикальному механизму (AR), а также реакций
полимеризации и окисления.
9.
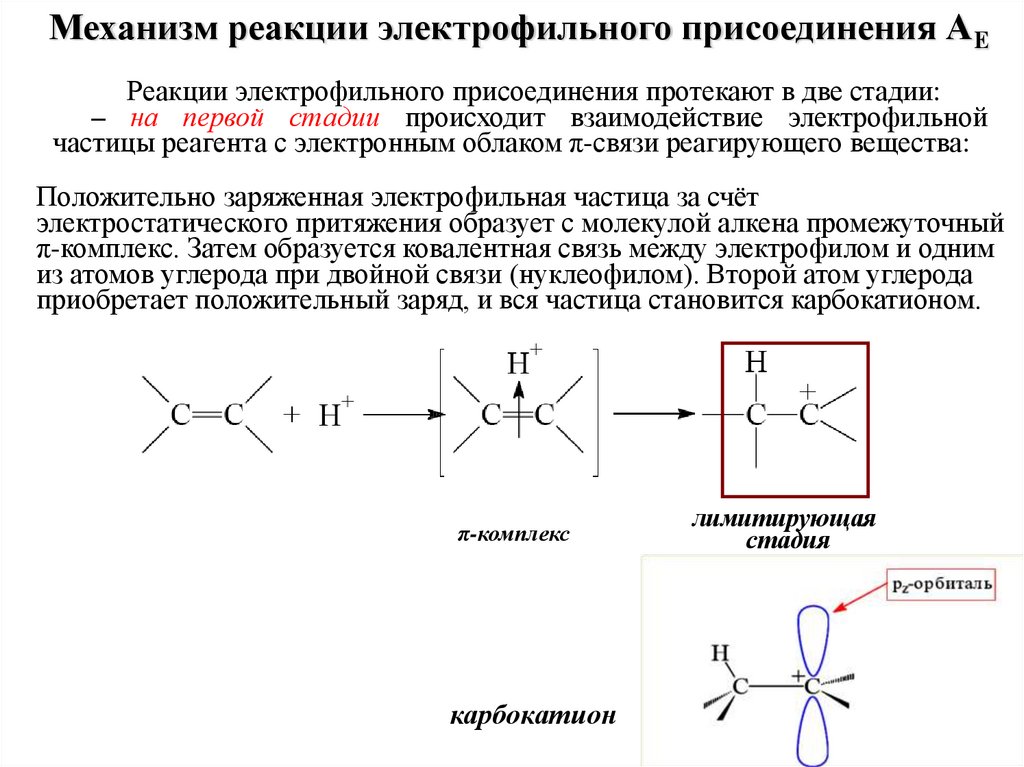
Механизм реакции электрофильного присоединения АЕРеакции электрофильного присоединения протекают в две стадии:
– на первой стадии происходит взаимодействие электрофильной
частицы реагента с электронным облаком π-связи реагирующего вещества:
Положительно заряженная электрофильная частица за счёт
электростатического притяжения образует с молекулой алкена промежуточный
π-комплекс. Затем образуется ковалентная связь между электрофилом и одним
из атомов углерода при двойной связи (нуклеофилом). Второй атом углерода
приобретает положительный заряд, и вся частица становится карбокатионом.
π-комплекс
карбокатион
лимитирующая
стадия
10.
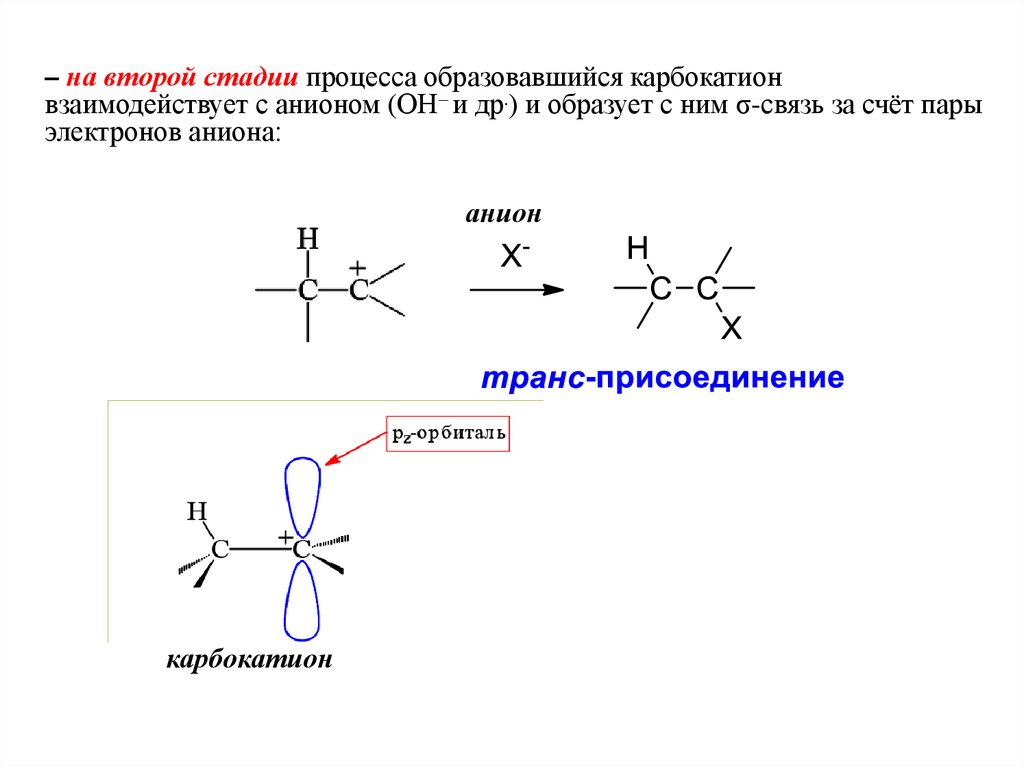
– на второй стадии процесса образовавшийся карбокатионвзаимодействует с анионом (ОН– и др.) и образует с ним σ-связь за счёт пары
электронов аниона:
анион
карбокатион
11.
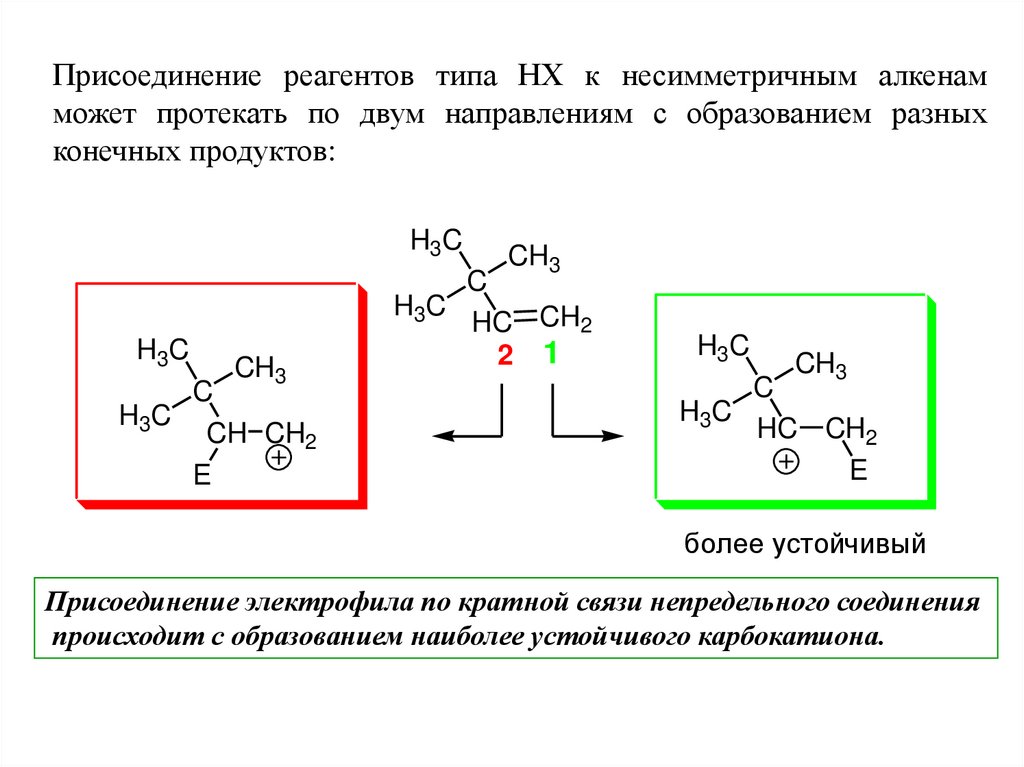
Присоединение реагентов типа НХ к несимметричным алкенамможет протекать по двум направлениям с образованием разных
конечных продуктов:
H3C
H3C
CH3
C
H3C
CH CH2
E
CH3
C
H3C
HC CH2
2 1
H3C
CH3
C
H3C
HC CH2
E
более устойчивый
Присоединение электрофила по кратной связи непредельного соединения
происходит с образованием наиболее устойчивого карбокатиона.
12.
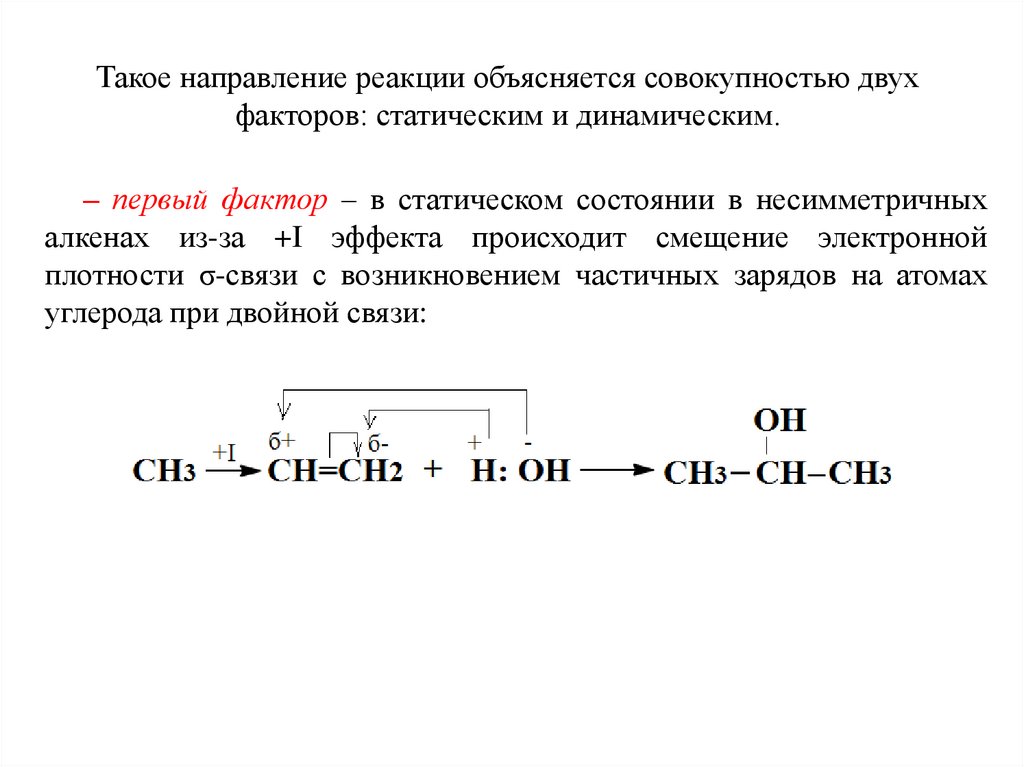
Такое направление реакции объясняется совокупностью двухфакторов: статическим и динамическим.
– первый фактор – в статическом состоянии в несимметричных
алкенах из-за +I эффекта происходит смещение электронной
плотности σ-связи с возникновением частичных зарядов на атомах
углерода при двойной связи:
13.
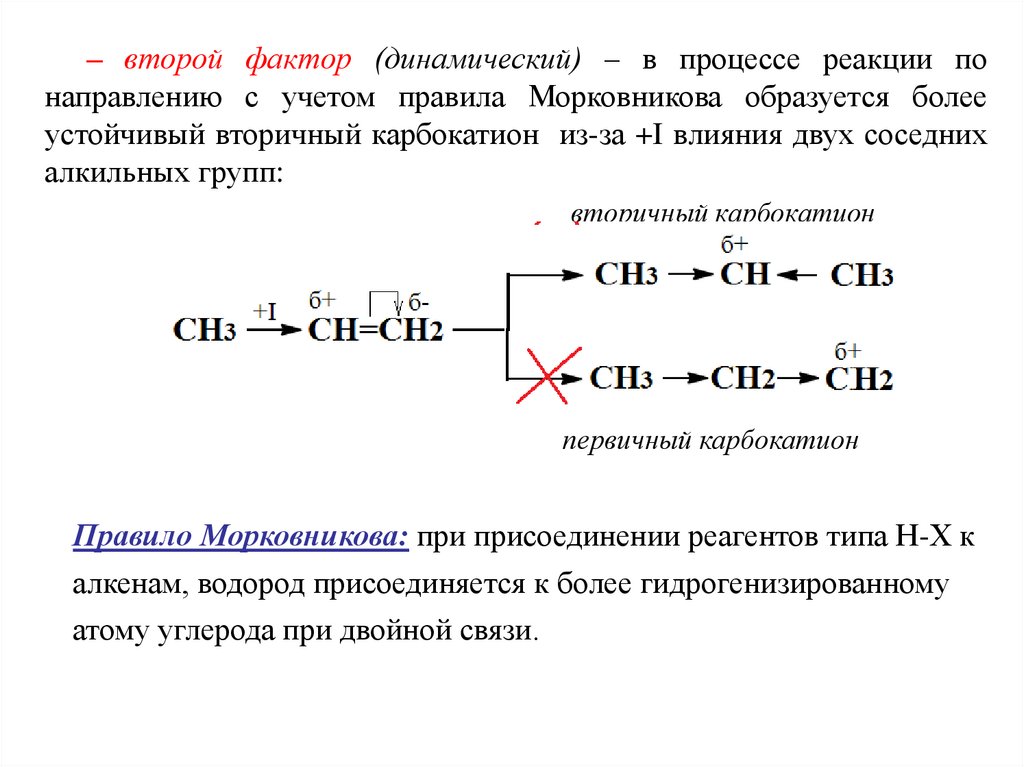
– второй фактор (динамический) – в процессе реакции понаправлению с учетом правила Морковникова образуется более
устойчивый вторичный карбокатион из-за +I влияния двух соседних
алкильных групп:
вторичный карбокатион
первичный карбокатион
Правило Морковникова: при присоединении реагентов типа Н-Х к
алкенам, водород присоединяется к более гидрогенизированному
атому углерода при двойной связи.
14.
Правило Морковникова применимо только для алкенов сэлектродонорными заместителями у атомов углерода при двойной связи.
Однако, присоединение реагентов типа Н-Х к несимметричным
алкенам, содержащих в углеродной цепи электроноакцепторные
заместители протекает против правила Марковникова:
15.
I. Реакции присоединенияпо механизму электрофильного присоединения (AE )
1.Гидрирование (присоединение водорода)
H3C
CH CH CH3
бутен – 2
+
H2
Ni, t
H3C
CH2 CH2 CH3
бутан
Алкены легко присоединяют водород при нагревании и
повышенном давлении в присутствии катализаторов, например
платины или порошкообразного никеля с образованием алканов.
16.
2. Галогенирование (присоединение галогенов)H2C
CH
CH2 CH3
+
Br2
H2C
CH
CH2 CH3
Br Br
бутен-1
1,2-дибромбутан
Быстрое обесцвечивание коричневой окраски раствора брома в
воде (бромной воды) служит качественной реакцией на
наличие кратных углерод-углеродных связей.
17.
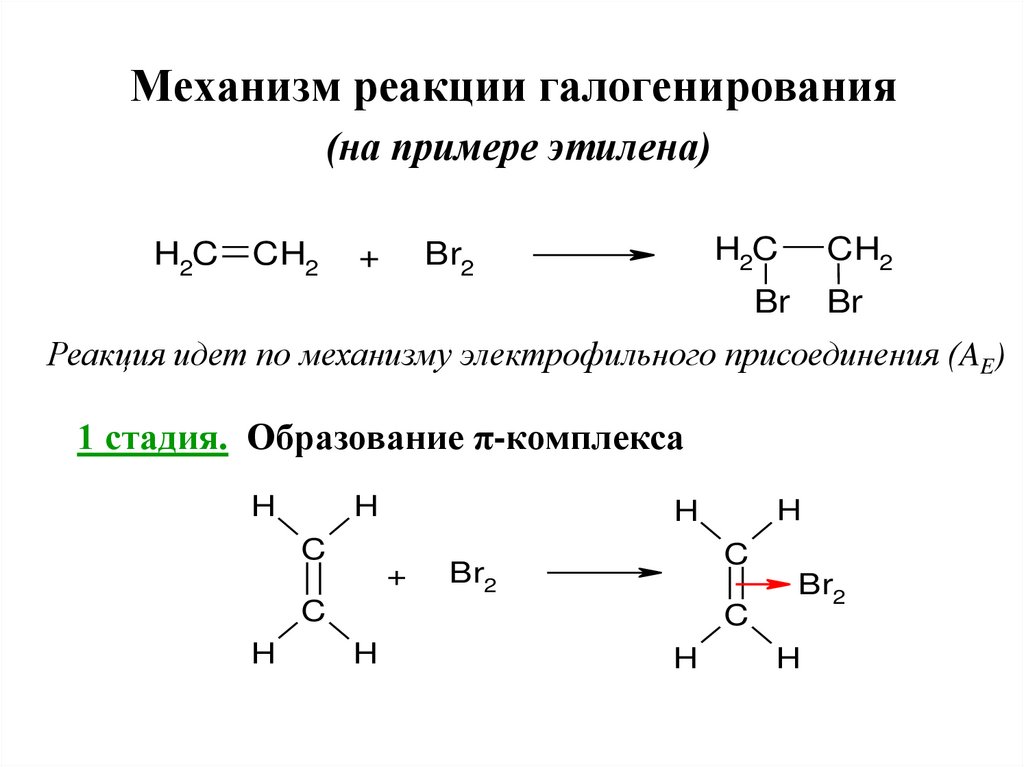
Механизм реакции галогенирования(на примере этилена)
H2C
CH2
H2C
Br2
+
CH2
Br
Br
Реакция идет по механизму электрофильного присоединения (AE)
1 стадия. Образование π-комплекса
H
H
C
+
C
Br2
C
H
H
H
C
H
H
Br2
H
18.
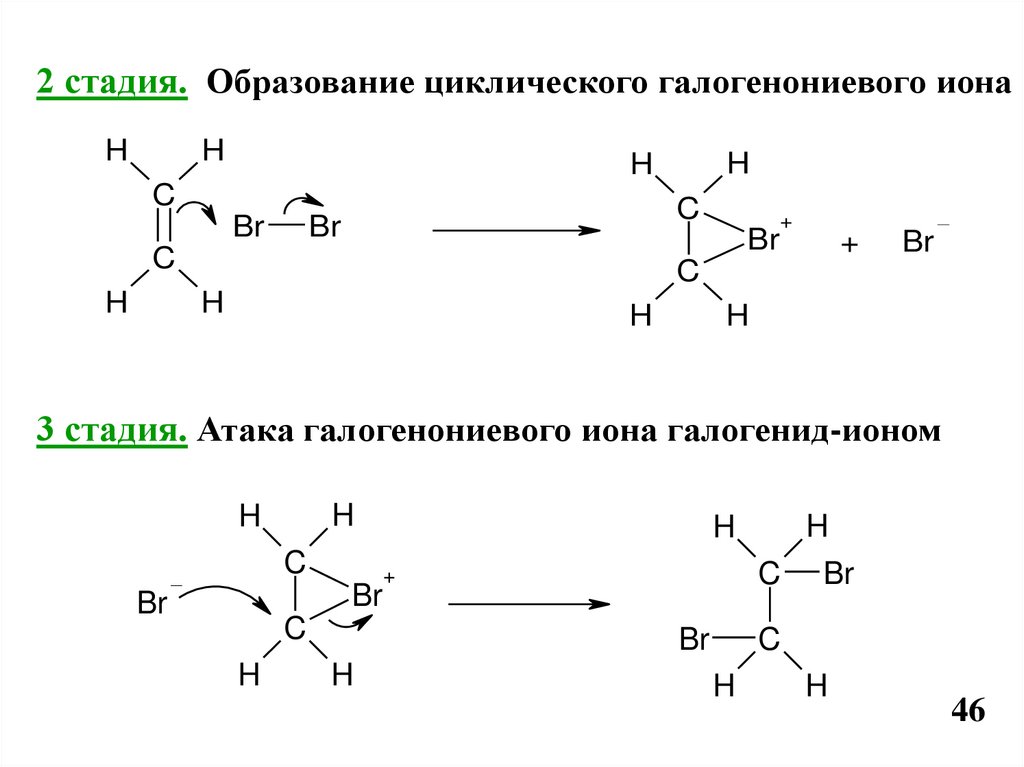
2 стадия. Образование циклического галогенониевого ионаH
H
C
Br
C
Br
Br
C
H
H
H
+
+
Br
C
H
H
H
3 стадия. Атака галогенониевого иона галогенид-ионом
H
H
C
Br
Br
C
H
H
+
Br
H
H
C Br
C
H
H
46
19.
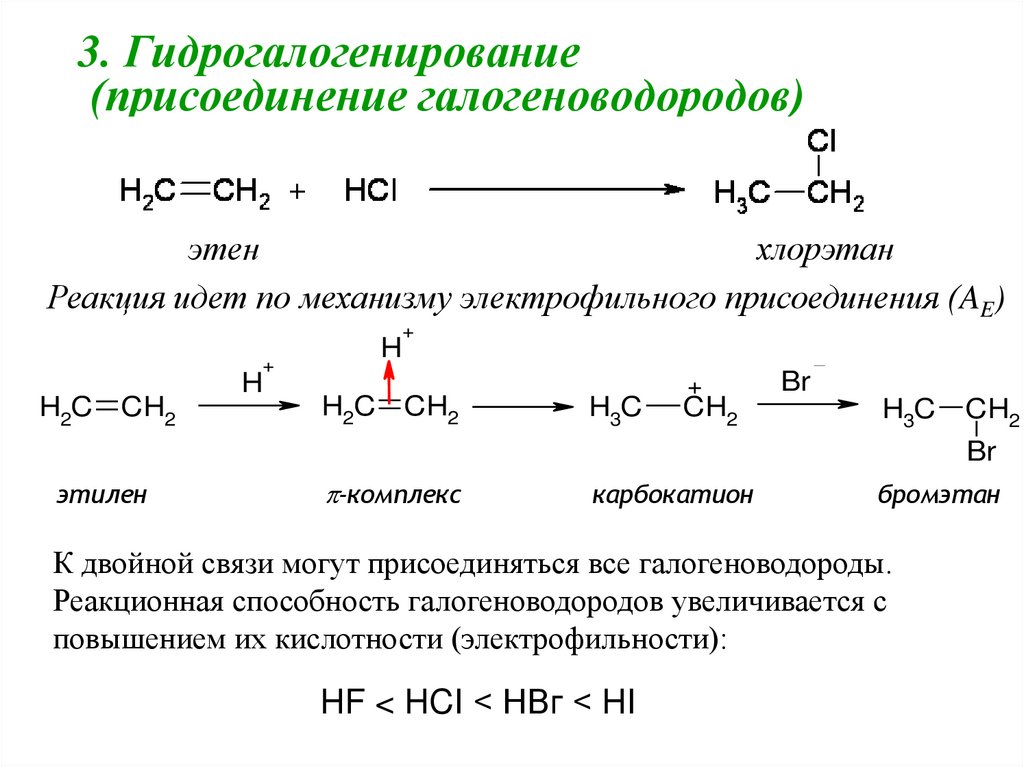
3. Гидрогалогенирование(присоединение галогеноводородов)
этен
хлорэтан
Реакция идет по механизму электрофильного присоединения (AE)
+
H
+
H2C
CH2
H
H2C
CH2
H3C
+
CH2
Br
H3C
CH2
Br
этилен
p-комплекс
карбокатион
бромэтан
К двойной связи могут присоединяться все галогеноводороды.
Реакционная способность галогеноводородов увеличивается с
повышением их кислотности (электрофильности):
HF < HCI < НВг < HI
20.
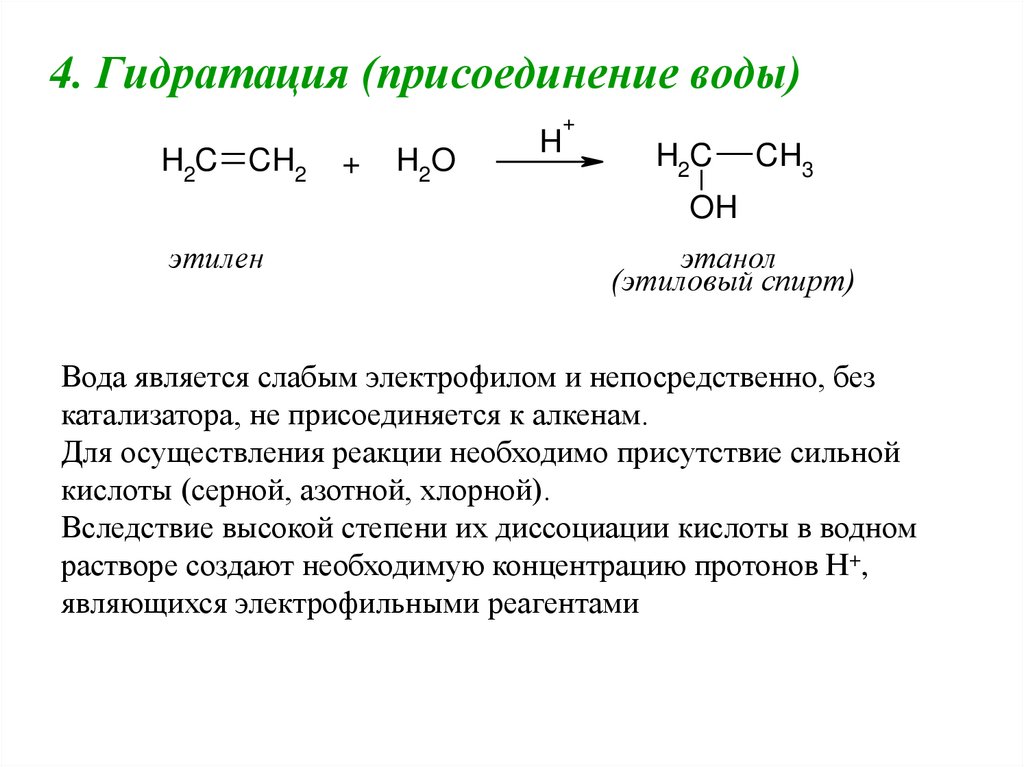
4. Гидратация (присоединение воды)+
H2C CH2
+
H2O
H
H2C
CH3
OH
этилен
этанол
(этиловый спирт)
Вода является слабым электрофилом и непосредственно, без
катализатора, не присоединяется к алкенам.
Для осуществления реакции необходимо присутствие сильной
кислоты (серной, азотной, хлорной).
Вследствие высокой степени их диссоциации кислоты в водном
растворе создают необходимую концентрацию протонов Н+,
являющихся электрофильными реагентами
21.
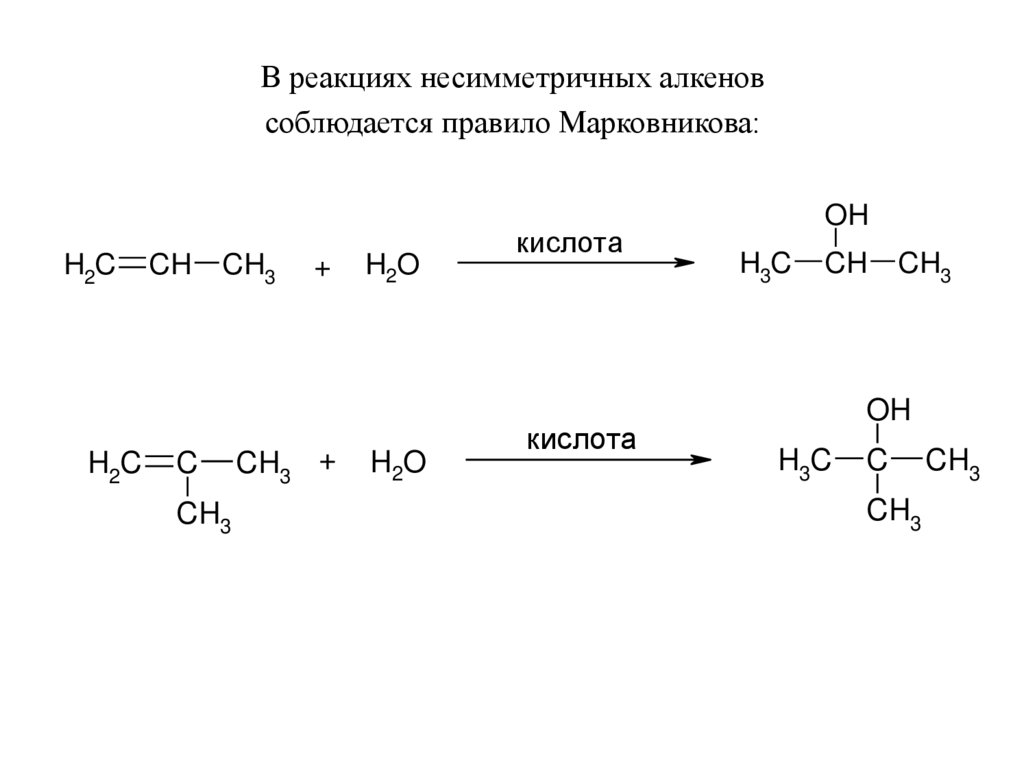
В реакциях несимметричных алкеновсоблюдается правило Марковникова:
H2C
H2C
CH
CH3
C
CH3
+
CH3 +
H2O
H2O
кислота
кислота
OH
H3C
CH
CH3
OH
H3C
C
CH3
CH3
22.
5. Присоединений серной кислотыэтилен
концентрованная
серная кислота
этилсульфат
При взаимодействии алкенов с концентрированной серной
кислотой образуются моноалкилсульфаты (гидросульфаты).
Реакция протекает при комнатной температуре.
При взаимодействии алкена с разбавленным водным раствором
серной кислоты алкислсерные кислоты не образуются.
23.
II. Реакции присоединения(по механизму радикального присоединения АR)
Реакции радикального присоединения протекают по цепному
механизму. Радикал, инициирующий реакцию может
вводиться в реакцию из другого источника.
Хорошими инициаторами цепных реакций являются
пероксиды, содержащие лабильный фрагмент – О – О –
Свободные радикалы являются электрон-дефицитными
частицами. Они активно атакуют π-электроны двойной связи,
разрывают ее и присоединяются по месту разрыва.
24.
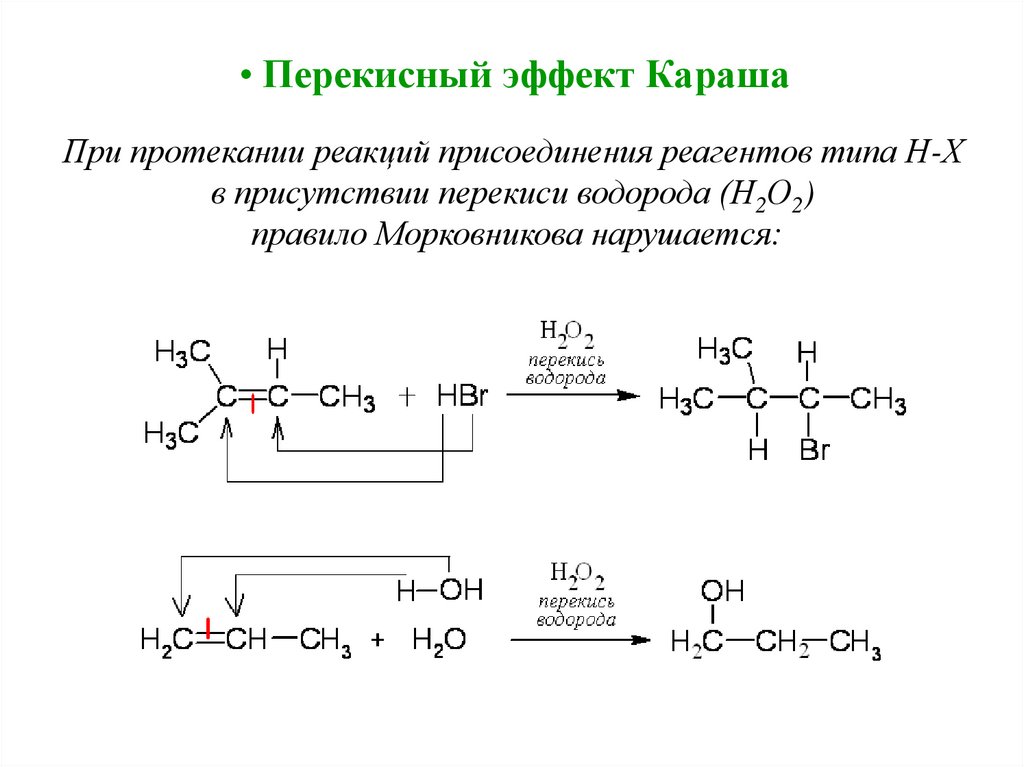
• Перекисный эффект КарашаПри протекании реакций присоединения реагентов типа Н-Х
в присутствии перекиси водорода (Н2О2)
правило Морковникова нарушается:
25.
III. Реакции замещения(по радикальному механизму)
• Аллильное замещение галогенами
В данных реакциях наиболее легко замещаются атомы
водорода в аллильном положении. Отрыв атома водорода из
аллильного положения ведет к образованию стабильного
радикала, при этом двойная связь оказывает стабилизирующее
влияние на реакционную способность соседней алкильной
группы:
26.
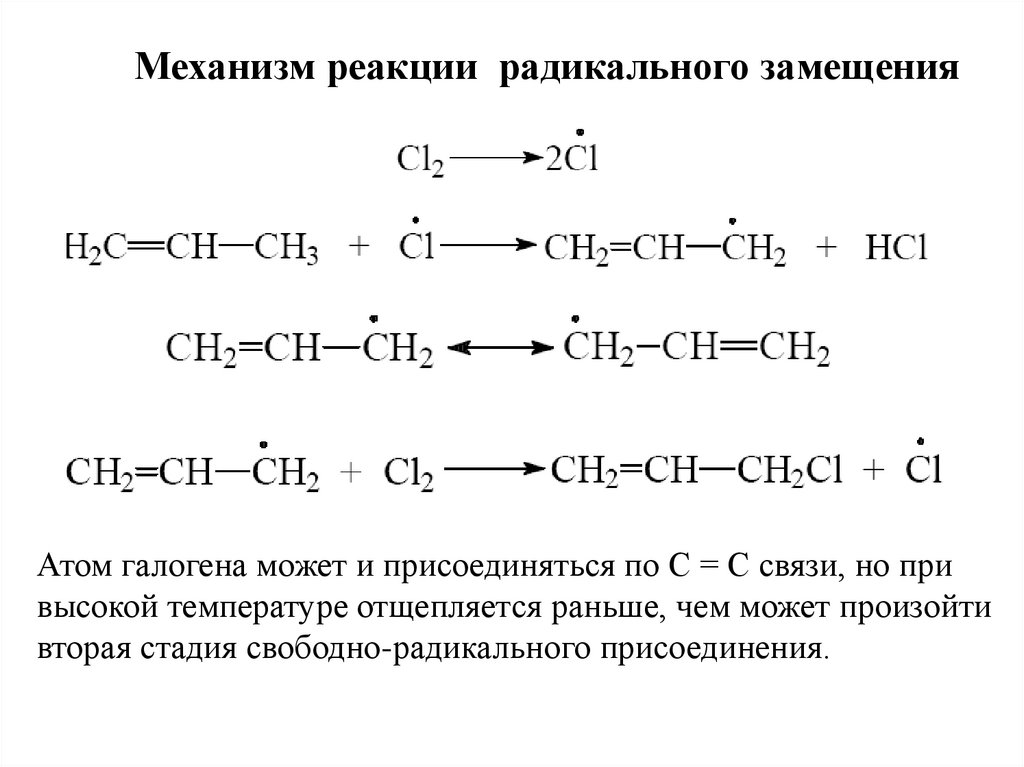
Механизм реакции радикального замещенияАтом галогена может и присоединяться по С = С связи, но при
высокой температуре отщепляется раньше, чем может произойти
вторая стадия свободно-радикального присоединения.
27.
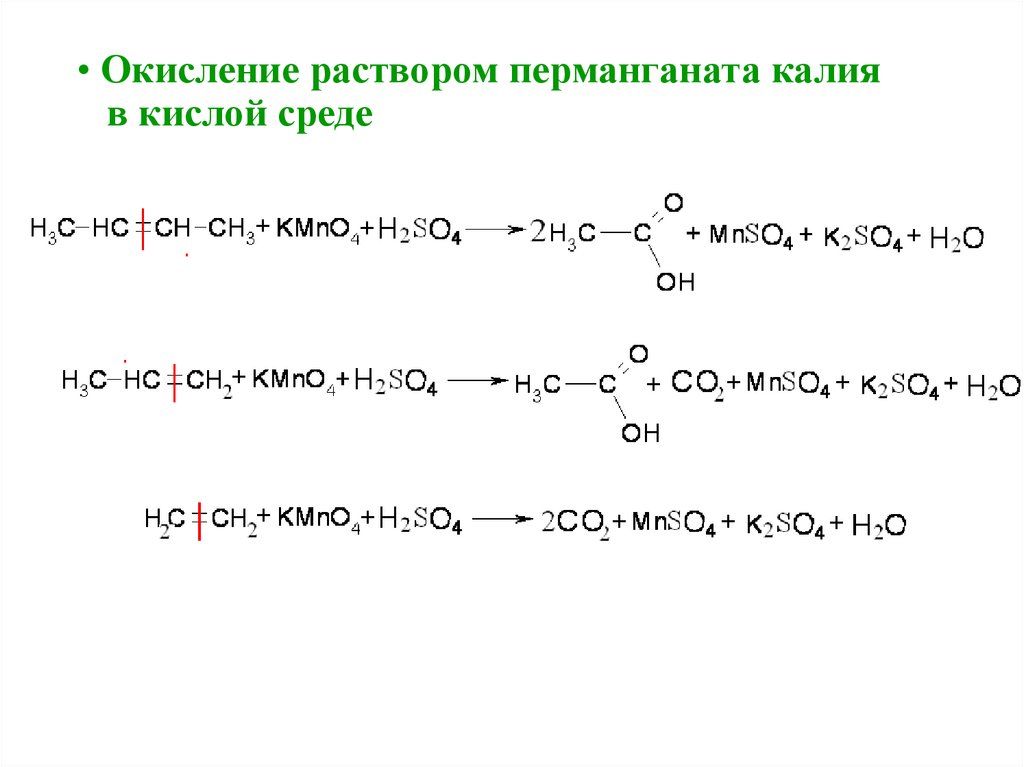
IV. Реакции окисления• Окисление раствором перманганата калия
в нейтральной среде (реакция Вагнера)
В ходе реакции происходит обесцвечивание раствора
перманганата калия (КMnO4) и выпадение бурого осадка –
диоксида марганца (MnО2).
Обесцвечивание раствора KMnO4 –
качественная реакция на двойную связь
этен
этиленгликоль
28.
• Окисление раствором перманганата калияв кислой среде
29.
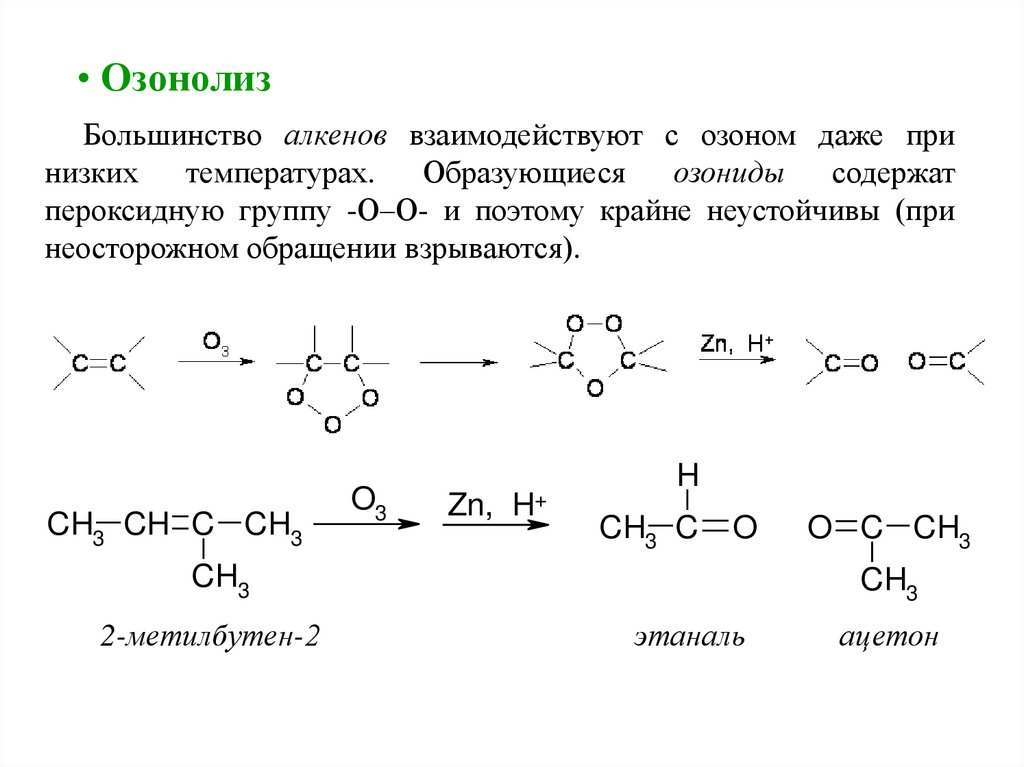
• ОзонолизБольшинство алкенов взаимодействуют с озоном даже при
низких
температурах.
Образующиеся
озониды
содержат
пероксидную группу -О–О- и поэтому крайне неустойчивы (при
неосторожном обращении взрываются).
CH3 CH C CH3
O3
Zn, H+
H
CH3 C
O
CH3
2-метилбутен-2
O C CH3
CH3
этаналь
ацетон
30.
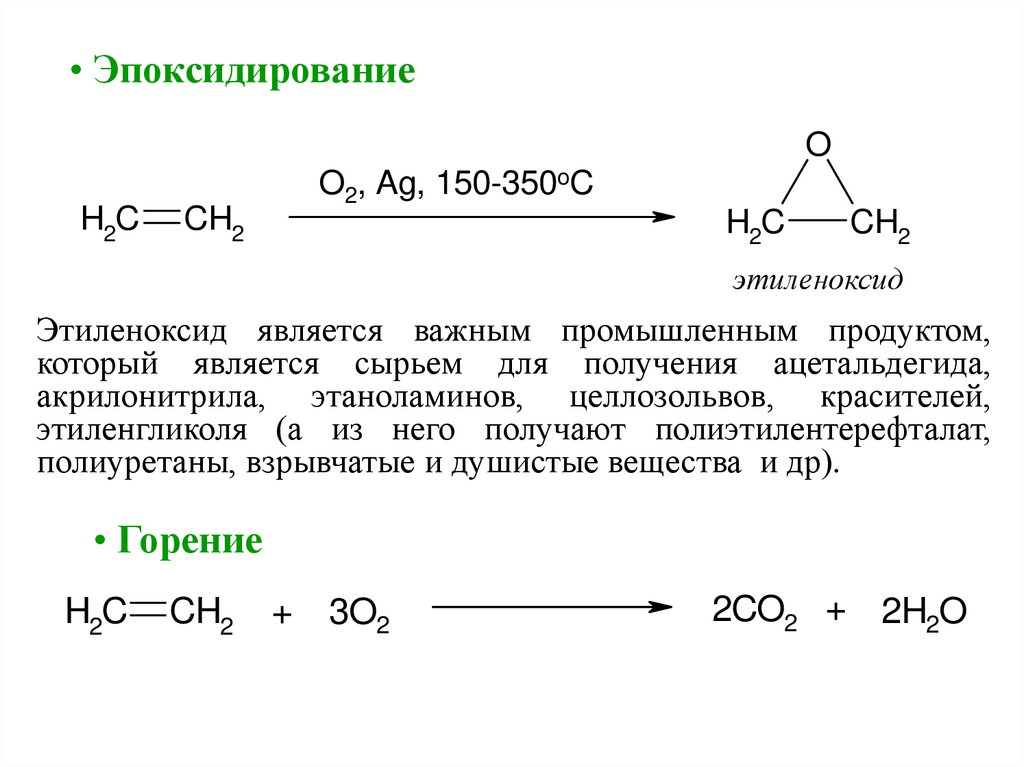
• ЭпоксидированиеO
H2C
O2, Ag, 150-350oC
CH2
H2C
CH2
этиленоксид
Этиленоксид является важным промышленным продуктом,
который является сырьем для получения ацетальдегида,
акрилонитрила, этаноламинов, целлозольвов, красителей,
этиленгликоля (а из него получают полиэтилентерефталат,
полиуретаны, взрывчатые и душистые вещества и др).
• Горение
H2C
CH2
+
3O2
2CO2 + 2H2O
31.
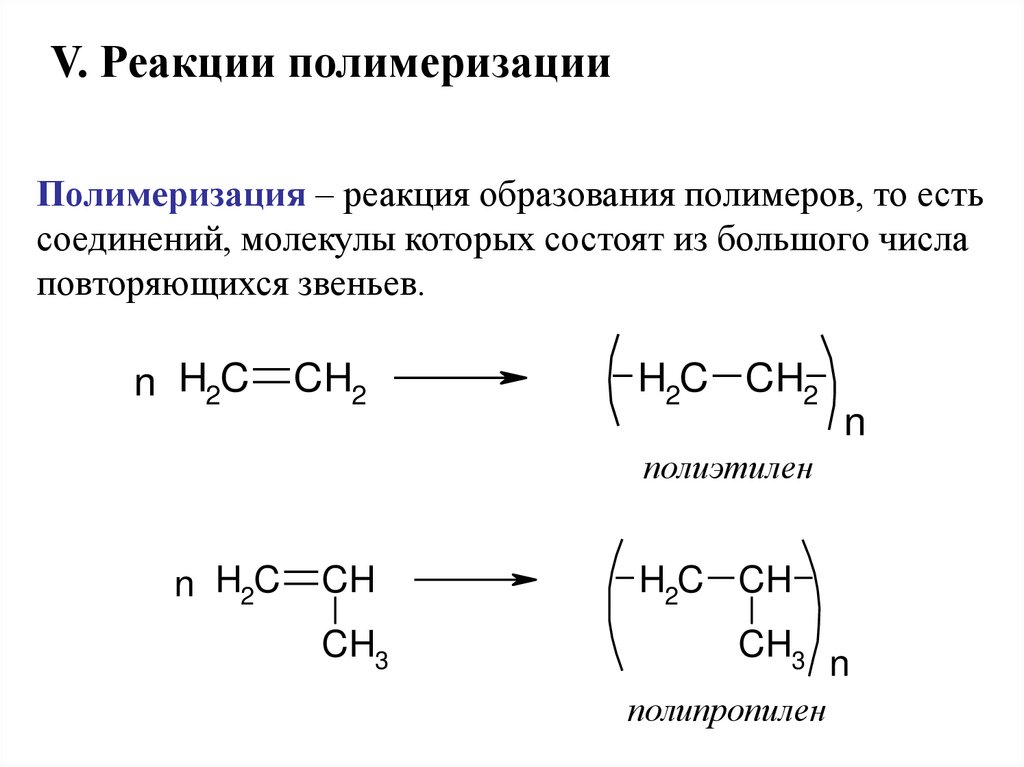
V. Реакции полимеризацииПолимеризация – реакция образования полимеров, то есть
соединений, молекулы которых состоят из большого числа
повторяющихся звеньев.
n H2C
CH2
H2C CH2
n
полиэтилен
n H2C
CH
H2C CH
CH3
CH3
полипропилен
n
32.
Полифторэтилен (фторпласт-4, фторлон-4, тефлон),является продуктом полимеризации тетрафторэтилена:
n F2C
CF2
CF2 CF2
n
Тефлон является хорошим диэлектриком, очень устойчив
к действию окислителей, щелочей, кислот, органических
растворителей.
Применяется в производстве изделий электротехнической,
радиотехнической и химической промышленности.
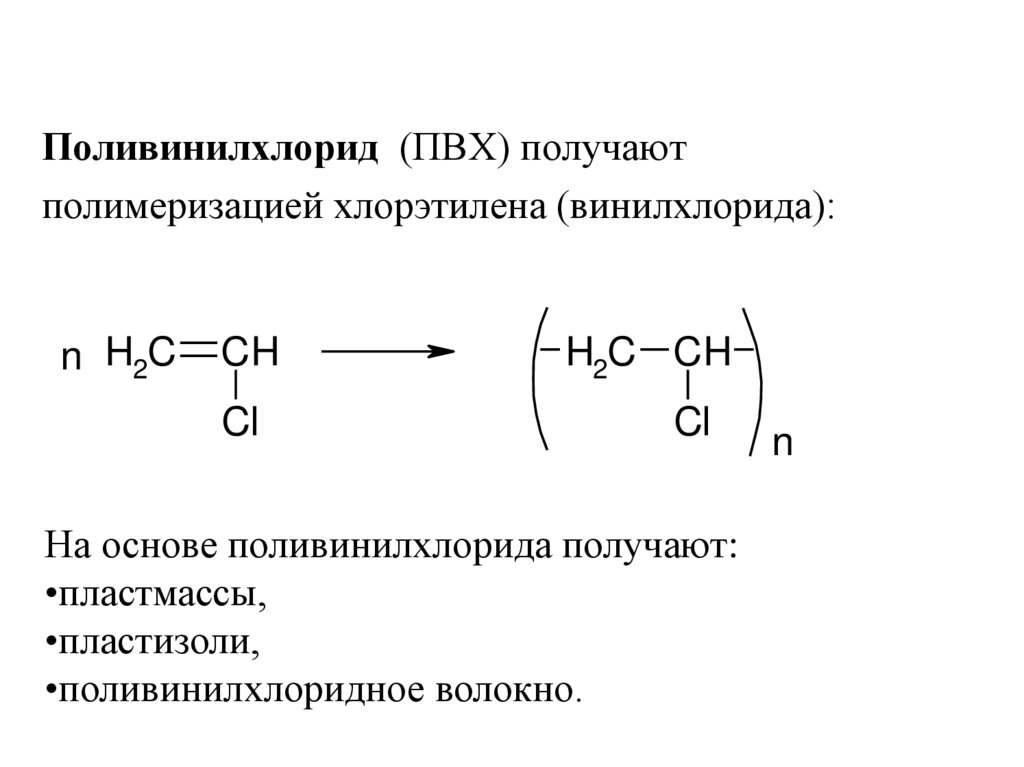
33.
Поливинилхлорид (ПВХ) получаютполимеризацией хлорэтилена (винилхлорида):
n H2C
CH
H2C CH
Cl
Cl
На основе поливинилхлорида получают:
•пластмассы,
•пластизоли,
•поливинилхлоридное волокно.
n
34.
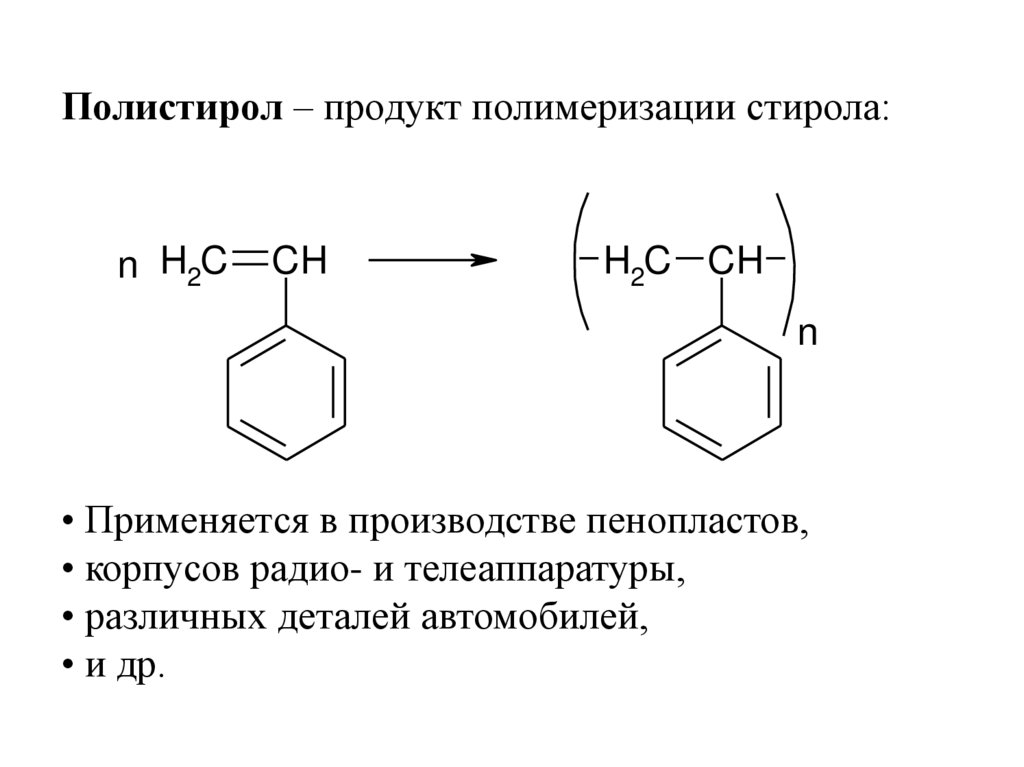
Полистирол – продукт полимеризации стирола:n H2C
CH
H2C CH
n
• Применяется в производстве пенопластов,
• корпусов радио- и телеаппаратуры,
• различных деталей автомобилей,
• и др.
35.
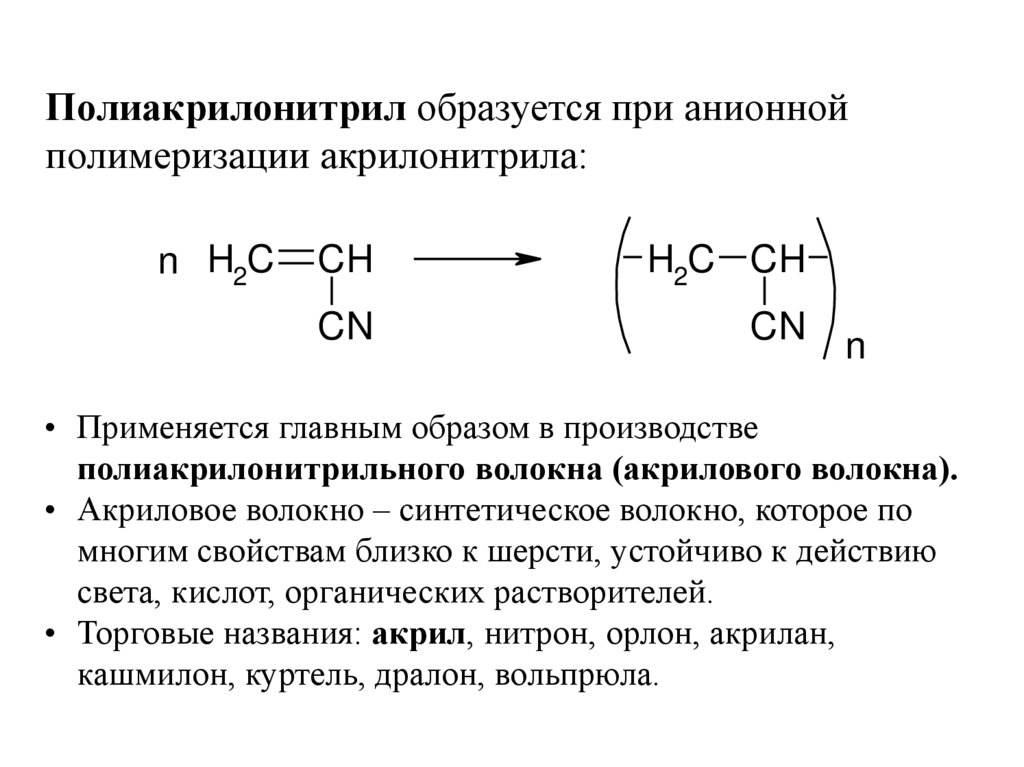
Полиакрилонитрил образуется при анионнойполимеризации акрилонитрила:
n H2C
CH
H2C CH
CN
CN
n
• Применяется главным образом в производстве
полиакрилонитрильного волокна (акрилового волокна).
• Акриловое волокно – синтетическое волокно, которое по
многим свойствам близко к шерсти, устойчиво к действию
света, кислот, органических растворителей.
• Торговые названия: акрил, нитрон, орлон, акрилан,
кашмилон, куртель, дралон, вольпрюла.
36.
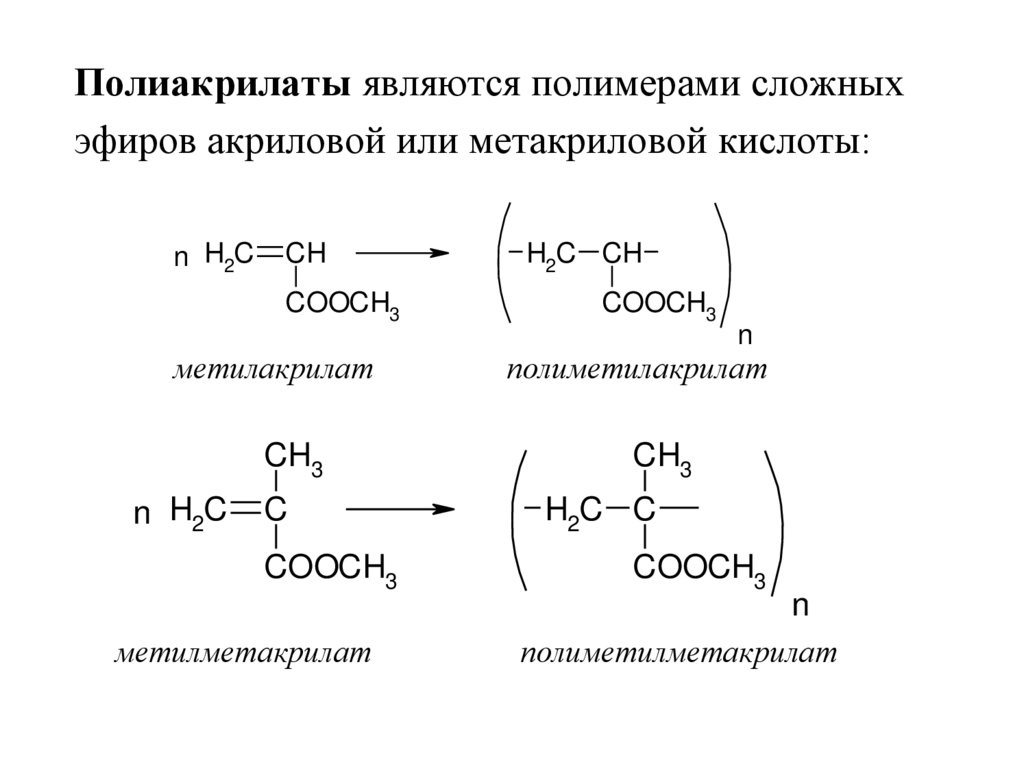
Полиакрилаты являются полимерами сложныхэфиров акриловой или метакриловой кислоты:
n H2C
CH
COOCH3
метилакрилат
CH3
n H2C
C
COOCH3
метилметакрилат
H2C CH
COOCH3
n
полиметилакрилат
CH3
H2C C
COOCH3
n
полиметилметакрилат
37.
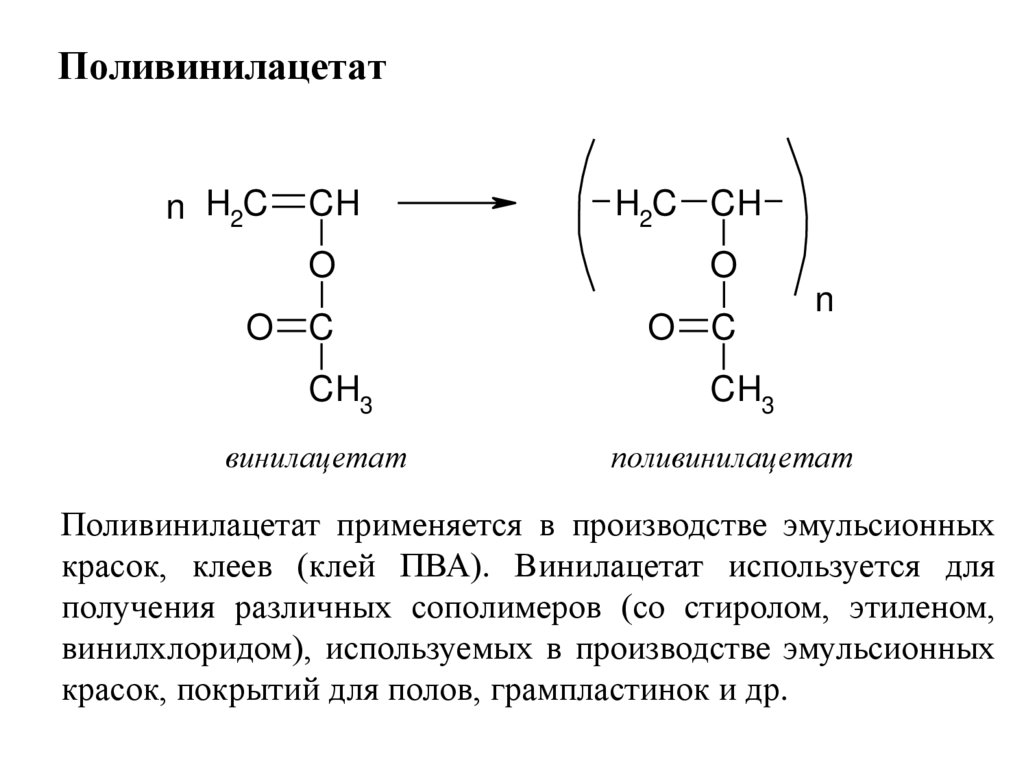
Поливинилацетатn H2C
CH
H2C CH
O
O
O C
CH3
винилацетат
O C
n
CH3
поливинилацетат
Поливинилацетат применяется в производстве эмульсионных
красок, клеев (клей ПВА). Винилацетат используется для
получения различных сополимеров (со стиролом, этиленом,
винилхлоридом), используемых в производстве эмульсионных
красок, покрытий для полов, грампластинок и др.
38.
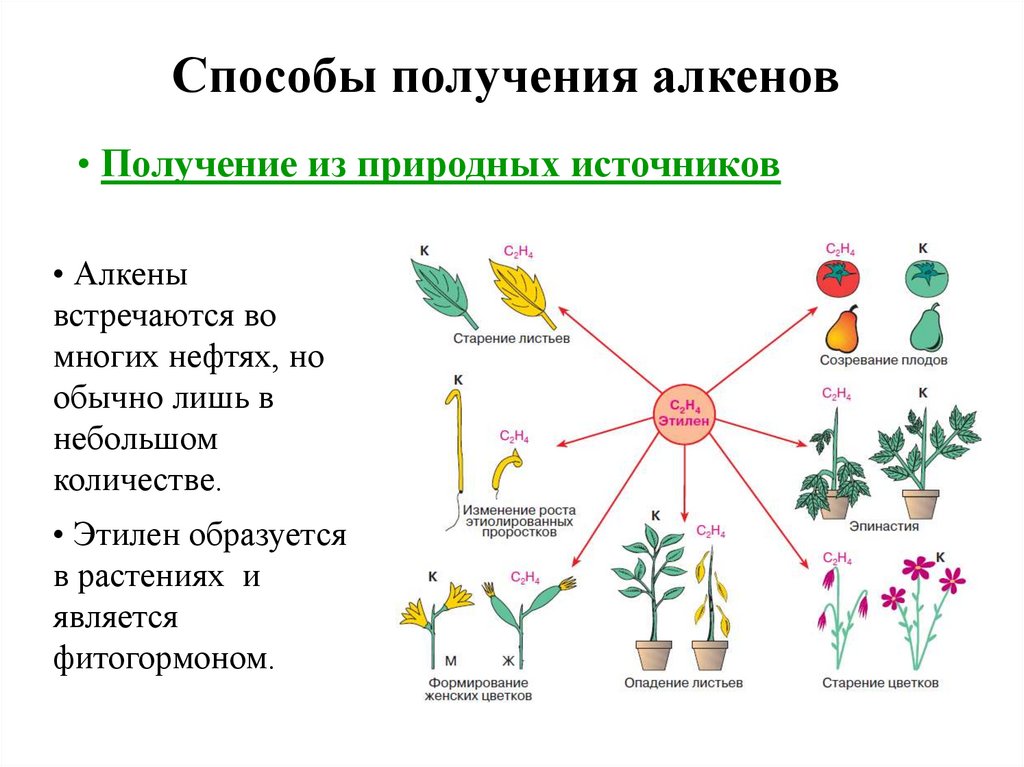
Способы получения алкенов• Получение из природных источников
• Алкены
встречаются во
многих нефтях, но
обычно лишь в
небольшом
количестве.
• Этилен образуется
в растениях и
является
фитогормоном.
39.
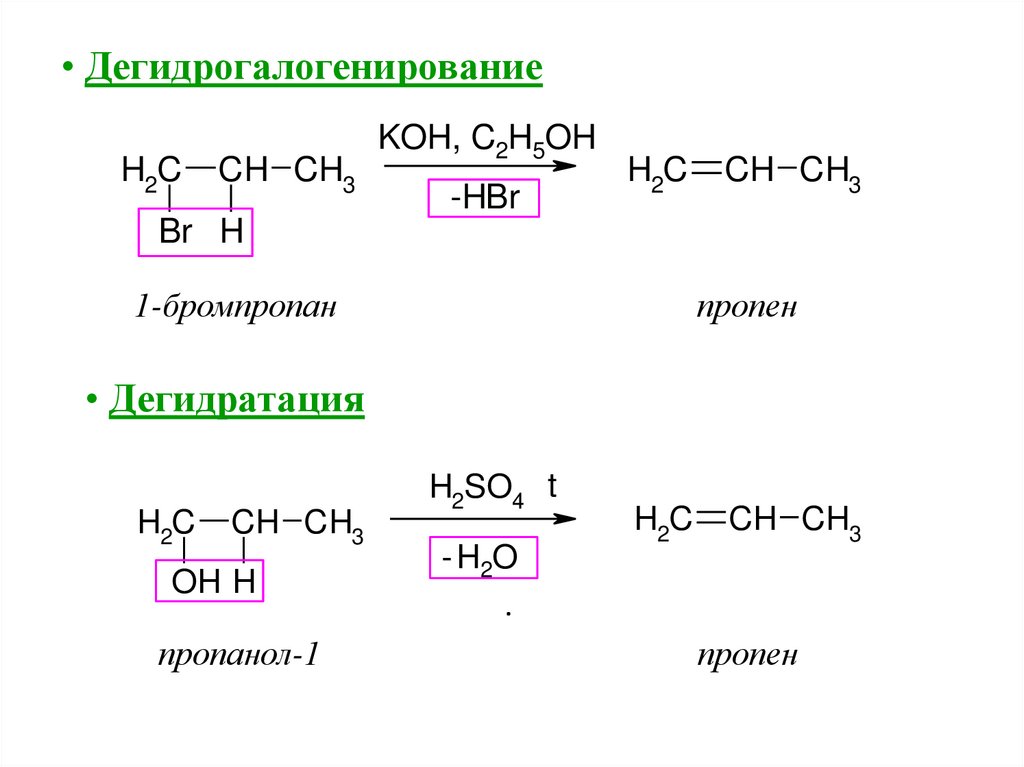
• ДегидрогалогенированиеH2C
CH CH3
KOH, C2H5OH
-HBr
H2C
CH CH3
Br H
пропен
1-бромпропан
• Дегидратация
H2C
CH CH3
OH H
пропанол-1
H2SO4 t
- H2O
H2C
CH CH3
пропен
40.
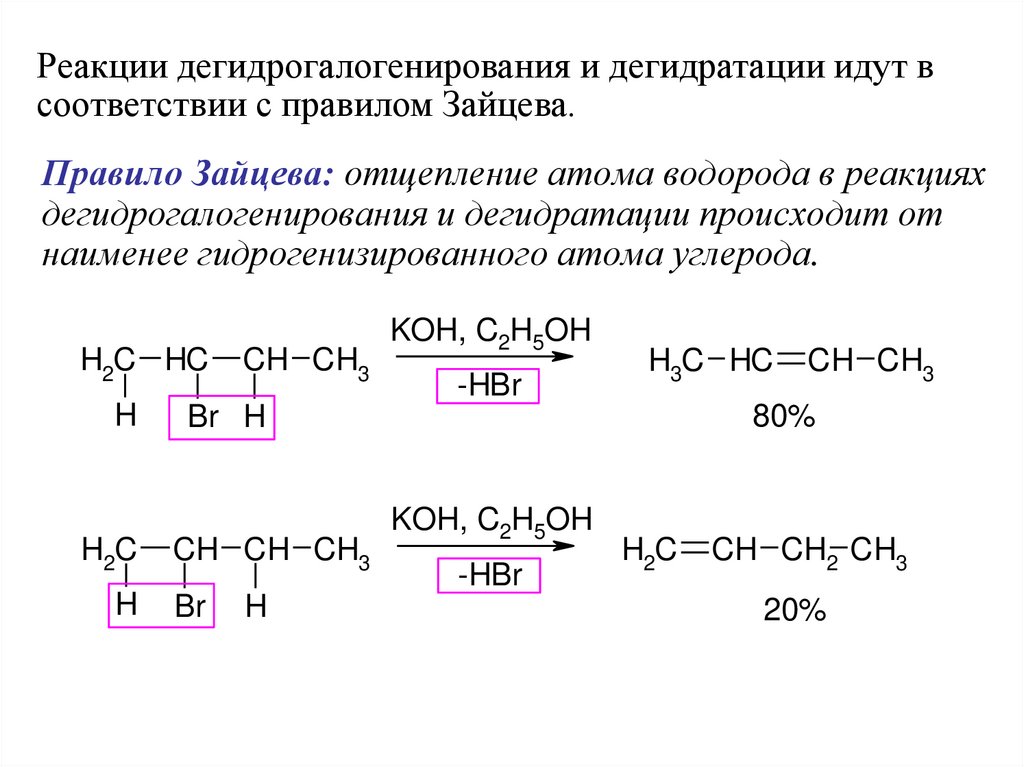
Реакции дегидрогалогенирования и дегидратации идут всоответствии с правилом Зайцева.
Правило Зайцева: отщепление атома водорода в реакциях
дегидрогалогенирования и дегидратации происходит от
наименее гидрогенизированного атома углерода.
H2C HC
H
H2C
H
CH CH3
KOH, C2H5OH
-HBr
H3C HC
80%
Br H
CH CH CH3
Br
H
CH CH3
KOH, C2H5OH
-HBr
H2C
CH CH2 CH3
20%
41.
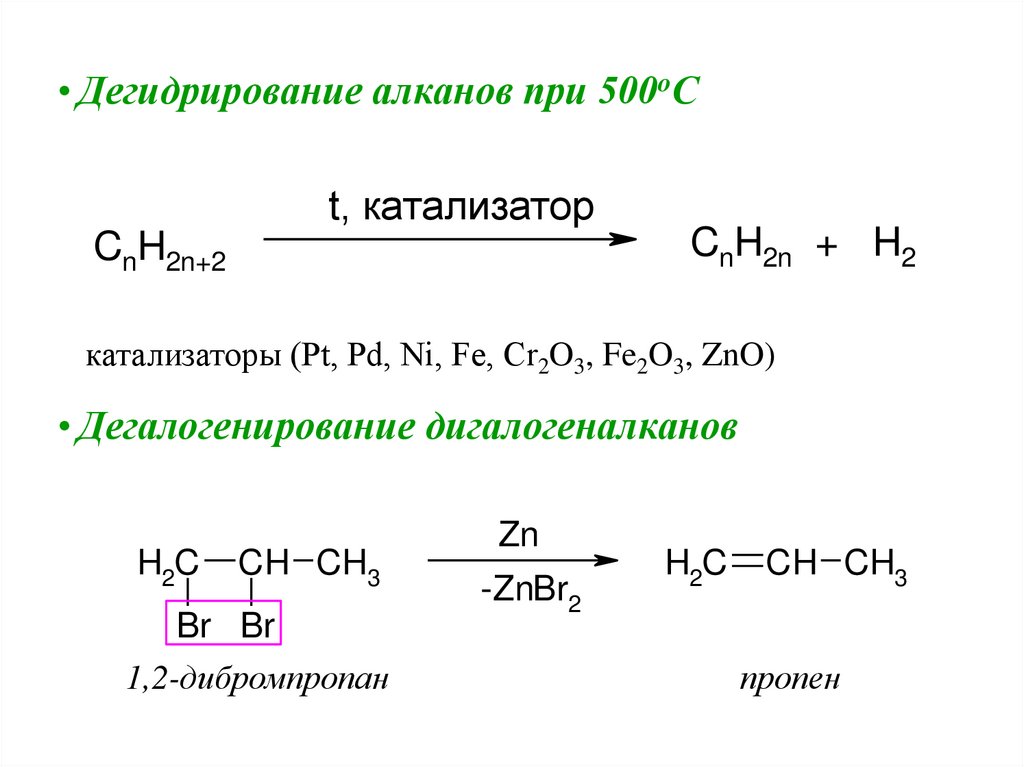
• Дегидрирование алканов при 500oСt, катализатор
CnH2n+2
CnH2n + H2
катализаторы (Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO)
• Дегалогенирование дигалогеналканов
H2C
CH CH3
Br Br
1,2-дибромпропан
Zn
-ZnBr2
H2C
CH CH3
пропен
42.
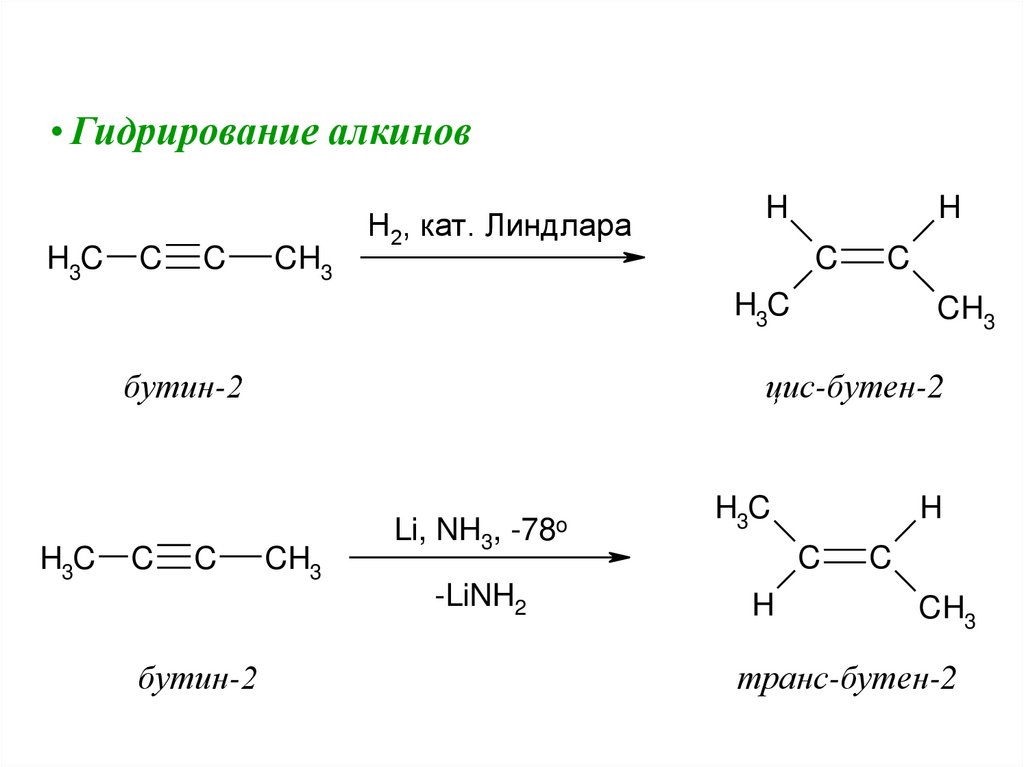
• Гидрирование алкиновH3C
C
C
CH3
H2, кат. Линдлара
H
H
C
C
H3C
бутин-2
H3C
C
C
цис-бутен-2
CH3
Li, NH3, -78o
-LiNH2
бутин-2
CH3
H3C
H
C
H
C
CH3
транс-бутен-2
43.
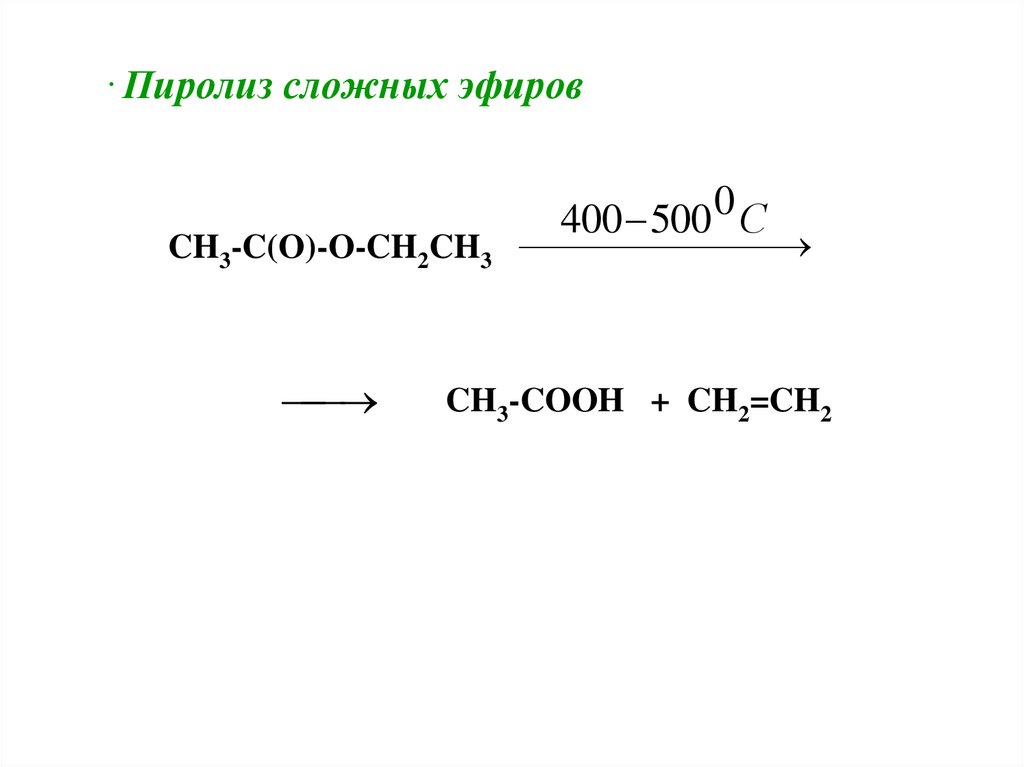
. Пиролиз сложных эфиров0
400 500 С
CH3-C(O)-O-CH2CH3
CH3-COOH + CH2=CH2












 Химия
Химия








